高产淀粉酶菌株的筛选及其培养条件的优化
2017-07-21张志强李思思李辉梁魁景刘言王婷
张志强+李思思+李辉+梁魁景+刘言+王婷婷+由明扬

摘要:为筛选淀粉酶高产菌株,通过比较水解圈与菌落的直径比及3,5-二硝基水杨酸(DNS)显色法所测酶活性高低,筛选得到高产淀粉酶能力的菌株WB-4。通过单因素试验,得到该菌株的最优碳源为可溶性淀粉,最优氮源为蛋白胨。利用Plackett-Burman进行显著因素筛选,发现可溶性淀粉含量、蛋白胨含量、温度为显著因素。利用响应面法对显著因素进行优化,得到菌株的最优培养条件为可溶性淀粉含量18.81 g/L,蛋白胨含量10.02 g/L,温度 31.12 ℃,淀粉酶活性 365.12 U/mL,酶活性提高了1.33倍。
关键词:高产淀粉酶菌株;响应面法;Plackett-Burman因素筛选;发酵条件优化;工业化应用
中图分类号: S182文献标志码: A
文章编号:1002-1302(2017)10-0221-03
淀粉酶是能催化淀粉水解转化成葡萄糖、麦芽糖及其他低聚糖的一类酶的总称[1]。淀粉酶来源极其广泛,不仅动物的唾液、胰脏富含淀粉酶,植物体内也含有丰富的淀粉酶,但是,目前商业化生产的淀粉酶主要由微生物发酵提炼所得[2]。自从19世纪初德国科学家Kirchhoff发现淀粉酶以来,有关淀粉酶的研究报道逐年增加,淀粉酶的应用也越来越广泛。特别是在酿造工业、纺织、医药工业、环保、洗涤剂等方面得到了广泛的应用[3]。近年来,虽然我国淀粉酶的品种、产量不断增加,但是与国外相比,我国的淀粉酶品种相对偏少、产量偏低[4]。为了适应经济快速发展对淀粉酶的需求,本试验对河北省衡水市周边采集到的样品进行分离筛选,并利用响应面法进一步提高其产量,以期为淀粉酶的工业化应用提供支持。
1材料与方法
1.1样品
试验所用样品采集地点为河北省衡水市某面粉厂、某食品加工厂、某学校食堂。
1.2培养基
筛选培养基:10 g/L蛋白胨,3 g/L牛肉膏,5 g/L NaCl,2 g/L 可溶性淀粉,20 g/L琼脂,加蒸馏水至1 000 mL,调节pH值为7.0~7.2。
摇瓶发酵培养基:除不加琼脂外,其他成分同筛选培养[LL]基。
1.3试验方法
1.3.1产淀粉酶菌株的筛选初筛:取1 g不同地点采集的样品溶解于9 mL灭菌蒸馏水中,然后进行梯度稀释,直到10-7稀释度为止。取0.1 mL不同稀释倍数的样液涂布到筛选培养基上,30 ℃培养数天,划线纯化,直到获得单菌落为止。将得到的单菌落接种到筛选培养基上,30 ℃培养2~4 d,经碘液染色后根据水解圈的大小,初步筛选出产淀粉酶的菌株。
复筛:将初筛到的菌株接种到摇瓶发酵培养基上,30 ℃、120 r/min摇床培养48 h。将发酵液于5 000 r/min离心 10 min,取上清液测定酶活性,选取酶活性较高的菌株作为试验菌种。
1.3.2发酵条件的优化
1.3.2.1单因素试验在摇瓶发酵培养基中,分别加入05%不同碳源(麦芽糖、蔗糖、可溶性淀粉、葡萄糖、甘油、乳糖)替换其碳源成分,进行碳源优化试验。在最优碳源的基础上,分别以不同氮源(硝酸铵、尿素、硫酸铵、胰蛋白、牛肉膏、蛋白胨)替换培养基中氮源成分,进行氮源优化试验。
1.3.2.2筛选显著因素用Design Expert 7.0软件中的Plackett-Burman对可溶性淀粉含量、蛋白胨含量、牛肉膏含量、温度、转速、装液量、初始pH值等7个因素进行设计,每个因素分别按低水平(-1)、高水平(+1)进行设计(表1),
1.3.2.3响应面法优化以“1.3.2.2”节筛选到的显著因素为基础,利用中心组合设计原理,对选取的显著因素从5个水平进行考察,确定最优条件,并验证其准确性。
1.3.3淀粉酶活性测定淀粉酶活性测定采用3,5-二硝基水杨酸(DNS)法[5]。酶活性单位定义:1 U(单位酶活)表示在试验条件下1 min释放出1 μmol还原糖需要的酶量。
2结果与分析
2.1菌株的筛选
样品经涂布及多次纯化后,将得到的单菌落接种到筛选培养基上,进行淀粉酶水解圈试验。经初步筛选共有32株菌株产生了透明圈,其中水解圈/菌落直径比(即D/d值)大于2的菌株共有8株,分别命名为WB-1、WB-2、WB-3、WB-4、WB-5、WB-6、WB-7、WB-8;D/d值最大的为 WB-3,其次为WB-4,再次为WB-2(表2)。因此,初步筛选这3株菌株进行复筛。
将初筛得到的3个菌株WB-2、WB-3、WB-4接种到摇瓶发酵培养基上培养一定时间后,进行酶活性测定。结果显示,WB-2、WB-3、WB-4的酶活性分别为126.4、137.3、156.5 U/mL。水解圈的大小在一定程度上可以反映酶活性的高低,但是却不能完全代表菌株產酶能力的强弱,其原因可能是不同菌株在生长、产酶速度上存在差异、菌苔的大小及其在平板上的堆积情况存在差异,此外,还有可能是由于固体培养基、液体培养基的培养条件存在差异等[6]。因此,在选择菌株时不能以水解圈的大小作为唯一标准。虽然WB-4的 D/d 值小于WB-3,本试验综合考虑水解圈大小及产酶能力的高低,最终选择WB-4作为目的菌株。
2.2发酵条件的优化
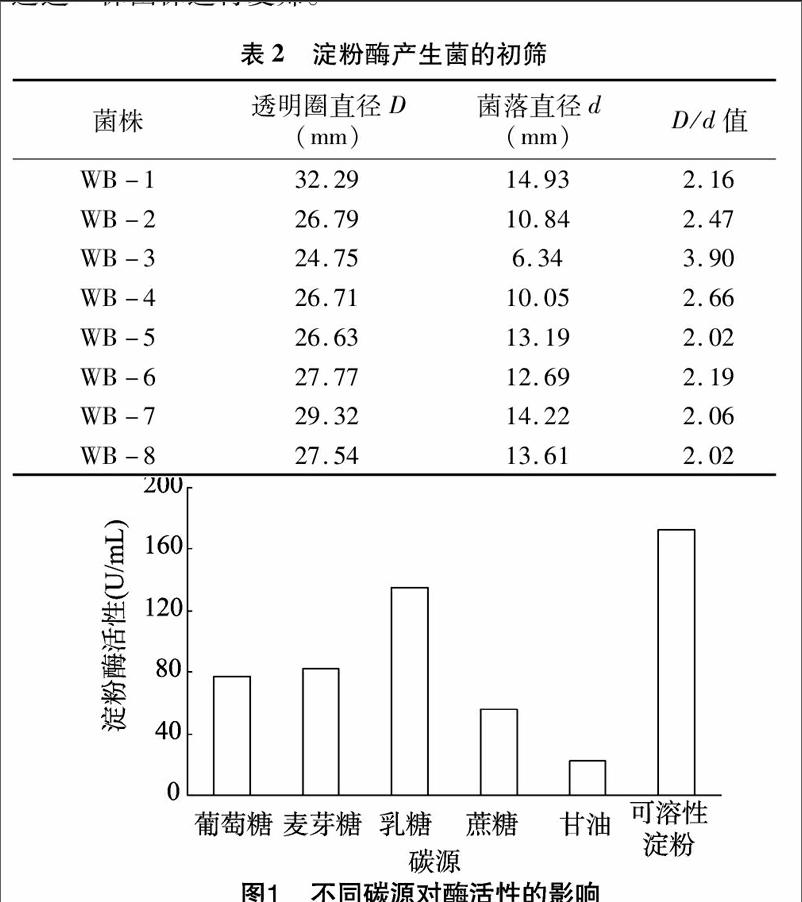
2.2.1单因素试验用6种不同碳源替换摇瓶发酵培养基中的碳源,于30 ℃、120 r/min培养48 h,测定上清液淀粉酶活性。从图1可以看出,以可溶性淀粉作为碳源时,酶活性最高,乳糖次之,甘油最低,因此选择可溶性淀粉作为碳源。
用6种不同氮源替换摇瓶发酵培养基中的氮源,于 30 ℃、120 r/min培养48 h,测定上清液淀粉酶活性。从图2可以看出,以蛋白胨作为氮源时,淀粉酶活性最高,以牛肉膏作为氮源时也能取得较好的效果。而以硫酸铵、硝酸铵、尿素等无机物质作为氮源,产酶效果较差。因此,本试验选择蛋白胨作为氮源。
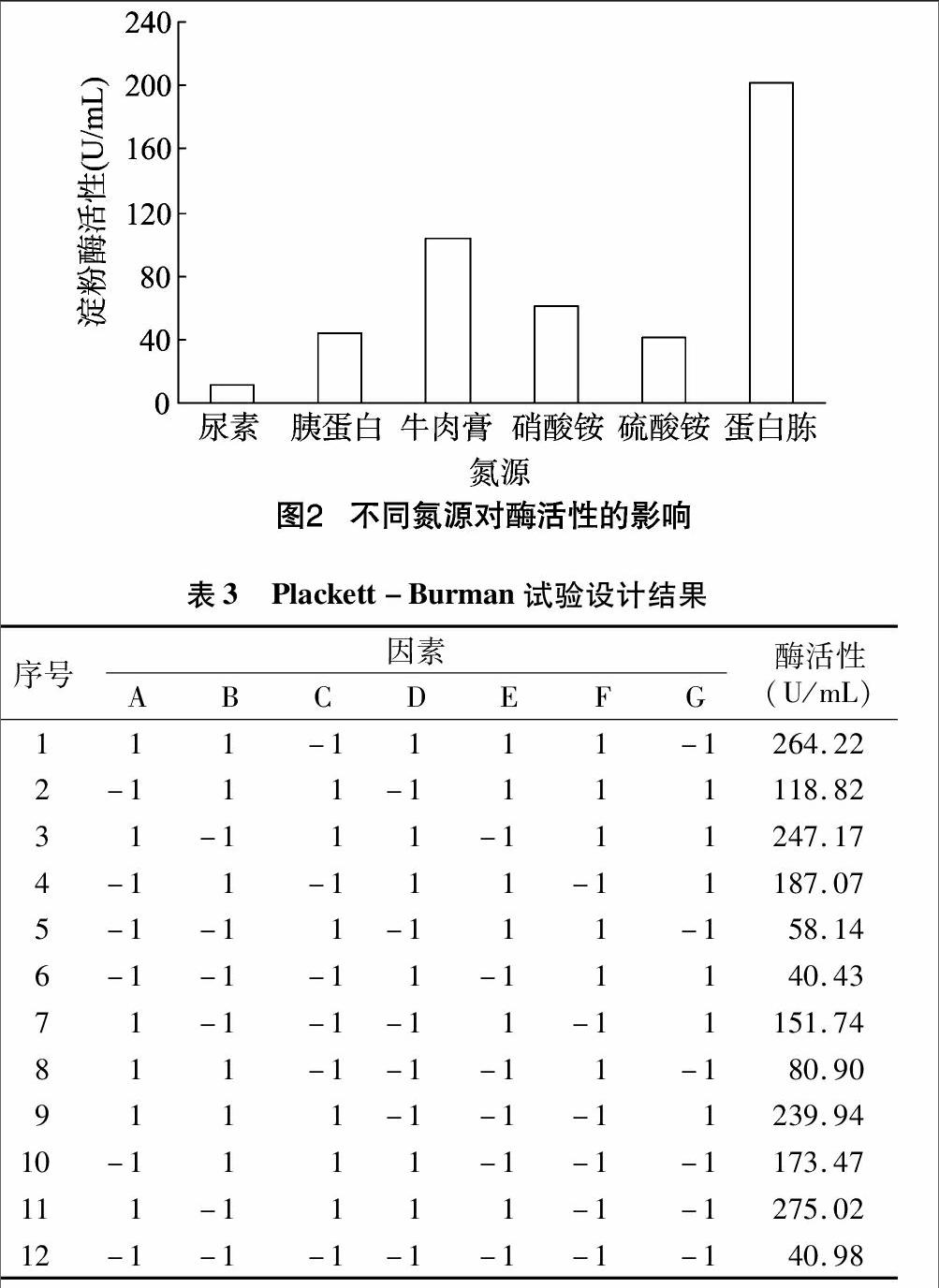
2.2.2显著因素的筛选利用Design Expert 7.0软件中的Plackett-Burman对7个因素进行设计,具体方案及结果见表3、表4。一般认为P值>F值小于0.05,说明该因素为显著因素。由表4可以看出,可溶性淀粉含量、蛋白胨含量及温度的P值>F值的值分别为0.006 2、0.046 1、0.015 0,说明这3个因素为显著因素,因此选择可溶性淀粉含量、蛋白胨含量、温度进行进一步的优化试验。
2.2.4验证模型的可靠性通过该模型拟合得出生产淀粉酶的最佳培养条件:可溶性淀粉含量18.81 g/L,蛋白胨含量10.02 g/L,温度31.12 ℃,预测最高淀粉酶活性为 371.89 U/mL。在最佳培养条件下得到的淀粉酶活性为 365.12 U/mL,与预测的最佳淀粉酶活性相差很小,说明该模型可用于淀粉酶发酵条件的优化。
3结论
笔者所在课题组对河北省衡水市周边采集到的样品进行筛选。在综合考虑初筛及复筛的结果后,决定将WB-4作为
目的菌株进行发酵条件的优化。对菌株进行单因素优化,发现最优碳源为可溶性淀粉,最优氮源为蛋白胨。在单因素优化的基础上,利用Plackett-Burman确定了可溶性淀粉含量、蛋白胨含量、温度为显著因素。利用响应面法对3个显著因素进行优化,通过分析显著因素与酶活性之间的关系,建立了两者之间的数学模型,通过响应面法的分析得到最优培养条件为可溶性淀粉含量18.81 g/L,蛋白胨含量10.02 g/L,培养温度 31.12 ℃,预测最高酶活性为371.89 U/mL,实测值为 365.12 U/mL,相差较小,说明优化结果可信。通过优化使得淀粉酶活性由最初的156.5 U/mL提高到365.12 U/mL,提高了1.33倍,效果明显,为该菌株的工业化应用提供了有力的支持。
参考文献:[HT8.SS][HJ1.76mm]
[1]王晓红. 产低温淀粉酶菌株的筛选及其酶学性质的研究[D]. 乌鲁木齐:新疆农业大学,2006.
[2]易征璇,赵彤,师旋,等. 高温淀粉酶高产菌株筛选及产酶条件优化[J]. 现代农业科技,2014(7):240-243.
[3]雷晓燕. 土壤中淀粉酶产生菌的筛选及产酶条件优化[J]. 沈阳化工学院学报,2010,24(3):203-208.
[4]刘杰雄,陈号,陆雯,等. 淀粉酶高产菌株的筛选及其酶活的测定[J]. 食品工程,2010(1):45-47.
[5]张惟杰. 糖复合物生化研究技术[M]. 杭州:浙江大学出版社,1994:10-11.
[6]楼超,刘铁帅,贾博深,等. 高产淀粉酶菌株的筛选及产酶条件优化的探究[J]. 中国卫生检验杂志,2010,20(11):2817-2820.
江苏农业科学2017年第45卷第10期
[SQ*5]
[HT6F]施磊,扶教龙,吴晨奇,等. 产辅酶Q10根瘤土壤杆菌的紫外诱变选育及其发酵培养基优化[J]. 江苏农业科学,2017,45(10):224-228.
doi:10.15889/j.issn.1002-1302.2017.10.062
产辅酶Q10根瘤土壤杆菌的紫外诱变选育及其发酵培养基优化
施磊, 扶教龙, 吴晨奇, 钱大伟, 徐敏强, 鞠鑫, 李良智
(苏州科技学院化学生物与材料工程学院,江苏苏州 215009)
摘要:以根瘤土壤杆菌作为出发菌株,经过紫外诱变、平板初筛、摇瓶发酵复筛,最终获得1株辅酶Q10高产菌株 Q-6,其辅酶Q10产量为11.92 mg/L,较出发菌株提高92.57%,且其遗傳性稳定,可用于进一步研究。然后在单因素试验的基础上,应用响应面分析方法,对其发酵培养基进行优化,得到生产辅酶Q10的最佳发酵培养基配方(葡萄糖35.46 g/L、酵母浸膏12.33 g/L、Na2HPO4 1.58 g/L、MgSO4·7H2O 0.39 g/L),在此培养基下辅酶Q10产量最高,为1132 mg/L,较单因素试验最高值提高8.53%。
关键词:根瘤土壤杆菌;辅酶Q10;紫外诱变;响应面分析法;发酵培养基
中图分类号: Q935文献标志码: A
文章编号:1002-1302(2017)10-0224-05
辅酶Q10(coenzyme Q10,CoQ10)别称癸烯醌、泛醌,它是人类生命不可缺少的重要元素之一,能激活人体细胞,同时还能提高人体免疫力并增强人体活力,现在医学上广泛用于心血管系统疾病的治疗[1],除此之外,辅酶Q10还具有抗氧化性、延缓衰老和增强人体活力等功能,所以现在它已经在食品和化妆品领域得到大量应用。辅酶Q10的制备有化学法、动植物组织提取法和微生物发酵法3种方法[2-4]。因为使用前2种方法合成辅酶Q10时的成本较高,并且会产生光学异构体,生物学活性也不是很高,所以现在微生物发酵法被认为是最具有前途的一种生产方式。本试验选择根瘤土壤杆菌为出发菌株,该菌是目前研究CoQ10生物发酵法较常用的菌种[5-7]。通过紫外照射诱导变异和平板初筛、摇瓶发酵复筛相结合的方法,以期获得CoQ10高产菌,为提高CoQ10工业生产效率打下基础。
1材料与方法
1.1试验材料
1.1.1菌种与试剂
根瘤土壤杆菌(Agrobacterium tumefaciens 1.1701)购自中国普通微生物菌种保藏管理中心(CGMCC),保藏于笔者所在试验室。辅酶Q10标准品(美国Sigma 公司),分析纯。其他药品和试剂,均为分析纯或化学纯。
1.1.2培养基
(1)平板培养基。葡萄糖5 g/L,酵母膏 5 g/L,蛋白胨10 g/L,MgSO4·7H2O 2 g/L,瓊脂20 g/L,pH值7.2,121 ℃灭菌20 min。(2)斜面培养基。葡萄糖10 g/L,酵母膏5 g/L,蛋白胨5 g/L,氯化钠5 g/L,琼脂20 g/L,pH值7.2,121 ℃灭菌20 min。(3)种子培养基。葡萄糖10 g/L,酵母膏5 g/L,蛋白胨5 g/L,氯化钠5 g/L,pH值7.2,121 ℃灭菌20 min。(4)发酵培养基。葡萄糖20 g/L,酵母膏10 g/L,蛋白胨10 g/L,MgSO4·7H2O 0.5 g/L,Na2HPO4 1.5 g/L,KH2PO4 0.5 g/L,pH值7.2,121 ℃灭菌20 min。
1.1.3试验设备
紫外分光光度计(UV-2450,日本岛津);可见分光光度计(上海欣茂仪器有限公司);离心机(上海安亭科学仪器厂);旋转蒸发仪(日本东京理化器械株式会社);恒温调速回转式摇床(上海跃进医疗器械厂);数显pH计(上海天达仪器有限公司);生物传感分析仪等。
1.2方法
1.2.1菌种活化
将保存的原始菌株接种于斜面培养基上,将接种后的斜面试管置于恒温培养箱中,30 ℃下培养48 h,之后再进行第2、第3次传代培养,放入冰箱冷藏待用。
1.2.2种子液培养
用接种环从斜面培养基中接1环菌种于种子培养基中,将接好种的三角瓶放入摇床中,在30 ℃、200 r/min条件下培养24 h,种子培养基为250 mL锥形三角瓶中装入50 mL培养基。
1.2.3摇瓶发酵培养
摇瓶发酵培养是将培养好种子培养液按10%(体积分数)接种量的接入装有50 mL发酵液的 250 mL 三角瓶中,在30 ℃、200 r/min条件下摇床培养72 h,发酵结束后进行相关参数测定。
1.2.4皂化法提取辅酶Q10
将菌体移入250 mL磨口锥形瓶内,在锥形瓶中加入2.5 g KOH、0.7 g焦性没食子酸、19 mL 甲醇、7mL蒸馏水,然后混匀,在90 ℃水浴锅中回流 30 min,用自来水迅速冷却到常温,倒入分液漏斗中,在分液漏斗中加入40 mL石油醚,剧烈振荡5 min,进行辅酶Q10的萃取,连续萃取2次,最后把萃取液合并,用蒸馏水洗涤到中性;然后加入5 g无水硫酸钠,干燥并使液体澄清;再用50 ℃的旋转蒸发仪浓缩至干,并且完全挥发,再加入5 mL无水乙醇,放入冰箱中冷冻,使胆固醇等杂质析出,过滤,滤液定容至 10 mL,进行测量。
1.2.5辅酶Q10产量的测定
参照紫外分光光度法[8]。
1.2.6菌株生长曲线的绘制
进行紫外诱变时,通常在细胞对数期进行紫外照射导致发生突变的概率较大,因此须要确定出发菌株的生长曲线。吸取5 mL生理盐水注入活化好的根瘤土壤杆菌斜面种子中,用竹签或接种针将菌落刮下,将菌悬液转移至空试管中用振荡器混匀,从中吸取1 mL菌悬液(按2%接种量)接种到50 mL种子培养基中,于30 ℃、200 r/min 条件下摇床培养,每间隔2 h 取9 mL种子液于事先已称好的10 mL离心管中,于4 000 r/min下离心15 min。洗涤后离心,重复2次,烘干测干质量,并且计算菌体浓度。将各时段的菌体浓度作为纵坐标,培养时间作为横坐标,绘制出发菌株的生长曲线。
1.2.7紫外诱变方法
1.2.7.1菌悬液的制备
取10 mL处于对数生长期(培养12 h)的发酵液,加入进无菌离心管中,10 000 r/min下离心20 min,去除上清液,收集菌体,菌体用10 mL生理盐水洗涤离心3次,然后重新悬于10 mL无菌生理盐水中,备用。使用血球计数板,在显微镜下直接计数,将细胞浓度调整为“亿个/mL”。
1.2.7.2紫外诱变
开启20 W的紫外线灯预热10~15 min,取3 mL制备好的菌悬液,置于1个直径为6 cm的空培养皿中,将培养皿放在离紫外灯30 cm的地方,分别振荡照射0、30、60、90、120、150、180 s,然后在黑暗中分别取0.1 mL处理菌液涂布于平板培养基上,用黑纸包好,30 ℃下倒置培养48 h,计数,绘制致死率曲线。同时,作对照试验,对照组菌悬液不进行紫外照射,其他操作相同。致死率[9]计算公式为:致死率=(对照菌落数-处理菌落数)/对照菌落数×100%。在正式试验时,选取致死率为80%的处理时间进行诱变,其余操作同上。
1.2.7.3初筛
根据致死率曲线,将诱变后的菌液涂布于筛选平板培养基上,30 ℃下培养48 h;挑取生长快、菌落大的单菌落,接入斜面,30 ℃培养48 h,置于4 ℃冰箱保藏,以备复筛。
1.2.7.4复筛
将初筛得到的突变株菌株逐个接入种子培养基中,于30 ℃、200 r/min摇床中培养24 h,然后按10%接种量转接到发酵培养基中,30 ℃、200 r/min培养72 h,离心收集菌体,利用醇碱皂化法提取辅酶Q10,测定菌体生物量及辅酶Q10产量。
1.2.7.5突变株稳定性试验
利用斜面培划线接种进行传代试验,30 ℃下培养48 h;分别测定第2、第4、第6代的辅酶Q10产量,比较其产辅酶Q10的稳定性。
1.2.8发酵培养基优化
1.2.8.1发酵培养基的单因素试验
本试验选择培养基中对发酵影响最大的葡萄糖、酵母膏、Na2HPO4、MgSO4·7H2O 等4种成分,分别考察其不同浓度对诱变菌株发酵产辅酶Q10的影响。其中,葡萄糖浓度为10、20、30、40、50 g/L,酵母膏浓度为5、7.5、10、12.5、15 g/L,Na2HPO4浓度为1.3、1.4、1.5、1.6、1.7 g/L,MgSO4·7H2O浓度为0.3、0.4、0.5、06、0.7 g/L。
1.2.8.2发酵培养基优化的响应面分析试验
根据单因素试验结果,选用葡萄糖、酵母膏、Na2HPO4、MgSO4·7H2O为考察因素,采用Design-Expert软件[10]中的中心组合设计(central composite design,CCD),设计4因素5水平的响应面分析[11]试验,其试验因子和编码水平见表1。
2结果与分析
2.1生长曲线
从图1可以看出,出发菌株在4 h后开始进入对数期,18 h 后进入稳定期。处于对数期的细胞中DNA复制较为活跃,对各种理化刺激较为敏感,出现突变的概率较大,因此选取4~18 h的细菌培养液进行紫外诱变出现变异的概率较大。
2.2紫外照射致死率曲线
从图2可以看出,当辐照时间为120 s时,约97%的根瘤土壤杆菌致死。这几年通过对紫外线诱变效应的研究发现,提高产量的正向突变较多地出现在偏低的剂量中,而负突变则较多地出现在偏高的剂量中[12]。因此,本研究选取的诱变剂量为紫外线照射60~90 s,致死率约为70%~83%,此时发生正向突变的概率较大。
2.3紫外诱变菌株筛选结果
将经过紫外诱变[13]处理后的菌悬液直接涂布于平板上,在30 ℃培养箱中培养48 h,从平板上挑取27株生长良好的单菌落,对这27株菌株进行摇瓶复筛,测定辅酶Q10产量,筛选结果见图3。从图3可以看出,有7株突变株辅酶Q10的产量有所提高,正突变率约为26%。其中,6号突变株Q-6表现最突出,辅酶Q10的产量达到11.92 mg/L,较出发菌株提高了9251%,诱变结果最好,所以选择突变株Q-6进行遗传稳定性研究。
2.5发酵培养基的优化
2.5.1葡萄糖浓度对辅酶Q10产量的影响
从图4可以看出,随葡萄糖浓度的增加,辅酶Q10产量增大,当葡萄糖浓度达到30 g/L时,辅酶Q10产量达到最大,为(10.05±0.301 5)g/L;当葡萄糖浓度继续加大时,辅酶Q10产量反而下降,这可能是由于在发酵过程中添加过多葡萄糖而引起的“葡萄糖效应”,进而影响菌体生长和代谢产物的形成。因此,确定本试验葡萄糖浓度为30 g/L。
2.5.2酵母膏浓度对辅酶Q10產量的影响
从图5可以看出,当酵母膏浓度低于12.5 g/L时,辅酶Q10产量不断增大;当酵母膏浓度达到12.5 g/L时,辅酶Q10产量达到最大,产量为(10.42±0.312 6)g/L;当葡萄糖浓度继续加大时,辅酶Q10产量反而下降,这可能是由于酵母膏成分复杂,在发酵后期底物消耗不完,某些成分抑制菌体生长及产物的合成。所以,酵母膏浓度定为12.5 g/L。
2.5.3Na2HPO4浓度对辅酶Q10产量的影响
从图6可以看出,当Na2HPO4浓度为1.6 g/L时,产量达到最大,此时辅酶Q10产量为(10.43±0.312 9)g/L;但继续加大Na2HPO4浓度时,辅酶Q10产量逐渐下降,这表明过多的Na2HPO4并不利于提高辅酶Q10产量,只有适宜的Na2HPO4浓度才有利于辅酶Q10的形成。所以,在本试验考察范围内,Na2HPO4最佳浓度为1.6 g/L。
2.5.4MgSO4· 7H2O浓度对辅酶Q10产量的影响
从图7可以看出,辅酶Q10产量随MgSO4·7H2O浓度的升高,先升高后降低,并当MgSO4·7H2O浓度达到0.4 g/L时,辅酶Q10产量达到最大,此时产量为(10.23±0.306 9)g/L。这可能是由于较低浓度的Mg2+能够促进辅酶Q10的形成,而当浓度达到一定高度时,又会抑制辅酶Q10的形成。所以,本试验可把MgSO4·7H2O浓度定为0.4 g/L。
2.5.5响应面设计优化发酵培养基组成
2.5.5.1模型的建立及显著性检验
根据单因素结果,采用Design-Expert软件对葡萄糖、酵母膏、Na2HPO4、MgSO4· 7H2O的浓度进行优化,试验结果如表3所示。
用Design-Expert软件对表3数据进行多元回归拟合,可以得到辅酶Q10
[FK(W+45mm][TPSL77.tif]
产量(Y)对葡萄糖浓度(A)、酵母膏浓度(B)、Na2HPO4浓度(C)、[CM(23*2]MgSO4· 7H2O浓度(D)的回归方程为:Y=-49.20+
0.50A+2.60B+32.82C+49.17D+5.20AB-0.07AC-003AD+0.29BC-0.23BD-2.67CD-5.50A2-012B2-10.43C2-52.85D2,对试验结果进行显著性检验及方差分析,结果如表4所示。
对模型进行回归方程系数显著性检验可知,一次项D(MgSO4· 7H2O浓度),交互项AC、BC对辅酶Q10产量影响显著,平方项A2、B2、C2、D2对辅酶Q10产量影响极显著。模型P值<0.000 1,是极显著的,而失拟项的P值=0.789 2,是不显著的,说明该方程的拟合度较好;模型的决定系数R2=0.976 1,表明该模型能较好地预测发酵培养基组分与辅酶Q10产量的关系;模型的调整决定系数R2Adj=0953 7,表明方程模型可信度较高,能够较好地描述试验结果。
2.5.5.2响应面优化及分析
根据CCD试验设计结果作出三维响应面(图8至图13),它们分别反映了葡萄糖浓度(A)、酵母膏浓度(B)、Na2HPO4浓度(C)、MgSO4· 7H2O浓度(D)这4个因素的两两交互作用对产量的影响。
2.5.5.3优化培养基的验证
根据所得的模型,由响应面分析法求得优化后4种成分的最佳浓度为:葡萄糖35.46 g/L、酵母膏12.33 g/L、Na2HPO4 1.58 g/L、MgSO4· 7H2O 0.39 g/L,预测得到辅酶Q10最高产量为11.28 mg/L。为了证实试验结果的可靠性,按上述最终培养基参数进行验证试验,3次重复试验的辅酶Q10产量的平均值为11.32 mg/L,与预测值接近,表明模型是可行有效的,具有一定的实践价值。
[BT1-*8][STHZ]3结论
采用紫外诱变,经过平板初筛和摇瓶发酵复筛,最终获得1株辅酶Q10高产菌株Q-6,其辅酶Q10产量为11.92 mg/L,较出发菌株提高92.57%,且其遗传性稳定。在单因素试验的基础上,应用响应面分析,对其发酵培养基进行优化,得到生产辅酶Q10的最佳发酵培养基配方为:葡萄糖35.46 g/L、酵
参考文献:
[1]Lenaz G,Fato R,Formiggini G,et al. The role of Coenzyme Q in mitochondrial electron transport[J]. Mitochondrion,2007,7(Suppl):28-33.
[2]郜曉峰,罗应刚,官家发.微生物发酵法生产辅酶Q10研究进展[J]. 天然产物研究与开发,2006,18(5):858-862,872.
[3]史立康,徐尔尼,汪金萍,等. 微生物发酵生产辅酶Q10的研究进展[J]. 中国酿造,2006,165(12):4-8.
[4]郑毅,王娅,朱志春,等. 发酵法生产辅酶Q10研究进展[J]. 海峡科学,2012,68(8):128-130.
[5]田玉庭,岳田利,袁亚宏. 根癌土壤杆菌DK-24生产辅酶Q10发酵培养基的优化[J]. 西北农林科技大学学报(自然科学版),2010,38(8):182-188.
[6]姜剑文,陈光,王立梅,等. 根癌农杆菌发酵生产辅酶Q10的培养条件优化[J]. 安徽农业科学,2010,38(12):6128-6130.
[7]田宝静,李剑,聂立影,等. 土壤杆菌中辅酶Q10的提取工艺[J]. 食品与生物技术学报,2009,28(6):858-861.
[8]王根华,钱和,肖刚. 发酵菌体中辅酶的提取及其测定方法[J]. 无锡轻工大学学报,2003,22(2):59-62.
[9]朱俊丰,郑方亮,艾海新,等. 微波结合紫外诱变选育辅酶Q10高产菌株[J]. 微生物学杂志,2010,30(2):57-62.
[10]高晗,南海娟,孔瑾,等. 响应面法优化苦杏仁中黄酮提取工艺[J]. 江苏农业科学,2013,41(10):231-233.
[11]王莹,王华,丁宁,等. 响应曲面法优化水溶性银杏叶多糖提取工艺[J]. 江苏农业科学,2015,43(5):268-270.
[12]邬小兵,徐惠娟,支小鹏,等. 利用甲硝唑及外加氧方法筛选耐氧产氢Klebsiella oxytoca HP1突变菌株[J]. 微生物学通报,2008,35(3):327-331.
[13]高启禹,徐光翠,张文博,等. 褐黄孢链霉菌高产纳他霉素的诱变选育[J]. 江苏农业科学,2013,41(8):360-362.
