八味益肾丸制备中的回收乙醇的质量研究
2017-07-20段树卿徐苗苗尹占芳胡晓梅李云霞
段树卿,宋 佳,徐苗苗,尹占芳,胡晓梅,李云霞
(颈复康药业集团有限公司中心化验室,河北 承德067000)
八味益肾丸制备中的回收乙醇的质量研究
段树卿*,宋 佳,徐苗苗,尹占芳,胡晓梅,李云霞#
(颈复康药业集团有限公司中心化验室,河北 承德067000)
目的:建立八味益肾丸制备中的回收乙醇的质量控制方法。方法:以乙醇中杂质、提取药材主成分的残留和安全性限量为综合评价指标,检测循环使用的回收乙醇的质量。结果:在八味益肾丸的制备中,回收乙醇循环使用20次内,其含有的杂质、提取药材主成分残留和安全性限量均符合要求。结论:本方法可用于八味益肾丸制备中的回收乙醇的质量控制,并可确定回收乙醇的循环使用次数。
八味益肾丸; 乙醇回收使用次数; 检查指标
在中药制剂的制备中,多采用乙醇来提取有效成分,或采用水提醇沉法除去药物中的杂质,以提高制剂质量。而乙醇作为一种溶剂,其质量有严格的规定。根据《药品生产质量管理规范》(2010年修订)附录5,“中药制剂第三十二条:中药提取用溶剂需回收使用的,应当制定回收操作规程;回收后溶剂的再利用不得对产品造成交叉污染,不得对产品的质量和安全性有不利影响”。八味益肾丸是由蚕蛾、淫羊藿、熟地黄、当归(酒炒)、菟丝子(炒)、杜仲(炒)、山药、鹿角胶等中药材组成的中药复方制剂,收载于国家食品药品监督管理局标准(YBZ10522009)中,具有温阳补肾、养血填精的功效[1]。目前已有对蚕蛾[2-4]、淫羊藿[5-7]、当归(酒炒)[8-9]等的相关研究报道。参考相关文献[10-13],本研究对八味益肾丸制备中所用乙醇进行回收或精馏,进而以乙醇中的杂质、提取药材主成分的残留和安全性限量为检测指标,建立了回收乙醇的质量控制方法;同时探讨了回收乙醇循环使用的次数,为实际生产中同品种回收乙醇的循环利用提供了理论依据。
1 材料
1.1 仪器
多功能提取罐(武汉制药机械有限公司);酒精精馏塔(无锡南泉化工成套设备有限公司);Agilent1260型高效液相色谱仪(美国安捷伦公司);KQ-500DE型医用数控超声波清洗器(昆山市超声仪器有限公司);AE 240型十万分之一电子分析天平(瑞士梅特勒托利多公司)。高效硅胶G板(烟台市化学工业研究所,批号:130830);高效硅胶H板(青岛谱科分离材料有限公司,批号:20150818)。
1.2 药品与试剂
淫羊藿苷对照品(批号:110737—200415),阿魏酸对照品(批号:110773—201012),淫羊藿对照药材(批号:121632—201101),当归对照药材(批号:120927—201014),蚕蛾对照药材(批号:121457—200501),均购于中国食品药品检定研究院;磷酸(天津市光复科技发展有限公司)、甲醇(美国Fisher公司)、乙腈(美国Fisher公司)为色谱纯;甲醇、乙醇、乙酸乙酯、丁酮、甲酸、正己烷、石油醚(30~60 ℃)(天津佳兴化工玻璃仪器工贸有限公司)为分析纯;纯化水(三级反渗法制得)。八味益肾丸的制备原料均由颈复康药业集团有限公司提供。
2 方法与结果
2.1 八味益肾丸的处方与制备工艺
2.1.1 处方:蚕蛾、淫羊藿、熟地黄、当归(酒炒)、菟丝子(炒)、杜仲(炒)、山药、鹿角胶。
2.1.2 制备工艺:山药,鹿角胶粉成细粉;淫羊藿、当归采用50%乙醇回流提取2次,每次1.5 h,合并提取液,滤过,滤液减压回收乙醇,浓缩至相对密度为1.25~1.30(50 ℃)的清膏;熟地黄、菟丝子、杜仲加水浸泡30 min后,煎煮1 h,滤过,药渣与淫羊藿、当归提取后的药渣合并,加水煎煮1 h,滤过,合并二次煎煮液,浓缩至相对密度为1.25~1.30(50 ℃)的清膏,与上述淫羊藿、当归的清膏合并,干燥,干浸膏粉碎成细粉;蚕蛾加入乙醇回流提取2次,第1次浸泡8 h后提取,每次提取1 h,合并提取液,滤过,滤液减压回收乙醇至无醇味,与山药、鹿角胶细粉、干浸膏细粉及适量的淀粉混匀,加水制丸,干燥,以黑色氧化铁为着色剂,包衣,干燥,制成1 000 g,即得。
2.2 回收乙醇的杂质检测
2.2.1 供试品溶液a的制备:根据八味益肾丸的提取工艺,经外循环浓缩器真空减压蒸馏得到回收乙醇。减压蒸馏分两组进行,一组为淫羊藿、当归提取过程中的回收乙醇,一组为蚕蛾提取过程中的回收乙醇。两组混匀,取样,待检。对循环使用20次内的回收乙醇按照上述方法收集,待检,即得。
2.2.2 供试品溶液b的制备:精密量取4-甲基-2-戊醇150 μl,置于500 ml容量瓶中,加入乙醇稀释至刻度,摇匀,即得。
2.2.3 对照溶液a的制备:精密量取无水甲醇100 μl,置于50 ml容量瓶中,加入乙醇稀释至刻度,摇匀;精密量取上述溶液5 ml,置于50 ml容量瓶中,加入乙醇稀释至刻度,摇匀,即得。
2.2.4 对照溶液b的制备:精密量取无水甲醇、乙醛各50 μl,置于50 ml容量瓶中,加入乙醇稀释至刻度,摇匀;精密量取上述溶液100 μl,置于10 ml容量瓶中,加入乙醇稀释至刻度,摇匀,即得。
2.2.5 对照溶液c的制备:精密量取乙缩醛150 μl,置于50 ml容量瓶中,加入乙醇稀释至刻度,摇匀;精密量取上述溶液100 μl,置于10 ml容量瓶中,加入乙醇稀释至刻度,摇匀,即得。
2.2.6 对照溶液d的制备:精密量取苯100 μl,置于100 ml容量瓶中,加入乙醇稀释至刻度,摇匀;精密量取上述溶液100 μl,置于50 ml容量瓶中,加入乙醇稀释至刻度,摇匀,即得。
2.2.7 挥发性杂质检测:根据《中华人民共和国药典:四部》(2015年版)中“气相色谱法”(通则0521)进行检验。精密量取“2.2.1”“2.2.2”项下供试品溶液a、b及“2.2.3”“2.2.4”“2.2.5”“2.2.6”项下对照溶液a、b、c、d各1 μl,分别注入气相色谱仪,记录色谱图。根据《中华人民共和国药典:二部》(2015年版)“乙醇”项下规定,甲醇量不得超过0.02%,乙醛和乙缩醛总量不得超过0.001%,苯不得超过0.000 2%,结果表明,乙醇循环使用20次内的挥发性杂质检测结果符合要求,见表1。
2.2.8 不挥发性杂质检测:根据《中华人民共和国药典:四部》(2015年版),取“2.2.1”项下供试品溶液a 100 m1,置于105 ℃恒质量的蒸发皿中,于水浴上蒸干后,在105 ℃下干燥2 h,称质量,计算。根据《中华人民共和国药典:二部》(2015年版)“乙醇”项下规定,其不挥发性杂质不得超过1.0 mg/40 ml,结果表明,乙醇循环使用20次内的挥发性杂质检测结果符合要求,见表1。

表1 回收乙醇中的杂质检测
2.3 提取药材主成分的残留检测
2.3.1 薄层鉴别:精密量取“2.2.1”项下供试品溶液a 100 ml,蒸至近干,根据《中华人民共和国药典》(2015年版)要求,对乙醇提取过程中的相关药材(淫羊藿、当归、蚕蛾)进行薄层鉴别,结果表明淫羊藿、当归、蚕蛾均未在循环使用20次内的回收乙醇中检出,见表2。
2.3.2 定量限及检测限:根据《中华人民共和国药典:四部》(2015年版)“药品质量标准分析方法验证指导原则(通则 9101)”要求,测定淫羊藿苷的检测限为0.41 ng,定量限为0.81 ng;阿魏酸的检测限为0.33 ng,定量限为1.23 ng。
2.3.3 含量测定:精密量取“2.2.1”项下供试品溶液a 100 ml,蒸至近干,根据《中华人民共和国药典:一部》(2015年版)要求,对当归中阿魏酸、淫羊藿中淫羊藿苷进行含量测定,结果表明淫羊藿、当归均未在循环使用20次内的回收乙醇中检出,见表2。
2.4 安全性限量检测
2.4.1 检测限和定量限:根据《中华人民共和国药典:四部》(2015年版)“药品质量标准分析方法验证指导原则(通则9101)”要求,测定黄曲霉毒素的检测限为0.3 μg/kg;农药残留α-六氯化苯、β-六氯化苯、γ-六氯化苯、δ-六氯化苯的定量限分别为1.25、2.50、1.25、1.25 μg/kg,对,对-二氯二苯基二氯乙烯、对,对-二氯二苯基二氯乙烷、邻,对-二氯二苯基三氯乙烷、对,对-二氯二苯基三氯乙烷的定量限分别为2.50、2.55、12.50、12.50 μg/kg;五氯硝基苯的定量限为1.25 μg/kg;铅、镉、砷、汞、铜的定量限分别为0.100、0.025、0.125、0.005、1.000 mg/kg。

表2 回收乙醇中提取药材主成分残留检测Tab 2 Determination of residue of extraction of medicinal materials principal components in recycled ethanol
2.4.2 二氧化硫的检测:根据《中华人民共和国药典:四部》(2015年版)“二氧化硫残留量测定法”中的第一法——酸碱滴定法进行检测,结果表明,循环使用20次内的回收乙醇未检出二氧化硫,见表3。
2.4.3 黄曲霉毒素的检测:根据《中华人民共和国药典:四部》(2015年版)“黄曲霉毒素测定法”中的第一法进行检测,结果表明,循环使用20次内的回收乙醇未检出黄曲霉毒素,见表3。
2.4.4 农药残留的检测:根据《中华人民共和国药典:四部》(2015年版)“农药残留量测定法”中的有机氯类农药残留量测定法第一法进行检测,结果表明,循环使用20次内的回收乙醇未检出农药残留,见表3。
2.4.5 重金属的检测:根据《中华人民共和国药典:四部》(2015年版),铅、镉、铜采用原子吸收分光光度法检验;砷、汞采用原子荧光光度计法检验。结果表明,循环使用20次内的回收乙醇中,最高含铅、镉、砷、汞、铜量分别为1.400、0.150、0.070、0.030、0.300 mg/kg,见表3。
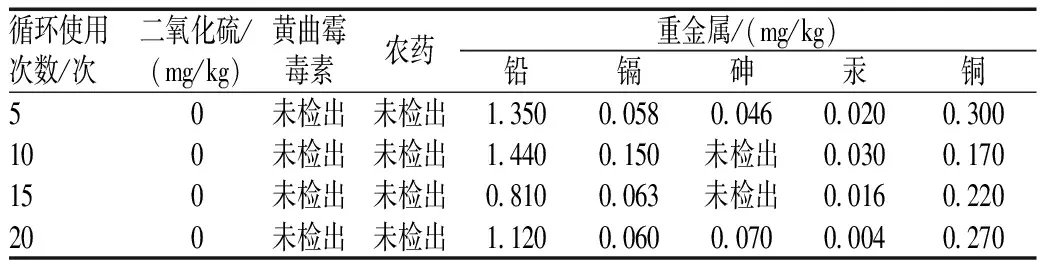
表3 回收乙醇中的安全性限量检测Tab 3 Determination of security of limited extracts in recycled ethanol
3 讨论
本研究是在工艺用水系统、检验方法、关键生产设备及辅助设施均验证合格的基础上进行的。方法中“提取药材的安全性指标检测”在《中华人民共和国药典》(2015年版)中未作规定,但从安全风险角度考虑,本研究参考相关文献,增加了安全性限量的检测,并对样品规定了重金属及有害物质最低限度[14-15]。
本研究样品为制剂生产过程中的回收乙醇。本研究建立了同种制剂回收乙醇中的杂质、提取药材主成分残留和安全性限量的考察。结果表明,在八味益肾丸制备中,回收的乙醇循环使用20次内,其含有的杂质、提取药材主成分残留和安全性限量均符合要求。说明同种制剂的回收乙醇在一定的循环使用次数内,不会对制剂造成交叉污染,不会影响制剂的质量和安全性。
综上所述,经精馏及减压回收的乙醇是可以循环使用的。同种制剂的回收乙醇在循环使用时,其指标性成分变化很小。
[1]苏国林,李君.八味益肾丸的质量控制研究[J].中国中医药现代远程教育,2013,11(22):155-257.
[2]任桂玲,董晓强,郭艳玲,等.八味益肾丸中雄蚕蛾油质量控制的研究[J].中国医药指南,2014,12(27):69-71.
[3]黄新球,杨有仙,王艳辉,等.蚕蛾油的研究进展[J].中国酿造,2014,33(8):20-23.
[4]陈智毅,刘学铭,吴娱明,等.GC-MS法分析蚕蛾油与蚕蛹油的脂肪酸组成[J].食品科学,2010,31(12):182-184.
[5]文治瑞,杨卫灵,田红红,等.淫羊藿挥发油的指纹图谱[J].中国实验方剂学杂志,2015,21(7):39-42.
[6]王焕珍,柴艺汇,陈云志,等.淫羊藿化学成分与药理作用研究进展[J].亚太传统医药,2016,12(7):63-65.
[7]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:327-328.
[8]牛亭惠,吴国泰,刘五州,等.当归挥发油稳定性研究概况[J].甘肃中医药大学学报[J].2016,33(3):93-96.
[9]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:133-134.
[10] 蒋三元,曾志坚,林传辉,等.中草药制剂的回收乙醇中杂质的去除方法探讨[J].中国医药导报,2008,5(5):33-34.
[11] 郝云龙,朱路甲,曹泽礼.关于木糖收率及回收乙醇的研究[J].河南化工,2010,27(9):23-26.
[12] 莫明秀,曾志坚,将三元,等.中草药制剂回收乙醇的质量分析[J].中国医药导报,2008,5(8):32-33.
[13] 王炯,张蕾,沈云.中药含醇液采用MVR蒸发器联合超重力精馏器回收乙醇的质量分析[J].海峡药学,2015,27(10):63-65.
[14] 章颖慧,王秀英,杨明,等.中药有害残留物限量制定原则及其影响因素[J].药物分析杂志,2015,35(3):558-567.
[15] 中华人民共和国对外贸易经济合作部.药用植物及制剂进出口绿色行业标准WM2—2001[S].对外贸易经济合作部公告〔2001〕年第4号.2001-04-23.
Study on Quality of Recycled Ethanol from Preparation of Baweiyishen Pills
DUAN Shuqing, SONG Jia, XU Miaomiao, YIN Zhanfang, HU Xiaomei, LI Yunxia
(Central Laboratory, Jingfukang Pharmaceutical Group Co. Ltd., Hebei Chengde 067000, China)
OBJECTIVE:To establish the method for quality control of recycled ethanol from preparation of Baweiyishen pills. METHODS: Impurities in the ethanol, residue of extraction of medicinal materials principal components and security of limited extracts were set as indicators to determine the quality of recycled ethanol. RESULTS: During the preparation process of Baweiyishen pills, the impurities in the ethanol, residue of extraction of medicinal materials principal components and security of limited extracts in recycled ethanol all met the requirements within twenty times. CONCLUSIONS: This method is can be used for quality control of recycled ethanol from preparation of Baweiyishen pills, and can ensure the recycled application times of recycled ethanol.
Baweiyishen pills; Application times of recycled ethanol; Determination indicator
R927.11
A
1672-2124(2017)05-0661-03
2017-02-09)
*工程师。研究方向:中药制剂工艺及质量标准。E-mail:314208069@qq.com
#通信作者:高级工程师,工程硕士。研究方向:中药生产工艺技术及质量管理、质量标准研究。E-mail:cdjfk-lyx@163.com
DOI 10.14009/j.issn.1672-2124.2017.05.032
