叔丁基对苯二酚及其氧化产物与牛血清蛋白的相互作用
2017-07-19毕艳兰孙尚德丁一冉河南工业大学粮油食品学院郑州450001
李 军 毕艳兰 孙尚德 丁一冉(河南工业大学粮油食品学院,郑州 450001)
叔丁基对苯二酚及其氧化产物与牛血清蛋白的相互作用
李 军 毕艳兰 孙尚德 丁一冉
(河南工业大学粮油食品学院,郑州 450001)
采用紫外吸收光谱和荧光光谱法研究叔丁基对苯二酚(TBHQ)及其氧化产物叔丁基对苯二醌(TQ)与牛血清蛋白(BSA)的结合作用。结果表明,TBHQ和TQ与BSA之间发生了相互作用并形成新的聚合体;TBHQ和TQ与BSA的荧光猝灭均属于静态猝灭机制。TBHQ和TQ与BSA之间的结合常数均大于104L/mol,表明它们之间形成的配合物结合较为牢固;TBHQ和TQ与BSA之间的结合位点数均为1;通过热力学参数方程计算得出:ΔH<0、ΔS>0和ΔG<0,表明它们之间结合的主要作用力是氢键和疏水作用力,此过程是自发进行的。根据Forster非辐射能量转移理论计算出供能体(BSA)与受能体(TBHQ和TQ)之间的结合距离r分别为3.13和3.73 nm。研究结果表明,TBHQ和TQ与BSA的结合引起了BSA的构象变化。
叔丁基对苯二酚 叔丁基对苯二醌 牛血清蛋白 紫外吸收光谱 荧光光谱
油脂及富油食品中常常添加酚类抗氧化剂,尤其是TBHQ,来延长其保质期。随着放置时间的延长,油脂及富油食品中的TBHQ会与氧气和油脂自由基(R·和ROO·)等发生反应生成TQ[1]。添加的TBHQ及其氧化产物TQ也会进入人体进行新陈代谢,并可能与人体自身的一些蛋白质、酶等发生相互作用,从而影响人体的生理机能和正常的新陈代谢,因此TBHQ和TQ与生物大分子蛋白质相互作用的研究是极为重要的。
血清蛋白是血浆中含量最丰富的可溶性蛋白和载体蛋白,它有着重要的运载、缓冲和营养功能,其最为显著的功能是作为许多外源性物质的贮存蛋白和转运蛋白,可与许多内源性或外源性化合物结合。药物学相关研究表明,药物小分子(多为酚类物质)与蛋白质之间会发生一定的相互作用,引起蛋白质二级、三级空间结构发生构象变化,这对酚类物质在体内的代谢会产生一定的影响[2]。因此,对于酚类物质与血清蛋白之间的研究是极为重要的。研究酚类物质与蛋白的结合将有助于解释其代谢和运输过程,同时也有助于解释蛋白质的空间结构与生理功能之间的关系。另外,由于BSA与人血清蛋白是同源性蛋白质,结构上具有很高的相似度,因此常常被用于代替人血清蛋白作为研究对象[3]。
对于TBHQ与蛋白质的相互作用已有学者做了相关的研究。Shahabadi等[3]研究了TBHQ与牛血清蛋白之间的相互作用,发现其猝灭过程是静态猝灭,此过程引起蛋白质构象发生变化,结合位点数是1,主要作用力是疏水作用力和氢键,此过程是自发进行的。但是,作为TBHQ氧化产物的TQ,其毒性远大于TBHQ[4],它与蛋白质之间的作用鲜有报道。
本试验以TBHQ做对比,模拟人体生理pH=7.4条件,采用紫外吸收光谱和荧光光谱法来研究TQ与BSA之间的相互作用,并对其猝灭机制、作用力的类型、结合常数、结合位点数、蛋白质的构象变化等进行考察,这对阐明其在人体内代谢过程中与血清蛋白的结合规律具有重要的意义,还能从微观层面揭示TQ与蛋白质的作用机制。
1 材料与方法
1.1 材料与试剂
TBHQ(纯度≥99.00%)、TQ(纯度≥99.00%)、Tris(纯度≥99.90%):美国Sigma-Aldrich公司;BSA(第五组分,相对分子质量68 000.00):瑞士Roche公司;盐酸(分析纯,浓度为36.46%):洛阳化学试剂厂;无水乙醇(色谱纯):天津市科密欧化学试剂有限公司;水为二次去离子水。
1.2 仪器与设备
PHS-3C型pH计:上海电科仪器股份有限公司;T1900型紫外分光光度计(带有恒温水浴装置):北京普析仪器有限公司;日立F7000型荧光分光光度计(带有恒温水浴装置):日本日立高新技术公司;2695-2487型高效液相色谱分析仪:美国Waters公司;SCQ-250B超声仪:上海生彦超声仪器有限公司。
1.3 试验方法
1.3.1 标准溶液的配制
1.20×10-5mol/L BSA标准溶液:准确称取0.41 g BSA于500 mL棕色容量瓶,用0.10 mol/L pH=7.40的Tris-HCl缓冲溶液(内含0.10 mol/L NaCl维持离子强度)定容至500 mL。
3.00×10-3mol/L TBHQ标准溶液:准确称取0.05 g TBHQ于100 mL棕色容量瓶,用色谱纯无水乙醇定容至100 mL。
3.00×10-3mol/L TQ标准溶液:准确称取0.05 g TQ于100 mL棕色容量瓶,用色谱纯无水乙醇定容至100 mL。
所有标准溶液均放置于1~4 ℃冰箱中储存。
1.3.2 TBHQ及其氧化产物TQ的定性测定
分别称取2.00 mg TBHQ、TQ标准品于100 mL棕色容量瓶,用色谱纯无水乙醇定容至100 mL,摇匀后储存于1~4 ℃冰箱中备用。经0.45 μm有机过滤膜进行过滤后,采用高效液相色谱仪进行定性测定。用正相HPLC法检测TBHQ和TQ,检测条件:色谱柱:Sunfire prep silica柱(4.6 mm×250 mm,5 μm);流动相:5%乙酸乙酯的正己烷(A):5%异丙醇的正己烷(B);梯度洗脱:10% B等度为10 min,10% B到100% B为5 min,100% B等度为12 min;流速:0.80 mL/min;检测波长:280、310 nm;进样体积:20 μL,柱温:30 ℃。溶剂A、B均超声脱气40 min。
1.3.3 紫外吸收光谱测定
将浓度为1.20×10-5mol/L的BSA标准溶液分别加入9个10 mL棕色容量瓶中并定容后,再用微量注射器分别向其中加入0、10、20、30、40、50、60、70、80 μL的TBHQ标准溶液(3.00×10-3mol/L)进行紫外滴定。每次加入TBHQ标准溶液后,分别于25、37 ℃恒温水浴锅中磁力搅拌6 min,以BSA标准溶液做参比,进行紫外光谱扫描并记录其在200~400 nm波长范围内的吸收光谱。将TBHQ替换为TQ,按相同方法测定。
1.3.4 普通荧光光谱和同步荧光光谱测定
将浓度为1.20×10-5mol/L的BSA标准溶液分别加入9个10 mL棕色容量瓶中并定容后,再用微量注射器分别向其中加入0、10、20、30、40、50、60、70、80 μL的TBHQ标准溶液(3.00×10-3mol/L)进行荧光滴定。每次加入TBHQ标准溶液后,分别于15、25、37 ℃恒温水浴锅中磁力搅拌6 min,以BSA标准溶液做参比,280 nm为激发波长,进行荧光光谱扫描并记录其在290~500 nm波长范围内的发射光谱(激发光栅和发射光栅均为5 nm)。分别以Δλ=15和60 nm进行同步荧光光谱扫描并记录其在265~485 nm和220~440 nm波长范围内的发射光谱。将TBHQ替换为TQ,按相同方法测定。
2 结果与讨论
2.1 TBHQ和TQ的定性测定
TBHQ作为油脂及富油食品中最常用的合成抗氧化剂,其稳定性较好,其在空气或油脂体系中加热的主要转化产物是TQ[1,5]。TQ在干燥的空气中很稳定,但在潮湿空气中易被还原生成TBHQ。为了避免检测过程中TBHQ和TQ之间的相互转化,本试验以正相HPLC法定性检测TBHQ和TQ。图1为TBHQ和TQ分别在双波长测定下的正相HPLC色谱图,其保留时间分别为27.60和5.66 min。

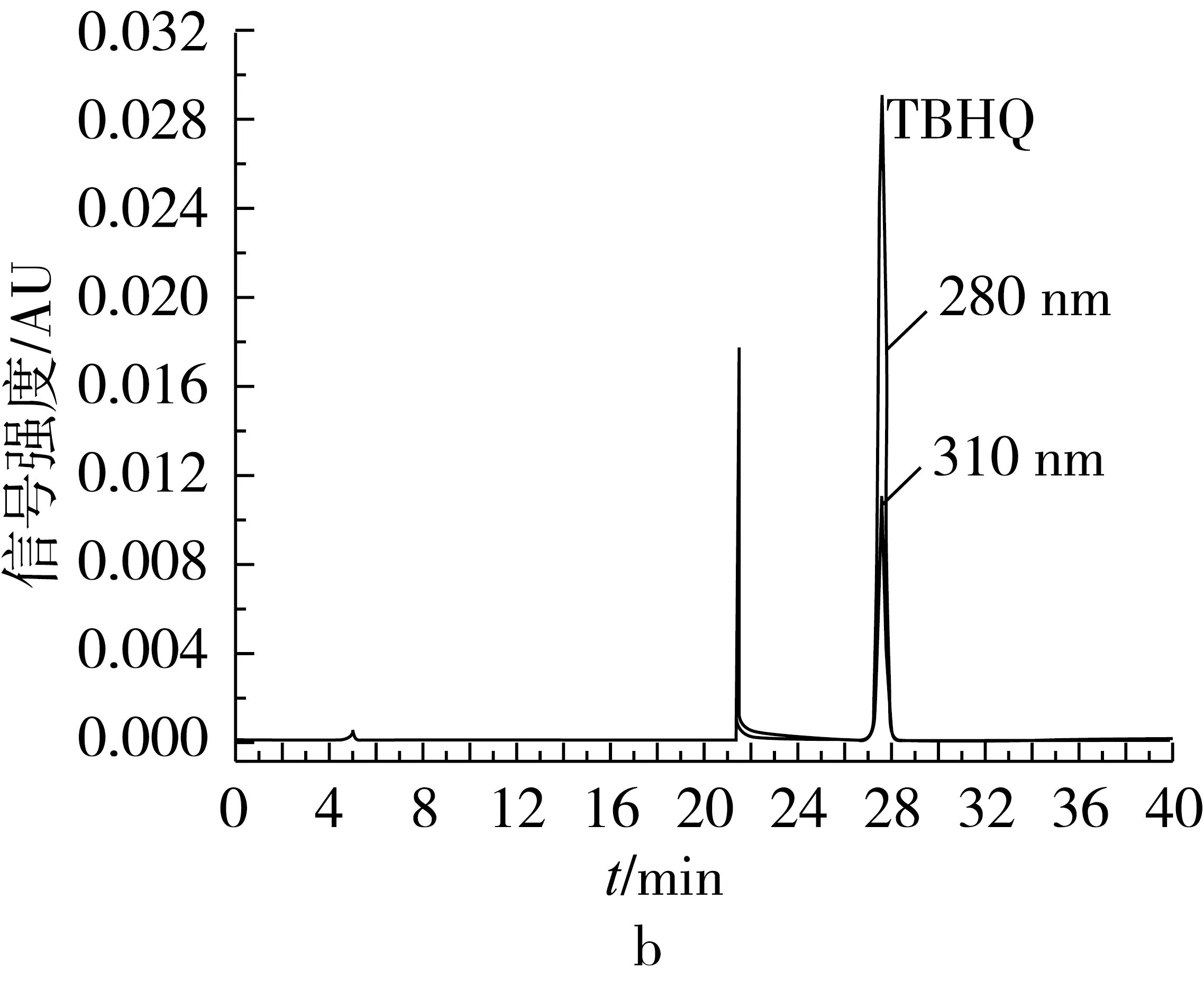
图1 TBHQ和TQ的正相HPLC图
2.2 紫外吸收光谱法
模拟人体条件,用pH为7.40的Tris-HCl溶液做参比,测量25 ℃下BSA、TBHQ、TQ以及BSA-TBHQ与BSA-TQ的紫外吸收光谱,如图2所示。

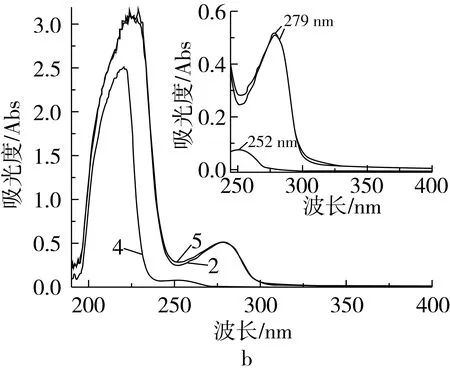
注:1为TBHQ,2为BSA,3为BSA-TBHQ,4为TQ,5为BSA-TQ。
图2 25 ℃下TBHQ/TQ、BSA和BSA-TBHQ/BSA-TQ的紫外吸收光谱
由图2可知,BSA在279 nm处有最大吸收峰出现,TBHQ在292、254 nm处有最大吸收峰出现,TQ在252 nm出有最大吸收峰出现;BSA-TBHQ体系在279 nm处的吸光度为0.531,小于BSA与TBHQ在279 nm处的吸光度之和(分别为0.510和0.149);BSA-TQ体系在279 nm处的吸光度为0.511,也小于BSA与TQ的吸光度之和(分别为0.005和0.515),即BSA-TBHQ体系和BSA-TQ体系均不符合Beer定律的加和性。由此表明BSA分别与TBHQ和TQ之间发生了相互作用并且形成了新的聚合体[6]。
2.3 荧光光谱法
通常,蛋白质的荧光是由蛋白质的3种带有苯环的氨基酸(色氨酸、酪氨酸、苯丙氨酸)的内在基团的特性引起的。实际上,许多蛋白的荧光主要是由色氨酸产生的。荧光猝灭是指由一些能够发射出荧光的物质同一些溶剂分子之间发生相互作用从而引起了荧光基团荧光强度减弱的过程。这其中包括激发态的反应、能量转变、分子的重新排列、以及基态复合物的形成和碰撞猝灭。
研究在不同温度下(15、25、37 ℃)抗氧化剂TBHQ、TQ对BSA荧光强度的影响,结果如图3所示。
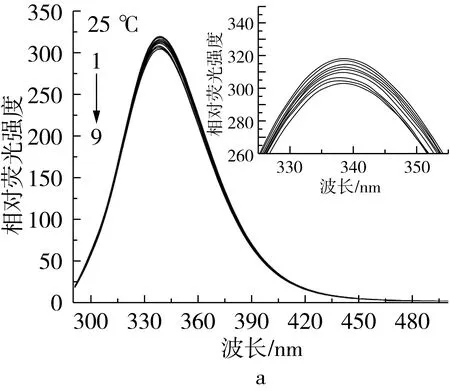
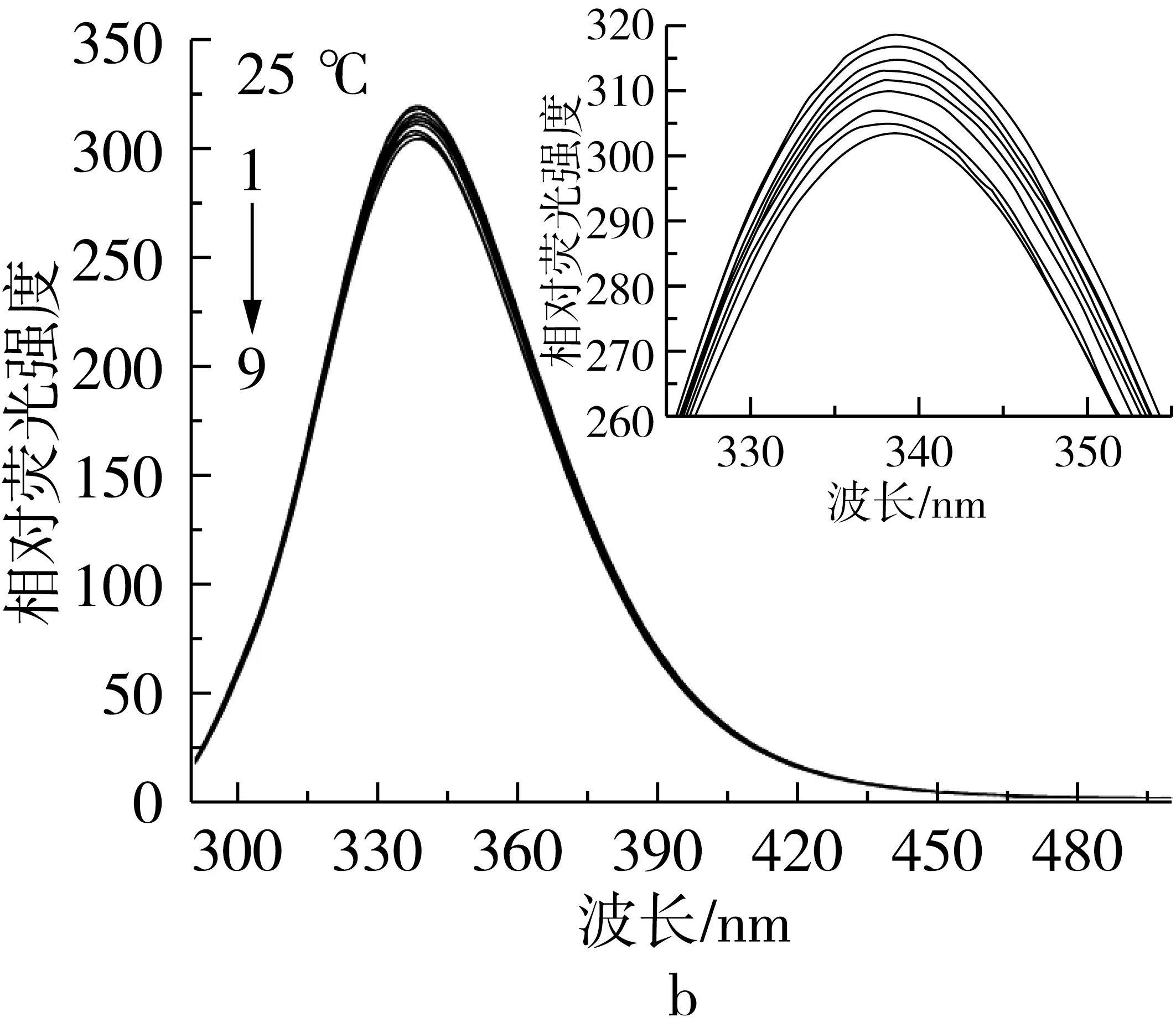
注:c(BSA)=1.20×10-5mol/L,c(TBHQ/TQ)/c(BSA)=0、0.25、0.50、0.75、1.00、1.25、1.50、1.75、2.00,余同。
图3 不同温度下BSA与不同浓度TBHQ/TQ作用的荧光光谱(以25 ℃为例)
由图3可以看出,不同温度下,BSA-TBHQ和BSA-TQ 3个体系中BSA在339 nm附近均有很强的荧光发射峰,TBHQ和TQ在339 nm附近区域均无荧光发射峰;随着不断滴加TBHQ/TQ溶液到BSA溶液中,BSA的荧光强度会有明显的减弱现象,且最大发射波长逐渐发生红移,但BSA的峰形没有发生变化,说明BSA与TBHQ和TQ之间发生了相互作用,BSA在变性过程中发生了构象的变化,从而导致BSA发生了荧光猝灭。此结果与Shahabadi等[3]的研究结果是相似的。
2.3.1 猝灭类型
根据猝灭方式的不同,猝灭过程被分为2种,一种是动态猝灭,即指在激发态瞬间存在时,荧光基团与猝灭剂接触的过程;另一种是静态猝灭,是指由一些能够发射出荧光的物质(基态荧光分子)与猝灭剂之间通过结合生成了非荧光复合物从而导致荧光强度减弱的过程。一般情况下,根据温度和激发态寿命的不同来区分动态猝灭和静态猝灭,这2种猝灭类型的荧光强度都与所添加猝灭剂的浓度有关。
荧光猝灭可以通过Stern-Volmer方程来表述[7]:
F0/F=1+Κqτ0[Q]=1+Ksv[Q]
(1)
式中:F0和F分别表示向溶液中添加猝灭剂前后的BSA的荧光强度、Kq为生物分子的猝灭速率常数、Ksv为动态猝灭常数、τ0为无猝灭剂时荧光分子的平均寿命的值(τ0=6.2 ns)、[Q]为猝灭剂的浓度。

图4 不同温度下TBHQ/TQ与BSA相互作用的Stern-Vorlmer曲线(T=15、25、37 ℃)
不同温度下TBHQ、TQ对BSA荧光猝灭作用的Stern-Volmer曲线如图4所示,可看出BSA的F0/F值与TBHQ/TQ在0到2.40×10-5mol/L的浓度范围内呈线性关系,同时通过线性拟合可以得到不同温度下(15、25、37 ℃)的直线方程和相关系数(表1),其相关系数均>0.98,由此表明在这一系列浓度下存在单一的猝灭机制,即静态猝灭或动态猝灭[8]。
动态猝灭和静态猝灭可以温度来区分[9]。动态猝灭由于与扩散有关,当温度升高时溶液的黏度下降,同时分子的运动加速,其结果将使分子的扩散系数增大,从而增大分子猝灭常数。反之,温度升高可能引起配合物稳定性的下降,静态猝灭常数减小。
根据表1中BSA-TBHQ和BSA-TQ 3个体系在不同温度下的Stern-Vorlmer曲线方程的斜率和截距算出3个体系在在不同温度下的动态猝灭常数Ksv和猝灭速率常数Kq,结果如表2所示。
由表2可以看出,BSA-TBHQ和BSA-TQ 3个体系的Ksv均随着温度的升高而减小,表明BSA与TBHQ及BSA与TQ的反应过程都是静态猝灭过程。另外,由表2也可以看出,BSA-TBHQ和BSA-TQ体系的猝灭速率常数Kq的值约为1011L/(mol·s)。由于各种荧光猝灭剂对于生物大分子的最大动态荧光猝灭速率常数Kq约为1010L/(mol·s)[10]。显然,BSA与TBHQ、TQ作用引起的猝灭常数大于最大动态荧光猝灭速率常数。进一步表明BSA与TBHQ、TQ反应的猝灭过程不是由动态碰撞引起的,而是因为它们之间通过静态结合形成配合物产生的。
2.3.2 结合常数和结合位点数
对于静态猝灭过程,如果生物分子中存在相似的和独立的结合位点,则结合常数(Kb)和结合位点数(n)可根据方程(2)求得。
log(F0/F-1)=logKb+nlog[Q]
(2)
式中:Kb为TBHQ/TQ与蛋白相互作用的结合常数;n为每个蛋白分子的结合位点数。
根据方程(2)做log(F0/F-1)对log[Q]的双对数回归曲线,相应的回归方程和相关系数如表3所示。由表3可以看出,BSA-TBHQ、BSA-TQ 3个体系不同温度下log(F0-F0/F)对log[Q]所做双对数回归曲线的相关系数均大于0.98,表明方程(2)的假设是正确的;在试验温度下n的值约为1,表明BSA与TBHQ、TQ的结合位点数均仅有1个;结合常数约为104L/mol,说明BSA与TBHQ、TQ之间的结合较为牢固。BSA的主要结合区域位于具有相似化学性质的亚结构域IIA(Sudlow’s Site I)和IIIA(Sudlow’s Site II)的疏水腔中。因此,TBHQ和TQ最可能与区域ⅡA的疏水性空腔相结合,即212位色氨酸所在的结合位点附近。
2.3.3 TBHQ、TQ与BSA的结合方式
一般情况下,小分子与生物分子之间的相互作用力有疏水作用力、静电作用力、范德华作用力和氢键[11]。为了阐明TBHQ、TQ与BSA之间的相互作用,以lnKb对1/T进行线性拟合,根据热力学方程(3)、(4)计算其相应的热力学参数如焓变(ΔH)、熵变(ΔS)和自由能变(ΔG),结果如表4所示。
lnKb=-ΔH/RT+ΔS/R
(3)
ΔG=ΔH-TΔS
(4)
式中:Kb为相应温度下的结合常数;R为气体常数。如果温度变化不明显,ΔH可视为常数。
由表4中ΔH、ΔS值可得出TBHQ、TQ与生物分子BSA之间相互作用的结合方式:ΔS>0表明了疏水作用力的存在,这是因为水分子在TBHQ、TQ周围排列有序,蛋白质获得了1个随机结构。ΔH<0且不接近于0表明主要作用力不可能是静电作用力。当有氢键结合时,ΔH<0。因此,TBHQ、TQ与BSA相互作用的主要作用力是疏水作用力与氢键。并且由ΔG<0可以得知此反应过程是自发进行的。
2.3.4 TBHQ和TQ与BSA之间的能量转移
根据Foster偶极-偶极非辐射能量转移理论,当能够发射荧光的供能体与受能体之间的最大距离不超过7 nm,且供能体的荧光发射光谱与受能体的紫外吸收光谱有足够的重叠时,将会发生非辐射能量转移现象,从而导致荧光体发生荧光猝灭[3]。
从图5中可以看出,TBHQ和TQ的紫外吸收光谱与BSA的荧光发射光谱均有一定程度的重叠,因此,根据能量转移理论公式(5)、(6)、(7)可求得TBHQ和TQ与BSA的结合距离r0,即能量转移的距离。

表1 不同温度下TBHQ/TQ与BSA相互作用的Stern-Vorlmer曲线方程和相关系数

表2 不同温度下BSA-TBHQ/BSA-TQ体系的动态猝灭常数(Ksv)、猝灭速率常数(Kq)

表3 BSA-TBHQ/BSA-TQ体系的双对数曲线方程、相关系数、结合常数(Kb)和结合位点数(n)

表4 不同温度下BSA-TBHQ/BSA-TQ体系的热力学参数
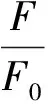
(5)
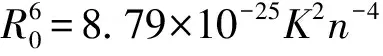
(6)
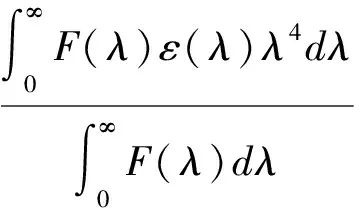
(7)
式中:E为能量转移效率;R0为转换能量效率取50%时的临界距离;r0为能量转移的实际距离;K2为偶极空间取向因子,通常取平均值2/3;φ为没有能量转移时供能体的荧光量子产率,通常蛋白质中取色氨酸的量子产率0.118;n为介质的折射率,通常取水和有机物折射率的平均值1.336;J为供能体的荧光发射光谱和受能体的紫外吸收光谱的重叠,F(λ)为波长从λ到λ±Δλ范围内经过矫正的供能体的荧光强度;ε为波长为λ时受能体的吸光系数。
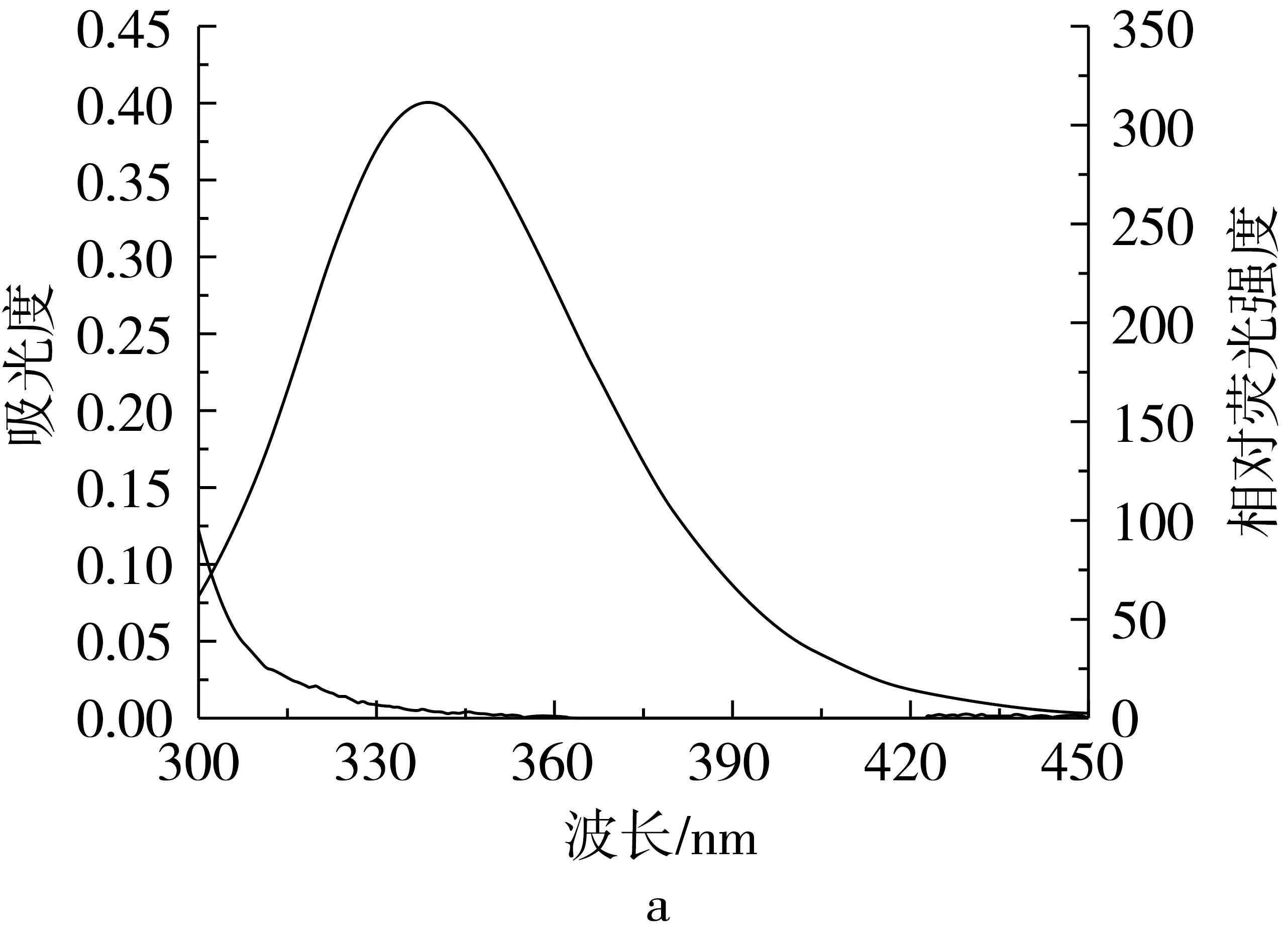

图5 TBHQ/TQ的紫外吸收光谱和BSA的荧光光谱叠加图
通过对波长在300~450 nm范围内供能体的荧光发射光谱和受能体的紫外吸收光谱的重叠部分进行积分,求得BSA-TBHQ体系中J为8.92×10-16cm3·L/mol,进一步求得E为0.02 nm,R0为1.64 nm,r0为3.13 nm,这与Shahabadi等[3]的研究结果是一致的。同理,求得BSA-TQ体系中J为2.53×10-15cm3·L/mol,进一步求得E为0.02 nm,R0为1.95 nm,r0为3.73 nm。显然,BSA-TBHQ和BSA-TQ体系中供能体与受能体的结合距离r均<7 nm,由此表明BSA到TBHQ和TQ均以能量转移的方式与BSA之间发生了相互作用。
2.4 构象变化
2.4.1 紫外吸收光谱
紫外可见吸收光谱对于检测络合物的形成是一种简单而有效的方法。在本研究中,以BSA溶液为参比,通过加入不同量的TBHQ、TQ到BSA溶液中,来探索BSA的结构变化(图6)。
从图6可以看出,BSA的紫外吸收强度随着TBHQ、TQ浓度的增加而增加,且拟合曲线的线性关系较好,这表明BSA与TBHQ、TQ之间形成了结合较好的复合物[6]。另外,BSA-TBHQ和BSA-TQ体系紫外吸收光谱的最大吸收峰均发生红移,进一步说明蛋白质的构象发生了改变。


图6 不同温度下BSA与不同浓度TBHQ/TQ作用的紫外吸收光谱(以25 ℃为例)
2.4.2 同步荧光
同步荧光光谱因具有简化光谱、窄化谱带和减小光谱重叠等优点而常用来探讨蛋白质构象的变化,近年来越来越广泛地被应用在小分子和生物大分子之间相互作用的研究领域中。对于蛋白质的同步荧光,Δλ=15 nm时仅表现出酪氨酸残基的荧光,Δλ=60 nm时仅表现出色氨酸残基的荧光,因为不同氨基酸残基的最大发射波长与其所处环境的极性有关,所以可以根据发射波长的改变判断蛋白质构象的变化。
如图7、图8所示,随着TBHQ和TQ的添加,酪氨酸和色氨酸残基的荧光同时被猝灭,且色氨酸残基的荧光强度随TBHQ和TQ添加而降低的程度明显快于酪氨酸残基,表明TBHQ和TQ与BSA的结合位点更接近色氨酸[3]。另外,TQ对色氨酸残基的荧光猝灭比TBHQ更明显,表明TQ更容易跟BSA结合。对于TQ,色氨酸和酪氨酸的最大发射波长均发生了微弱的蓝移,表明TQ的加入使BSA中这2种荧光发射基团附近的极性降低,疏水环境增强,说明构象发生了变化[12];TBHQ在色氨酸最大波长处发生蓝移,在酪氨酸最大波长处发生红移,表明TBHQ和BSA的相互作用改变了色氨酸残基和酪氨酸残基附近的构象,使色氨酸残基基团附近的极性降低、疏水环境增强,酪氨酸残基集团附近的极性增强、疏水环境减弱。


图7 BSA与不同浓度TBHQ作用的同步荧光光谱
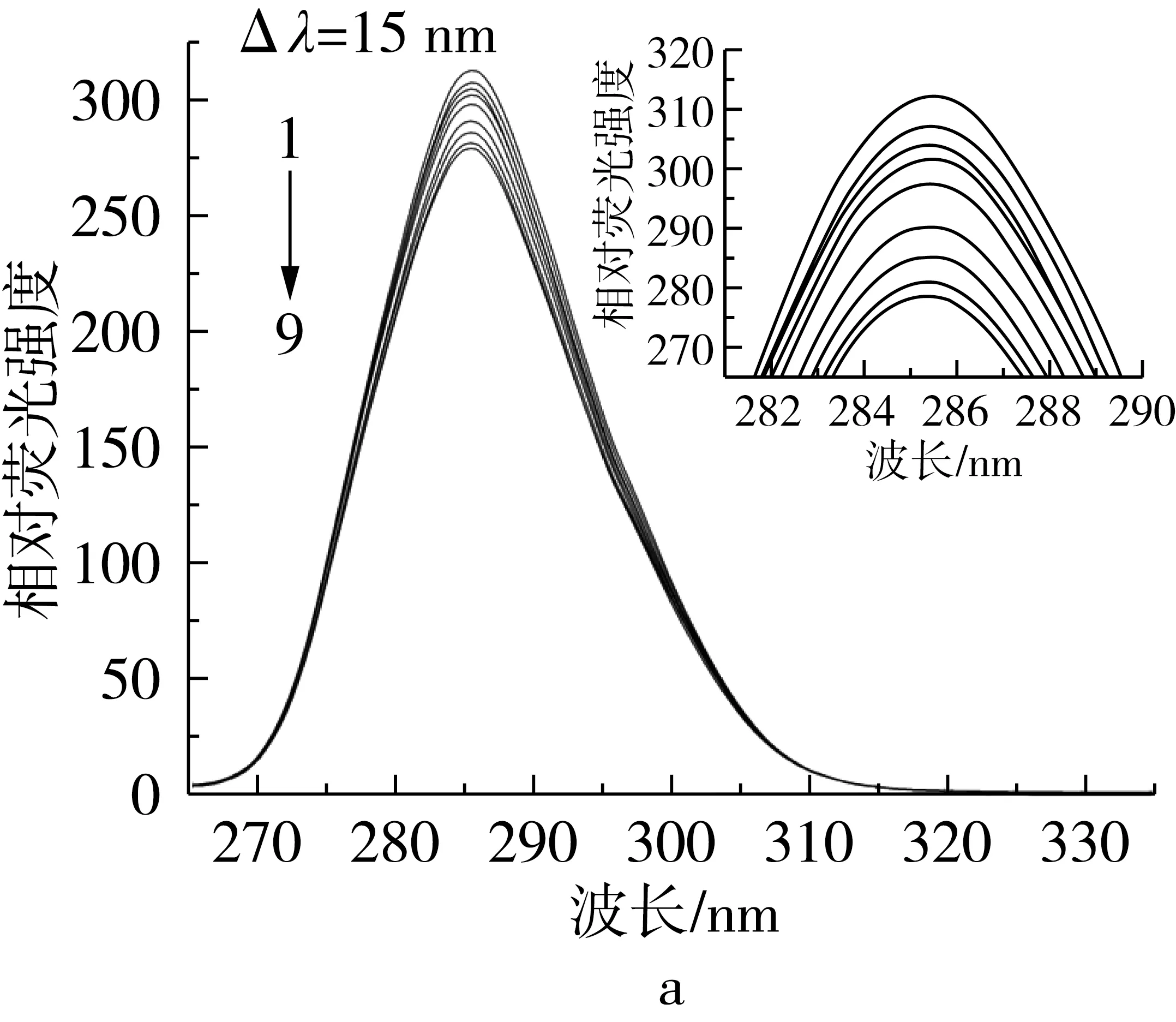
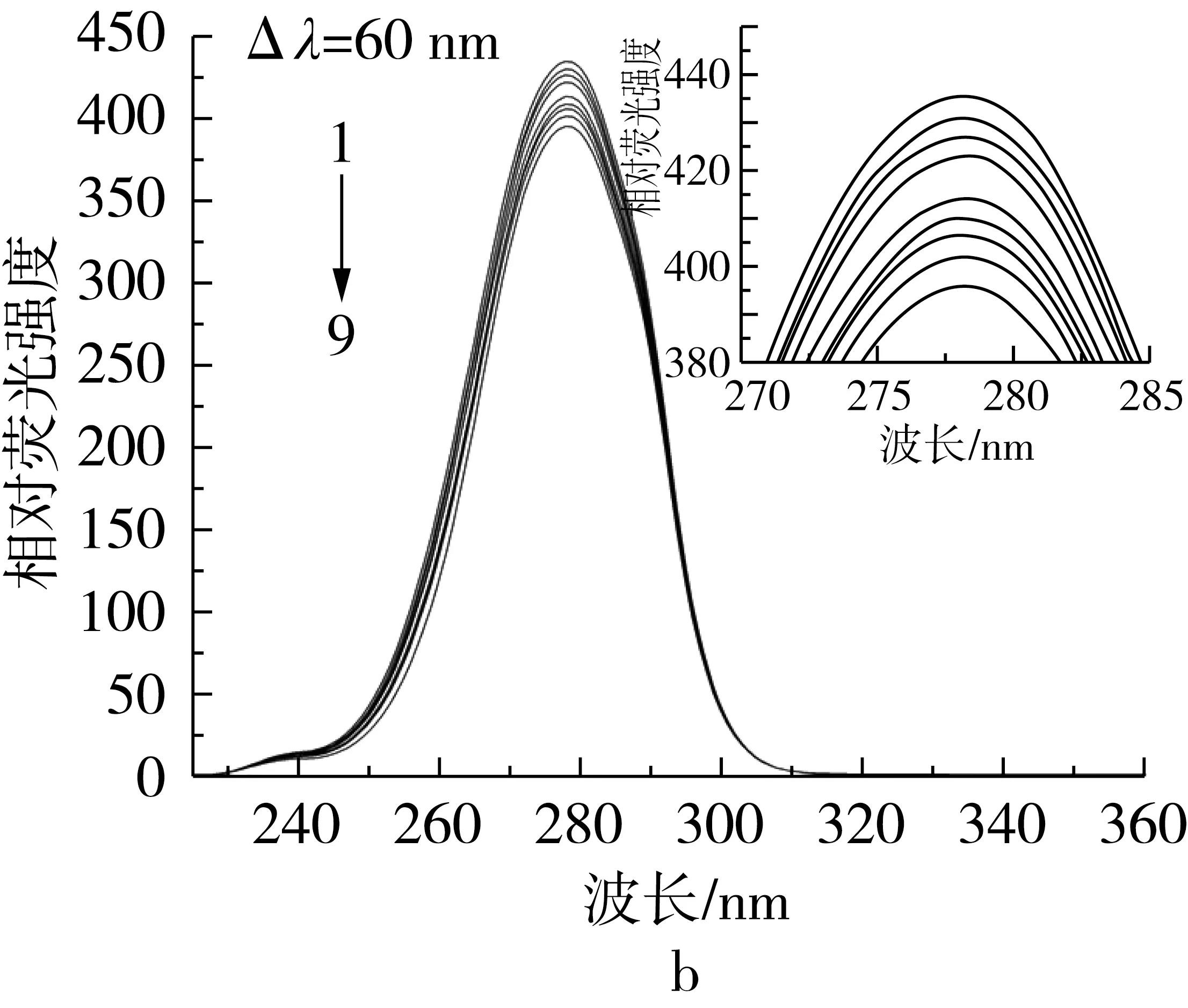
图8 BSA与不同浓度TQ作用的同步荧光光谱
3 结论
采用紫外吸收光谱法和荧光光谱法研究了TBHQ和TQ与BSA的作用机制,TBHQ和TQ对BSA的荧光猝灭机制是静态猝灭,它们分别与BSA以1∶1的结合方式形成复合物;TBHQ和TQ与BSA的相互作用力以疏水作用力和氢键为主;紫外吸收光谱和同步荧光光谱表明TBHQ和TQ的加入,使得BSA在微环境中的极性发生了改变,从而导致BSA构象发生了变化。
[1]李军,毕艳兰,杨会芳,等.加热条件下大豆油中TBHQ的挥发、转化规律及其对大豆油品质的影响[J].食品科学,2014,35(14):106-112 Li Jun,Bi Yanlan,Yang Huifang,et al.Volatilization and transformation rules of TBHQ and its effect on the quality of soybean oil under heating condition[J].Food Science,2014,35(14):106-112
[2]Shaikh S M T,Seetharamappa J,Ashoka S,et al.A study of the interaction between bromopyrogallol red and bovine serum albumin by spectroscopic methods[J].Dyes and Pigments,2007,73(2):211-216
[3]Shahabadi N,Maghsudi M,Kiani Z,et al.Multispectroscopic studies on the interaction of 2-tert-butylhydroquinone(TBHQ),a food additive,with bovine serum albumin[J].Food Chemistry,2011,124(3):1063-1068
[4]Braeuning A,Vetter S,Orsetti S,et al.Paradoxical cytotoxicity of tert-butylhydroquinone in vitro:What kills the untreated cells?[J].Archives of Toxicology,2012,86:1481-1487
[5]杨会芳.叔丁基对苯二酚在加热过程中的变化及其检测方法的研究[D].郑州:河南工业大学,2011 Yang Huifang.Changes of tert-butylhydroquinone by thermal treatment and its detection methods[D].Zhengzhou:Henan University of Technology,2011
[6]唐世华,黎幼群,陈维竹.对苯二酚和对苯醌与明胶蛋白质相互作用的紫外光谱分析[J].广西民族大学学报:自然科学版,2011,16(4):78-81 Tang Shihua,Li Youqun,Chen Weizhu.A study on the interaction between hydroquinone,p-benzoquinone and gelatin by UV spectroscopy[J].Journal of Guangxi University for Nationalities:Natural Science Edition,2011,16(4):78-81
[7]Lakowicz J R,Masters B R.Principles of fluorescence spectroscopy[J].Journal of Biomedical Optics,2008,13(2):237-265
[8]Eftink M R,Ghiron C A.Fluorescence quenching studies with proteins[J].Analytical Biochemistry,1981,114(2):199-227
[10]Kandagal P B,Ashoka S,Seetharamappa J,et al.Study of the interaction between doxepin and human serum albumin by spectroscopic methods[J].Journal of Photochemistry and Photobiology A:Chemistry,2006,179(1):161-166
[11]Li Y,He W Y,Liu J Q,et al.Binding of the bioactive component jatrorrhizine to human serum albumin[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2005,1722(1):15-21
[12]Zhang G,Wang L,Fu P,et al.Mechanism and conformational studies of farrerol binding to bovine serum albumin by spectroscopic methods[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2011,82(1):424-431.
Interaction Among Tertiary Butylhydroquinone and Its Oxidation Product with Bovine Serum Albumin
Li Jun Bi Yanlan Sun Shangde Ding Yiran
(School of Food Science and Engineering,Henan University of Technology,Zhengzhou 450001)
The interactions of tertiary butylhydroquinone(TBHQ)and its oxidation product—tertiary butyl benzoquinone(TQ)with bovine serum albumin(BSA)were investigated by ultraviolet absorption spectrum and fluorescence spectra.The experimental results showed that the interactions of TBHQ and TQ with BSA occurred and new polymers were formed.The quenching mechanisms of BSA with TBHQ and TQ were static quenching procedures.Both binding constants involved in the interaction between TBHQ/TQ and BSA were above 104L/mol,which indicated that the coordination compound of TBHQ and TQ with BSA was firm.The number of both binding sites involved in the interaction between TBHQ/TQ and BSA was 1.Their thermodynamic parameters equation was calculated and showed that ΔHand ΔGwere negative value and ΔSwas positive value,which indicated that hydrogen bond and hydrophobic interactions played major roles in the combination between BSA and TBHQ/TQ.ΔGwas negative value,which indicated that the interaction process was spontaneous.Based on the Forster’s theory of non-radiation energy transfer,the combination distances(r)between the donor(BSA)and acceptor(TBHQ or TQ)were 3.13 and 3.73 nm respectively.The research results of ultraviolet absorption spectrum and synchronous fluorescence spectrum showed the conbination between TBHQ/TQ and BSA induced conformational changes in BSA.
tertiary butylhydroquinone,tertiary butyl benzoquinone,bovine serum albumin ultraviolet absorption spectrum,fluorescence spectra
国家自然科学基金(31271883),河南工业大学优秀学位论文培育项目(PY201401)
2015-09-23
李军,男,1989年出生,硕士,脂质化学与品质
毕艳兰,女,1969年出生,教授,脂质化学与品质
O657
A
1003-0174(2017)04-0133-08
