黑曲霉发酵制备高可溶性膳食纤维豆渣工艺优化及其水合性质研究
2017-07-19涂宗财阮传英
谢 欢 涂宗财,2 张 露,2 王 辉 阮传英
(南昌大学食品科学与技术国家重点实验室1,南昌 330047)(江西师范大学生命科学学院2,南昌 330022)
黑曲霉发酵制备高可溶性膳食纤维豆渣工艺优化及其水合性质研究
谢 欢1涂宗财1,2张 露1,2王 辉1阮传英1
(南昌大学食品科学与技术国家重点实验室1,南昌 330047)(江西师范大学生命科学学院2,南昌 330022)
以豆渣为原料,以可溶性膳食纤维与总膳食纤维的比例(SDF/TDF)为指标,通过正交试验优化黑曲霉发酵豆渣制备高SDF豆渣的工艺,并研究黑曲霉发酵时间对豆渣膳食纤维(DF)水合性质的影响。结果显示黑曲霉发酵豆渣DF的最优条件为:发酵温度30 ℃,接种量1.5%、料液比1∶3(V/V)、发酵初始pH为自然pH值。在此条件下,发酵后的豆渣中SDF的含量占TDF的37.84%,与未发酵豆渣相比,发酵豆渣的SDF/TDF提高了7.19倍,发酵过程中产生的半纤维素酶将半纤维素水解转化为SDF是SDF/TDF升高的主要原因。在最佳发酵条件下发酵36 h时,豆渣DF的持水力增加了55.33%,膨胀力增加了60.67%,结合水力增加了21.74%,因此黑曲霉发酵可作为提高豆渣膳食纤维品质的有效方法。
豆渣 可溶性膳食纤维 黑曲霉 发酵 水合性质
膳食纤维是人类“第七大营养素”,分为可溶和不可溶性膳食纤维(SDF和IDF),它在预防和治疗肥胖、糖尿病和肠道疾病等方面具有特殊功效,如清除自由基、调节血糖、降低胆固醇,延缓小肠对葡萄糖的吸收,增强肠道蠕动,防止结肠癌、便秘等,其中SDF比IDF具有更强的功能性[1-3]。因此,富含可溶性膳食纤维的食品成为一种理想的降血压、降血脂、降血糖以及降胆固醇的健康和保健食品。
我国是大豆的主要生产和消费大国,豆渣是豆制品生产加工中产生的主要副产物,每年产生大量的豆渣。由于豆渣水分含量高、易腐烂、不耐储存,颗粒大、口感粗糙等特点[4-5],大部分豆渣被当作动物饲料或者直接作为废弃物丢弃,利用率非常低。但干燥后的豆渣中膳食纤维含量高达60%,同时富含蛋白质(以干计约20%)和钙、钾等矿物质,是一种极好的天然膳食纤维来源[6],可作为一种新型的保健食品原料。因此如何将豆渣转化为高品质膳食纤维产品成为目前国内外研究的热点。
目前报道的提高膳食纤维中SDF含量的方法有化学法、生物法、物理法[4-5]和物理-生物结合法[7]。发酵法因其成本低、操作简单、产率高、易实现工业化生产的特点成为目前膳食纤维改性的有效方法之一,它在提高膳食纤维中SDF和IDF的比例同时,可改善膳食纤维的理化性质,如持水力、膨胀力等[8-9]。黑曲霉是国际公认的可用于食品生产的安全菌株,它在发酵过程中能产生纤维素酶、半纤维素酶、木聚糖酶、果胶酶等丰富的酶系,可更好的作用于底物,将大分子纤维素降解成较小分子物质,提高SDF的含量(黑曲霉及其应用研究进展[10-11],同时其产生的短链脂肪酸类物质可以改善膳食纤维的持水力等物化特性[12]。
因此本试验以黑曲霉为菌种,采用正交试验优化黑曲霉发酵豆渣制备可溶性膳食纤维的工艺条件,并对发酵后的豆渣膳食纤维的水合性质进行研究,旨在提高豆渣膳食纤维中SDF的含量及其品质,从而真正将工业废弃物利用起来,变废为宝,同时为科学合理的改善豆渣中膳食纤维的营养价值及其功能性质提供理论指导。
1 材料与方法
1.1 材料与仪器
豆渣、马铃薯:市售木瓜蛋白酶Sigma公司;热稳定α-淀粉酶、糖化酶 北京奥博星生物技术有限责任公司;乙醇、丙酮、葡萄糖、盐酸、氢氧化钠、磷酸氢二钠、磷酸二氢钠均为分析纯试剂。
ZDX-35BI型座式自动电热压力蒸汽灭菌锅 上海申安医疗器械厂;PYX-150H-B恒温恒湿培养箱 厦门精艺兴业科技有限公司。
1.2 试验方法
1.2.1 豆渣发酵
新鲜豆渣→60 ℃烘干12 h → 粉碎 → 过80目筛→ 调料→ 装罐→ 灭菌→ 冷却→ 接种→发酵培养→60 ℃烘干→粉碎→理化分析。
1.2.2 单因素试验
取料液比、酶接种量、初始pH和发酵温度4个因素进行单因素试验。准确称取30 g豆渣,按一定的料液比与蒸馏水混匀后接种黑曲霉,在一定 pH和温度条件下发酵,相对湿度控制在85%左右,发酵完后测定样品中SDF/TDF的比值。每个试验做3次平行,取平均值。
1.2.3 正交试验
根据单因素试验的结果,选择对豆渣中SDF/TDF影响较大的三个发酵条件进行L9(33)正交试验,确定黑曲霉发酵提高豆渣SDF/TDF比值的最佳工艺,正交因素及水平见表1。

表1 正交试验因素水平表
1.2.4 豆渣中膳食纤维的测定
采用AOAC991.43酶-重量法[13],总膳食纤维(TDF)、不溶性膳食纤维(IDF)和可溶性膳食纤维(SDF)的测定计算公式如下:
式中:R1和R2为双份样品残留物质量/mg,P和A分别为蛋白质和灰分质量/mg,M1和M2为样品质量/mg。
1.2.5 膨胀力的测定[14]
准确称取0.5 g(m)膳食纤维于盛有蒸馏水并带有刻度的玻璃试管中振荡均匀,静置后记录膳食纤维初始体积V1(mL),25 ℃下放置24 h后测量膳食纤维样品在试管中的膨胀体积V2(mL),膳食纤维的膨胀力计算公式如下:
1.2.6 持水性的测定[14]
准确称取3 g(m1)样品于50 mL离心管中,加入25 mL蒸馏水后在25 ℃下搅拌30 min,2500 g离心10 min,弃去上清液并用滤纸吸干离心管壁残留水分,然后将膳食纤维转移到表面皿上称重m2(g),样品的持水力(g/g)为:
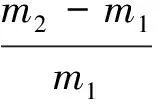
1.2.7 结合水力的测定[15]
先将100 mg(m)膳食纤维浸泡于25℃的蒸馏水中,在14 000 g下离心处理l h,小心除去上层清液,残留物置于G-2多孔玻璃增塌上静置1 h,称重该残留物m1,然后在120 ℃下干燥2 h后再次称重残留物m2,膳食纤维样品结合水的能力(g/g)为:
1.2.8 酶活测定[16-17]
果胶酶酶活定义:每分钟单位质量的粗酶粉水解果胶生成1 μg的果糖为一个酶活单位。
半纤维素酶活定义:每分钟单位质量的粗酶粉水解木聚糖生成1 μg的木糖为一个酶活单位。
纤维素酶活定义:每分钟单位质量的粗酶粉水解纤维素生成1 μg的葡萄糖为一个酶活单位。
取1 g最佳条件下发酵后的豆渣用水稀释定容至100 mL,取0.5 mL溶液,加入1.5 mL多糖(纤维素、半纤维素、果胶)酶解30 min,然后用DNS测定单糖含量。酶活(μg·min-1·mg-1)计算公式为:
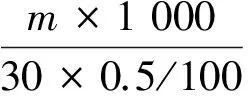
式中:m为所测木糖、果糖或葡萄糖的质量/μg;1 000为豆渣样品的质量/mg;30为酶解时间/min;0.5为测试样品体积/mL;100为样品总体积/mL。
2 结果与讨论
2.1 单因素试验结果与讨论
2.1.1 不同料液比对SDF/TDF的影响
取30 g豆渣,分别以1∶1、1∶2、1∶3、1∶4和1∶5的料液比与蒸馏水混匀,然后按1%接种量加入黑曲霉,在自然pH(pH 5~6)条件下28 ℃发酵3 d,相对湿度控制在85%左右。发酵完后测定样品中SDF和TDF的含量。
不同料液比对SDF/TDF的影响如图1(A)所示。随料液比的增加,SDF/TDF出现先增大后减小的趋势,当料液比为1∶4时,发酵得到较多的SDF,SDF/TDF达30.25%,是料液比为1∶1时(11.32%)的2.67倍。这说明当固态发酵的水分含量不足时,黑曲霉生长受到限制,发酵不能充分进行,影响SDF的得率,而含水量过大时,豆渣基质的湿度过大,发酵体系的通气、散热性差,豆渣易结块成团,不利于黑曲霉的生长,从而抑制纤维素酶、半纤维素酶等酶系的产生[18],因此选1∶3、1∶3.5、1∶4进行后续正交试验。

图1 不同料液比(A)、接种量(B)、发酵温度(C)、发酵初始pH(D)对SDF/TDF的影响曲线
2.1.2 不同的接种量对SDF/TDF的影响
取30 g豆渣以1∶4的料液比与蒸馏水混匀,分别按0.1%、0.5%、1.0%、1.5%、2.0%、3.0%的接种量加入黑曲霉,在自然pH条件下28 ℃发酵3 d,相对湿度控制在85%左右,发酵完后测定样品中SDF和TDF的含量。
不同的接种量对SDF/TDF如图1(B)所示。由图可知,随着接种量的增加,SDF/TDF出现先增大后减小的趋势,当接种量为1%时,豆渣样品中的SDF/TDF出现最高值,为33.43%。这说明当接种量太少时,菌的生长过于缓慢,存在着较长时间的环境适应期,相应的代谢时间缩短,即在本试验中表现为产酶量的不足,进而影响SDF的得率。但如果接种量过大,将导致菌体过速生长,出现菌内竞争,使得菌不能得到充足的营养而使生长代谢受到限制[14]。因此接种量选0.5%、1%、1.5%作为后续正交试验。
2.1.3 发酵温度对SDF/TDF的影响
取30 g豆渣以1:4的料液比与蒸馏水混匀,并按1.0%的接种量加入黑曲霉,然后在自然pH条件下,分别于20、25、30、35、40 ℃发酵3 d,相对湿度控制在85%左右,发酵完后测定样品中SDF和TDF的含量。
不同发酵温度对SDF/TDF如图1(C)所示。由图可知,随着发酵温度的增加,SDF/TDF出现先增大后减小的趋势,当发酵温度为30 ℃时发酵得到最多的SDF,SDF/TDF达32.97%。当发酵温度大于30 ℃时,发酵温度越高,SDF/TDF反而下降,这可能与黑曲霉的生长和代谢受温度影响,以及纤维素酶、半纤维素酶等酶类的最佳酶活温度有关。冯培勇等[19]证明,黑曲霉发酵产纤维素酶活力最大的最佳发酵温度为31℃。因此我们选25、30、35 ℃做后续正交试验。
2.1.4 发酵初始pH值
取30 g豆渣以1:4的料液比与蒸馏水混匀,按1.0%的接种量加入黑曲霉,然后分别在pH 3、4、5、6、7、8条件下30 ℃发酵3 d,相对湿度控制在85%左右,发酵完后测定样品中SDF和TDF的含量。
由图1(D)可知,随着起始pH 值的升高, SDF/TDF的值呈先上升后下降的趋势,当起始pH 值为5.0时,豆渣膳食纤维有最大的SDF/TDF值36.22%,即发酵得到最多的SDF。但当pH高于5之后,SDF/TDF值开始下降,当高于pH 6时,SDF/TDF急剧降低。由于豆渣与水的混合溶液的天然pH为5~6,pH为5和6时发酵豆渣样品的SDF/TDF相差不大。考虑到发酵的经济性和安全性,以及操作过程的简便性,选择用自然pH进行发酵。因此确定黑曲霉发酵豆渣的适宜初始pH为天然pH,即pH为5~6。
2.2 正交试验结果分析
由表2中正交试验结果的极差分析可知,A、B、C三个因素的主次顺序为:A>C>B即对黑曲霉发酵豆渣中SDF/TDF值影响最大的是发酵温度,其次是料液比,影响最小的是接种量。最佳发酵条件为A2B3C1:发酵温度30 ℃、接种量1.5%、料液比1∶3(g/mL)、发酵初始pH为自然pH值。在此条件下,豆渣中SDF/TDF达37.84%,较未发酵豆渣中的5.26%提高了7.19倍,较优化前的36.22%提高了1.62个百分点。

表2 正交试验数据与结果
2.3 SDF/TDF值、水合性质及酶活随发酵时间的变化
根据正交试验得到的最佳条件进行发酵,即豆渣30 g、料液比1∶3、接种量1.5%、初始pH为自然pH,相对湿度85%左右,研究黑曲霉在固态发酵豆渣的过程中,纤维素酶、果胶酶、半纤维酶的酶活、以及发酵豆渣的SDF/TDF值和水合性质随着发酵时间(0~96 h)的变化。
2.3.1 酶活的变化
纤维素酶、果胶酶、半纤维酶酶活随发酵时间的变化如图2所示。纤维素酶是降解纤维素生成葡萄糖的一组酶的总称;广义的半纤维素酶是指能够降解半纤维素、木聚糖生成木寡糖和木糖的一组酶的总称;果胶酶可将果胶分解成半乳糖醛酸等物质的酶[20]。豆渣膳食纤维由纤维素、半纤维素、果胶、木质素(含量极低)组成,以上三类酶的综合作用,使TDF 的糖苷键断裂,生成小分子多糖,提高SDF/TDF值,改善豆渣膳食纤维的性质和生理功能。姜竹茂等[21]在豆渣中添加3%(V/V)纤维素酶液,50 ℃酶解1.5 h,可使可溶性膳食纤维提高到16.59%。半纤维素酶在发酵60 h后达到最大酶活10 758.48 μg·min-1·mg-1,而果胶酶的酶活一直处于上升趋势,纤维素酶活在发酵36 h后达到最大值4 975.3μg·min-1·mg-1,随后呈先下降后上升的趋势。这可能是由于随着发酵时间的延长(0~36 h),黑曲霉生长,菌体数目增加,自身生产纤维素酶、果胶酶和半纤维酶的量增加,使测得的单位质量的豆渣中这3种酶的活力上升。但随着发酵时间的进一步延长(>36 h),反应体系的温度上升,pH下降,营养物质逐渐被消耗,有毒物质开始积累,导致半纤维素酶和果胶酶酶活的上升速率下降,而使纤维素酶的酶活力降低,在发酵60 h时酶活达最低值。因此,在发酵的不同阶段,黑曲霉自身生产纤维素酶、果胶酶、半纤维酶的量和这些酶在培养基中发挥主要作用的顺序不同。

图2 发酵过程中酶活的变化
2.3.2 SDF/TDF值随发酵时间的变化
由图3可知,随着发酵的进行,SDF/TDF先上升至最大值后又逐渐下降,当发酵时间为48 h时,SDF/TDF最高36.92%。这可能是由黑曲霉在发酵豆渣过程中产生的半纤维素酶对半纤维素的降解作用所导致的,相关性分析显示半纤维素酶酶活与SDF/TDF相关性为0.902,果胶酶酶活与SDF/TDF相关性较小(0.328),而纤维素酶与SDF/TDF几乎无相关性。即发酵过程中不溶性半纤维素在半纤维素酶作用下酶解为SDF,这可能是SDF/TDF升高的主要原因,这与Zongcai Tu等[7]从单糖组成分析得出IDF转化为SDF主要是半纤维变化的结论相一致。而随着发酵的进行,基质物质逐渐被消耗,黑曲霉开始分解利用SDF,将其进一步降解为单糖、二糖等可直接作为生长代谢碳源的小分子糖,因此发酵后期SDF减少[22]。
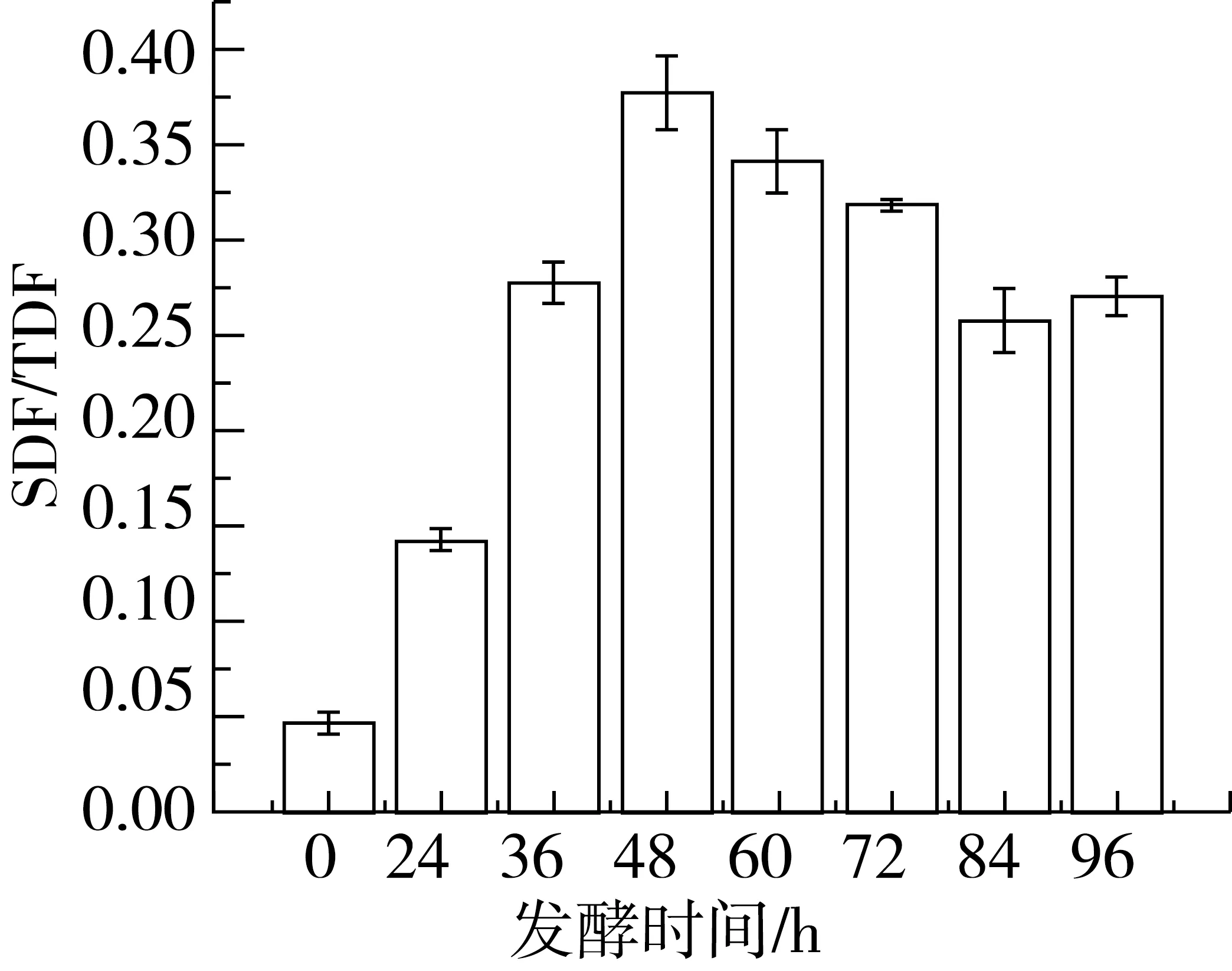
图3 SDF/TDF随发酵时间的变化
2.3.3 水合性质
在最佳发酵条件下发酵豆渣,豆渣DF的水合性质(持水力、结合水力、膨胀力)随发酵时间的变化如图4。TDF的持水力先增大后降低,发酵36 h时达到的最大值2.33 g/g,较未发酵豆渣的持水力1.50 g/g增加了55.33%。豆渣DF的结合水力随发酵时间的变化增加的较少,但最大水合能力(36h时)较未发酵样品增加了21.74%。豆渣DF的膨胀力随发酵时间的延长先增大后下降,后又有所回升,发酵36 h后豆渣膨胀力达到最大值为4.29 mL/g,这比未发酵豆渣的膨胀力(2.67 mL/g)增加了60.67%。纤维素酶水合力的增加可能是由于黑曲霉发酵产生的纤维素酶、半纤维素酶、果胶酶和对豆渣基料中的纤维素、淀粉、蛋白质的水解作用[14],这一方面使细胞壁破裂,豆渣颗粒变小,增加了纤维素与水结合的表面积(黑曲霉和米曲霉发酵改善豆渣口感);另一方面增加了纤维颗粒孔洞的数量和体积,使纤维结构变得较疏松、溶胀的,从而水更易进入分子的内部,增加豆渣的水合性质[23]。当发酵时间超过36 h后,豆渣膳食纤维的持水力和膨胀力随发酵时间的延长逐渐降低,这可能是由于半纤维素酶酶活的增加(图2)使半纤维素、木聚糖进一步降解为小分子的木寡糖和木糖,使豆渣样品中TDF的相对含量降低,豆渣的持水力和膨胀力下降[22]。吸水膨胀力是膳食纤维预防便秘、肠癌等生理功能的重要物理指标,因此从某种意义上来说,豆渣也可以作为一种防便秘的食物。黑曲霉发酵可使豆渣DF的水合性质得到改善。

图4 膳食纤维水合性质随发酵时间的变化
3 结论
本研究通过单因素和正交试验,以SDF/TDF比值为评价指标,得到了黑曲霉发酵对豆渣DF改性的最佳发酵条件:发酵温度为30 ℃、接种量为1.5%、豆渣:水为1:3、发酵初始pH为自然pH值。在此发酵条件下SDF/TDF的值可以达到37.84%,较未发酵时提高了7.19倍。
黑曲霉发酵可大大提高豆渣DF的水合性质,在最佳参数条件下发酵36 h时,豆渣DF的持水力增加了55.33%,膨胀力增加了60.67%,结合水力增加了21.74%。纤维素酶和半纤维素酶分别在发酵36 h和60 h时达到最大酶活,发酵过程中产生的半纤维素酶将半纤维素水解转化是SDF/TDF升高的主要原因。
[1]M Elleuch, D Bedigian, O Roiseux, et al. Dietary fibre and fibre-rich by-products of food processing: Characterisation, technological functionality and commercial applications: A review[J]. Food Chemistry, 2011, 124(2): 411-421
[2]M M Kaczmarczyk, M J Miller, G G Freund. The health benefits of dietary fiber: beyond the usual suspects of type 2 diabetes mellitus, cardiovascular disease and colon cancer[J]. Metabolism, 2012, 61(8): 1058-1066
[3]X Zhong, Y J. Fang, Z Z. Pan, et al. Dietary fiber and fiber fraction intakes and colorectal cancer risk in Chinese adults[J]. Nutrition and cancer, 2014, 66(3): 351-361
[4]李艳芳, 郝建雄, 程永强, 等. 黑曲霉和米曲霉发酵改善豆渣口感[J]. 农业工程学报, 2012, 28(7): 248-253 Li Y F, Hao J X, Cheng Y Q, et al. Improvement of okara mouthfeel by Aspergillus niger and Aspergillus oryzae fermentation [J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(7): 248-253
[5]王继楠, 陈忱, 迟玉杰, 等. 微波对豆渣中提取水溶性膳食纤维的影响[J]. 食品工业, 2014, 35(1): 56-58 Wang Jinan, Chen Chen, Chi Yujie, et al. Effect of microwave on extraction soluble dietary fiber from soybean dregs [J]. The Food Industry, 2014, 35(1): 56-58
[6]毕韬韬, 吴广辉, 高愿军. 豆渣深加工研究进展[J]. 食品研究与开发, 2011, 32(6): 149-152 Bi Taotao, Wu Guanghui,Gao Yuanjun. Development and deep processing of soybean residues[J]. Food Research and Development, 2011, 32(6): 149-152
[7]Tu Z, Chen L, Wang H, et al. Effect of fermentation and dynamic high pressure microfluidization on dietary fibre of soybean residue[J]. Journal of Food Science and Technology, 2014, 51(11): 3285-3292
[8]R J Redgwell, M Fischer. Dietary fiber as a versatile food component: an industrial perspective[J]. Molecular Nutrition & Food Research, 2005, 49(6): 521-535
[9]申瑞玲, 王英. 膳食纤维的改性及其对功能特性的影响[J]. 农产品加工. 学刊, 2009(3): 17-20 Shen Ruiling, Wang Ying. Modification of dietary fiber and its effects on the property [J]. Academic Periodical of Farm Products Processing, 2009(3): 17-20
[10]G Oboh, A Akindahunsi, A Oshodi. Nutrient and anti-nutrient contents of Aspergillus niger-fermented cassava products (flour and gari)[J]. Journal of Food Composition and Analysis, 2002, 15(5): 617-622
[11]罗明, 郝志刚. 黑曲霉及其应用研究进展[J]. 第二届饲料微生态制剂应用技术研讨会暨微生态制剂大会论文集, 2012: 115-116 Luo Ming, Hao Zhigang. Development and application on Aspergillus niger [J]. The 2th Conference of Technology on the Use of Probiotics in Feed Industry, 2012: 115-116
[12]Y Hang, E Woodams. Corn husks: a potential substrate for production of citric acid by Aspergillus niger[J]. LWT-Food Science and Technology, 2000, 33(7): 520-521
[13]S Lee, L Prosky, J De Vries. Determination of total, soluble, and insoluble dietary fiber in foods: Enzymatic-gravimetric method, MES-TRIS buffer: Collaborative study[J]. Journal of AOAC International (USA), 1992, 75(3): 395-416
[14]田亚红, 常丽新, 贾长虹, 等. 黑曲霉发酵提取甘薯渣中水不溶性膳食纤维的工艺研究[J]. 粮油食品科技, 2014, 22(4): 86-88 Tian Yahong,Chang Lixin,Jia Changhong, et al. Study on extraction of insoluble dietary fiber from sweet potato residue by aspergillus niger fermentation[J]. Science and Technology of Cereals,Oils and Foods, 2014, 22(4): 86-88
[15]蓝海军, 刘成梅, 涂宗财, 等. 大豆膳食纤维的湿法超微粉碎与干法超微粉碎比较研究[J]. 食品科学, 2007, 28(6): 171-174 Lan Haijun, Liu Chengmei, Tu Zongcai, et al. Wet or dry processing comparative study on super micro-milling soybean dietary fiber [J]. Food Science, 2007, 28(6): 171-174
[16]石乾乾. 纤维素酶和半纤维素酶高产菌株的筛选及其在生物质降解中的应用[D]. 广州:华东理工大学, 2011 Qian Qianshi. Catalytic Performance of Corn Stover Hydrolysis by a New Isolate Penicillium sp.ECU0913 Producing Both Cellulase and Hemicellulase Titers[D].Guangzhou: East China University of Science and Technology, 2011
[17]赵玉萍, 杨娟. 四种纤维素酶酶活测定方法的比较[J]. 食品研究与开发, 2006, 27(3): 116-118 Zhao Yuping, Yang Juan. Comparison of four cellulase activity measurement methods[J]. Food Research and Development, 2006, 27(3): 116-118
[18]李红霞, 吕敬军, 陆丰升, 等. 黑曲霉固态发酵花生壳提取水溶性膳食纤维[J]. 食品科学, 2010, 31(19): 277-282 Li Hongxia, Lv Jingjun, Lu Fengsheng, et al. Optimization of extraction of soluble dietary fibre from peanut hull by aspergillus niger solid-state fermentation [J]. Food Science, 2010, 31(19): 277-282
[19]冯培勇, 赵彦宏, 张丽. 响应面法优化黑曲霉产纤维素酶发酵条件[J]. 食品科学, 2009, 30(23): 335-339 Feng Peiyong, Zhao Yanhong, Zhang Li. Optimization of cellulase production by aspergillus niger using response surface methodology [J]. Food Science, 2009, 30(23):335-339
[20]D Chahal. Solid-state fermentation with Trichoderma reesei for cellulase production[J]. Applied and Environmental Microbiology, 1985, 49(1): 205-210
[21]姜竹茂, 缪静. 从豆渣中制取可溶性膳食纤维的研究[J]. 中国粮油学报, 2001, 16(3): 52-55 Jiang Zhumao, Miao Jing. Producing soluble dietary fibre from bean dregs[J]. Journal of the Chinese Cereals and Oils Association, 2001, 16(3): 52-55
[22]何晓哲, 李梅青, 陈健, 等. 液态混菌发酵法制备高活性大豆膳食纤维研究[J]. 食品研究与开发, 2014, 35(7): 25-29 He Xiaozhe, Li Meiqing, Chen Jian, et al. Studyon Production of High-activity Dietary Fiber by Mixed Culture Liquid-state Fermentation on Soybean Dregs [J]. Food Research and Development, 2014, 35(7): 25-29
[23]S Raghavendra, S R Swamy, N Rastogi, et al. Grinding characteristics and hydration properties of coconut residue: A source of dietary fiber[J]. Journal of Food Engineering, 2006, 72(3): 281-286.
Process Optimization of Preparation of Soluble Dietary Fiber Bean Dregs byAspergillusnigerand Hydration Properties
Xie Huan1Tu Zongcai1,2Zhang Lu1,2Wang Hui1Ruan Chuanying1
(National Key Laboratory of Science Science and Technology, Nanchang University1, Nanchang 330047)(Jiangxi Normal University2, Nanchang 330022)
In this research, theAspergillusnigerfermentation parameters for preparing soybean dregs with high content of soluble dietary fibers (SDF) were optimized by using orthogonal experiment with the ratio of SDF and total
dietary fibers (TDF) as indicator and bean dregs as raw materials. Effect of fermentation time on the hydration properties of soybean dregs DF was also estimated. The results indicated that the optimal fermentation parameters were as follows: fermentation temperature 30 ℃, inoculation quantity 1.5%, solid/liquid ratio 1∶3 (g/mL), initial fermentation pH of natural pH value. Under such conditions, the SDF/TDF value in fermented soybean dregs reached to 37.84%, which was improved by 7.19 times compared with that without fermentation. This could be resulted from the hydrolyzation of hemicellulose into SDF induced by hemicellulase produced during fermentation. The water-holding, swelling and water-binding capacity of soybean dregs fermented for 36 h under the optimal parameters were increased by 55.33%, 60.67% and 21.74%, respectively. Thus, fermentation withAspergillusnigercan be an effective method to improve the quality of soybean dregs.
soybean dregs, soluble dietary fiber,aspergillusniger, fermentation, hydration properties
863计划(2011AA 100803),江西省现代农业产业技术体系建设专项(JXARS-04)
2015-08-23
谢欢,男,1991年出生,硕士,食物资源的高效利用与开发
涂宗财,男,1965年出生,教授,博士生导师,食物资源的高效利用与开发
TS209
A
1003-0174(2017)04-0116-07
