富亮氨酸胶质瘤失活1蛋白抗体阳性边缘叶脑炎临床分析
2017-07-19商秀丽
石 珂, 商秀丽
富亮氨酸胶质瘤失活1蛋白抗体阳性边缘叶脑炎临床分析
石 珂, 商秀丽
目的 分析富亮氨酸胶质瘤失活1蛋白(leucine-rich glioma inactivated 1,LGi1)抗体相关边缘性脑炎(Limbic encephalitis,LE)的临床特点、诊断及治疗。方法 回顾性分析7例LGi1抗体相关LE患者的临床资料、实验室和电生理、影像学检查结果及治疗和预后。结果 7例患者发病年龄22~72岁,男女比例5∶2,7例患者均有精神行为异常、认知功能下降的临床表现。6例患者有癫痫发作,4例出现面臂肌张力障碍(FBDS)。3例脑电图出现慢波或癫痫样波。3例患者MRI检查可见颞叶海马异常信号影。5例患者有低钠血症。6例患者脑脊液氯化物低。所有患者血清LGi1抗体阳性,6例患者脑脊液LGi1抗体阳性。5例合并其他血清自身抗体,所有患者均未发现肿瘤,所有患者经免疫治疗均有效。结论 LGi1抗体相关LE以认知功能障碍、精神行为异常、癫痫发作为主要临床表现,常伴有低钠血症,很少合并肿瘤,头部MRI以颞叶、海马受累为主,免疫治疗有效。
富亮氨酸胶质瘤失活1蛋白; 边缘叶脑炎; 面臂肌张力障碍; 低钠血症
富亮氨酸胶质瘤失活1蛋白(leucine-rich glioma inactivated-1,LGil)抗体阳性边缘叶脑炎是近年来发现的一种新型自身免疫相关边缘叶脑炎(Limbic encephalitis,LE)。自2010年发现电压门控性钾离子通道(VGKC)复合物抗体最常见类型为LGil抗体以来,国外陆续有此类抗体相关脑炎的报道[1]。Shin等于2013年总结125例自身免疫性LE中LGi1抗体脑炎占11.2%[2]。国内于2013年首次报道该病[3],由于自身免疫性LE本身发病率低,中国仍处于临床研究初期,临床医生对该病认识不足,且实验室检测技术手段限制,分布存在地区差异,LGi1抗体检测明显受限,导致漏诊、误诊。本文分析2015年9月-2016年11月期间中国医科大学附属第一医院诊断的7例LGi1抗体阳性LE患者的临床资料,总结其临床特点,为临床工作提供借鉴。
1 资料和方法
1.1 研究对象 2015年9月-2016年11月期间临床上确诊为LGi1抗体相关LE的患者,其血清及脑脊液标本均送检至北京协和医院神经内科实验室及北京海斯特临床检验所进行抗LGi1抗体检测。其中抗LGi1抗体阳性的患者7例,其中男女比例5∶2,年龄22~72岁,平均(46.86±19.43)岁,发病至诊断时间17 d~68 d。所有患者均符合2016年Lancet Neurol提出的自身免疫性LE诊断指南[4~6]: (1)抗神经元细胞膜(如LGi1)抗体阳性,排除其他病因,可直接确诊;(2)未行抗体检测或抗体阴性,需满足以下3项:①病程<3个月,症状提示边缘系统受累;②双侧或单侧大脑T2加权Flair像局限于内侧颞叶的异常信号(或FDG-PET异常);③脑脊液细胞数增多或EEG显示颞叶痫性放电或慢波。
1.2 研究方法 对7例患者的临床表现、实验室检查(所有患者均行血清及脑脊液抗NMDAR、LGi1、CASPR2、GABABR、AMPA1R、AMPA2R神经元表面或突触蛋白相关抗体检测以及经典副肿瘤抗体抗CV2、Hu、Yo、Ri、PNMA2、Amphiphys检测,并完善血钠、甲功甲炎、风湿系列、肿瘤标志物等检查)、头部磁共振等影像学检查、脑电图及简易智能精神状态量表检测(MMSE)和蒙特利尔认知评估(MOCA)评分等检查,并对治疗及预后进行分析,随访2 m。
2 结 果
2.1 临床资料 急性起病(病程<1 m)1例,亚急性起病(病程<3 m)6例,3例(43%)患者有头痛、发热、腹泻、乏力的前驱症状。首发症状以记忆力减退起病3例(43%),癫痫发作起病2例(28.5%),精神行为异常起病的2例(28.5%)。所有患者均有认知功能障碍,以近记忆力减退为主要症状,且均有精神症状(出现幻觉3例,性格改变3例,胡言乱语3例)。癫痫发作6例(86%),其中全面强直阵挛发作2例。类似于面臂肌张力障碍发作(faciobrachial dystonic seizures,FBDS)4例(57%),其中1例FBDS还合并复杂部分性发作,表现为大脑空白感,持续1~3 min。出现自主神经障碍4例(57%),分别表现为阳痿、呃逆、尿量增多及心动过速。1例患者既往胸腺瘤切除术外,1例患者糖尿病,余患者无特殊既往史,所有患者否认精神疾病、癫痫及其他遗传史。
2.2 实验室检查 所有患者脑脊液常规未见异常,且未见瘤细胞,生化指标中有6例(86%)氯化物稍低,4例(57%)糖偏高。所有患者均行血清及脑脊液抗神经肿瘤抗原抗体和抗细胞表面或细胞外抗原抗体的检测,血清LGI1抗体均阳性(100%),脑脊液LGI1抗体阳性6例(86%)。低钠血症5例(71%),其中顽固性低钠血症2例,静脉补钠(Na+<125 mmol/L时)或食盐胶囊口服仍持续低钠。4例患者血清抗甲状腺微粒体抗体测定TPOAb及血清抗甲状腺球蛋白抗体测定TGAb升高,1例抗核抗体ANA阳性。3例患者血清肿瘤标志物出现轻度异常,例4糖类抗原CA12-5 52.28 U/ml(0.00~35.00),例5神经元特异性烯醇化酶NSE 25.6 ng/ml(0~16.3),例6糖类抗原CEA5.46 ng/ml (0.00~4.30)。(临床资料详细信息见表1)。
2.3 辅助检查 所有患者均行头部增强MRI检查 3例(43%)提示颞叶内侧海马(双侧或单侧)T2WI呈高信号,FLAIR呈高信号(见图1); 1例提示多发腔梗。其中1例行PET检查,提示右侧海马局部较对侧FDG摄取略增高(见图2)。有5例患者行24 h动态脑电图检查,其中1例示左颞、顶、枕导联间断出现周期性锐波;其余2例患者行视频脑电图检查,示在全部导联可见短程阵发性慢波(1例监测期间肢体不自主动,伴随脑电图为体动干扰,未见节律改变)。所有患者行MMSE及MOCA评分,MMSE平均22分,MOCA平均17分。所有患者均行胸部CT、腹部CT/超声、盆腔超声检查,未发现肿瘤相关证据 (辅助检查详细信息见表2)。
2.4 治疗情况 5例(除例1,3)患者入院时给予抗癫痫药物治疗,2例全面强直痉挛发作减少至消失,但抗癫痫药物对面臂肌张力障碍(FBDS)患者无效。丙种球蛋白治疗联合激素治疗2例(例3,7),单纯激素治疗5例,治疗后患者幻觉发作及胡言乱语等精神症状消失,癫痫发作频次减少甚至消失,低钠血症补钠治疗效果不佳,免疫治疗1 w后均得到纠正。1 m后复查MMSE及MOCA评分,平均分分别提高5分及7分。出院1 m后随访生活均可自理。1例患者在出院2 m后复发FBDS,但较之前发作频次明显减少。1例出院2 m后因偶发口角抽搐再次入院,调整抗癫痫药物用量后再无发作。
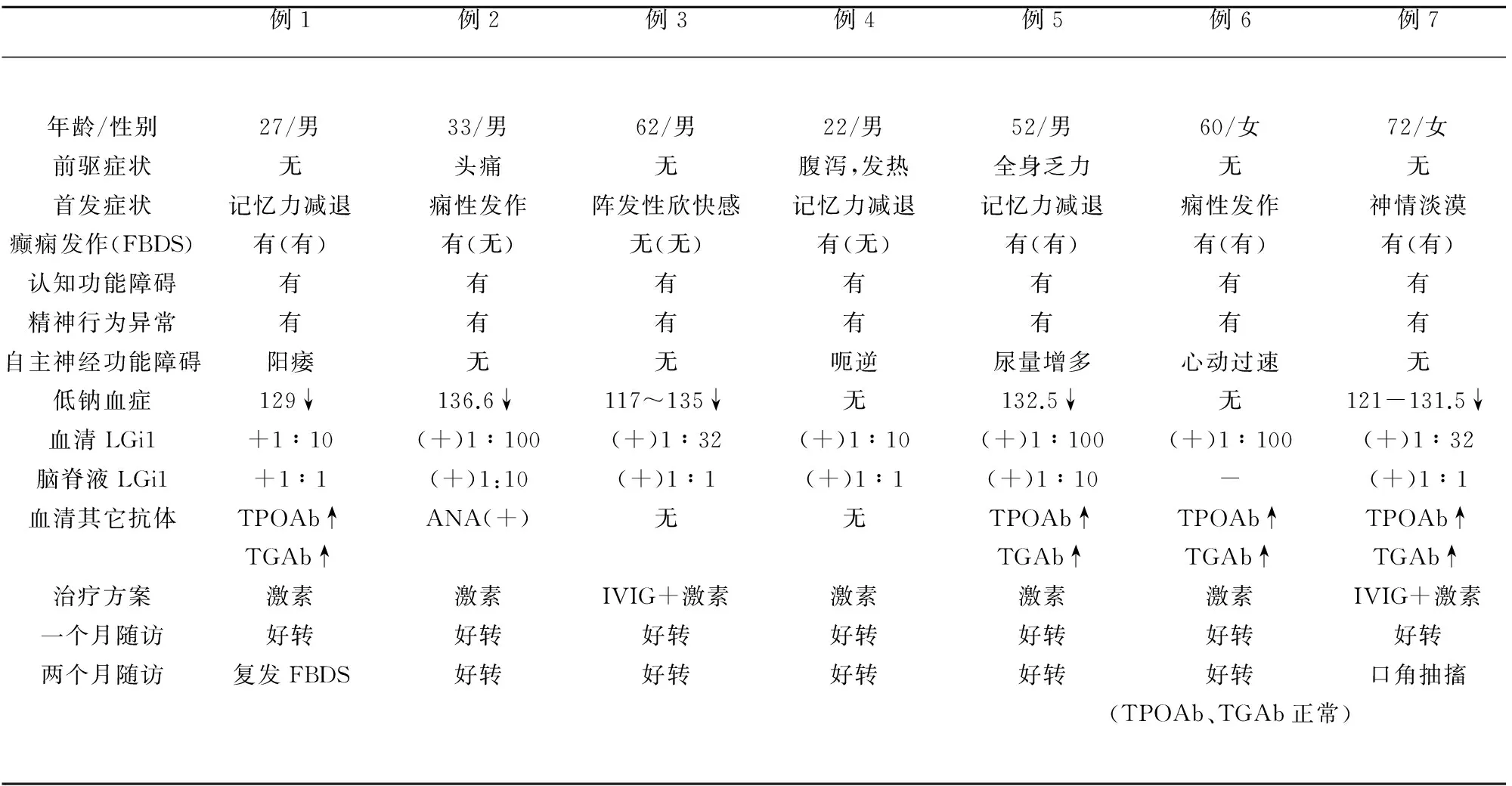
表1 临床资料
FBDS:面-臂肌张力障碍发作(faciobrachial dystonic seizures);IVIG:静脉滴注免疫球蛋白(intravenous immune globulin);TGAb:抗甲状腺微粒体抗体;TPOAb:抗甲状腺球蛋白抗体;ANA:抗核抗体

表2 辅助检查结果
MMSE:简易智力状况检查法 (mini-mentalstate examination);MOCA:蒙特利尔认知评估(montreal cognitive assessment)
3 讨 论
自1968年Corsellis等通过分析边缘叶存在炎性及变性改变的患者提出边缘叶脑(limbic encephalitis,LE)这一概念,当时普遍认为副肿瘤综合征是LE最常见的病因。2001年,Yuasa等[7]发现LE患者体内存在VGKC抗体,大多不伴有肿瘤并且临床过程呈可逆性,紧接着其它细胞膜抗原(如NMDAR、AMPAR等)抗体相继被发现[8],LE的经典概念得到拓展,自身抗体(包括抗细胞内抗原抗体和抗细胞表面或细胞外抗原的抗体)介导性的自身免疫性脑炎的发现在脑炎的探索史上具有里程碑式的意义。随后在2010年发现VGKC抗体靶抗原实际上是跨突触复合物蛋白组分或细胞黏附分子,最常见的就是LGi1,LGi1抗体相关脑炎作为一种新型边缘叶脑炎开始被临床医生逐渐认识。
目前研究发现,LGi1抗体相关LE好发于中老年男性,单项病程为主,这与抗NMDAR脑炎主要累及青年女性不同[9]。其主要临床表现包括:急性或亚急性出现的以近期记忆减退为主要表现的认知功能障碍,思维混乱、幻觉、性格改变等精神行为异常,癫痫发作。还可能性出现睡眠障碍、抑郁、疼痛及自主神经功能紊乱等。本病具有诊断意义的发作类型为FBDS[10],表现为发作频繁的、短暂的主要累及面部、肩部及上肢等部位不自主运动,既可为抽动,也可为肌张力障碍样发作,伴或不伴意识障碍。睡眠中亦可发作,此种发作抗癫痫药物疗效差,免疫调节治疗有效。既往报道约40%的LGi1-Ab相关LE的患者会出现FBDS,且出现在其他症状(主要是认知功能障碍)之前。本组患者男女比例5∶2,年龄最大为72岁,均有明显的记忆力减退,并出现精神症状,86%有癫痫发作,但仅有57%的患者有FBDS发作,其中1例还合并复杂部分性发作,只有1例为首发症状,但经抗体检测均确诊为LGi1脑炎。FBDS一直被作为LGi1抗体阳性LE特异性表现,既往国内个案报道中FBDS出现率为100%,本研究提示无典型FBDS发作的患者不能除外LGi1抗体相关LE的可能,FBDS可能并非是确诊必要的特异性临床特征。当然本组患者FBDS发现少可能与住院观察时间短,观察不仔细或发作症状不典型有关,同时FBDS可以与其他发作类型共同存在,这也对典型FBDS的发现造成困扰,提示临床中的任何阶段都需仔细观察是否有FBDS出现,还需与其他类型发作相鉴别。
既往报道LGi1抗体阳性是确诊本病的特异性指标,Vincent等[11]报道血清抗LGi1抗体阳性的患者约50%脑脊液抗体为阴性,即使为阳性,其滴度也仅为血清的1%~10%。该病患者脑脊液检查可表现为轻度蛋白增高及轻度炎症反应[12]。大部分LGi1抗体阳性LE患者不伴有肿瘤。本组患者血清LGi1抗体均阳性(100%),其中6例(86%)脑脊液LGi1抗体阳性,且这6例中脑脊液中抗体滴度为血清的3%~10%。所有患者脑脊液检查蛋白及细胞数均正常,但脑脊液生化指标中6例患者氯化物稍低,4例糖偏高,之前未见类似报道,这可能与患者本身血清低钠低氯有关。约60%LGi1抗体阳性患者出现低钠血症,并且通常难以纠正[3]。本组5例低钠血症的患者,口服或静脉补钠效果不佳,在免疫治疗7 d内完全纠正,文献提示低钠血症是应该进行LGi1抗体检测的线索之一[3],且低钠血症经免疫治疗后可以纠正。另外,本研究发现5例(71%)患者合并血清其它抗体(TPOAb、TGAb异常升高,ANA阳性),且1例患者激素治疗后甲状腺相关抗体恢复正常,提示这些患者可能合并Hashimoto脑病或风湿免疫疾病,虽然之前国内也有LGi1相关LE合并抗Yo抗体弱阳性和合并Hashimoto脑病等的个案报道[3,13],但本研究远远大于国外研究约10%患者合并其他抗体阳性的报告[14]。这些现象更加验证了LGi1抗体阳性相关脑炎的疾病本质是自身免疫机制,需进一步筛查体内潜在的肿瘤及其他相关抗体,还应注意复查这些抗体,避免漏诊,并且治疗后观察这些抗体指标可能恢复正常。
多数患者头部MRI显示双侧对称性颞叶海马为主边缘系统的异常病变,少数为单侧病变[15]。本组43%的患者颞叶内侧海马(双侧或单侧)异常信号,恢复期可见病灶缩小。1例发病1 m后头部增强MRI未见病灶的患者行PET-CT示患者海马区代谢增高,提示PET-CT对病变具有更高敏感性,更有助于早期诊断,与文献报道相符[2]。有研究发现,FBDS患者脑电图显示发作性癫痫波,且视频脑电图对FBDS和运动障碍鉴别具有重要价值[3]。因此,考虑到LGi1脑炎的患者应及时行头部MRI检查,若经济条件允许,可行PET检查,出现FBDS的患者应积极行ECG以与运动障碍相鉴别。
有研究表明,早期免疫治疗是改善自身免疫性脑炎患者预后的关键因素之一[9]。既往报道中该病常依赖于抗体的检测后再给予治疗,现参考2016年Lancet Neurol提出的自身免疫性LE诊断指南,对亚急性起病、有认知功能障碍、癫痫或精神症状、典型的影像学改变、脑脊液细胞数增多或ECG异常,再排除其他病因的情况下就可确诊自身免疫脑炎[4~6],可在抗体检测前应尽早免疫治疗。当然若LGi1抗体的检测阳性可直接确诊该病,因此符合Lancet Neurol提出可能的自身免疫性脑炎的患者,出现FBDS或低钠血症,应尽早完善血清及脑脊液LGi1抗体的检测,才能合理排除其他可能病因,尽快确诊该病。Gastaldi等[16]提出本病治疗首选糖皮质激素,若单用激素效果不佳或功能障碍较重时,应联合应用丙种球蛋白或血浆置换,并提出糖皮质激素联合应用丙种球蛋白治疗,并有效维持免疫抑制剂,能够更好的改善临床症状,不易复发。本研究中诊断时间相对较短,发病至诊断时间17 d~68 d,平均 (46.14±13.28)d,患者入院后考虑到LGi1抗体相关脑炎,早期行抗体检测并确诊,及时给予免疫治疗,1 m后随访生活均可自理,2 m后随访除2例仍有癫痫发作(发作频次较前明显减少)外,其余患者预后良好。所以早诊断早给予免疫治疗可能是良好预后的保障。
综上所述,LGi1抗体阳性LE作为一种新型自身免疫相关LE正逐渐被认识和重视,目前该病相关的指南、诊断和治疗尚未有统一的标准,极易漏诊、误诊,导致治疗的延误。本组研究收集的病例均符合LE的临床表现及影像学等辅助检查结果,有FBDS、低钠血症特异临床特征,考虑到LGi1抗体相关脑炎的可能,并及时行相关抗体检测,早期诊断及给予免疫治疗,预后良好。为LGi1脑炎临床诊疗工作提供了良好的借鉴,也引起广大医务工作者的关注。
[1]Irani SR,Alexander S,Waters P,et al.Antibodies to Kvl potassium channel-complex proteins leucine-rich,glioma inactivated l protein and contactin-associated protein-2 in limbic encephalitis,Morvan’s syndrome and acquired neuromyotonia[J].Brain,2010,133(9):2734-2748.
[2]Shin YW,Lee ST,Shin JW,et al.VGKC-complex/LGI1-antibody en-cephalitis:clinical manifestations and response to immunotherapy[J].Neuroimmunology,2013,265 (1/2):75-81.
[3]金丽日,柳 青,任海涛,等.富亮氨酸胶质瘤失活1蛋白抗体阳性边缘系统脑炎1例临床特点[J].中华神经科杂志,2013,46(7):461-464.
[4]Francesc Graus,Maarten J,Titulaer,et al.A clinical approach to diagnosis of autoimmune encephalitis [J].Lancet Neurol,2016,15:391-404.
[5]王佳伟,李 琳.对Lancet Neurol发表的自身免疫性脑炎诊断路径的思考[J].中国现代神经疾病杂志,2016,16:469-471.
[6]陈向军,邓 波.自身免疫性脑炎的诊断标准及其临床指导意义[J].中国临床神经科学,2016,24(3):336-340.
[7]Yuasa T,Fujita K.Limbic encephalitis-history,symptoms and the latest classification[J].Brain and Nerve Shinkei Kenkyu no Shinpo,2010,62(8):817-826.
[8]Dalmau J,Bataller L.Limbic encephalitis: the new cell membrane antigens and a proposal of clinical-immunological classification with therapeutic impliacations[J].Neurologia,2007,22:526-537.
[9]Newman MP,Blum S,Wong CW,et al.Autoimmune encephalitis[J].Intern Med J,2016,46(2):148-157.
[10]Irani SR,Stagg CJ,Schott JM,et al.Faciobrachial dystonic seizures: the influence of immunotherapy on seizure control and prevention of cognitive impairment in a broadening phenotype[J].Brain,2013,136:3151-3162.
[11]Vincent A,Buckley C,Schott JM,et al.Potassium channel antibody-associated encephalopathy:a potentially immunotherapy-responsive form of limbic encephalitis[J].Brain,2004,127:701-712.
[12]Ramanathan S,Mohammad SS,et al.Autoimmune encephalltis: recent updates and emerging challenges[J].J Clin Neurosci,2014,21(5):722-730.
[13]胡洪涛,郭笑磊,李 墨,等.抗LGi1抗体阳性边缘系统脑炎叠加Hashimoto脑炎临床特点分析并文献复习[J].中风与神经疾病杂志,2015,32(8):736-739.
[14]Lancaster E,Martinez-Hernandez E,Dalmau J.Encephalitis and antibodies to synaptic and neuronal cell surface proteins[J].Neurology,2011,77:179-189.
[15]Jai M,Huijbers MG,Lancaster E,et al.Investigation of LGi1 as the antigen in limbic encephalitis previously attributed to potassium channels:a ease series[J].Lancet Neurol,2010,9(8):776-785.
[16]Gastaldim,Thoui A,Vincent A,et al.Antibody-mediated autoimmune encephalopathies and immunotherapies[J].Neurotherpeutics,2016,13(1):147-162.

图A、B:例3患者右颞叶内侧T2WI呈高信号,FLAIR呈高信号;图C、D:例5患者双侧海马T2WI呈高信号,FLAIR呈高信号;图E、F:例6患者双侧颞叶海马及海马旁回T2WI呈高信号,FLAIR呈高信号
图1 患者头部MRI检查结果
The clinical analysis of LGi1-antibody-related limbic encephalitis
SHIKe,SHANGXiuli.
(DepartmentofNeurology,TheFirstHospitalofChinaMedicalUniversity,Shenyang110001,China)
Objective To analysis the clinical character,diagnosis and therapy of Leucine-rich glioma inactivated-1 (LGi1) antibody associated limbic encephalitis.Methods We retrospectively analyzed the clinical phenotypes,laboratory,ECG,imaging data,therapy and prognosis of 7 patients with LGi1-LE.Results 7 patients ranging in age from 22 to 72 years,male female ratio is 5∶2.All patients presented with psychiatric symptoms and cognitive dysfunction.Among the 8 patients,6 presented with seizures,while 4 patients experienced faciobrachial dystonic seizures (FBDS).3 patients were found abnormal electroencephalographs,with 3 patients showed abnormal temporal hippocampus signals on MRI.5 patients had hyponatremia.Six of the 7 patients had decreased chlorine concentrations in cerebrospinal fluid (CSF) examination.The positive of anti-LGi1 antibody of serum was 100%,while it was 85.7% in CSF.Other serumal autoantibodies were found in 5 patients.Screening for malignant tumors of all revealed normal findings.Immunomodulatory therapy were effective to all patients.Conclusion Most patients with LGi1-LE not only develop the classic syndromes of limbic encephalitis,such as psychiatric symptoms,cognitive dysfunction and seizures,but also have hyponatremia and a weak association with cancer.MRI scans mainly show abnormal temporal hippocampus signals.The respond to immunotherapy is kind.
Leucine-rich glioma inactivated 1 (LGi1); Limbic encephalitis; Lmmunotherapy; Faciobrachial dystonic seizures (FBDS); Hyponatremia

图2 例1患者PET-CT结果。左侧海马局部较对侧FDG摄取略增高
1003-2754(2017)06-0523-05
2017-02-08;
2017-05-25
(1.中国医科大学附属第一医院神经内科,辽宁 沈阳 110001)
商秀丽,E-mail:shang_zhao@ sohu.com
R512.3
A
