氨甲酰化促红细胞生成素经PI3-K/Akt信号通路抗脑缺血损伤
2017-07-19柏玉兰石少亭李亚军
张 蓓, 王 林, 柏玉兰, 石少亭, 张 雷, 李亚军
氨甲酰化促红细胞生成素经PI3-K/Akt信号通路抗脑缺血损伤
张 蓓, 王 林, 柏玉兰, 石少亭, 张 雷, 李亚军
目的 观察脑缺血后氨甲酰化促红细胞生成素(CEPO)的神经保护作用并探讨其可能机制。方法 健康雄性SD大鼠随机分为6组(n=10):(1)假手术组;(2)缺血组;(3)EPO组;(4)CEPO组;(5)LY(LY294002)组;(6)CEPO+LY组。应用大脑中动脉线栓法(MCAO)制作大鼠局灶性脑缺血模型,评定大鼠神经功能并计算脑梗死体积,Western blot 方法检测PI3-K/Akt活性变化。结果 EPO组与CEPO组脑梗死体积均明显缩小,神经功能显著改善,磷酸化Akt(pAkt)水平明显增高,且两组之间无明显差异,但CEPO的神经保护作用及对Akt磷酸化的诱导效应均可被PI3-K抑制剂 LY294002部分抵消。结论 CEPO具有与EPO相当的缺血后脑保护作用,其机制可能与PI3-K/Akt信号通路激活有关。
磷脂酰肌醇-3激酶/丝氨酸-苏氨酸蛋白激酶; 促红细胞生成素; 氨甲酰化促红细胞生成素; 脑缺血
氨甲酰化促红细胞生成素(carbamylated erythropoietin,CEPO)是促红细胞生成素(erythropoietin,EPO)的一种衍生物。与EPO相比,CEPO没有促红细胞生成的作用,但仍具有对脑、脊髓、心脏等的组织保护功能,且CEPO不能与经典型EPO受体(EPOR)2结合[1],因此CEPO诱导的神经保护作用的分子机制可能与EPO存在差异,目前尚不明晰。本实验拟观察EPO及CEPO干预后局灶性脑缺血大鼠中PI3-K/Akt活性变化,初步探讨介导CEPO脑保护作用的可能的信号通路。
1 材料与方法
1.1 实验动物及分组 健康成年SD大鼠60只(雄性,260~300 g,由西安交通大学医学院实验动物中心提供),随机均分为6组(n=10):(1)假手术组(仅分离暴露颈部动脉不阻断血流);(2)缺血组;(3)EPO组(于术后30 min经尾静脉注射重组人促红细胞生成素(rhEPO) 5000 IU/kg);(4)CEPO组(于术后30 min经尾静脉注射CEPO 50 μg/kg)[2];(5)LY组(PI3-K/Akt抑制剂LY 294002 0.3 mg/kg于栓塞前15 min经尾静脉给药);(6)CEPO+LY组(于相应时间点分别给予LY294002和CEPO)。
1.2 主要试剂 rhEPO(沈阳三生制药有限责任公司),CEPO(lundbeck公司),LY294002(Selleck公司),pAkt抗体、Akt抗体(Cell Signaling公司),β-actin多克隆抗体(Santa Cruz公司),HRP标记山羊抗兔IgG、RIPA裂解液、BCA蛋白浓度定量试剂盒(上海浩然生物技术有限公司),ECL显色试剂盒(Santa Cruz公司)。
1.3 动物模型制备 参照Zea-Longa法[3]改良后制作右侧大脑中动脉闭塞模型:大鼠经10%水合氯醛(0.3 mg/kg)腹腔注射麻醉后仰卧位固定,备皮,消毒,沿颈前正中线切开皮肤,逐层分离,暴露右侧颈动脉,结扎颈外动脉及颈总动脉近心端,于颈总动脉近分叉处切口,将自制线栓(4-0单丝尼龙手术缝合线,头端加热成直径0.3 mm光滑球形,酒精消毒、 肝素浸泡后备用)自切口插入颈内动脉18~20 mm至大脑中动脉起始处,结扎固定线栓。
1.4 神经功能评定 所有动物均于术前及术后24 h参照Zea-longa[3]标准进行神经功能评定。0分:无神经功能缺损; 1分:不能完全伸展左侧前爪;2分:向左侧转圈;3分:行走时向左侧倾倒;4分:不能自发行走,有意识障碍。1~4分视为造模成功,术前大于0分、术后评0分及术后24 h内死亡者剔除,并随机补足。
1.5 脑梗死体积测定 每组各取5只大鼠于术后24 h断头取脑,去除嗅球、小脑和低位脑干,以前囟(Bregma)为标志点,从Bregma+4.0 mm~Bregma-8.0 mm,以2 mm间隔行连续冠状切片共6片,放入1%红四氮唑(TTC)磷酸盐缓冲液中(pH=7.4),37 ℃孵育30 min。正常脑组织着深红色,梗死灶呈苍白色,4%多聚甲醛固定,拍照,利用Photoshop等软件计算脑梗死体积。
1.6 Western blot方法检测Akt表达及PI3-K/Akt活性变化 每组动物各取5只,术后24 h断头取脑,迅速置于液氮中保存备用。按常规方法提取脑组织总蛋白,应用BCA蛋白定量试剂盒进行蛋白定量,经变性取20%SDS-PAGE电泳转移到PVDF,4 ℃封闭过夜,加入一抗(Akt:1∶400,pAkt:1∶400),相应抗体4 ℃孵育过夜,洗膜后加入辣根过氧化物标记的二抗(1∶2000),化学发光法进行显色反应。
2 结 果
2.1 死亡率 假手术组大鼠无死亡,缺血组、LY组各死亡两只,CEPO组1只(术中刺激颈动脉窦引起迷走减压反射而迅速死亡),CEPO+LY组1只。以上大鼠均死于术后24 h内,不列入统计,另随机选取大鼠补齐。各组大鼠死亡率比较无明显差异(P>0.05)。
2.2 神经功能评分 假手术组全部动物未检测到神经功能缺损(0分),其余各组大鼠术后24 h均出现不同程度的神经功能缺损。 EPO及CEPO干预后大鼠神经功能明显改善,且两组的神经功能评分无明显差异(P>0.05);LY组神经功能损伤较缺血组加重;CEPO+LY组与缺血组没有明显差异(P>0.05)(见表1)。
2.3 脑梗死体积测定 假手术组未见TTC不着色区, EPO或CEPO干预可显著减小梗死体积,且两组之间无明显差异,脑保护作用相当(P>0.05);而LY组(P<0.01)、 CEPO+LY组(P<0.05)脑梗死体积均较缺血组增大,这表明特异性PI3-K/Akt抑制剂LY294002可以抑制CEPO减小脑梗死体积的作用,PI3-K/Akt信号途径可能介导了CEPO的脑保护作用(见表1)。
2.4 Akt蛋白表达及PI3-K/Akt活性变化 Akt的持续活化是其发挥促细胞生存、抑制细胞凋亡等功能的重要前提,而其相关位点的磷酸化是Akt激活的必要条件。各组大鼠Akt表达无明显差异(P>0.05);缺血组磷酸化Akt(pAkt)明显低于假手术组(P<0.05);与缺血组比较,EPO组和CEPO组pAkt水平均明显增高(P<0.01),且两组之间无显著差异(P>0.05),LY组pAkt明显降低(P<0.01),CEPO+LY组无明显差异(P>0.05);相较于CEPO组,Akt被CEPO诱导增强的磷酸化作用被LY294002部分阻断(P<0.01)(见图1)。

表1 各组大鼠神经功能评分及 脑梗死体积测定
与缺血组比较*P<0.05,**P<0.01;与CEPO组比较#P<0.05,##P<0.01;与LY组比较△P<0.05,△△P<0.01
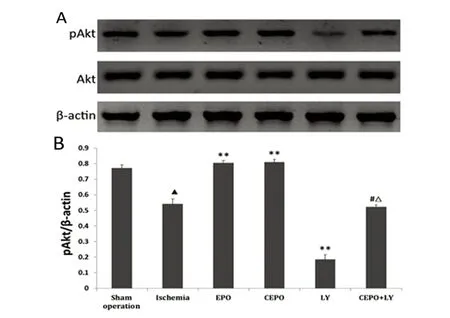
与假手术组比较▲P<0.05;与缺血组比较**P<0.01;与CEPO组比较#P<0.01;与LY组比较△P<0.01
图1 各组大鼠Akt和pAkt的表达
3 讨 论
EPO是一种主要由胎儿的肝脏和成年人的肾脏合成和分泌的酸性糖蛋白,除了能够刺激骨髓中红系祖细胞的增殖与分化具有造血活性外,还在多种细胞因子联合作用下,通过促进血管生长、抑制炎症反应和细胞凋亡、抗兴奋性氨基酸毒性、调节NO的合成、提高神经突触传递、抗氧化损伤、调节神经干细胞的增殖与分化等途径在缺血/缺氧性脑损伤时发挥神经营养活性及重要的保护作用[4~12]。然而EPO本身的促红细胞生成、促血栓形成等副作用极大地限制了其临床应用推广[13]。CEPO是EPO的氨甲酰化衍生物,CEPO不具促红细胞特性,但它仍具有细胞保护作用,而且其药代动力学特征与EPO保持相似[14]。本实验发现,EPO及CEPO干预组动物脑缺血后神经功能评分、脑梗死体积测定均较缺血组有显著改善,进一步证实了二者对局灶性脑缺血大鼠的神经保护作用,且EPO与CEPO组间并无差别,提示缺血性脑损伤后CEPO发挥保护作用的效能与EPO基本相同。
EPO可通过激活JAK2(Janus-tyrosine kinase-2),进而调控其下游的信号传导途径,包括Ras-分裂素活性蛋白激酶 (Ras-mitogerr-activated-protein-kinase,Ras-MAPK),磷脂酰肌醇-3-激酶(Phosphoatidyli-nositol-3-kinase,PI3-K)和信号转导及转录激活因子-5(signal transducers and activators of transcription-5,STAT5)发挥神经保护作用。现已证实,CEPO通过结合非经典型EPO受体EPOR (erythropoietin receptor)-βcR起作用,不能与经典型EPO受体(EPOR)2结合,因此CEPO诱导的组织保护作用的分子机制可能与EPO存在差异。已有学者报道CEPO不能有效地触发JAK2/STAT5的磷酸化[15]。Akt,即丝氨酸-苏氨酸蛋白激酶(serine/threonne kinase,Akt),是PI3-K直接的下游作用靶点,其磷酸化即pAkt水平是PI3-K/Akt途径活化的标志。CEPO是否能有效地激活PI3-K/Akt信号通路从而发挥脑保护作用尚不清楚。PI3-K/Akt信号通路是一条重要的抗凋亡/促增殖信号途径。多种神经营养因子通过激活PI3-K/Akt信号通路抑制细胞凋亡,发挥脑保护作用[16,17]。LY294002是靶向PI3-K的催化亚基p110的高度选择性、竞争性抑制剂,可以使PI3-K/Akt通路处于失活状态。我们的研究发现,在持续性脑缺血24 h,EPO和CEPO均可有效促进Akt的磷酸化,pAkt蛋白表达上调;而LY294002不仅加重了神经功能缺损、增大了梗死体积、抑制了缺血组pAkt的表达,同时阻断了CEPO对Akt磷酸化的诱导效应,使得CEPO对PI3-K/Akt信号转导通路的激活力明显下降,提示LY294002亦能削弱CEPO通过PI3-K/Akt信号转导通路诱导的缺血后脑保护效应,因此PI3-K/Akt通路的激活可能是CEPO发挥神经保护作用的机制之一。开发无造血功能但具有确切的组织保护功效的EPO衍生物,为探索脑缺血后神经保护药物的研究提供了新的思路和方法,而新型EPO衍生物脑保护作用的信号转导机制的阐明将为其深入研究和临床应用提供重要依据。
[1]Dumont F,Bischoff P.Non-Erythropoietic tissue-protective peptides derived from erythropoietin:W02009094172[J].Expert Opin Ther Pat,2010,20(5):715-723.
[2]Millet A,Bouzat P,Trouve-Buisson T,et al.Erythropoietin and its derivates modulate mitochondrial dysfunction after diffuse traumatic brain injury[J].J Neurotrauma,2016,33(17):1625-1633.
[3]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[4]Li X,Bai ZY,Zhang FY,et al.Neuroprotection of herbs promoting EPO on cerebral ischemia[J].Zhongguo Zhong Yao Za Zhi,2015,40(12):2265-2271.
[5]Nguyen AQ,Cherry BH,Scott GF,et al.Erythropoietin:powerful protection of ischemic and post-ischemic brain[J].Exp Biol Med (Maywood),2014,239(11):1461-1475.
[6]Xiong Y,Mahmood A,Meng Y,et al.Delayed administration of erythropoietin reducing hippocampal cellloss,enhancing angiogenesis and neurogenesis,and improving functionaloutcome following traumatic brain injury in rats:comparison of treatment with single and triple dose[J].J Neurosurg,2010,113:598-608.
[7]Li Y,Ogle ME,Wallace GC,et al.Erythropoietin attenuates intracerebral hemorrhage by diminishing matrix metalloproteinases and maintaining blood-brain barrier integrity in mice[J].Acta Neurochir Suppl,2008,105:105-112.
[8]Baines CP.The cardiac mitochondrion:nexus of stress[J].Annu Rev Physiol,2010,72:61-80.
[9]Sifringer M,Brait D,Weichelt U,et al.Erythropoietin attenuates hyperoxia-induced oxidative stress in the developing rat brain[J].Brain Behav Immun,2010,24:792-799.
[10]Zhang GL,Wang W,Kang YX,et al.Chronic testosterone propionate supplement activated the Nrf2-ARE pathway in the brain and ameliorated the behaviors of age rats[J].Behav Brain Res,2013,252:388-395.
[11]Kamal A,Al Shaibani T,Ramakers G.Erythropoietin decreases the excitatory neurotransmitter release probability and enhances synaptic plasticity in mice hippocampal slices[J].Brain Res,2011,1410:33-37.
[12]Jin R,Song Z,Yu S,et al.Phosphatidylinositol-3-kinase gamma plays a central role in blood-brain barrier dysfunction in acute experimental stroke[J].Stroke,2011,42:2033-2044.
[13]Souvenir R,Doycheva D,Zhang JH,et al.Erythropoietin in stroke therapy: friend or foe[J].Curr Med Chem,2015,22(10):1205-1213.
[14]Liu W,Shen Y,Plane JM,et al.Neuroprotective potential of erythropoietin and its derivative carbamylated erythropoietin in periventricular leukomalacia[J].Exp Neurol,2011,230(2):227- 239.
[15]Ehrenreich H.A boost for translational neuroscience[J].Science,2004,305:184-185.
[16]Nayak GH,Prentice HM,Milton SL.Neuroprotective signaling pathways are modulated by adenosine in the anoxia tolerant turtle[J].J Cereb Blood Flow Metab,2011,31(2):467-475.
[17]王长明,蒋国红,徐 平,等.MicRNA-124可能通过PI3K/Akt通路调节缺血脑组织细胞凋亡[J].中风与神经疾病杂志,2016,33(2):146-149.
Carbamylated erythropoietin via PI3-K/Akt signaling pathway reduces cerebral ischemic injury
ZHANGBei,WANGLin,BAIYulan,etal.
(DepartmentofNeurology,TheFirstAffiliatedHospitalofXi’anMedicalUniversity,Xi’an710077,China)
Objective To study the neuroprotective effect of carbamylated erythropoietin (CEPO) on cerebral ischemic injury and its possible mechanism.Methods Sixty healthy male SD rats were randomly divided into 6 groups (n=10 each):sham operation group,ischemia group,EPO group,CEPO group,LY group and CEPO+LY group.Focal cerebral ischemia model of middle cerebral artery occlusion (MCAO) was established in rats using the suture method.Neurological function and the volume of cerebral infarction were evaluated on the expected time points.The changes in activity of PI3-K/Akt pathway were determined by Western blot.Results In both EPO group and CEPO group,the protein levels of phosphorylated Akt (pAkt) were increased markedly with less volume of cerebral infarction and better neurological function,and there was no significant difference between the two groups.However,the neuroprotection of CEPO and its induction of Akt phosphorylation were partially abolished by LY294002,which was the inhibitor of PI3-K.Conclusion The neuroprotective effect of CEPO is equivalent to EPO after cerebral ischemia,which may be related to the activation of PI3-K/Akt signaling pathway.
PI3-K/Akt; Erythropoietin; Carbamylated erythropoietin; Cerebral ischemia
1003-2754(2017)06-0488-03
2016-12-23;
2017-03-29
陕西省自然科学基金资助项目(No.2010JM4054);陕西省教育厅科研基金资助项目(No.14JK1629);陕西省卫生厅科研基金资助项目(No.2010H27);陕西省优势学科建设项目资助
(西安医学院第一附属医院神经内科,陕西 西安 710077)
李亚军,E-mail:liyajun9@hotmail.com
R743.3
A
