人脐血间充质干细胞移植对脑梗死兔神经功能障碍和头部核磁共振波谱的影响
2017-07-19黄海丽管叶明刘学春刘红娟汪青松
黄海丽, 管叶明, 刘学春, 刘红娟, 汪青松
人脐血间充质干细胞移植对脑梗死兔神经功能障碍和头部核磁共振波谱的影响
黄海丽, 管叶明, 刘学春, 刘红娟, 汪青松
目的 观察人脐血间充质干细胞移植对缺血再灌注兔神经功能障碍和头部核磁共振波谱参数的影响。方法 采集足月新生儿脐带血60~80 ml,分离hUCB-MSCs,并体外培养。将造模成功的大脑中动脉栓塞模型30只兔随机分为脑梗死组、干细胞组、生理盐水组,每组10只,后两组移植人脐血间充质干细胞和生理盐水。移植48 h、2 w时,采用Purdy评分进行神经损害严重程度评估,行核磁共振及氢质子核磁共振波谱检查,进行梗死体积、及梗死中心区N-乙酰天门冬氨酸、 胆碱和肌酸等代谢物含量的测定。结果 与脑梗死组及生理盐水组相比,干细胞组NSS评分较低,差异具有统计学意义(P<0.05);生理盐水组与脑梗死组NSS评分无明显差异(P>0.05)。与脑梗死组和生理盐水组相比,干细胞组梗死体积明显减小(P<0.05)。与假手术组相比,干细胞组、脑梗死组与生理盐水组NAA/Cr、Cho/Cr比值均明显下降,Lac/Cr比值均显著上升(P<0.01);但干细胞组NAA/Cr、Cho/Cr比值显著高于脑梗死组及生理盐水组(P<0.05),Lac/Cr比值显著低于后两组(P<0.05);而生理盐水组NAA/Cr、Cho/Cr、Lac/Cr比值与脑梗死组之间无明显差异(P>0.05)。结论 脐血间充质干细胞移植能提高脑梗死兔脑NAA/Cr、Cho/Cr比值,降低Lac/Cr比值,缩小梗死范围,明显改善兔神经功能。
人脐血间充质干细胞; 脑梗死; 神经功能; 磁共振波谱
脑卒中以其高发病率、高病死率和高致残率严重影响着人们的生存及生活质量,缺血性脑卒中是最常见的类型。通过溶栓和介入治疗,能部分恢复血管再通,但由于时间及适应证的局限性,仅少数患者从中受益。干细胞工程的兴起给缺血性脑卒中患者的治疗带来了新希望。而脐血作为MSCs的重要来源之一,具有自我更新、免疫调控、向不同组织分化潜能、促进微血管形成等特点,与其他类似干细胞相比,具有易于采集、来源广泛、免疫排斥性弱、无伦理学争议及被病原体污染可能性小等优点[1]。
本实验通过线栓法建立兔大脑中动脉栓塞再灌注模型,观察hUCB-MSCs移植对缺血再灌注兔脑核磁共振波谱成像、血清hs-CRP水平和梗死体积的影响,探索hUCB-MSCs移植改善缺血性脑卒中的可能机制,为hUCB-MSCs治疗缺血性脑卒中提供实验依据。
1 材料与方法
1.1 实验动物 选用健康雄性新西兰大白兔40只,体重2.5~3.0 kg,购自安徽医科大学实验动物中心。均通过动物实验管理办法,通过动物实验伦理论证。
1.2 试剂和器材 细胞培养箱购自美国Thermo Scientific公司。水浴箱购自上海精密实验设备有限公司。-80 ℃低温冰箱购自美国NBS公司。超净工作台购自上海荣翔实验设备有限公司。流式细胞仪购自美国Beckman Coulter公司。DMEM (500 ml)培养基购自美国Invitr公司。CD34-PE、CD44-FITC单抗及CD45-PE、CD29-FITC单抗购自美国Beckman Coulter。线栓购自北京沙东生物有限公司。Siemens Novus 1.5T MR扫描仪及Siemens Novus 1.5T MR 图像处理软件购自Siemens公司。
1.3 hUCB-MSCs的分离、培养及鉴定 无菌条件下采取本院产科健康分娩新生儿的脐血60 ml~80 ml,用一次性采血袋收集,摇匀后冰盒保存,2 h内送实验室分离。脐血与PBS液按1∶1混匀,叠加于人淋巴细胞分离液上(1∶1∶1),2500 rpm离心20 min,收集白膜层,加入等量红细胞裂解液混匀,放置4 ℃冰箱10 min后离心弃上清。以1×106/ml接种于DMEM培养基中,37 ℃,5%CO2培养箱内培养。分离后72 h后首次换液(半量),除去未贴壁细胞。以后根据细胞生长情况,以后每3 d~4 d换液一次,更换培养基,倒置相差显微镜逐日观察细胞形态、贴壁情况及生长情况。10 d~14 d待细胞80%融合时,0.25%胰蛋白酶消化,1∶2的比例传代接种于培养皿中,置于37 ℃,5%CO2培养箱内培养。直至贴壁细胞彼此融合铺满皿底时,重复上述操作,反复传代扩增,并标记为P1(Passage1,P1)至P4等。通过贴壁培养法,每次换液弃除悬浮细胞。贴壁细胞主要是hUCB-MSCs,但可能混有淋巴细胞、单核细胞、成纤维细胞、上皮细胞,每次传代用0.25%胰蛋白酶,0.02%EDTA(0.1 ml/cm3)消化1 min。轻度吹打,严格控制消化液的量和消化时间,利用hUCB-MSCs较易脱落的特点,保证hUCB-MSCs在短暂的作用时间内与培养瓶底分开,淋巴细胞、单核细胞、成纤维细胞、上皮细胞则因贴壁性强仍贴附于培养皿底,从而使hUCB-MSCs得到纯化。取传3代后的细胞,去掉培养液,PBS洗两遍,用1∶1的0.25%胰蛋白酶和0.02%EDTA混合液消化,以1000 rpm离心5 min,用PBS洗涤一次,调整细胞浓度,制成浓度为1×109/L的单细胞悬液。每个EP管加1 ml细胞悬液,PBS或0.9%生理盐水离心洗涤后,分别加入各种抗体。其中1管为阴性对照,其余2管分别加入CD29-FITC、CD45-PE和CD44-FITC、CD34-PE单抗,室温避光孵育20 min,流式细胞仪检测鉴定细胞表型。
1.4 动物模型 参考Longa等[2]的线栓法,制成兔右侧大脑中动脉栓塞再灌注模型。术前动物禁食24 h,耳缘静脉缓慢注射2%戊巴比妥钠(剂量为20 mg/kg),麻醉成功后,颈部备皮,利多卡因局部麻醉,取颈部正中切口,长3 cm~3.5 cm,暴露右侧颈总动脉和颈外动脉,4号线结扎颈外动脉,分离与颈总动脉伴行的迷走神经,在距颈总动脉分叉处近心端1.5 cm处结扎颈总动脉,在结扎线的远端,置线备用。用微小动脉夹夹闭备用线远心端的颈总动脉,在备用线的近端用眼科剪剪一小切口,将标记线栓(头端直径0.53 mm)送入切口,将备用线扎紧,逐渐松开动脉夹,将线栓沿颈总动脉、颈内动脉顺行向上插入至大脑中动脉(middle cerebral artery,MCA)起始部,遇阻力时停止,从颈总动脉分叉处计算插入深度5.0 cm~6.0 cm,造成大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)。逐层缝合皮肤,将线栓末端留于皮外,缺血2 h后,无需再次麻醉,轻轻抓握动物将线栓缓慢拔出,颈总动脉切口处按压数分钟,防止少量出血。造模时室温保持在25 ℃左右。术后将动物置于放有清洁垫料的饲养箱。另外部分兔子只需分离颈总动脉、颈内动脉,无需插入线栓。
1.5 动物分组与干细胞的移植 兔清醒后出现左侧肢体偏瘫造模成功方可纳入实验组。除去死亡或造模失败的兔子(13只)。将造模成功的兔子随机分脑梗死组(n=10)、干细胞组(n=10)和生理盐水组(n=10)。只行分离颈总动脉、颈内动脉,无需插入线栓的10只兔子作为假手术组。干细胞组与生理盐水组分别于建模后1 d经股静脉注射已制备好的hUCB-MSCs悬液及等体积0.9%的生理盐水。
1.6 神经功能缺损评分 采用Purdy评分标准,于移植后2 d、7 d、14 d对脑缺血再灌注模型家兔的意识、行为、转头、转圈及偏盲五方面进行神经功能缺损评分。总得分最低分为2分,表示完全正常,无神经功能缺陷;总得分最高分为11分,表示动物意识丧失或死亡。
1.7 氢质子核磁共振波谱MRS检查 用Siemens Novus 1.5T超导型磁共振系统行MRI及1H-MRS检查。检测梗死中心区代谢产物,包括N-乙酰天门冬氨酸(NAA)、乳酸(Lac)、胆碱(Cho)和肌酸(Cr)的含量,并以Cr作为标准,计算各代谢物与其比值。所得图像用Siemens Novus 1.5T MR图像处理软件进行相同基线校正、相位调整及化学移位确定,自动获取波谱各代谢物以Cr为参照的代谢产物比值而进行比较。
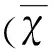
2 结 果
2.1 移植后各组兔神经功能评分对比 采用Purdy评分标准对移植后各组兔神经功能进行评分,假手术组各时间点神经功能评分均为2分。移植2 d时,脑梗死组、干细胞组和生理盐水组NSS评分比较无统计学差异(P>0.05)。移植7 d、14 d时,干细胞组NSS评分明显低于2 d时,差异有统计学意义(P<0.05)。在移植14 d时,各组NSS评分较2 d显著减低,差异有统计学意义(P<0.05),且干细胞组NSS评分明显低于脑梗死组和生理盐水组,差异有统计学意义(P<0.05)(见表1)。
2.2 各组兔脑梗死体积比较 采用Siemens Novus 1.5T MR 图像处理软件自动得出各层梗死面积,再乘以层厚得出各层梗死体积,再将各层梗死体积求和得出总梗死体积。结果(见表2)。由表2可知:与生理盐水组和脑梗死组相比,干细胞组梗死体积明显减小(P<0.05)。与脑梗死组相比,生理盐水组梗死体积未见明显减小(见图1)。
2.3 MRS检测代谢物含量的比较 MCAO 2 h再灌注2 d和2 w时MRS检查结果显示,脑缺血区代谢物含量在不同组有明显差异。与假手术组相比,干细胞组、脑梗死组与生理盐水组NAA/Cr、Cho/Cr比值均明显下降,Lac/Cr比值均显著上升(P<0.01);与脑梗死组及生理盐水组相比,干细胞组NAA/Cr、Cho/Cr比值显著增高(P<0.05),Lac/Cr 比值显著降低(P<0.05);与脑梗死组相比,生理盐水组NAA/Cr、Cho/Cr、Lac/Cr比值无明显改变(P>0.05)(见表3、表4、图2)。

表1 各组细胞移植后NSS的比较
与2 d比较*P<0.05;与梗死组比较#P<0.05;与生理盐水组比较△P<0.05

表2 各组兔不同时间点梗死体积比较(n=10, ±s)
与脑梗死组比较*P<0.05;与生理盐水组比较#P<0.05

表3 各组2 d时脑梗死区代谢物含量比值比较
与假手术组比较*P<0.01;与脑梗死组比较#P<0.05;与生理盐水组比较△P<0.05

表4 各组2 w时脑梗死区代谢物含量比值比较±s)
与假手术组比较*P<0.01;与脑梗死组比较#P<0.05;与生理盐水组比较△P<0.05

A:假手术组;B:脑梗死组;C:生理盐水组;D:干细胞组
图1 各组兔脑MRI图

A:假手术组;B:脑梗死组;C:生理盐水组;D:干细胞组
图2A:假手术组兔MRS图,可见NAA、Cho为直立陡峭波峰,未检出Lac峰。图2B、C分别为脑梗死组及生理盐水组,较图2A,NAA峰减低,可见高大的Lac峰;图2D:为干细胞组,与图2A相比,NAA峰减低,可见明显Lac峰;与图2B和2C相比,NAA峰明显增高,而Lac峰显著减低
图2 造模后各组兔颅脑MRS成像
3 讨 论
缺血性脑卒中现有的抗血小板聚集、改善脑血循环、促进脑代谢、使用脱水剂等药物均不能保证脑梗死后缺血区神经细胞的存活,而溶栓、拉栓等介入治疗手段仍存在很大的局限性,不能根本改善脑梗死的预后。近年来,干细胞移植为中枢神经系统损伤的修复带来了新的希望。脐血被认为是各种干细胞的来源[3]。脐血中的MSCs被认为是用于移植的最佳选择。
干细胞治疗的最终目标是将活细胞送入脑内,并希望这些细胞或其释放的神经营养因子可重建受损的宿主神经连接,或通过形成新的网络或重建原有通路,从而促进神经功能恢复[4]。有多项研究证实,UCB-MSC具有神经分化潜能。另外,UCB-MSC具有重要的“免疫逃避”特性、免疫调节功能和迁移性等特点。本实验将体外分离的hUCB-MSCs经静脉途径注射入MCAO兔体内,设立脑梗死组及生理盐水组,结果显示自14 d起,干细胞组NSS评分显著低于脑梗死组及生理盐水组,而生理盐水组与脑梗死组之间无显著差异。提示hUCB-MSC能促进脑缺血再灌注兔神经功能的恢复。此外该试验通过对各组兔脑MRI检查统计分析,显示干细胞组梗死体积明显小于生理盐水组及脑梗死组,提示hUCB-MSC移植可减轻脑缺血再灌注兔脑的损伤。因此,我们推测hUCB-MSCs具有神经分化潜能及迁移等特性。
质子磁共振波谱是目前唯一能非创伤性观察活体内某一特定组织区域的代谢物浓度改变的检测手段,采用MRS观察组织病理生理改变亦逐渐在临床上运用。这对早期诊断以及预后和疗效的判断非常有用,目前临床上NAA、Cr、Cho、MI、Lac的测定较为常用。NAA作为公认的神经元损伤相关的标记物,主要存在于有功能的神经元的胞体和轴突内,由神经元的线粒体产生,能敏感地反映神经元的脱失、功能失活及残存神经元的状态[5,6]。本实验结果显示,脑梗死组、干细胞组及生理盐水组较假手术组NAA/Cr均显著降低,但干细胞组降低幅度较脑梗死组及生理盐水组小。因此,我们可以推断,hUCB-MSCs移植可以阻断细胞凋亡,减少神经元的损伤,提高缺血区域神经元的数量或神经元的密度,从而使缺血区域的NAA增高。
Lac是葡萄糖无氧酵解的产物,反映早期缺血性脑梗死严重程度,同时认为Lac是早期脑梗死最敏感的标记物,它可能在常规MR出现异常之前就能被检测到,可根据Lac峰值出现的位置提示疑似早期缺血的脑组织的部位及范围。在脑梗死中,Lac浓度呈动态变化过程。有多项研究报道[7~9],Lac在脑梗死发生后3 h就可被检测出,48 h内显著升高,随后急性期继续升高,并达到高峰,亚急性期开始有不同程度的下降,以后随病程的延长呈进行性下降,至慢性晚期(发病后1 m以上)逐渐消失。本实验结果显示,脑缺血后,Lac水平显著上升,48 h Lac水平明显高于2 w的。并且,干细胞组Lac水平显著低于生理盐水组及脑梗死组的。这可能与hUCB-MSCs移植能在宿主脑内存活、分化,促进新生血管的再生有关。近年来,有多项动物实验证实,MSCs能增加缺血区域的新生血管的生成[10,11],能显著改善局部血流灌注及脑细胞缺血缺氧。而MaXL[12]等的实验研究表明移植hUCB-MSCs能导致脑缺血大鼠血管生成素-1(Angiopoietin-1)和大鼠血管生成素-2 mRNA的显著上调,且Ang-2的表达早于Ang-1,提示Ang-2可能是血管生成的起始物。
Cho是细胞膜磷脂代谢的中间产物,主要存在于神经胶质细胞中,参与细胞膜的合成和髓鞘的降解。Cho含量的变化可间接反映细胞的增殖情况。而有关脑梗死后Cho变化规律的文献报道不尽相同,多数研究以下降多见[7,13]。也有研究报道[8]不同年龄脑梗死时Cho的变化存在差异性,可能与年龄和代谢水平有一定的关系。本实验结果显示脑缺血后Cho显著下降,并且干细胞组较生理盐水组及脑梗死组下降幅度小。脑缺血后Cho持续下降,反映随着时间的延长,缺血区神经元坏死、丢失增多,细胞密度下降,而干细胞组较生理盐水组下降幅度小,也间接表明干细胞移植在一定程度上能阻断梗死灶中心区神经元的凋亡。
综上所述,MRS能动态观察脑梗死后代谢物的变化,有助于了解脑梗死发生发展的过程,在脑梗死的研究中具有重要的价值。本研究表明hUCB-MSCs移植能改善脑缺血再灌注兔神经功能缺损,减小梗死体积,提高缺血中心区NAA/Cr、Cho/Cr比值,降低Lac/Cr比值,为hUCB-MSCs移植能改善缺血区细胞缺血缺氧,并在一定程度上减少神经元的凋亡提供间接的证据。
[1]Choumeianou DM,Martimianaki G,Stiakaki E,et al.Comparative study of stemness characteristics of mesenchymal cells from bone marrow of children and adults[J].Cytotherapy,2010,12(7):881-887.
[2]Longa EZ,Weinsteion PR,Canlson S,et al.Reversible middle cerebral artery occlusion without craniectiomy in rats[J].Stroke,1989,20:84-91.
[3]Weiss ML,Troyer DL.Stem cells in the umbilical cord[J].Stem Cell Rev,2006,2:155-162.
[4]Borlongan CV,Hadman M,Sanberg CD,et al.Central nervous system entry of peripherally injected umblilical cord blood cells is not required for neuroprotection in stroke[J].Stroke,2004,35:2385-2389.
[5]Soares DP,Law M.Magnetic resonance spectroscopy of the brain review of metabolions and clinical application[J].Clinic Radiol,2009,64:12-21.
[6]李铭鑫,胡慧军,郑奎宏,等.DTI与MRS成像在一氧化碳中毒迟发性脑病中的应用研究[J].中国CT和MRI杂志,2014,12(8):8-10.
[7]陈若伟,郑文斌,刘国瑞,等.磁共振波谱及LCModel定量分析对缺血性脑梗死代谢物变化的研究[J].实用放射学杂志,2012,28(1):6-10.
[8]利 晞,周志衡,张 斌,等.青年和老年急性脑梗死代谢物差异性波谱研究[J].中国CT和MRI杂志,2016,14(7):3-6.
[9]Saunder DE,Howe FA,Boogaart AD,et al.Continuing ischemic damage after acute middle cerebral artery infarction in humans demonstrsted by short-echo proton spectr Oscopy[J].Stroke,1995,26(6):1007-1013.
[10]Tsai LK,Wang Z,Munsainghe J,et al.Mesenchymal stem cells primed with valproate and lithum robustly migrate to infrcted regions and facilltate recovery in a stroke model[J].Stroke,2011,42(10):2932-2939.
[11]Yu X,Chen D,Zhang Y,et al.Overespression of CXCR4 in mesenchymal stem cells promotes migration,neuroprotection and angiongenesis in a rat model of stroke[J].Neurol Sci,2012,316(1/2):141-149.
[12]Ma XL,Liu KD,Li FC,et al.Human mesenchymal stem cells increases expression of A-tubulin and angiopoietin 1 and 2 in focal cerebral ischemiaand reperfusion[J].Curr Neuro Vasa Res,2013,10(2):103-111.
[13]Federico F,Simone IL,LuciveroV,et al.Prognostic value of proton magnetic resonance spectroscopy in ischemic stroke[J].Arch Neurol,1998,55(4):489-494.
Effect of human umbilical cord blood mesenchymal stem cells transplantation on functional recovery and the1H-MRS parameters in the rabbits with cerebral ischemia-reperfusion
HUANGHaili,GUANYeming,LIUXuechun,etal.
(DepartmentofNeurology,The105thHospitalofChinesePeople’sLiberationArmy,Hefei230031,China)
Objective To observe the effect of human umbilical cord blood mesenchymal stem cells (hUCB-MSCs) transplantation on functional recovery and the1H-MRS parameters in the rabbits with cerebral ischemia-reperfusion.Methods The hUCB-MSCs abstracted from 60~80 ml of cord blood of full term babies were cultured in vitro.The cerebral artery occlusion(MCAO) rabbits models were divided into three groups:cerebral infarction(CI) group,stem cell group and saline group,and the last two groups were separately transplanted with hUCB-MSCs and saline.On 2 d,14 d after reperfusion,neurological deficits were evaluated by the neurological severity scores (NSS) in the last three groups.The volume of cerebral infarction and the level of NAA,Cho,Cr,Lac in center area of ischemia were detected by using MR scanning.Results The neurological scores of hUCB-MSCs group significantly decreased,compared with CI group and saline group(P<0.05).There was no significant difference between CI group and saline group(P>0.05).Conclusion hUCB-MSCs treatment could increase the ratio of NAA/Cr,Cho/Cr,decrease the ratio of Lac/Cr,reduce the infarct volume,and could significantly improve the neurological function of rabbit.
Human umbilical cord blood mesenchymal stem cells; Cerebral infarction; Neurological dysfunction; Proton magnetic resonance spectros-copy
1003-2754(2017)06-0484-04
2016-12-05;
2017-03-29
国家自然科学基金(No.81171108)
(解放军第一〇五医院神经内科,安徽 合肥 230031)
汪青松,E-mail:Wangqs65@yahoo.com
R743.3
A
