TP-M13-SSR技术在枸杞遗传多样性研究中的应用
2017-07-18樊云芳赵建华李彦龙王亚军曹有龙
樊云芳,尹 跃,安 巍,赵建华,李彦龙,王亚军,曹有龙
(宁夏农林科学院 国家枸杞工程技术研究中心,银川 750002)
TP-M13-SSR技术在枸杞遗传多样性研究中的应用
樊云芳,尹 跃,安 巍,赵建华,李彦龙,王亚军,曹有龙
(宁夏农林科学院 国家枸杞工程技术研究中心,银川 750002)
利用在SSR扩增产物检测过程中的一种基于荧光测序技术的高通量低成本分析技术体系TP-M13-SSR对29份枸杞种质资源进行遗传多样性研究。13对引物共检测到78个等位基因,平均每个位点6个等位基因。群体平均的主等位基因频率(MAF)、有效等位基因数(NE)、观测杂合度(HO)、期望杂合度(HE)、Shannon’s信息指数(I)和多态信息含量(PIC)分别为0.625、2.684、0.401、0.514、1.103和0.487。聚类分析表明:29份枸杞种质间相似系数为0.66~0.97,平均相似系数为0.81;供试材料可分为5大类7亚类。研究表明,供试材料的遗传相似性较高,遗传多样性较低。TP-M13-SSR方法具有经济、灵敏、高效等优点,在枸杞遗传多样性研究中应用效果好。
枸杞;TP-M13-SSR;遗传多样性
枸杞(LyciumbararumL.)系茄科(Solanaceae)枸杞属(LyciumL.),全球约有80余种,主要分布在南美洲南部、北美洲南部、非洲南部和欧亚大陆[1]。中国枸杞属有7个种3个变种,宁夏枸杞和中国枸杞分布最广泛,宁夏枸杞主要分布在中国西北地区,中国枸杞主要分布在中国华中、西南和东南地区[2]。枸杞种质资源研究始于20世纪50年代,细胞学、形态学、同工酶等方面的研究都在种质资源鉴定和亲缘关系研究中起积极作用[3-4]。分子标记(RAPD、AFLP、SSR)等技术发展,为种质资源研究提供了一条准确、高效、快捷的途径,近年来也被逐渐应用到枸杞种质资源的上述研究中[5-8],SSR标记具有高多态性、重复性、稳定性等优点,广泛应用于植物种质资源鉴定及亲缘关系等方面研究中。在用SSR方法进行枸杞遗传多样性研究中,研究者主要采用银染技术[9-10],该技术存在难以读取扩增片段大小、试验过程耗时费力等缺点。
荧光测序技术在SSR扩增产物检测上的应用,实现了数据收集和处理的自动化,克服了银染法的不足。Oetting等[11]首次将一段19 bp的核苷酸序列(称为Tailed primer,即尾巴引物)引入到短串联重复(Short tandem repeat,STR)标记体系中,并与荧光分析技术和多重PCR(Multiplex RCR)技术结合。Schuelke[12]又用M13序列作为尾巴引物,对该技术体系进行完善,最终实现SSR技术与荧光自动测序技术的结合,形成了一套低成本的基于荧光测序技术的SSR扩增产物检测体系,即TP-M13-SSR技术。此技术已经被应用到苹果、杨树、桂花等树种遗传多样性分析、品种指纹图谱构建等[13-16]研究中。
本研究采用TP-M13-SSR毛细管电泳自动检测法对29份枸杞种质资源进行遗传多样性分析,旨在从DNA水平上揭示枸杞种质资源的亲缘关系及遗传背景,以期为枸杞种质资源的开发与利用、品种选育及杂交育种提供科学依据。
1 材料与方法
1.1 试验材料
29份枸杞种质资源分别来自宁夏、新疆、河北、四川、青海和云南6个省(自治区)的地方品种、栽培品种和野生种(表1)。均保存于国家枸杞工程技术研究中心枸杞种质资源圃(38°38′49″N,106°9′10″E)。
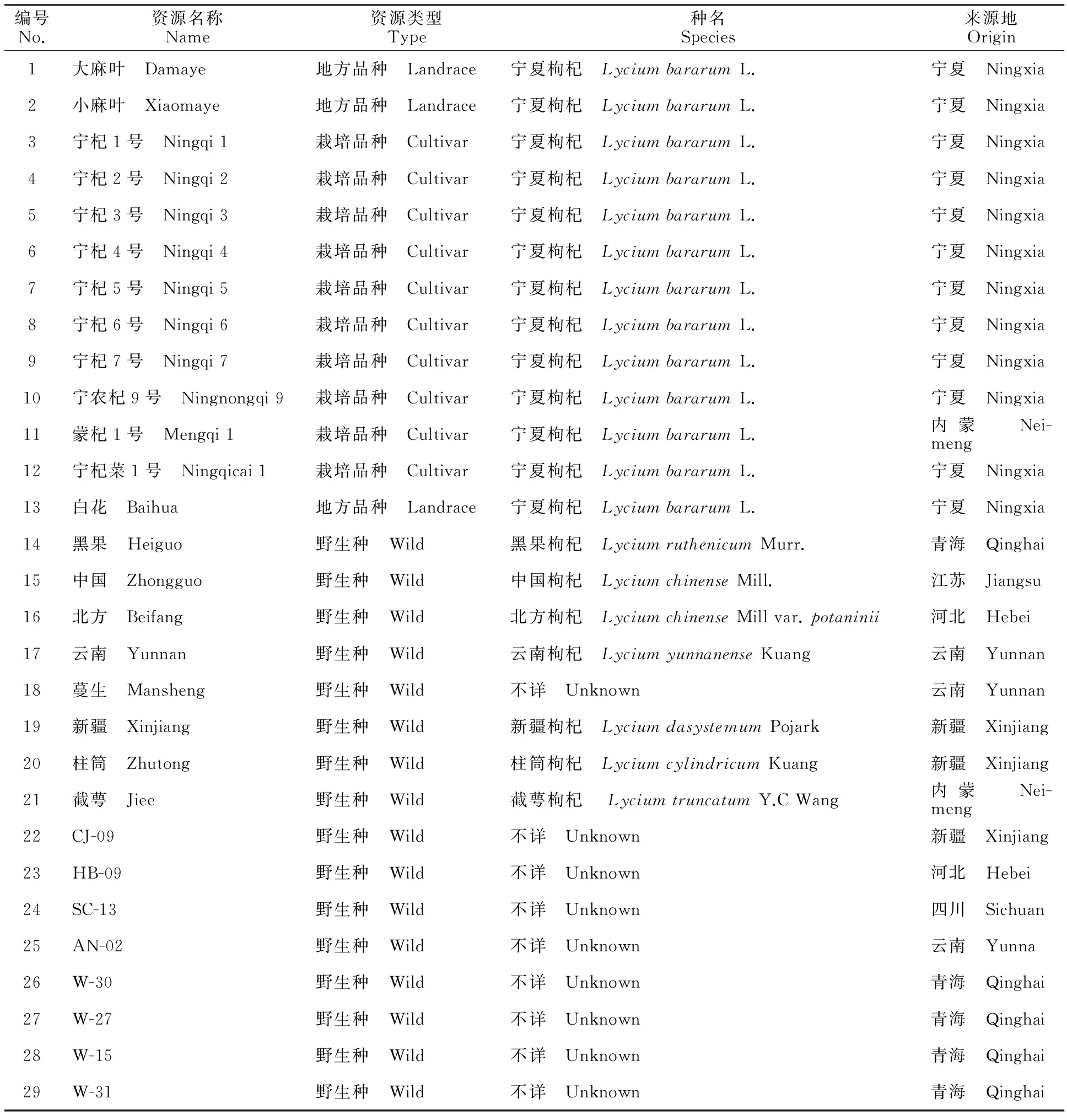
表1 29份枸杞种质资源名称及来源Table 1 29 wolfberry germplasm and its sources
1.2 试验方法
1.2.1 DNA提取 参照Porebski等[17]方法提取枸杞基因组DNA,用80 g·L-1琼脂糖凝胶电泳和核酸蛋白检测仪检测DNA质量和质量浓度,并用ddH2O将母液质量浓度稀释至50 ng·μL-1,-20 ℃保存,备用。
1.2.2 引物合成 在TP-M13自动荧光检测系统中,用3条引物进行PCR扩增。第1条引物是把普通的SSR引物的正向引物分别和M13的反向引物相连合成带有M13尾巴的引物,即TP-M13引物,第2条引物为正常的SSR反向引物,第3条引物是5′端带有荧光标记的M13正向引物。选用124对普通SSR引物是从枸杞全基因组测序结果(未公布)中开发的,由国家枸杞工程技术研究中心李彦龙先生提供,TP-M13-SSR引物和5′端带有荧光标记的M13正向引物(表2)均由美国ABI公司合成。

表2 5′端带有荧光标记的M13正向引物序列Table 2 M13 forward primer and sequence with fluorescent-labelled at 5′ end
1.2.3 PCR扩增及其产物检测 采用TP-M13-SSR毛细管电泳荧光检测法进行PCR扩增和产物检测。PCR扩增体系为15 μL:其中含10×PCR buffer(含Mg2+)1.5 μL、50 ng模板DNA、0.2 mmol·L-1dNTPs、0.7 μmol·L-1引物、0.27 μmol·L-1M13引物和0.75 U Hot startTaqDNA Polymerase。扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,57 ℃变性30 s,72 ℃延伸30 s,30个循环;94 ℃变性30 s,53 ℃变性30 s,72 ℃延伸30 s,10个循环; 72 ℃ 延伸5 min。
扩增产物的自动荧光检测,在96孔板中每孔加入分子质量内标和甲酰胺混合液(0.5∶8.5)9 μL,PCR产物1.0 μL,95 ℃变性3 min,用ABI3730进行自动荧光检测。
1.3 数据分析
利用GeneMapper 5.0软件[18]对原始数据进行分析,获得不同样品扩增片段长度。利用Popgen32[19]软件计算等位基因数(Number of alleles,NA)、有效等位基因数(Effective number of alleles,NE)、观测杂合度(Observed heterozygosity,HO)、期望杂合度(Expected heterozygosity,HE)、Shannon’s信息指数(Shannon’s information index,I)。利用PowerMarker V 3.25[20]软件计算主等位基因频率(Major allele frequency,MAF)和位点多态信息含量(Polymorphism information content,PIC)。同时使用NTSYSpc-2.10软件[21]计算遗传相似系数,即Gsij=a/(a+b+c),Gsij是用来衡量2个个体i和j的遗传相似系数,a为2个体共有条带数,b和c为个体i和个体j各自特有的多态性条带数,根据遗传相似性系数进行UPGMA聚类分析(unweighted pair group method analysis)。
2 结果与分析
2.1 TP-M13-SSR引物筛选及条件优化
应用合成的124对TP-M13-SSR引物对遗传背景和表型性状差异较大的4份种质进行筛选,初步筛选出稳定性好、重复性好、PCR条件相对稳定的13对引物(引物名称及序列见表3)。其PCR条件优化后,用于29份枸杞种质资源遗传多样性研究。

表3 SSR引物信息Table 3 SSR primers used in this study
2.2 SSR位点多态性分析
利用筛选出的13对引物对29份枸杞种质材料进行扩增,准确获得不同材料在不同位点的等位基因片段大小(图1),共检测到78个等位基因(表4),变幅为2~11个,平均为6个;有效等位基因数(NE)变幅为1.035~5.861,平均为2.684;主等位基因频率变幅为0.276~0.983,平均为0.625;观测杂合度(HO)变幅为0.034~0.862,平均为0.401;期望杂合度(HE)变幅为0.034~0.831,平均为0.514;Shannon’s信息指数(I)变幅为0.087~1.992,平均为1.103;多态信息含量(PIC)值变幅为0.033~0.811,平均为0.487;表明29份枸杞种质资源间存在丰富的遗传多样性。

扩增片段/bp Size of bands amplified

引物名称PrimernameNANEMAFHOHEIPICSF194.3580.3280.6900.7791.7050.749SF641.6600.7590.3790.3980.7640.367SF1342.4340.5690.2760.5901.0600.531SF2621.3990.8280.3450.2850.4600.245SF30114.0430.4310.5860.7531.7750.728SF3221.0350.9830.0340.0340.0870.033SF3441.2830.8790.1030.2210.4840.211SF6162.8270.5520.3450.6461.3650.615SF63105.8610.2760.8620.8311.9920.811SF6891.7800.7410.2760.4381.0570.425SF7341.4270.8280.2760.2990.6000.277SF9273.4680.4660.3100.7121.5360.678SF10763.3180.4830.7240.6991.4520.665平均值Mean62.6840.6250.4010.5141.1030.487
2.3 聚类分析
应用NTSYS-pc软件计算13对引物对29份种质遗传相似系数,采用UPGMA方法构建聚类图(图2)。从图2可知,在遗传相似系数为0.78时,可将供试材料分为5个类群。第Ⅰ大类包括21份种质,第Ⅱ大类包括4份种质,第Ⅲ大类包括2份种质,第Ⅳ大类和第Ⅴ大类仅包括1份种质。
第Ⅰ大类在遗传相似系数为0.80处分为2个亚类群Ⅰ-1和Ⅰ-2,Ⅰ-1亚类在遗传相似系数为0.84处又分为2个亚亚类群Ⅰ-11和Ⅰ-12,Ⅰ-11亚亚类群包括大麻叶、小麻叶、‘宁杞1号’和‘宁杞2号’4份种质,其中‘宁杞1号’和‘宁杞2号’都是通过群体选优从大麻叶群体选育的,Ⅰ-12亚亚类群包括8个枸杞品种和7份野生种质,栽培品种与野生种质混合聚类在一起,表明栽培品种与野生种质有基因交流现象。
第Ⅱ大类在遗传相似系数为0.80处分为2个亚类群Ⅱ-1和Ⅱ-2,Ⅱ-1包括北方枸杞、HB-09和W-31共3份种质,其中北方枸杞和HB-09的地理来源相同。
第Ⅲ、Ⅳ和Ⅴ大类在遗传相似系数为0.80处各包括1个亚类群,其中第Ⅲ类群包括2份从云南引进野生种质云南枸杞和AN-02,第Ⅳ类群仅有黑果枸杞1份种质,第Ⅴ类群仅包括CJ-09 1份种质。

图2 29份枸杞种质资源的UPGMA聚类图Fig.2 Dendrogram of cluster of 29 wolfberry germplasm analysis by UPGMA
3 讨 论
3.1 TP-M13-SSR自动荧光检测技术的优缺点
与基于普通SSR标记的种质资源遗传多样性方法相比,基于SSR荧光标记的种质资源遗传多样性研究结果更准确、效率更高,能区分大小相差1个碱基的片段。郝晨阳等[22]应用SSR荧光标记分析技术和常规的SSR银染技术对小麦451份材料进行遗传多样分析,结果表明SSR荧光技术比常规银染法在每个位点上多检测到3个等位基因,检测效率更高。程本义等[23]建立水稻SSR荧光标记体系,结合常规SSR技术进行水稻品种DNA指纹鉴定,结果表明,SSR荧光检测法可以准确读出扩增片段大小,检测效率明显高于普通SSR检测方法。但荧光标记毛细管电泳检测所需的DNA测序仪及配套试剂价格昂贵,一般实验室可能难以承受。
3.2 TP-M13-SSR在枸杞种质资源遗传多样性研究中的应用
TP-M13自动荧光检测系统具有精确、灵敏、高效等优点。自该技术问世以来,广泛用于植物种质资源遗传多样性及品种鉴定等方面的研究[15-16]。本研究中,利用筛选出的13对SSR荧光引物对29份枸杞种质资源进行遗传多样性研究,聚类结果表明,供试材料亲缘关系较近,遗传基础狭窄,这符合材料遗传背景与地理来源的实际情况[24],且部分种质聚类结果与AFLP标记聚类结果[25]相一致,但与基于表型性状的聚类结果[4]和常规SSR标记的聚类结果[10]并不完全一致,其原因可能是表型性状检测水平和常规SSR的检测效率较低,说明TP-M13-SSR技术在枸杞种质资源遗传多样性研究中应用效果较好。
Reference:
[1] FUKUDA T,YOKOYAMA J,OHASHI H.Phylogeny and biogeography of the genusLycium(Solanaceae):inferences from chloroplast DNA sequences [J].MolecularPhylogeneticsEvolution,2001,19(2):246-258.
[2] 董静洲,杨俊军,王 瑛.我国枸杞属物种资源及国内外研究进展 [J].中国中药杂志,2008,33(18):2020-2027.
DONG J ZH,YANG J J,WANG Y.Resources of Lycim species and related research progress [J].ChinaJournalofChineseMateriaMedica,2008,33(18):2020-2027(in Chinese with English abstract).
[3] 侯 杰,程广有.3种药用枸杞过氧化物同工酶遗传多样性研究 [J].北华大学(自然科学版),2006,7(7):556-559.
HOU J,CHENG G Y.On the genetic diversity of peroxidase lsozymes of three medical species ofLyciumgenes [J].JournalofBeihuaUnivesity(NaturalScienceEdition),2006,7(7):556-559(in Chinese with English abstract).
[4] 袁海静,安 巍,李立会,等.中国枸杞种质资源主要形态学性状调查与聚类分析 [J].植物遗传资源学报,2013,14(4):627-633.
YUAN H J,AN W,LI L H,etal.The invesitigaiton and cluster analsysis of main morphological characters for germplasm of Chinese wolfberry [J].JournalofPlantGeneticResources,2013,14(4):627-633(in Chinese with English abstract).
[5] 尹 跃,曹有龙,陈晓静,等.枸杞SRAP反应体系建立和优化 [J].福建农林大学(自然科学版),2013,43(3):297-301.
YIN Y,CAO Y L,CHEN X J,etal.Establishment andoptimization of SRAP-PCR reaction system in Chinese wolfberry [J].JournalofFujianAgricultureandForeestryUniversity(NaturalScienceEdition),2013,43(3):297-301(in Chinese with English abstract).
[6] LIU Z,SHU Q,WANG L,etal.Genetic diversity of the endangered and medically importantLyciumruthenicumMurr.revealed by sequence-related amplified polymorphism(SRAP) markers [J].BiochemicalSystematicsandEcology,2012,20(8):86-97.
[7] 王锦楠,陈进福,陈武生,等.柴达木地区野生黑果枸杞种群遗传多样性的AFLP分析 [J].植物生态学报,2015,39(10):1003-1011.
WANG J N,CHEN J F,CHEN W SH,etal.Population genetic diversity of wildLyciumruthenicumin Qaidam inferred from AFLP makers [J].ChineseJournalofPlantEcology,2015,39(10):1003-1011(in Chinese with English abstract).
[8] 阿力同·其米克,王青锋,杨春锋,等.新疆产药用植物黑果枸杞遗传多样性的ISSR分析[J].植物科学学报,2013,31(5):517-524.
Alitong·qimike,WANG Q F,YANG CH F,etal.ISSR analysis on gnentic diversity of mdeically importantLyciumruthenicumMurr.in Xinjiang [J].PlantScienceJournal,2013,31(5):517-524(in Chinese with English abstract).
[9] 胡秉芬,张宝琳,蔡国军,等.十七份中美枸杞材料的SSR遗传多样性 [J].北方园艺,2016(1):90-94.
HU B F,ZHANG B L,CAI G J,etal.Genetic diversity by SSR markers in seventeen Chinese and AmericanLyciumbararumL.[J].NorthernHorticulture,2016(1):90-94(in Chinese with English abstract).
[10] 邵千顺,高 磊,南雄雄,等.利用SSR技术对十七分枸杞材料进行遗传多样性分析及标准指纹图谱构建 [J].北方园艺,2015(12):91-95.
SHAO Q SH,GAO L,NAN X Xetal.Analysis of genetic diversity and construction of fingerprint ofLyciulbararumL.using SSR technology [J].NorthernHorticulture,2015(12):91-95(in Chinese with English abstract).
[11] OETTING W S,LEE H K,FLANDERS D J,etal.Linkage analysis with multiplexed short tandem repeat polymorphisms using infrared flouorescence and M13 tailed primers [J].Genomic,1995(30):450-458.
[12] SCHUELKE.An economic method for the fluorescent labeling of PCR fragements [J].NatureBiothehnology,2000,18(2):233-234.
[13] 高 源,王 昆,王大江,等.利用TP-M13-SSR标记构建苹果栽培品种的分子身份证 [J].园艺学报,2016,43(1):25-37.
GAO Y,WANG K,WANG D J,etal.Molecular ID establishment of apple cultivars by TP-M13-SSR [J].ActaHorticulturaeSinica,2016,43(1):25-37(in Chinese with English abstract).
[14] 贾会霞,姬慧娟,胡建军,等.杨树新品种的SSR指纹图谱构建和倍性检测 [J].林业科学,2015,51(2):69-79.
JIA H X,JI H J,HU J Jetal.Fingerprints of SSR markers and ploidy detection for new populus varieties [J].ScientiaSilvaeSinicae,2015,51(2):69-79(in Chinese with English abstract).
[15] 段一凡,王贤荣,梁丽丽,等.桂花品种SSR荧光指纹图谱的构建[J].南京林业大学学报(自然科学版),2014,38(增刊):1-5.
DUAN Y F,WANG X R,LIANG L L,etal.Fingerprinting and identification ofOsmanthusfragranscultivas using fluorescence-labeled SSR makers [J].JournalofNanjingForestryUniversity(NaturalScienceEdition),2014,38(Supp):1-5(in Chinese with English abstract).
[16] 高 源,田路明,刘凤之,等.TP-M13-SSR技术在梨遗传多样性研究中的应用 [J].果树学报,2011,28(3):394-399.
GAO Y,TIAN L M,LIU F ZH,etal.TP-M13-SSR technique and its application in the analysis of genetic diversity for pear germplasm resources [J].JournalofFruitScience,2011,28(3):394-399(in Chinese with English abstract).
[17] POREBSKI S,BAILEY L,BAUM B.Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components [J].PlantMolecularBiologyRepoeter,1997,15(1):8-15.
[18] RINEHART T A.AFLP analysis using gene Mapper○Rsoftware and an Excel○Rmacro that aligns and converts output to binary [J].Biotechniques,2004,37(2):186-187.
[19] YEH F C,BOYLE T J B.Population genetic analysis of co-dominant and dominant markers and quantitative traits [J].BelgianJournalofBotany,1998,129:157.
[20] LIU K,MUSE S V.Power Marker:Integrated analysis environment for genetic marker data [J].Bioinformatics,2005,21(9):2128-2129.
[21] ROHLF F J.NTSYS-pc:Numerical Taxonomy and Multivariate Analysis System Version 2.1 User Guide [M].New York:Exeter Software,Setauket,2000.
[22] 郝晨阳,王兰芬,贾继增,等.SSR荧光标记和银染技术的比较分析 [J].作物学报,2005,31(2):144-149.
HAO CH Y,WANG L F,JIA J Zetal.Comparison of fluorescence and silver-staining detection systems of microsatellite markers [J].ActaAgronomicaSinica,2005,31(2):144-149(in Chinese with English abstract).
[23] 程本义,夏俊辉,龚俊义,等.SSR荧光标记毛细管电泳检测法在水稻DNA指纹鉴定中的应用 [J].中国水稻科学,2011,25(6):672-676.
CHENG B Y,XIA J H,GONG J Y,etal.Application of capillary electophoresis detection with fluorescent SSR markers in rice DNA fingerprint identification [J].ChinaJournalRiceScience,2011,25(6):672-676(in Chinese with English abstract).
[24] 曹有龙,巫鹏举.中国枸杞种质资源 [M].北京:中国林业出版社,2014:86-134.
CAO Y L,WU P J.Wolfberry Germplasm Resources in China [M].Beijing:China Forestry Publishing Press,2014:86-134(in Chinese).
[25] 李彦龙,樊云芳,戴国礼,等.枸杞种质遗传多样性的AFLP分析 [J].中草药,2011,42(4):770-773.
LI Y L,FAN Y F,DAI G L,etal.Analysis of genetic diversity for wolfberry germplasms by AFLP technology [J].ChineseTraditionalandHerbalDrugs,2011,42(4):770-773(in Chinese with English abstract) .
(责任编辑:潘学燕 Responsible editor:PAN Xueyan)
TP-M3-SSR Technique and Its Application in Analysis of Genetic Diversity of Wolfberry Germplasm Resources
FAN Yunfang,YIN Yue, AN Wei, ZHAO Jianhua, LI Yanlong, WANG Yajun and CAO Youlong
(Ningxia Academy of Agricultural and Forestry Sciences, National Wolfberry Engineering Research Center, Yinchuan 750002,China)
An economical detection method for simple sequence repeat with tailed primer M13(TP-M13-SSR) was used in genetic diversity analysis for 29 wolfberry germplasm. Thirteen pairs of SSR primers screened amplified 78 alleles with an average of six alleles per locus. The average ofMAF,NE,HO,HE,IandPICwas 0.625, 2.684, 0.401, 0.514, 1.103 and 0.487, respectively. The similarity coefficients among 29 wolfberry germplasm ranged from 0.66 to 0.97, with average of 0.81. 29 wolfberry germplasm could be divide into five groups and seven subgroups. The results showed there was a low level of genetic diversity among 29 wolfberry germplasm.The method had the advantages of economy, sensitiveness and high efficiency,and it had been used in genetic diversity analysis of wolfberry successfully.
Wolfberry; TP-M13-SSR;Genetic diversity
2016-03-28 Returned 2016-05-10
Ningxia Special Program of New Variety Breeding in Speical and Advantagous Industy in Agriculture(No.2013NYYZ0101); the National Natural Science Foundation of China(No. 31060104,31260351);the Natural Science Foundation of Ningxia(No.NZ15123);the Program of Technology Innovation of Ningxia Academy of Agricultural and Forestry Sciences(No. NKYJ-14-31,NKYZ-16-0405).
FAN Yunfang,female,associate researcher.Research area:molecular biology research of wolfberry.E-mail:majoriefyf@163.com
CAO Youlong,male,researcher,master supervisor.Research area:biotechnology breeding of wolfberry.E-mail:youlongchk@163.com
日期:2017-06-05
2016-03-28
2016-05-10
宁夏农业特色优势产业新品种选育专项(2013NYYZ0101);国家自然科学基金(31060104, 31260351);宁夏自然科学基金(NZ15123);宁夏农林科学院科技创新先导资金(NKYJ-14-31, NKYZ-16-0405)。
樊云芳,女,副研究员,主要从事枸杞分子生物学研究。E-mail:majoriefyf@163.com
曹有龙,男,研究员,硕士生导师,主要从事枸杞生物技术育种研究。E-mail:youlongchk@163.com
S567.1+9
A
1004-1389(2017)06-0890-07
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170605.1728.024.html
