Wnt/β-catenin信号通路在去睾丸小鼠骨质疏松发病中的作用
2017-07-18阮立奇黄波
阮立奇,黄波
(解放军第117医院 骨二科,浙江 杭州 310013)
·论 著·
Wnt/β-catenin信号通路在去睾丸小鼠骨质疏松发病中的作用
阮立奇,黄波
(解放军第117医院 骨二科,浙江 杭州 310013)
目的:研究Wnt/β-catenin信号通路在去睾丸小鼠骨质疏松发病中的作用。方法:11月龄雄性健康ICR小鼠30只,随机分为3组,睾丸切除组、睾丸切除+雄激素替代组和假手术组,每组10只。睾丸切除组和睾丸切除+雄激素替代组摘除小鼠双侧睾丸,假手术组仅切开皮肤,分离睾丸包膜。手术后睾丸切除+雄激素替代组丙酸睾酮肌注每次10 μg,每隔3 d注射1次;睾丸切除组和假手术组0.9%氯化钠溶液肌注每次10 μg,每隔3 d注射1次。饲养14周后,检测3组小鼠骨密度(BMD)。处死后心脏采血,ELISA法检测雌、雄激素含量。取小鼠骨组织,部分提取RNA并翻转成为cDNA,再通过实时荧光定量PCR法检测β-catenin和Runx2的mRNA表达;部分提取总蛋白,通过Western blot法检测β-catenin和Runx2蛋白的表达。结果:与假手术组比,睾丸切除+雄激素替代组和睾丸切除组BMD值均降低,差异均有统计学意义(P<0.05);睾丸切除+雄激素替代组与睾丸切除组比较BMD值升高,差异有统计学意义(P<0.05)。与假手术组比,睾丸切除组小鼠β-catenin和Runx2的mRNA和蛋白表达均降低,差异有统计学意义(P<0.05);使用雄激素替代治疗后,β-catenin和Runx2的mRNA及蛋白表达均上调,差异有统计学意义(P<0.05)。结论:去睾丸骨质疏松小鼠Wnt/β-catenin信号通路受到抑制,可能是其骨质疏松发生发展的重要分子生物学机制之一。
睾丸切除;小鼠;骨质疏松;Wnt/β-catenin信号通路
研究发现,经典Wnt信号通路,即Wnt/β-catenin信号通路对骨重建的影响主要表现在对成骨细胞的增殖和分化产生影响[1],同时影响成骨细胞的功能和活性[2]。β-catenin为Wnt/β-catenin信号通路上的关键因子,Wnt/β-catenin通路上大量相关因子都是需要通过影响β-catenin的表达改变来影响下游靶基因的表达[3]。Runx2的表达是成骨细胞开始分化的标志,是Wnt/β-catenin信号通路下游上的相关因子,Wnt/β-catenin信号通路激活与否直接影响着Runx2的活性及表达[4]。当Wnt/β-catenin信号通路下调后,Runx2的表达随之下调,两者有较为密切的联系[5]。所以,Wnt/β-catenin信号通路的变化可能是雄性原发骨质疏松发生的重要分子生物学机制之一。本研究通过检测去睾丸小鼠骨的Wnt/β-catenin信号通路中的关键因子mRNA及蛋白的表达变化,揭示雄性原发骨质疏松的发生发展机制,为从该机制阻断致病因素提供理论依据。
1 材料和方法
1.1 材料
1.1.1 实验动物:健康ICR小鼠30只,体质量37~44 g,雄性,11月龄,购于北京维通利华实验动物技术有限公司。
1.1.2 主要试剂和仪器:小鼠雄激素、雌激素ELISA试剂盒,Trizol Reagent,1st-Strand cDNA Synthesis Kit,40%丙烯酰胺溶液,总蛋白提取试剂盒,BCA蛋白定量试剂盒(含Protease Inhibitor Cocktail)(杭州浩基生物科技有限公司),RNase-Free DNase I(德国Qiagen公司),Power SYBR® Master Mix(美国Invitrogen公司);anti-Runx2 antibody、anti-β-catenin antibody、内参β-actin(美国Santa Cruz公司);羊抗小鼠IgG-HRP、羊抗兔IgG-HRP、SuperSignal®West Dura Extended Duration Substrate(美国Pierce公司);双能X线骨密度仪(美国GE公司),酶标仪(芬兰Thermo公司)。
1.2 方法
1.2.1 动物分组及造模:30只小鼠按随机数字表法分为假手术组、睾丸切除组和睾丸切除+雄激素替代组,每组10只。于清洁动物室单笼常规饲养,适应性饲养1周后3组小鼠均采用3%戊巴比妥钠40 mg/kg腹腔注射麻醉。麻醉成功后仰卧位固定,5%碘伏消毒阴囊及附近皮肤。睾丸切除组及睾丸切除+雄激素替代组小鼠沿正中纵行切开阴囊,分离睾丸包膜,结扎输精管及睾丸动脉后切除双侧睾丸,取少量青霉素G放入腹腔后缝合皮肤。假手术组仅切开皮肤,分离睾丸包膜,取少量青霉素G放入腹腔后缝合皮肤。睾丸切除+雄激素替代组肌肉注射丙酸睾酮每次10 μg,每3 d注射1次,假手术组和睾丸切除组肌肉注射0.9%氯化钠溶液每次10 μg,每3 d注射1次。
1.2.2 骨密度(bone mineral density,BMD)及雌、雄性激素含量测定:小鼠手术后放入原笼继续常规饲养14周。14周后均采用3%戊巴比妥钠40 mg/kg腹腔注射麻醉。麻醉成功后俯卧位固定,腰椎尽可能保持笔直,双侧股骨保持伸展,使用X线骨密度仪测定双侧股骨的BMD。然后立即心脏采血,ELISA法测定雌二醇及睾酮水平。
1.2.3 RT-PCR技术检测小鼠骨β-catenin、Runx2 mRNA含量:于术后14周处死小鼠,用Trizol试剂盒体外提取骨组织总RNA,以适量cDNA为模板扩增β-catenin、Runx2 mRNA片段。β-catenin引物序列:上游为5’-CACCATGCACCACCACCTCGAAT-3’,下游为5’-GCTTCCGTCAGCGTCAACACCAT-3’,扩增片段长度86 bp。Runx2引物序列:上游为5’-GCTGGGACCCTTCACAACCTT-3’,下游为5’-GCTGGGATGCCACCAGACTTA-3’,扩增片段长度74 bp。内参β-actin引物序列:上游为5’-CGG ACACGGACAGGATTGACA-3’,下游为5’-CCAGACAAATCGC TCCACCAACTA-3’,扩增片段长度94 bp,反应条件均为95 ℃ 1 min、95 ℃ 10 s、64 ℃ 25 s,40个循环,72 ℃延伸25 s。每个样品重复3次,基因的相对表达水平以2(Ct内参基因-Ct目的基因)进行统计分析。
1.2.4 Western blot技术检测小鼠骨β-catenin、Runx2蛋白含量:采用蛋白提取试剂盒进行样品总蛋白的提取,然后采用BCA定量试剂盒进行总蛋白定量。配制10%分离胶和4%浓缩胶。PVDF膜甲醇中浸泡20 s,然后转移到Tris-Glycine转移缓冲液(5%甲醇)中平衡至少5 min;SDS-PAGE胶在Tris-Glycine转移缓冲液平衡至少30 min;在冷却条件下以100 V恒压转膜2 h。转膜结束后,放到T-TBS室温封闭1 h,然后T-TBS漂洗3次,每次5 min。一抗以1:1 000溶于T-TBS,4 ℃孵育过夜;然后T-TBS漂洗4次每次5 min;内参β-actin以1:2 000溶于T-TBS中。二抗以1:5 000溶于T-TBS,室温1 h孵育;然后T-TBS漂洗5次每次5 min。采用SuperSignal®West Dura Extended Duration Substrate,制备约1 mL ECL工作液,室温孵育转印膜1 min,然后去除多余ECL试剂,保鲜膜密封,暗盒中放上X-ray film曝光5~10 min后进行显影和定影。采用Bandscan 5.0软件分析条带的光密度值,目的蛋白相对表达量=目的蛋白(光密度值)/内参β-actin(光密度值),重复测3次。
1.3 统计学处理方法 采用SPSS17.0统计学软件进行分析。各组数据均行正态性检验,正态分布数据以±s表示,3组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 BMD测量结果 手术14周后,睾丸切除+雄激素替代组和睾丸切除组与假手术组比较,BMD值降低,差异均有统计学意义(P<0.05)。睾丸切除+雄激素替代组与睾丸切除组比较,BMD值升高,差异有统计学意义(P<0.05),见表1。BMD测量区域见图1,因腰椎BMD单样本重复测量偏差较大,本实验未采纳腰椎BMD数值。
表1 3组小鼠BMD测量结果(n=10,±s,g/cm2)

表1 3组小鼠BMD测量结果(n=10,±s,g/cm2)
与假手术组比:aP<0.05;与睾丸切除组比:bP<0.05
组别左股骨右股骨假手术组0.34±0.030.34±0.05睾丸切除组0.28±0.04a0.25±0.06a睾丸切除+雄激素替代组0.29±0.03ab0.27±0.04ab
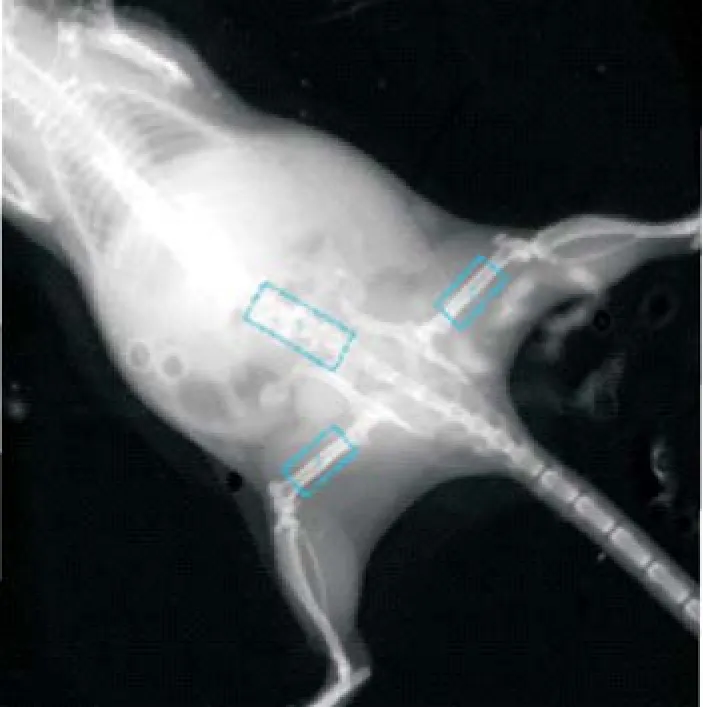
图1 BMD测量区域
2.2 小鼠性激素测定 睾丸切除组小鼠雌、雄激素含量均小于假手术组和睾丸切除+雄激素替代组,差异均有统计学意义(P<0.05);假手术组和睾丸切除+雄激素替代组比较雌、雄激素含量差异均无统计学意义(P>0.05)。见表2。
2.3 3组小鼠mRNA定量检测结果 睾丸切除+雄激素替代组和睾丸切除组与假手术组比较,β-catenin和Runx2 mRNA含量均降低,差异均有统计学意义(P<0.05);睾丸切除组与睾丸切除+雄激素替代组比较,β-catenin和Runx2 mRNA含量均降低,差异均有统计学意义(P<0.05)。见表3。
表2 3组小鼠性激素含量(n=10,±s,pg/mL)
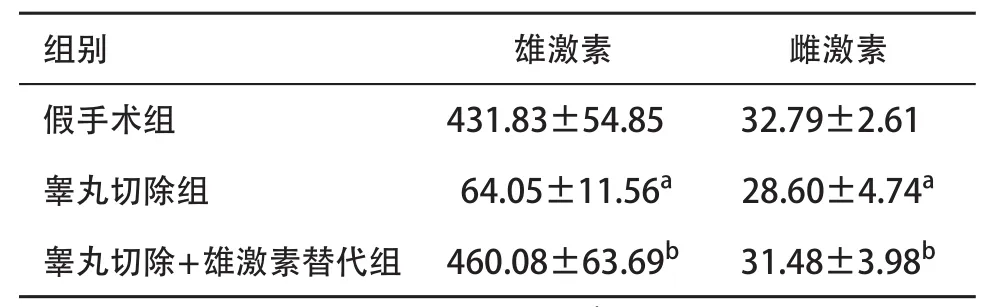
表2 3组小鼠性激素含量(n=10,±s,pg/mL)
与假手术组比:aP<0.05;与睾丸切除组比:bP<0.05
组别雄激素雌激素假手术组431.83±54.8532.79±2.61睾丸切除组 64.05±11.56a28.60±4.74a睾丸切除+雄激素替代组460.08±63.69b31.48±3.98b
表3 3组小鼠β-catenin和Runx2 mRNA含量(n=10,±s)
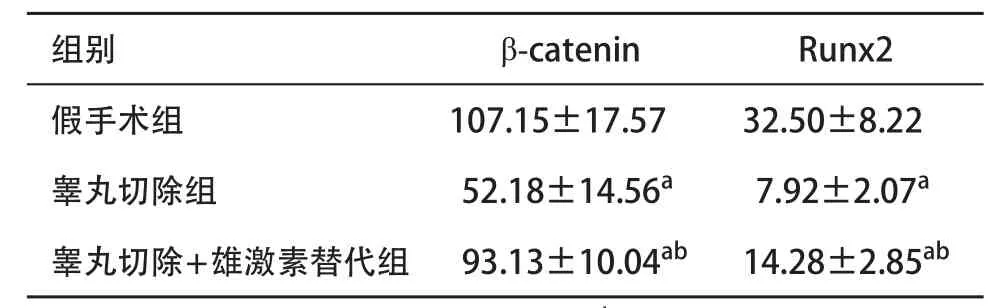
表3 3组小鼠β-catenin和Runx2 mRNA含量(n=10,±s)
与假手术组比:aP<0.05;与睾丸切除组比:bP<0.05
组别β-cateninRunx2假手术组107.15±17.5732.50±8.22睾丸切除组 52.18±14.56a7.92±2.07a睾丸切除+雄激素替代组 93.13±10.04ab14.28±2.85ab
2.4 3组小鼠Western blot检测结果 睾丸切除+雄激素替代组和睾丸切除组与假手术组比较,β-catenin和Runx2蛋白含量均降低,差异均有统计学意义(P<0.05);睾丸切除组与睾丸切除+雄激素替代组比较,β-catenin和Runx2蛋白含量均降低,差异均有统计学意义(P<0.05)。见表4和图2。
表4 3组小鼠β-catenin和Runx2蛋白含量(n=10,±s)
与假手术组比:aP<0.05;与睾丸切除组比:bP<0.05
组别β-cateninRunx2假手术组0.82±0.0280.75±0.037睾丸切除组0.12±0.019a0.36±0.031a睾丸切除+雄激素替代组0.18±0.021ab0.39±0.033ab
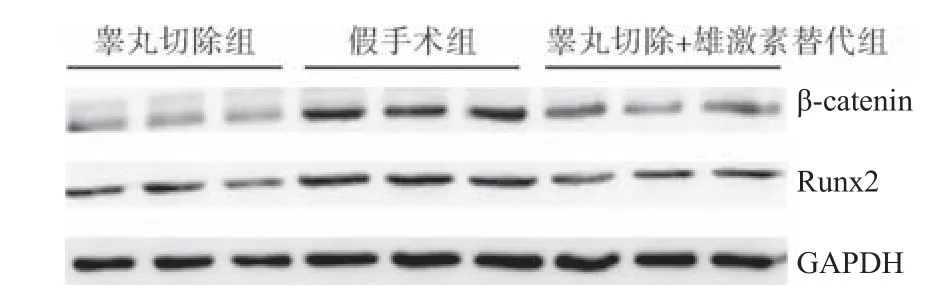
图2 3组小鼠β-catenin和Runx2 Western blot检测结果
3 讨论
研究发现各种原因引起的骨质疏松与Wnt/βcatenin信号通路有关。GONG等[6]研究发现,骨质疏松-假神经胶质瘤综合征(Osteoporosis-pseudoglioma syndrome,OPPG)就是因为Wnt/β-catenin上游的LRP5基因突变,导致该通路抑制形成的一种以影响骨量和视觉为主要临床表现的隐性遗传病。王燕等[7]研究发现,去卵巢大鼠手术后4周和8周骨量即明显下降,β-catenin、Runx2的表达均明显降低。PORTAL-NÚÑEZ等[8]研究发现,将大鼠注射链脲佐菌素,形成糖尿病大鼠模型,其骨量明显降低,β-catenin的表达数量不仅降低,而且进入细胞核发挥作用的β-catenin数量明显减少,证明了糖尿病引起的骨质疏松不仅使β-catenin表达的数量明显减少,Wnt/β-catenin信号通路的转导也发生了障碍。
对于雄性动物Wnt/β-catenin信号通路与骨质疏松关系的研究较少。LU等[9]研究发现给雄性幼鼠喂食高热量的食物,形成肥胖症的同时骨量亦会减少,这是由于成骨细胞的分化受到了影响,其股骨β-catenin和Runx2的表达减少,认为骨量的减少与β-catenin和Runx2信号通路的抑制有关。CHEN等[10]研究发现肥胖引起的快速生长期的雄鼠的骨量减少与过氧化物酶增殖物活化受体γ(peroxisome proliferator activated receptor γ,PPARγ)的激活和Wnt/β-catenin信号通路的抑制有关。但是这些研究主要针对幼年雄鼠,实验结果表明Wnt/ β-catenin信号通路可能影响雄鼠的峰值骨量,但对于已经达到峰值骨量的老年鼠,Wnt/β-catenin信号通路是不是参与其骨质疏松的发生发展鲜有报道。本研究发现,小鼠在去睾丸后,β-catenin的表达明显降低,而使用雄激素替代治疗后,β-catenin的表达升高,受Wnt/β-catenin信号通路影响的Runx2的表达也增加,这表明Wnt/β-catenin信号通路参与了去睾丸小鼠的骨重建过程,提示去睾丸小鼠骨质疏松的发生发展可能与Wnt/β-catenin信号通路被抑制有关联。但是虽然使用雄激素替代使Wnt/ β-catenin信号通路的表达增加在统计学上有差异,但具体数值增加不大,这可能是实验时间不足的原因,也可能是雄激素本身不能大量地增加Wnt/ β-catenin信号通路的表达。并且实验小鼠睾丸切除+雄激素替代组BMD的增加不明显,可能是因为实验时间较短,骨量的增加需要较长时间才能在X线下表现,也可能是单纯补充雄激素对骨量的大量增加不起决定性作用。
目前,已经有调节Wnt/β-catenin信号通路来治疗骨质疏松的药物正在进行动物或临床试验,动物实验的受试对象为去卵巢小鼠或特定模型鼠,临床试验的受试对象为绝经后女性,未见雄性参与此类试验。本研究发现了原发性男性骨质疏松症可能与Wnt/β-catenin信号通路有关,为将来从该通路入手研制抗骨质疏松药物治疗原发性老年男性骨质疏松症提供了理论依据。
[1] MACDONALD B T, TAMAI K, HE X. Wnt/beta-catenin signaling: components, mechanisms, and diseases[J]. Dev Cell, 2009, 17(1): 9-26.
[2] CHEN S, FENG J, BAO Q, et a1. Adverse effects of osteocytic constitutive activation of β-catenin on bone strength and bone growth[J]. J Bone Miner Res, 2015, 30(7): 1184-1194.
[3] LIM W H, LIU B, HUNTER D J, et al. Downregulation of Wnt causes root resorption[J]. Am J Orthod Dentofacial Orthop, 2014, 146(3): 337-345.
[4] IWATA M, AIKAWA T, HAKOZAKI T, et a1. Enhancement of Runx2 expression is potentially linked to β-catenin accumulation in canine intervertebral disc degeneration[J]. J Cell Physiol, 2015, 230(1): 180-190.
[5] HAN N, ZHENG Y, LI R, et a1. β-catenin enhances odontoblastic differentiation of dental pulp cells through activation of Runx2[J]. PLoS One, 2014, 9(2): e88890.
[6] GONG Y, SLEE R B, FUKAI N, et al. LDL receptor-related protein 5 (LRP5) affects bone accrual and eye development [J]. Cell, 2001, 107(4): 513-523.
[7] 王燕, 刘岩, 马剑侠, 等. Wnt/LRP5/β-catenin信号通路在绝经后骨质疏松发病中的作用[J]. 中华妇产科杂志, 2011, 46(10): 769-772.
[8] PORTAL-NÚÑEZ S, LOZANO D, DE CASTRO L F, et a1. Alterations of the Wnt/beta-catenin pathway and its target genes for the N-and C-terminal domains of parathyroid hormone-related protein in bone from diabetic mice[J]. FEBS Lett, 2010, 584(14): 3095-3100.
[9] LU X M, ZHAO H, WANG E H. A high-fat diet induces obesity and impairs bone acquisition in young male mice[J]. Mol Med Rep, 2013, 7(4): 1203-1208.
[10] CHEN J R, LAZARENKO O P, WU X, et al. Obesity reduces bone density associated with activation of PPARγ and suppression of Wnt/β-catenin in rapidly growing male rats [J]. PLoS One, 2010, 5(10): e13704.
(本文编辑:赵翠翠)
Wnt/β-catenin signaling pathway is involved in the osteoporosis of elder mice
RUAN Liqi, HUANG Bo.
Second Department of Orthopaedics, the 117th Hospital of People’s Liberation Army, Hangzhou, 310013
Objective:To evaluate the potential pole of Wnt/beta-catenin signaling pathway in the induction and development of osteoporosis within elder mice.Methods:Healthy ICR mice were randomly divided into three groups, including sham-operated group (n=10), orchiectomy (ORX) group (n=10) and ORX+androgen group (n=10). Testicles were removed from the mice within ORX group and ORX+androgen group. In shamoperated group, the surgery to separate the testicular capsula was performed and the testicles were intact. After surgery, all the mice were fed for 14 weeks freely with water and food under the same condition. The mice were subjected to the evaluation of the bone mineral density (BMD). The blood samples were collected from heart to examine the expression level of estrogen and androgen by an ELISA method. The bone tissues were obtained. The expression levels of β-catenin and Runx2 mRNA expression were determined by real-time PCR while the expression levels of β-catenin and Runx2 protein were evaluated by Western blot.Results:The BMD in the mice of ORX group was signifi cantly decreased compared with NS group (P<0.05). The expression levels of both β-catenin and Runx2 in the mice of ORX group were also signifi cantly decreased compared with sham-operated group (P<0.05). The mice in ORX+androgen group showed no signifi cant difference from ORX group (P>0.05) in BMD. The treatment of androgen could enhance the expression levels of β-catenin and Runx2 in ORX group.Conclusion:Wnt/β-catenin signaling pathway is inhibited 14 weeks after orchiectomy in osteoporosis mice, which can be involved in the induction and development of the osteoporosis.
orchiectomy; mice; osteoporosis; Wnt/β-catenin signaling pathway
R332
A
10.3969/j.issn.2095-9400.2017.07.011
2016-05-08
阮立奇(1988-),男,浙江安吉人,住院医师,硕士。
黄波,副主任医师,Email:huangbo6737@163.com。
