基于光解笼锁谷氨酸的离体癫痫模型建立
2017-07-18郑茜茜陈亮亮叶学松
郑茜茜,陈亮亮,叶学松
(1.温州医科大学 生物医学工程学院,浙江 温州 325035;2.浙江大学 生物医学工程与仪器科学学院,浙江 杭州 310027)
·论 著·
基于光解笼锁谷氨酸的离体癫痫模型建立
郑茜茜1,陈亮亮1,叶学松2
(1.温州医科大学 生物医学工程学院,浙江 温州 325035;2.浙江大学 生物医学工程与仪器科学学院,浙江 杭州 310027)
目的:建立离体癫痫模型模拟癫痫发作,更好地研究癫痫发病的内在机制。方法:针对目前电刺激和药物干预存在的缺陷,建立了基于光解笼锁谷氨酸的神经元细胞刺激系统,并以培养在微电极阵列(MEA)上的海马神经元作为研究对象。特定波长的紫外光经光学聚焦系统聚焦后,照射到笼锁谷氨酸电解液中,解除光敏基团的笼锁作用,释放出谷氨酸。结果:紫外光未作用时海马神经元呈现正常的电位发放;紫外光激发后释放出谷氨酸,海马神经元呈现癫痫样放电。结论:初步建立了离体癫痫模型,为癫痫发病机制的研究提供了理性的离体模型。
光刺激;笼锁谷氨酸;海马神经元;离体癫痫模型;微电极阵列
癫痫是发病率较高的神经系统疾病,难治性癫痫中颞叶癫痫(temporal lobe epilepsy,TLE)是最常见的,大量研究表明TLE的发生可能与海马和边缘系统之间复杂的兴奋性连接环路以及海马结构变化[1]有关。谷氨酸与癫痫发作关系密切[2],因此谷氨酸诱导的海马神经元组群离体癫痫模型的建立对研制抗癫痫药物具有一定的意义。目前神经细胞的刺激主要通过电刺激[3]和药物干预[4]来实现。虽然电刺激施行方便,可精确控制,但难以实现多点同时刺激。针对产生的刺激伪迹,可通过一些处理方法[5]来消除,但是传播的不受控制仍然是一大缺陷。药物干预由于受加药方式和药物扩散等影响,时间和空间精度、细胞特异性不高。为了克服上述缺陷,本研究采用光解笼锁(uncaging)技术作为研究神经活动的新方法。本研究在微电极阵列(microelectrode array,MEA)芯片上离体培养海马神经元,使用特定波长的紫外光照射笼锁谷氨酸,释放出谷氨酸,诱发海马细胞产生癫痫样放电,建立离体神经元网络癫痫模型,进而探索癫痫的发病机制。
1 材料和方法
1.1 材料
1.1.1 海马神经元的培养:取孕龄18 d的Wistar大鼠(由浙江大学动物实验中心提供),根据文献[6]常规分离原代培养海马神经元。6 d后海马神经元初步形成网络,可进行下一步的记录和实验。
1.1.2 光解笼锁刺激系统:笼锁化合物(caged compound)是一类人工合成的功能被屏蔽的生物活性化合物,一旦被特定波长的光照射,隐蔽基团的笼锁作用被解除,释放出活性分子,这一过程称为光解笼锁。本研究使用特定波长的紫外光照射笼锁谷氨酸,解除光敏基团的笼锁作用,在光照的特定部位释放出谷氨酸,诱发海马细胞产生癫痫样放电,整个刺激系统见图1。在本研究中用375 nm的紫外光激发MNI-笼锁谷氨酸(4-methoxy-7-nitroindolinyl-caged-glutamate,由CANEPARI等[7]合成的)。光解笼锁前,MNI-笼锁谷氨酸溶液的浓度被电解液(NaCl 148 mmol/L,KCl 2.8 mmol/L,MgCl22 mmol/L,CaCl22 mmol/L,葡萄糖10 mmol/L,HEPES 10 mmol/L,pH 7.2~7.4)稀释到1 mmol/L。由光纤引导的紫外光经光学聚焦系统(由两片平凸石英透镜构成)聚焦后,传递到电解液中进行解笼锁。光纤的出射端连接到一个薄的钢杆上,并固定在三维微操纵器上,利用微操纵器把光纤的尖端移至目标神经元附近。微操纵器安装在防振台上的倒置显微镜上。为了控制紫外光脉冲的频率和持续时间,利用信号发生器产生一个方波信号,并传递到激光光源,整个实验平台见图2。

图1 光刺激电记录及其检测系统示意图
1.2 方法
1.2.1 光纤尖端的制作:为得到一个高分辨率的紫外线光斑,光纤的尖端被化学腐蚀成锥形,具体操作步骤见图3。用于制备裸光纤锥的石英玻璃光纤(纤芯直径200 μm,覆盖层直径280 μm,数值孔径0.22)末端被光纤切刀切断,去除覆盖层,浸入氢氟酸(HF)溶液(50 mL 40%的HF溶液加入到50 mL的水中)中进行湿化学腐蚀,见图3A。为了防止HF挥发,利用甲基硅油对HF溶液的表面进行密封,将近6 h的腐蚀后,光纤尖端被腐蚀成锥形,见图3B。同时也暴露了光纤核心的一部分,导致了横向光的泄露和发射光斑的扩大。因此,为了防止横向光泄露,光纤尖端还需要覆盖上一层银膜,见图3C。把光纤尖端浸泡在银浴中(溶液A和溶液B的混合物,A:在35 mg/mL的AgNO3中添加28%的NH3·H2O;B:95 mL 99%乙醇,1.1 mL 38%甲醛和3.9 mL去离子水的混合物)。银涂层后,光纤再浸泡到硝酸中去除出射端的银层,见图3D。制作完成的光纤尖端见图3E。

图2 实验平台实物图
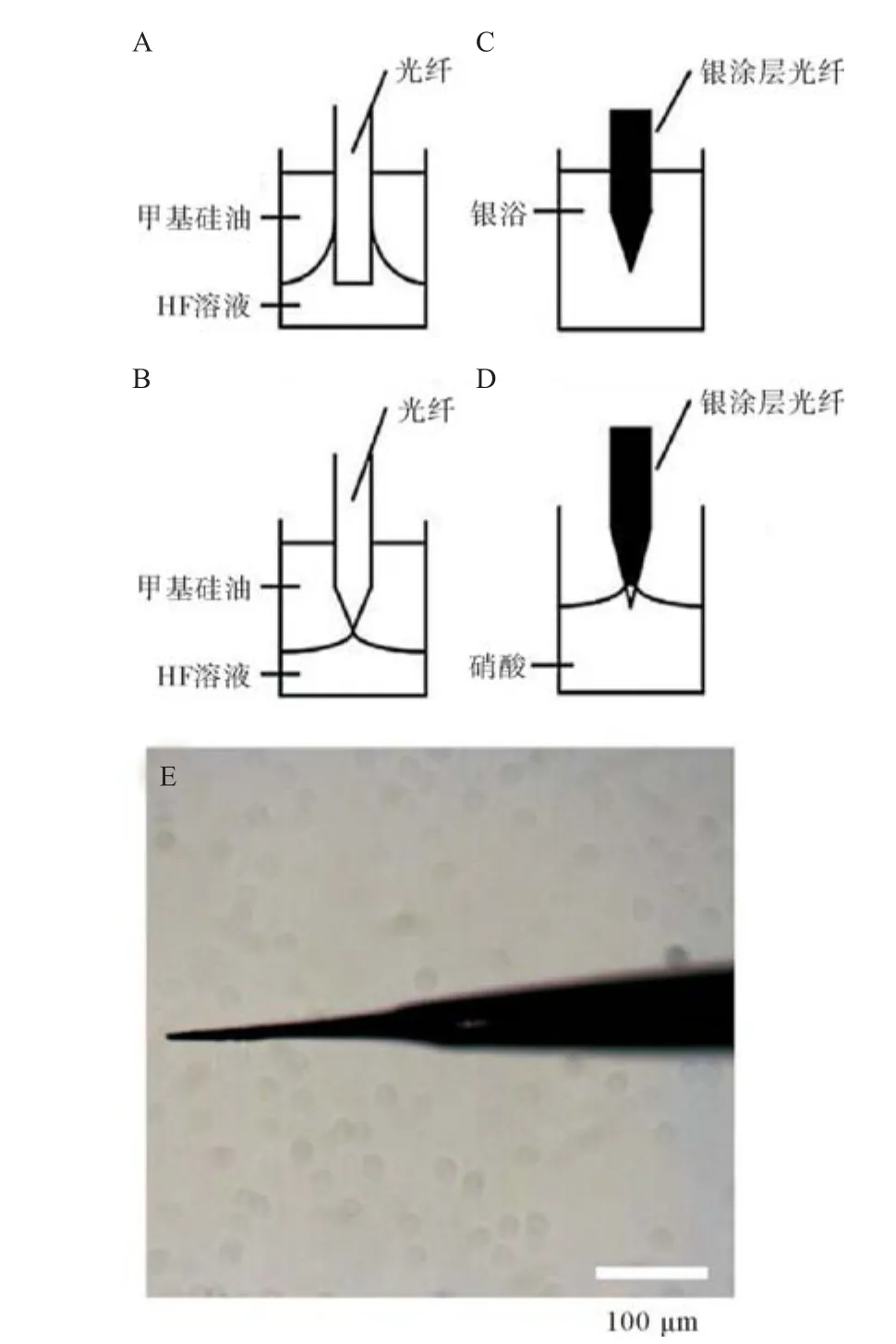
图3 光纤尖端的制作过程
1.2.2 实验参数的选择:笼锁化合物浓度、刺激波长、刺激功率和刺激时间都会影响光解笼锁后的光斑面积[8]。MNI-笼锁谷氨酸的活化光谱范围为300~380 nm,本研究中选用的刺激波长为375 nm,因为目前市场上375 nm的激光器比较容易获得;MNI-笼锁谷氨酸溶液浓度是1 mmol/L。
1.2.3 MEA记录系统:为记录谷氨酸诱导的神经元电活动,实验采用集成MEA记录系统(60MEA200/30-Ti,多通道系统)。在MEA芯片表面粘合玻璃圆环形成培养腔,MNI-笼锁谷氨酸溶液(前面提到的被电解液稀释到1 mmol/L的笼锁谷氨酸溶液)倒入培养腔中。在解笼锁期间,60个通道同时获得电信号,采样频率为50 kHz。带通滤波器(300~2 000 Hz)对信号进行滤波。
2 结果
2.1 光解笼锁实验结果 为了研究刺激时间对光解笼锁后光斑面积的影响,利用笼锁荧光素进行模拟。实验结果表明:刺激时间越长,形成的光斑越大。刺激光功率为1 mW,不同刺激时间(50 ms、100 ms、200 ms和500 ms)引起的荧光光斑见图4。经比较后,本研究选用的刺激功率为1 mW,刺激时间为50 ms,产生的光斑大小为(22.77±2.01)μm,与海马神经元细胞尺寸相近。

图4 荧光光斑面积和刺激时间之间的关系
2.2 离体培养的海马神经元网络 培养6 d后海马神经元网络在MEA芯片表面形成。可以看出细胞胞体增大,突起增多,呈现三角形或者椭圆形,并和周围的神经元通过突触连接形成网络,见图5。
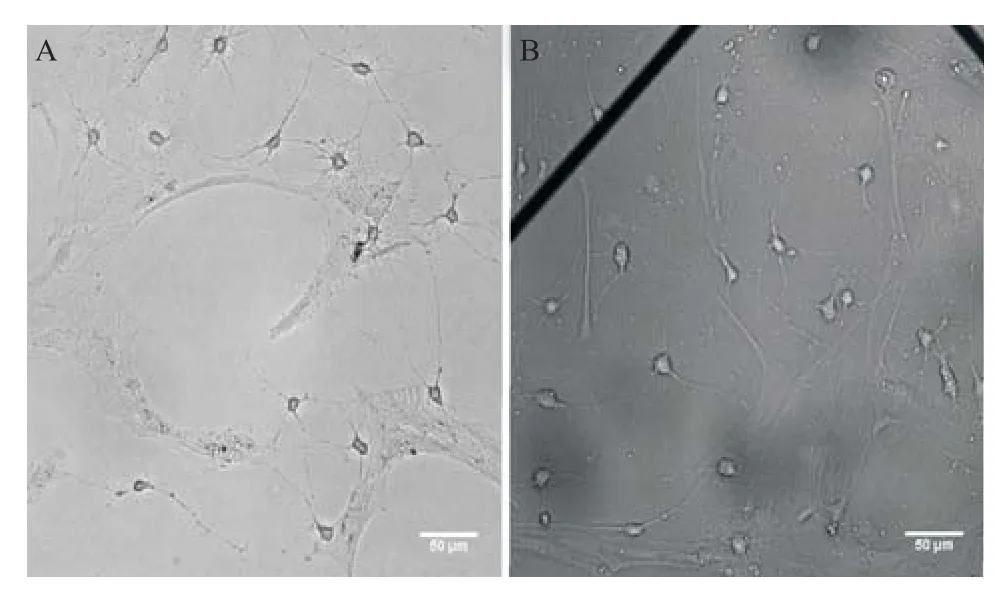
图5 在培养瓶(A)和MEA芯片(B)上培养的海马神经元网络(×200)
2.3 谷氨酸诱发的癫痫样放电 紫外光未作用时记录到2个海马神经元正常的电位发放,见图6A和6C;实验中可以观察到有些神经元细胞除了动作电位还有一些自发的突触后电位,见图6A;海马神经元细胞有一些自发的爆发现象,见图6C。经紫外光激发后这2个海马神经元都呈现癫痫样放电,见图6B和6D,确定该癫痫模型建立成功。
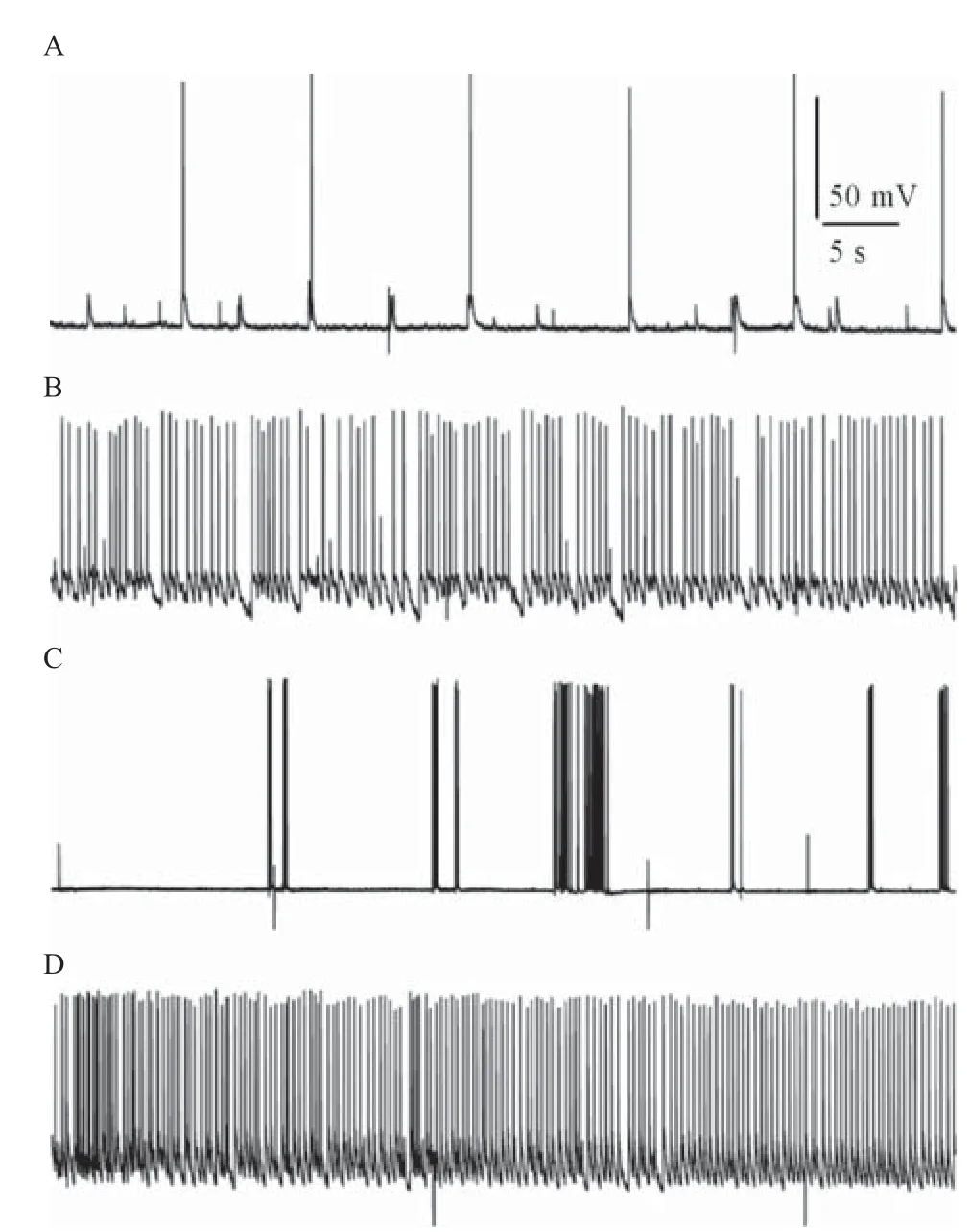
图6 谷氨酸诱发的海马神经元癫痫样放电
3 讨论
目前关于神经系统刺激的方法很多,但把光作为调控手段的不是很多;本研究参考相关文献[9-11],成功研制了基于光解笼锁谷氨酸的神经元细胞刺激系统,弥补电刺激方法刺激不可控的缺陷。MNI-笼锁谷氨酸解笼锁后,现象不明显,难以观察解笼锁和上述因素的关系,因此利用笼锁荧光素进行模拟,研究刺激时间的影响。笼锁荧光素解笼锁后会产生荧光效应,通过CCD(charge coupled device)相机观察解笼锁后出现的荧光光斑,并利用此系统成功诱发培养在MEA芯片上的海马神经元组群癫痫样放电,初步建立离体癫痫模型,有利于人们探索癫痫发病机制以及研制抗癫痫药物。本实验还研究了谷氨酸兴奋性毒性可能会给实验带来的影响。谷氨酸的过度激活会伤害甚至杀死神经元。TORIMITSU和NIWA[12]发现笼锁谷氨酸的浓度在激光辐射期显示出线性相关性。在本研究中,根据紫外光的照射时间,谷氨酸的峰值浓度大概是20 μmol/L,这远低于GARTHAITE等[13]提到的有毒浓度。同时,本研究建立的刺激系统同样可广泛适合于神经细胞电生理和神经生物学的实验。
尽管初步建立了离体癫痫模型,但是本研究很多地方仍然处于探索阶段,在下一步研究中,需要改进的地方有:①将利用微流控技术引导细胞定向生长,建立不同的拓扑连接结构,利用光解笼锁谷氨酸刺激系统,在光照的特定部位(如神经元胞体、神经突触等局部位置)释放出谷氨酸,研究不同拓扑连接结构的细胞网络在谷氨酸作用下的放电情况,阐明网络结构、突触连接与癫痫发作的内在机制;②根据海马神经系统的解剖结构,首先建立单个神经元仿真模型,包括锥体细胞和中间神经元;然后建立各个神经元之间的突触连接(兴奋性和抑制性突触),形成神经元网络仿真模型。通过将仿真结果与实验数据相比较,优化网络结构和参数,获得与实际观察相符合的网络模型,在细胞水平上阐明癫痫发作的内在机制。
[1] HANEEF Z, LENARTOWICZ A, YEH H J, et al. Functional connectivity of hippocampal networks in temporal lobe epilepsy[J]. Epilepsia, 2014, 55(1): 137-145.
[2] EID T, LEE T S, WANG Y, et al. Gene expression of glutamate metabolizing enzymes in the hippocampal formation in human temporal lobe epilepsy[J]. Epilepsia, 2013, 54(2): 228-238.
[3] HOTTOWY P, SKOCZEŃ A, GUNNING D E, et al. Properties and application of a multichannel integrated circuit for low-artifact, patterned electrical stimulation of neural tissue [J]. J Neural Eng, 2012, 9(6): 066005.
[4] SCHÖNECKER S, KRAUSHAAR U, DÜFER M, et al. Longterm culture and functionality of pancreatic islets monitored using microelectrode arrays[J]. Integr Biol (Camb), 2014, 6(5): 540-544.
[5] LIMNUSON K, HUI L U, CHIEL H J, et al. Real-time stimulus artifact rejection via template subtraction[J]. IEEE Trans Biomed Circuits Syst, 2014, 8(3): 391-400.
[6] 李艳玲, 李向宁, 周炜, 等. 培养海马神经元网络学习模型的构建[J]. 生物化学与生物物理进展, 2007, 34(2): 169-175.
[7] CANEPARI M, NELSON L, PAPAGEORGIOU G, et al. Photochemical and pharmacological evaluation of 7-nitroindolinyl-and 4-methoxy-7-nitroindolinyl-amino acids as novel, fast caged neurotransmitters[J]. J Neurosci Methods, 2001, 112(1): 29-42.
[8] TRIGO F F, CORRIE J E, OGDEN D. Laser photolysis of caged compounds at 405 nm: photochemical advantages, localisation, phototoxicity and methods for calibration[J]. J Neurosci Methods, 2009, 180(1): 9-21.
[9] GHEZZI D, PEDROCCHI A, MENEGON A, et al. Photo-MEA: an opto-electronic biosensor for monitoring in vitro neuronal network activity[J]. Biosystems, 2007, 87(2-3): 150-155.
[10] GHEZZI D, MENEGON A, PEDROCCHI A, et al. A microelectrode array device coupled to a laser-based system for the local stimulation of neurons by optical release of glutamate[J]. J Neurosci Methods, 2008, 175(1): 70-78.
[11] YANG X F, SCHMIDT B F, RODE D L, et al. Optical suppression of experimental seizures in rat brain slices[J]. Epilepsia, 2010, 51(1): 127-135.
[12] TORIMITSU K, NIWA O. Direct detection of uncaged glutamate and the laser photostimulation of cultured rat cortex [J]. Neuroreport, 1998, 9(4): 599-603.
[13] GARTHWAITE G, WILLIAMS G D, GARTHWAITE J. Glutamate toxicity: an experimental and theoretical analysis [J]. Eur J Neurosci, 1992, 4(4): 353-360.
(本文编辑:吴彬)
Establishment of the epilepsy model in vitro based on optical release of caged-glutamate
ZHENG Qian qian1, CHEN Liangliang1, YE Xuesong2.
1.College of Biomedical Engineering, Wenzhou Medical University, Wenzhou, 325035; 2.College of Biomedical Engineering & Instrument Science, Zhejiang University, Hangzhou, 310027
Objective:In order to better study the internal mechanism of the seizure, the epilepsy model in vitro was established to simulate seizure discharge.Methods:Aiming at the drawbacks of the electrical stimulation and drugs intervention, a stimulation system of neurons based on optical release of caged-glutamate was developed. The hippocampal neurons cultured on the microelectrode array were used as the research object. The ultraviolet (UV) focused by the optical focus system was delivered to the bath solution contained cage-glutamate. Using a specifi c wavelength of UV to remove the caged function of photosensitive groups, glutamate was released.Results:The hippocampal neurons showed the normal potential when the UV did not work. The glutamate induced seizure discharge in the hippocampal neurons after the UV excitation.Conclusion:The epilepsy model in vitro was preliminarily set up. The model provides the rational model in vitro for the researches on the mechanism of the epilepsy.
optical stimulation; caged-glutamate; hippocampal neurons; the epilepsy model in vitro; microelectrode array
R318.6
A
10.3969/j.issn.2095-9400.2017.07.009
2016-09-09
浙江省教育厅访问学者教师专业发展项目;温州市科技计划项目(G20150022)。
郑茜茜(1978-),女,浙江温州人,讲师,硕士。
