miR-21在人骨肉瘤细胞系U2OS体外侵袭中的作用及其机制
2017-07-18吕晨陈鑫朱雄白林文军王路黄正湘杨胜武
吕晨,陈鑫,朱雄白,林文军,王路,黄正湘,杨胜武
(温州医科大学附属第一医院 骨科,浙江 温州 325015)
·论 著·
miR-21在人骨肉瘤细胞系U2OS体外侵袭中的作用及其机制
吕晨,陈鑫,朱雄白,林文军,王路,黄正湘,杨胜武
(温州医科大学附属第一医院 骨科,浙江 温州 325015)
目的:探讨miR-21在人骨肉瘤细胞系U2OS体外侵袭中的作用及其机制。方法:培养人正常成骨细胞系hFOB 1.19和人骨肉瘤细胞系U2OS,通过实时荧光定量PCR(qRT-PCR)比较2组细胞miR-21的表达差异。通过miR-21-up慢病毒感染U2OS细胞,qRT-PCR检测感染前后U2OS细胞中miR-21的表达变化。Transwell侵袭实验检测miR-21对U2OS细胞侵袭的影响,并通过Western blot检测验证在U2OS细胞中miR-21对于靶基因PTEN是否具有调控作用及miR-21对U2OS细胞中侵袭相关蛋白基质金属蛋白酶(MMP)-2、MMP-9表达的影响。结果:qRT-PCR结果表明miR-21在骨肉瘤细胞系U2OS中高表达(P<0.05)。Transwell检测结果表明上调miR-21的表达能够明显促进U2OS细胞的侵袭(P<0.05)。Western blot检测表明PTEN在骨肉瘤细胞中低表达,且与miR-21表达呈负相关(P<0.05)。miR-21可促进侵袭相关蛋白MMP-2、MMP-9的表达(P<0.05)。结论:miR-21可通过抑制PTEN蛋白的表达,进而促进侵袭相关蛋白MMP-2、MMP-9的表达,促进人骨肉瘤细胞系U2OS的侵袭。
miR-21;骨肉瘤;PTEN;基质金属蛋白酶;侵袭
骨肉瘤是一种好发于儿童和青少年的骨原发性恶性肿瘤,约占儿科肿瘤的5%[1],男性发病率略高于女性。骨肉瘤好发于长管状骨的干骺端,以股骨远端和胫骨近端最多见。骨肉瘤恶性程度高,预后极差。近年来,随着辅助检查和手术技术的提高,特别是新的化疗药物的使用,骨肉瘤5年生存率从20%提高到70%。然而,由于骨肉瘤早期就可出现肺部转移,临床单纯骨肉瘤截肢术后患者的5年生存率仍然不容乐观[2-3]。目前,骨肉瘤侵袭和转移的具体分子机制仍未明确。因此,迫切需要寻找一种新的可以预测肿瘤进展的有效分子标记物,探讨其作用机制,并用于指导临床预后。
microRNA(miRNA)是一类存在于动植物以及病毒中可调控基因表达的内源性非编码单链小分子RNA,长21~23个核苷酸。研究[4]表明miRNA可通过与其靶基因mRNA 3’端非翻译区完全或部分的匹配结合,使后者降解或抑制其翻译过程,从而发挥调控基因表达的作用。研究表明,miRNA和骨肉瘤的发生发展以及耐药性有着密切的关系[5-6]。根据文献[7]报道,多种肿瘤标本以及细胞系都检测出miR-21表达水平的异常升高,包括神经系统肿瘤、消化系统肿瘤、妇科肿瘤、生殖系统肿瘤等,因此miR-21是目前公认的一个致癌性miRNA。但目前有关miR-21与骨肉瘤的相关性研究甚少。为了更好地探究miR-21在骨肉瘤进展中的作用,本研究通过比较miR-21在正常人成骨细胞系hFOB 1.19和人骨肉瘤细胞系U2OS中的表达差异,以及通过上调miR-21的表达,研究miR-21的表达对骨肉瘤细胞侵袭的影响,并对miR-21调控骨肉瘤细胞侵袭的机制进行初步的探讨,为骨肉瘤的靶向治疗提供新的理论依据。
1 材料和方法
1.1 材料
1.1.1 实验细胞和主要试剂:人正常成骨细胞系hFOB 1.19由SUBRAMANIAM博士惠赠[8],人骨肉瘤细胞系U2OS购自中国科学院上海细胞研究所,胎牛血清、DMEM/F12培养基、DMEM/High-glucose培养基、0.25%胰蛋白酶、青-链霉素等购自美国Gibco公司,pGCMV-rno-miR-21-up慢病毒表达载体购自上海吉凯基因技术有限公司,Hairpin-itTMmiRNAs RT-PCR Quantitation试剂盒(探针法)购自上海吉玛制药技术有限公司,兔抗大鼠PTEN(phosphatase and tensin homolog deleted on chromosometen)单克隆抗体购自美国CST公司,兔抗大鼠基质金属蛋白酶(matrix metalloproteinase,MMP)-2/9多克隆抗体购自美国Protein Tech公司,兔抗大鼠GAPDH多克隆抗体购自北京康为世纪生物有限公司,HRP标记的山羊抗兔IgG购自北京中杉金桥生物有限公司,Transwell小室购自美国Millipore公司,结晶紫购自北京索莱宝生物技术公司。
1.1.2 主要仪器:超净工作台、CO2培养箱、倒置显微镜、培养皿、孔板、微量加样器、37 ℃水浴箱、4/-20 ℃冰箱、-80 ℃冰箱、低速离心机、PCR扩增仪、罗氏480荧光定量PCR仪、ECL发光系统等。
1.2 方法
1.2.1 细胞培养:人正常成骨细胞系hFOB 1.19采用含10%胎牛血清的DMEM/F12培养基培养,人骨肉瘤细胞系U2OS采用含10%胎牛血清的DMEM/Highglucose培养基培养;2组细胞均放置于含5% CO2的37 ℃恒温培养箱中。细胞每2 d换液1次,当贴壁细胞融合度达80%左右用胰酶消化制成细胞悬液,按1:3传代。
1.2.2 miR-21-up慢病毒感染人骨肉瘤细胞系U2OS:将对数生长期的U2OS细胞接种于6孔板(密度约3× 104/mL),于含5% CO2的37 ℃恒温培养箱中培养24 h后细胞融合度达到30%~50%。 配置病毒感染液:miR-21-up慢病毒(1860-5,miR-21-up)20 μL,阴性对照慢病毒(CON063,NC)10 μL,polybrene 1 μL,Enhanced infection solution 2 mL。miR-21-up慢病毒及阴性对照慢病毒载体感染U2OS细胞12 h后,更换为正常含10%血清的DMEM/High-glucose培养基继续培养72 h后荧光显微镜检测细胞感染情况(绿色荧光蛋白GFP表达情况)。
1.2.3 实时荧光定量PCR(qRT-PCR)检测miR-21的表达:收集感染前后各组细胞,分别加入1 mL Trizol。按照Trizol使用说明书提取细胞总RNA。反转录得到cDNA,反应总体积20 μL,RNA模板量1 μg。选取U6 snRNA作为内参,采用探针法定量PCR反应:反应体积20.0 μL,向0.2 mL PCR管内加入cDNA 2.0 μL、2×Real-time PCR Master Mix 10 μL、miR-21 Primer set 0.4 μL(U6 snRNA Primer set 0.4 μL)、miR-21 Probe 0.2 μL(U6 snRNA Probe 0.2 μL)、Taq DNA polymerase 0.2 μL、Sterilized H2O27.2 μL。扩增条件:95 ℃预变性3 min,然后95 ℃/12 s、62 ℃/40 s进行40个循环。每个样品设置3个复孔。计算miR-21相对于U6 snRNA的表达比率,基因引物见表1。

表1 qRT-PCR反应引物序列
1.2.4 Transwell检测细胞侵袭能力:Transwell小室(孔径8 μm)微孔膜上表面预先均勾涂抹Matrigel人工基底膜20 μL,37 ℃孵箱孵育30 min使基底膜凝固。收集各组细胞,无血清培养基重悬并计数,以25×104/mL密度将细胞铺至小室上室,下室加入含10%血清的完全培养基,培养24 h。培养结束后取出小室,以棉签轻轻拭去微孔膜上层细胞,对微孔膜下细胞染色:PBS浸泡清洗3遍,4%多聚甲醛固定30 min,0.1%结晶紫染色20 min,PBS浸泡清洗至紫色消失,显微镜下观察微孔膜并随机计数5个非重复视野下细胞数,取均值。每组设定3个复孔。
1.2.5 Western blot检测蛋白表达:收集各组细胞,细胞裂解液4 ℃裂解,12 000 r/min离心,取上清蛋白液。BCA法蛋白液浓度测定,10% SDS-PAGE电泳分离总蛋白,电泳结束后取出分离胶,通过转膜转移到PVDF膜。将PVDF膜放入5%脱脂奶粉封闭2 h,后加入兔抗大鼠PTEN(1:1 000)、MMP-2/9(1:500)、GAPDH(1:2 000)抗体,4 ℃摇床封闭过夜。TBST洗3次,HRP标记的抗兔二抗(1:5 000)室温摇床孵育2 h。TBST洗3次,ECL显色,凝胶成像系统扫描并分析结果。
1.3 统计学处理方法 采用SPSS13.0统计软件进行数据分析。数据以±s表示,应用Graph Pad Prism 6作图软件作图,2组间的比较采用独立样本t检验,多组间的比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 miR-21在U2OS细胞中的表达 采用qRT-PCR检测细胞中miR-21的mRNA表达水平,结果发现hFOB 1.19、U2OS细胞中miR-21的相对表达量分别为1.00± 0.00、5.80±0.44。与hFOB 1.19细胞相比,U2OS细胞中miR-21的mRNA表达显著升高,差异有统计学意义(P<0.05)。
2.2 miR-21-up慢病毒感染U2OS细胞 通过参照吉凯基因公司提供的《慢病毒使用操作手册Version 2.0》,miR-21-up及NC感染U2OS细胞(MOI=20),感染96 h后倒置显微镜下观察细胞形态。与正常U2OS细胞比较,未见病毒对感染后细胞生长状态有明显影响。倒置荧光显微镜下观察,可见绝大多数细胞成功表达GFP(表达率超过80%),见图1,结果表明,miR-21-up慢病毒成功感染了U2OS细胞。
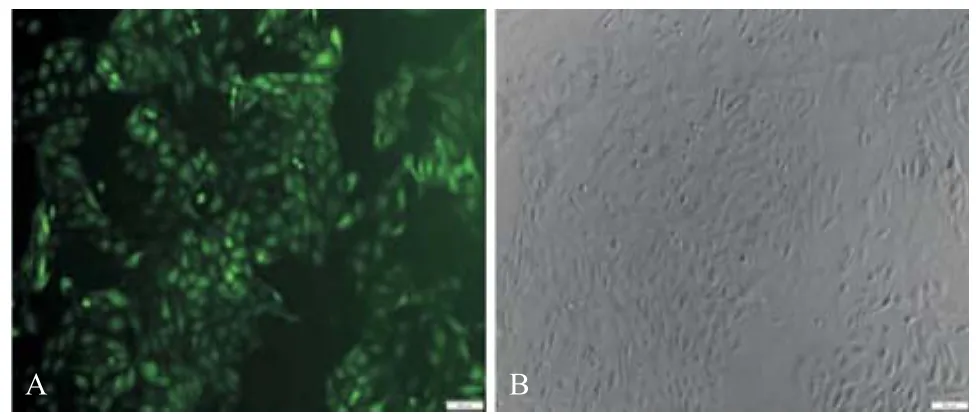
图1 miR-21-up慢病毒感染U2OS细胞(×100)
2.3 qRT-PCR检测感染前后细胞miR-21的表达情况
通过qRT-PCR检测慢病毒感染前后各组细胞miR-21的表达情况。实验结果显示,与正常组和阴性对照组比,miR-21-up组miR-21的表达均上调,差异有统计学意义(P<0.05),阴性对照组与正常组比较差异无统计学意义(P>0.05),见图2。
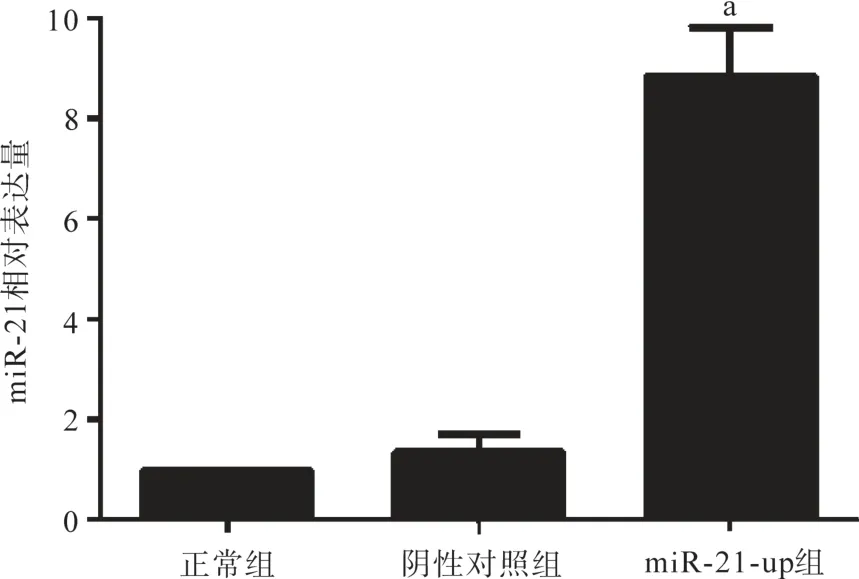
图2 miR-21-up慢病毒感染前后miR-21相对表达量
2.4 miR-21对U2OS细胞体外侵袭的影响 采用Transwell检测miR-21对U2OS体外侵袭的影响,结果显示,正常组、阴性对照组、miR-21-up组发生侵袭的U2OS细胞数量分别为54.3±6.0、49.7±7.5、103.7±7.1。miR-21-up组细胞的侵袭能力较正常组、阴性对照组均明显升高(P<0.05),而阴性对照组与正常组比较差异无统计学意义(P>0.05),见图3。
2.5 miR-21靶基因预测以及Western blot检测 通过生物信息学软件分析,我们发现PTEN可能是miR-21的一个靶基因[9]。通过Western blot检测发现PTEN在U2OS细胞中的表达较hFOB 1.19细胞明显降低(P<0.05),见图4A。通过Western blot检测比较慢病毒感染前后各组细胞PTEN表达情况,结果显示,miR-21-up组PTEN的表达量较正常组、阴性对照组均明显降低(P<0.05),而阴性对照组与正常组比较差异无统计学意义(P>0.05),见图4B。
2.6 miR-21对U2OS细胞MMP-2、MMP-9表达的影响采用Western blot检测慢病毒感染前后各组细胞MMP-2、MMP-9蛋白的表达情况,结果显示,miR-21-up组MMP-2、MMP-9蛋白的表达量较正常组、阴性对照组均明显增高,差异有统计学意义(P<0.05),阴性对照组与正常组比较差异无统计学意义(P>0.05),见图5。

图3 Transwell检测各组细胞侵袭能力变化(×200)

图4 Western blot检测各组细胞PTEN表达变化
3 讨论
骨肉瘤恶性程度高,预后差,即使采用手术联合化疗,治疗效果仍不佳。基因水平的治疗一直是骨肉瘤研究中的热点,寻求有效的治疗靶点是研究的关键。miRNA是近年来新发现的一类非编码单链小RNA分子,因其表达具有时序性、时间和组织特异性以及保守性等特点,在肿瘤发生发展过程中可作为癌基因或者抑癌基因调控肿瘤转移基因的表达[10]。研究报道miRNA与肿瘤的侵袭、转移等生物学效应相关[11-12]。由于miR-21在绝大多数肿瘤中的表达均显著增加,且与肿瘤的预后密切相关,因而成为近年来miRNA领域的研究热点。YANG等[13]报道miR-21通过下调PTEN表达促进人大肠癌细胞的增殖;BAO等[14]研究表明miR-21通过抑制PTEN和hSulf-1的表达,激活AKT/ERK通路,促进肝细胞癌的进展;ZHANG等[15]报道miR-21通过下调PTEN表达而促进胃癌细胞的增殖和侵袭。但目前关于miR-21是否参与调控骨肉瘤细胞的侵袭转移及其具体分子机制的报道很少。ZIYAN等[16]报道在骨肉瘤组织中miR-21的表达与肿瘤抑制基因RECK的表达呈负相关。VANAS等[17]研究表明miR-21可通过抑制Sprouty2的表达,进而提高骨肉瘤细胞对卡铂治疗的敏感性。因此,我们推测miR-21在骨肉瘤中同样呈现高表达,并与骨肉瘤的发生、进展等密切相关。

图5 Western blot检测各组细胞MMP-2、MMP-9表达变化
我们前期的研究通过比较miR-21在人骨肉瘤细胞系(MG63、U2OS、143B、SaO2)与正常人成骨细胞系(hFOB1.19)的表达差异,发现miR-21在U2OS细胞中的表达量最高,而在MG63细胞中的表达量最低(数据未提供),研究结果与VANAS等[17]研究相一致。因此,我们选择miR-21表达差异最大的2组细胞系(MG63、U2OS)进行后续研究。我们已经证实miR-21在骨肉瘤细胞系MG63中的作用[9]。qRT-PCR检测结果表明miR-21在U2OS细胞的表达较hFOB 1.19细胞明显增加。为探讨miR-21对U2OS细胞侵袭的影响,本研究成功构建miR-21-up慢病毒载体,并成功感染U2OS细胞,经qRT-PCR检测证实感染后的U2OS细胞中miR-21的表达明显上调。本研究采用Transwell侵袭实验推测miR-21在U2OS细胞侵袭中的作用,发现miR-21可显著地提高U2OS细胞的侵袭能力。
PTEN是迄今为止发现的第一个具有双特异性磷酸酶活性的抑癌基因,是继p53基因后另一个较为广泛地与肿瘤发生密切关系的基因[18]。PTEN蛋白在细胞生长、凋亡、迁移、侵袭等方面具有重要作用[19]。研究表明,PTEN作为抑癌基因,通过调控细胞侵袭相关蛋白的表达抑制肿瘤细胞的侵袭[20]。近些年来,关于PTEN在骨肉瘤进展中的作用研究逐渐增多[21]。LEVINE等[22]报道PTEN在狗骨肉瘤细胞中表达降低;TIAN等[23]报道miR-23a可以通过抑制PTEN的表达促进人骨肉瘤细胞迁移和侵袭。本研究通过Western blot检测发现PTEN蛋白在人骨肉瘤细胞系U2OS中的表达较正常人成骨细胞系hFOB 1.19明显降低,并且PTEN蛋白的表达与细胞内miR-21的表达呈负相关。研究结果表明,miR-21在U2OS细胞中能显著地负调控PTEN的表达,推断miR-21可通过抑制PTEN的表达促进U2OS细胞侵袭。
MMPs是一类以Ca2+、Zn2+等金属离子作为辅助因子的蛋白酶类,其主要功能是降解细胞外基质,维持细胞外基质的动态平衡[24]。肿瘤细胞能通过分泌MMPs,穿透细胞外基质基底膜形成侵袭转移。因而,MMPs与肿瘤的侵袭转移和预后密切相关[25]。MMP-2和MMP-9是MMP家族中参与体内细胞外基质降解的最主要的两个蛋白,两者能有效地分解基底膜的主要成分IV型胶原纤维和层黏连蛋白,在细胞侵袭、迁移等生物学过程中起到了更多的特殊作用。近年来的研究发现在多种肿瘤细胞中MMPs的分泌与PTEN表达呈负相关。LI等[26]研究表明PPAR-gamma可激活PTEN的表达从而抑制MMP-2的分泌,抑制胰腺癌细胞浸润转移;CHEN等[27]研究发现PTEN可以通过抑制MMP-9的表达而抑制肝细胞的侵袭转移。本研究通过Western blot检测发现MMP-2、MMP-9蛋白的表达与细胞内miR-21的表达呈正相关;同时,与细胞内PTEN的表达呈负相关。因此,我们认为miR-21可通过抑制PTEN的表达,促进MMP-2、MMP-9的表达,提高U2OS细胞的侵袭能力。
综上所述,本研究证实miR-21可通过靶向调控PTEN基因的表达,进而促进侵袭相关蛋白MMPs的分泌,促进骨肉瘤细胞U2OS的侵袭,这为早期治疗骨肉瘤侵袭转移等提供新的思路。我们相信随着基因技术的发展,miR-21可作为评估骨肉瘤恶性程度、有无远处转移等生物学行为的重要分子生物标志,不仅可以为肿瘤的早期发现及预后提供预测,并且可以作为新的靶向药物应用于临床中。但本研究亦存在不足之处,即体内微环境在恶性肿瘤的侵袭转移中起着非常重要的作用,后期研究需要通过更多的体内实验证实miR-21在骨肉瘤早期侵袭转移中的作用。
[1] ENDO-MUNOZ L, CUMMING A, SOMMERVILLE S,et al. Osteosarcoma is characterised by reduced expression of markers of osteoclastogenesis and antigen presentation compared with normal bone[J]. Br J Cancer, 2010, 103(1): 73-81.
[2] BIELACK S S, MARINA N, FERRARI S, et al. Osteosarcoma: the same old drugs or more?[J]. J Clin Oncol, 2008, 26(18): 3102-3103.
[3] GILL J, AHLUWALIA M K, GELLER D, et al. New targets and approaches in osteosarcoma[J]. Pharmacol Ther, 2013, 137(1): 89-99.
[4] BARTEL D P. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136(2): 215-233.
[5] LI H, ZHANG K, LIU L H, et al. MicroRNA screening identifi es circulating microRNAs as potential biomarkers for osteosarcoma[J]. Oncol Lett, 2015, 10(3): 1662-1668.
[6] KOBAYASHI E, SATOW R, ONO M, et al. MicroRNA expression and functional profi les of osteosarcoma[J]. Oncology, 2014, 86(2): 94-103.
[7] KUMARSWAMY R, VOLKMANN I, THUM T. Regulation and function of miRNA-21 in health and disease[J]. RNA Biol, 2011, 8(5): 706-713.
[8] SUBRAMANIAM M, JALAL S M, RICKARD D J, et al. Further characterization of human fetal osteoblastic hFOB 1.19 and hFOB/ER alpha cells: bone formation in vivo and karyotype analysis using multicolor fl uorescent in situ hybridization[J]. J Cell Biochem, 2002, 87(1): 9-15.
[9] LV C, HAO Y, TU G. MicroRNA-21 promotes proliferation, invasion and suppresses apoptosis in human osteosarcoma line MG63 through PTEN/Akt pathway[J]. Tumour Biol, 2016, 37(7): 9333-9342.
[10] 赵晓蕾, 蔡林, 邓洲铭. microRNA与骨肉瘤的研究进展[J].中国骨与关节杂志, 2014, 3(10): 773-778.
[11] 季菊玲, 张锦生. microRNA与肿瘤[J]. 中华病理学杂志, 2006, 35(10): 628-630.
[12] 韩玉萍, 秦玉花, 杨红亚, 等. miRNA与肿瘤[J]. 生命的化学, 2009, 29(2): 252-256.
[13] YANG Y, YANG J J, TAO H, et al. MicroRNA-21 controls hTERT via PTEN in human colorectal cancer cell proliferation[J]. J Physiol Biochem, 2015, 71(1): 59-68.
[14] BAO L, YAN Y, XU C, et al. MicroRNA-21 suppresses PTEN and hSulf-1 expression and promotes hepatocellular carcinoma progression through AKT/ERK pathways[J]. Cancer lett, 2013, 337(2): 226-236.
[15] ZHANG B G, LI J F, YU B Q, et al. microRNA-21 promotes tumor proliferation and invasion in gastric cancer by targeting PTEN[J]. Oncol Rep, 2012, 27(4): 1019-1026.
[16] ZIYAN W, SHUHUA Y, XIUFANG W, et al. MicroRNA-21 is involved in osteosarcoma cell invasion and migration[J]. Med Oncol, 2011, 28(4): 1469-1474.
[17] VANAS V, HAIGL B, STOCKHAMMER V, et al. MicroRNA-21 increases proliferation and cisplatin sensitivity of osteosarcoma-derived cells[J]. PLoS One, 2016, 11(8): e0161023.
[18] TSUGAWA K, JONES M K, SUGIMACHI K, et al. Biological role of phosphatase PTEN in cancer and tissue injury healing[J]. Front Biosci, 2002, 7: e245-251.
[19] HU Y, XU S, JIN W, et al. Effect of the PTEN gene on adhesion, invasion and metastasis of osteosarcoma cells[J]. Oncol Rep, 2014, 32(4): 1741-1747.
[20] ZHENG H C, SUN J M, LI X H, et al. Role of PTEN and MMP-7 expression in growth, invasion, metastasis and angiogenesis of gastric carcinoma[J]. Pathol Int, 2003, 53(10): 659-666.
[21] 蒋正辉, 张维康, 邵金祥, 等. Skp2、p27和PTEN在骨肉瘤中表达及调控[J]. 临床骨科杂志, 2012, 15(3): 339-342.
[22] LEVINE R A, FOREST T, SMITH C. Tumor suppressor PTEN is mutated in canine osteosarcoma cell lines and tumors[J]. Vet Pathol, 2002, 39(3): 372-378.
[23] TIAN K, DI R, WANG L. MicroRNA-23a enhances migration and invasion through PTEN in osteosarcoma[J]. Cancer Gene Ther, 2015, 22(7): 351-359.
[24] SWARNAKAR S, PAUL S, SINGH L P, et al. Matrix metalloproteinases in health and disease: regulation by melatonin [J]. J Pineal Res, 2011, 50(1): 8-20.
[25] BACK M, KETELHUTH D F, AGEWALL S. Matrix metalloproteinases in atherothrombosis[J]. Prog Cardiovasc Dis, 2010, 52(5): 410-428.
[26] LI Y, ZHANG D W, LIN D Q, et al. Peroxisome proliferator-activated receptor-gamma inhibits pancreatic cancer cell invasion and metastasis via regulating MMP-2 expression through PTEN[J]. Mol Med Rep, 2015, 12(4): 6255-6260.
[27] CHEN J S, WANG Q, FU X H, et al. Involvement of PI3K/ PTEN/AKT/mTOR pathway in invasion and metastasis in hepatocellular carcinoma: Association with MMP-9[J]. Hepatol Res, 2009, 39(2): 177-186.
(本文编辑:赵翠翠)
Role and mechanism of miR-21 in human osteosarcoma cell line U2OS invasion in vitro
LYU Chen, CHEN Xin, ZHU Xiongbai, LIN Wenjun, WANG Lu, HUANG Zhengxiang, YANG Shengwu.
Department of Orthopedics, the First Affi liated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective:To study the role and mechanism of miR-21 on regulating invasion in osteosarcoma cell line U2OS in vitro.Methods:The cultivation of human fetal osteoblastic cell line hFOB1.19 and human osteosarcoma cell line U2OS. qRT-PCR was used to detect the expression of miR-21 in the previous two groups. miR-21-up lentivirus infected U2OS cells. qRT-PCR was then used to detect the expression of miR-21 between the miR-21-up-infected U2OS cells and no-infected U2OS cells. Transwell chamber invasion assay was used to observe the effect of miR-21 in U2OS cells invasion. Western blot analysis was used to verify miR-21’s role in regulating the expression of PTEN and invasive associated protein MMP-2/MMP-9 in U2OS cells.Results:qRTPCR results showed that the expression of miR-21 was signifi cantly increased in U2OS cells (P<0.05). Transwell assay results showed that overexpression of miR-21 could signifi cantly promote U2OS cells invasion (P<0.05). Western blot analysis results showed that the expression of PTEN was decreased in U2OS cells and negative correlated with miR-21 (P<0.05). Western blot results analysis also showed that miR-21 could signifi cantly improve the expression of MMP-2/9 (P<0.05).Conclusion:miR-21, which targets PTEN, promotes U2OS invasion by activating the expression of MMP-2/9.
miR-21; osteosarcoma; PTEN; matrix metalloproteinases; invasion
R730.54
A
10.3969/j.issn.2095-9400.2017.07.005
2016-09-14
浙江省自然科学基金资助项目(LY14H060007)。
吕晨(1989-),男,江苏盐城人,住院医师,博士。
杨胜武,主任医师,硕士生导师,Email:yangshengwu188@sina.com。
