Th17细胞免疫应答对高危型人乳头瘤病毒感染宫颈疾病的影响
2017-07-18薛纪森朱华章圣辉吕杰强胡燕
薛纪森,朱华,章圣辉,吕杰强,胡燕
(1.温州医科大学附属第一医院 妇科,浙江 温州 325015;2.温州医科大学附属第一医院 血液内科,浙江 温州 325015;3.温州医科大学附属第二医院 妇科,浙江 温州 325027)
·论 著·
Th17细胞免疫应答对高危型人乳头瘤病毒感染宫颈疾病的影响
薛纪森1,朱华1,章圣辉2,吕杰强3,胡燕1
(1.温州医科大学附属第一医院 妇科,浙江 温州 325015;2.温州医科大学附属第一医院 血液内科,浙江 温州 325015;3.温州医科大学附属第二医院 妇科,浙江 温州 325027)
目的:探讨Th17细胞及其主要效应因子IL-17所介导的细胞免疫应答在高危型人乳头瘤病毒(HPV)感染引起宫颈疾病中的作用。方法:收集宫颈癌组(28例)、CIN 3组(29例)、CIN 2组(30例)、CIN 1组(26例)、宫颈高危HPV感染组(25例)以及对照组(30例)血标本。采用流式细胞术检测各组患者外周血中Th17细胞的表达水平,采用ELISA法检测各组患者外周血清中IL-17的表达水平。结果:随宫颈病变的进展,外周血中Th17细胞亚群所占CD4+T细胞比例与对照组比较有逐渐增加的变化趋势,组间Th17细胞表达率的差异有统计学意义(P<0.05)。随着宫颈疾病的进展,各组外周血清中IL-17的表达水平有逐渐升高的变化趋势,差异有统计学意义(P<0.05),但两两比较结果提示各组间差异无统计学意义(P>0.05)。结论:Th17细胞免疫应答及其主要效应因子IL-17与高危型HPV感染引起宫颈疾病的发生、发展相关。
Th17细胞;白细胞介素17;宫颈疾病;人乳头瘤病毒;T细胞免疫
目前宫颈癌的发病率和病死率在女性生殖道恶性肿瘤中居第二位,我国宫颈癌病死率高居世界第二[1]。高危型人乳头瘤病毒(human papillomavirus,HPV)的感染已被证实[2]是发生宫颈病变的必要条件和根本致病因素。临床上,生殖道HPV感染大多数患者呈一过性,只有10%~15%的高危型HPV在宫颈上皮内呈慢性持续性感染状态,从而引起宫颈病变,因此对高危型HPV感染及宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)进行早期干预是预防宫颈癌发生的主要手段[3]。而宿主的免疫反应正是决定HPV感染转归的一个关键因素。近来研究[4-5]发现,一类独特的效应性CD4+T细胞-辅助性T细胞17(T helper 17 cells,Th17)亚群与其特异性的效应因子白细胞介素17(interleukin-17,IL-17)在介导包括感染、肿瘤等多种疾病的发生和发展中均发挥了重要的作用。但迄今为止,对于Th17细胞及IL-17在高危型HPV感染中的作用,少有报道。本课题拟对高危HPV感染的各级宫颈疾病患者体内Th17细胞频率及IL-17表达水平进行检测,并与无高危HPV感染的正常妇女相比较,以探讨Th17细胞及IL-17介导的细胞免疫应答在与高危HPV感染相关宫颈疾病发生、发展中的作用。
1 材料和方法
1.1 材料
1.1.1 主要试剂及仪器:流式细胞术主要抗体Anti-Human CD4 FITC、Anti-Human IL-17A PE、Anti-Human CD69 PE、Anti-Human IFN gamma APC、Mouse IgG1 K Isotype Control及PE Mouse IgG1 K Isotype Control APC均购于美国eBioscience公司;Phorbol 12-myristate 13-acetate粉(1 mg)、Lonomycin calcium salt、Brefeldin A Solution(BFA溶液)购于美国Enzo公司;固定破膜剂(FIX & PERM)购于美国Invitrogen公司;Lysing solution for FACS 10X、人IL-17A ELISA检测试剂盒、人IL-17A标准品购于杭州联科生物技术有限公司;RPMI-1640培养液、胎牛血清(fetal bovine serum,FBS)购于美国Gibco公司;HPV基因分型检测试剂盒购于广东凯普生物科技股份有限公司;FACS Calibur流式细胞仪购于美国BD公司。
1.1.2 对象:收集2010年12月至2013年12月于温州医科大学附属第一医院妇科诊治的患者,分为宫颈癌组(28例,FIGO分期≤ IIa期)、CIN 3组(29例)、CIN 2组(30例)、CIN 1组(26例)、高危HPV感染组(25例),均作为研究组;所有诊断均经病理组织学证实,患者接受治疗前宫颈高危HPV均为阳性,均行HPV基因分型检测确定感染的高危HPV型别。对照组:选择同期因子宫肌瘤收治行子宫全切除术,术前经宫颈液基细胞学及HPV检测无异常且术后病理未提示CIN及以上病变的30例患者。入选标准:①年龄为30~45岁女性;②非经期;③近3 d无性生活。排除标准:①糖尿病、高血压、冠心病、妊娠、生殖道及全身其他部位急、慢性感染性疾病、结缔组织病、免疫性疾病或其他系统恶性肿瘤;②本次患病近期曾接受过抗生素、干扰素、化疗、放疗或免疫抑制药物治疗;③术前四项阳性。本研究经温州医科大学附属第一医院伦理委员会批准,标本采集前获得患者知情同意。
1.1.3 标本采集:①全血标本采集:采集患者外周血2 mL后4 h内送达实验室,进行流式细胞学实验;②血清样本采集:采集患者外周血2 mL,分离出血清后置于-20 ℃冰箱保存待测。
1.2 方法
1.2.1 Th17细胞的荧光染色:吸取患者抗凝外周血100 μL,加同体积10% FBS的RPMI-1640培养液接种于96孔培养板,加入25 μL(1 μg/mL)PMA、5 μL(50 μg/mL)离子霉素、5 μL(0.5 mg/mL)BFA溶液,混匀后置于培养箱中培养4~6 h,取出培养板,吸出经体外刺激活化后的外周血全血至干净离心管中。加入5 mL缓冲液1 000 r/min离心10 min,弃上清,以缓冲液同法冲洗1次。分别加入2.5 μL Anti-Human CD4 FITC液,混匀后置于室温下避光孵育15 min后加入PBS 1 mL,2 500 r/min离心3 min,弃上清。每管加入FIX & PERM Reagent A(固定剂)50 μL,轻柔震荡混匀,室温下避光孵育15 min。每管加入3 mL PBS,1 200 r/min离心5 min,弃去上清。每管加入FIX & PERM Reagent B(破膜剂)50 μL,轻柔震荡混匀,室温下避光孵育15 min。每管加入3 mL PBS,1 200 r/min离心5 min,弃去上清。细胞内染色:每管加入Anti-Human IL-17A PE 5 μL与Anti-Human IFN gamma APC 2.5 μL,轻柔震荡混匀,室温下避光孵育15 min。每管加入3 mL PBS,1 200 r/min离心5 min,弃去上清。每管加入0.5 mL PBS重悬细胞,立即上机检测。
1.2.2 同型对照和空白对照:同型对照的制备:细胞内染色步骤每管加入Mouse IgG1 K Isotype Control PE及Mouse IgG1 K Isotype Control APC各2.5 μL,其余步骤均相同。空白管的制备:同Th17细胞荧光染色中的步骤,但不加任何染色剂。每次流式细胞染色均设有空白对照管。
1.2.3 流式细胞计数:上机前吹打混匀细胞,吸取各管细胞悬液,通过滤网过滤至管中。过滤后的样品由专业计数人员进行细胞计数测定。检测结果经Cell Quest软件分析,用Anti-Human CD4 FITC细胞表面染色圈定CD4+T细胞;用Anti-Human IL-17A PE与Anti-Human IFN gamma APC行细胞内染色,在双变量流式细胞仪的散点图上分选Th17细胞(CD4+IL-17A+IFN-γ-)、Th1细胞(CD4+IL-17A-IFN-γ+)及双阳性细胞(CD4+IL-17A+IFN-γ+),分别计算各细胞占CD4+T细胞百分率。
1.2.4 ELISA法检测血清中IL-17的表达水平:取出-20 ℃冰箱中血清标本,按照IL-17A ELISA试剂盒方法进行检测,根据标准曲线查出血清样本中IL-17浓度。1.3 统计学处理方法 采用GraphPad Prism 5软件分析实验数据。计量资料用±s描述,其均符合正态分布;正态性和方差齐性检验后行方差分析,各组间两两比较用Bonferroni法检验。P<0.05为差异有统计学意义。
2 结果
2.1 研究组与对照组基本临床资料比较 各组间参数比较差异无统计学意义(P>0.05),见表1。
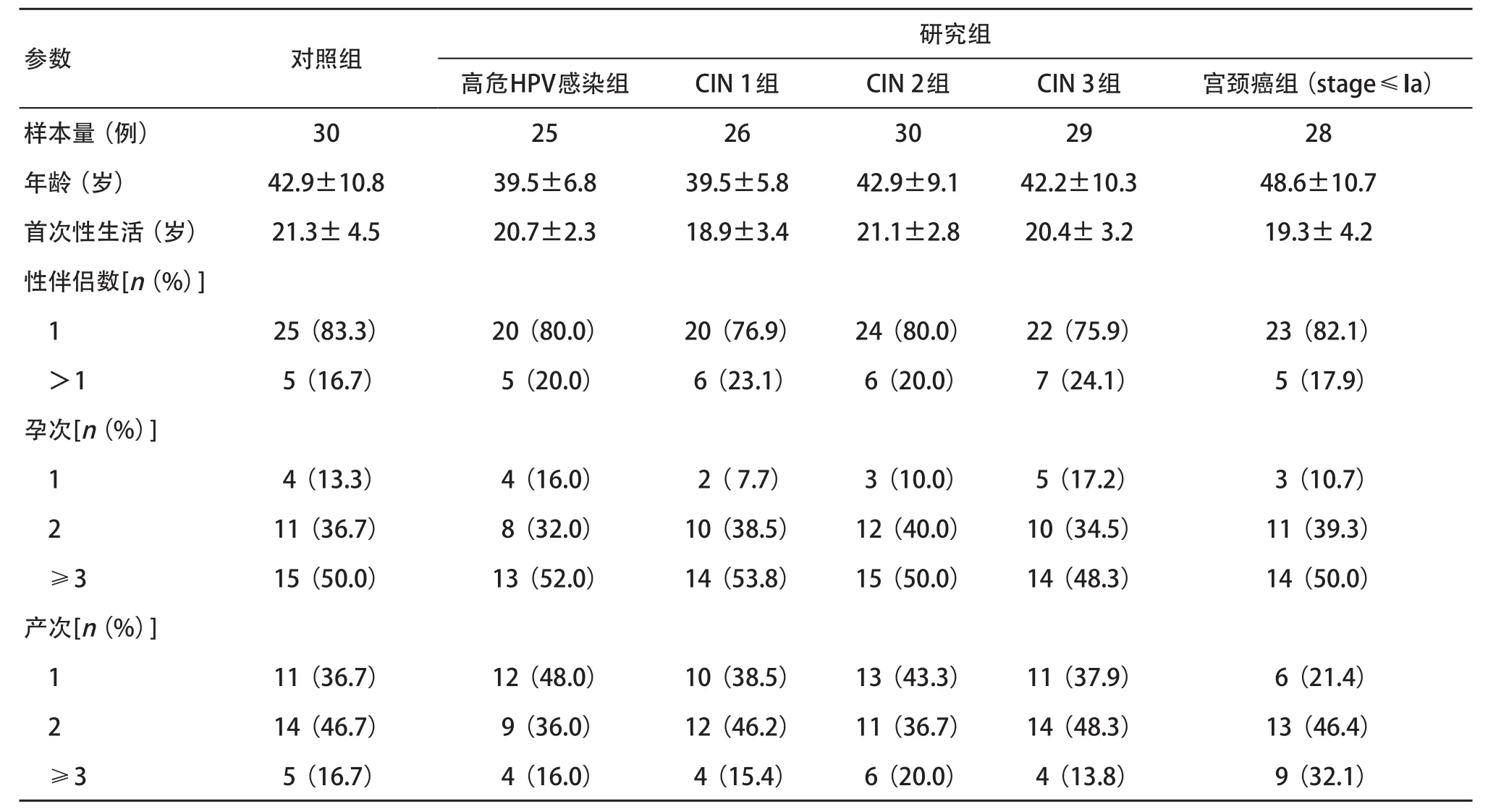
表1 研究组与对照组入选者基本资料
2.2 各研究组宫颈高危HPV感染型别分布情况 单一型别感染为多数,占76.09%(105/138);混合型别感染占23.91%(33/138)。包含HPV16亚型的感染最多见,占52.90%(73/138);其他较多见型别依次分别为HPV52亚型(占17.39%,24/138)、HPV58亚型(占16.67%,23/138)和HPV18亚型(占10.87%,15/ 138),见表2。
2.3 流式细胞仪检测各组外周血循环中Th17细胞的表达水平
2.3.1 流式细胞仪检测的设阈及各组流式细胞染色分析:经PMA与离子霉素体外短暂刺激后,分别检测研究组与对照组外周血中Th17细胞亚群(IL-17A+IFN-γ-CD4+)、Th1细胞亚群(IL-17A-IFN-γ+CD4+)和双阳性T细胞亚群(IL-17A+IFN-γ+CD4+)的百分率。流式细胞仪检测的具体设阈方法及各组流式细胞染色结果见图1。
2.3.2 研究组与对照组外周血中CD4+T细胞的构成比较:Th1细胞亚群所占比例最高,平均浓度均超过20%,各组间比例差异无统计学意义(P>0.05)。Th17细胞亚群所占比例为1%~5%,随宫颈病变的严重程度加重呈逐渐增加的趋势,宫颈癌组比例最高,差异有统计学意义(P<0.05)。而双阳性CD4+T细胞亚群在各组所占比例均较小,为1%~2%,各组间比例相差不大(P>0.05)。见图2。
2.3.3 研究组与对照组外周血中Th17细胞的表达水平比较:患者外周血Th17细胞所占CD4+T细胞比例各组间表达率差异有统计学意义(P<0.05),随宫颈病变程度加重而有逐渐增加的趋势,宫颈癌组最高,对照组最低。Th17细胞表达率在CIN 3组(3.582%±0.600%)>CIN 2组(2.452%±0.456%)>CIN 1组(1.355%±0.239%),差异均有统计学意义(均P<0.05)。见图3。
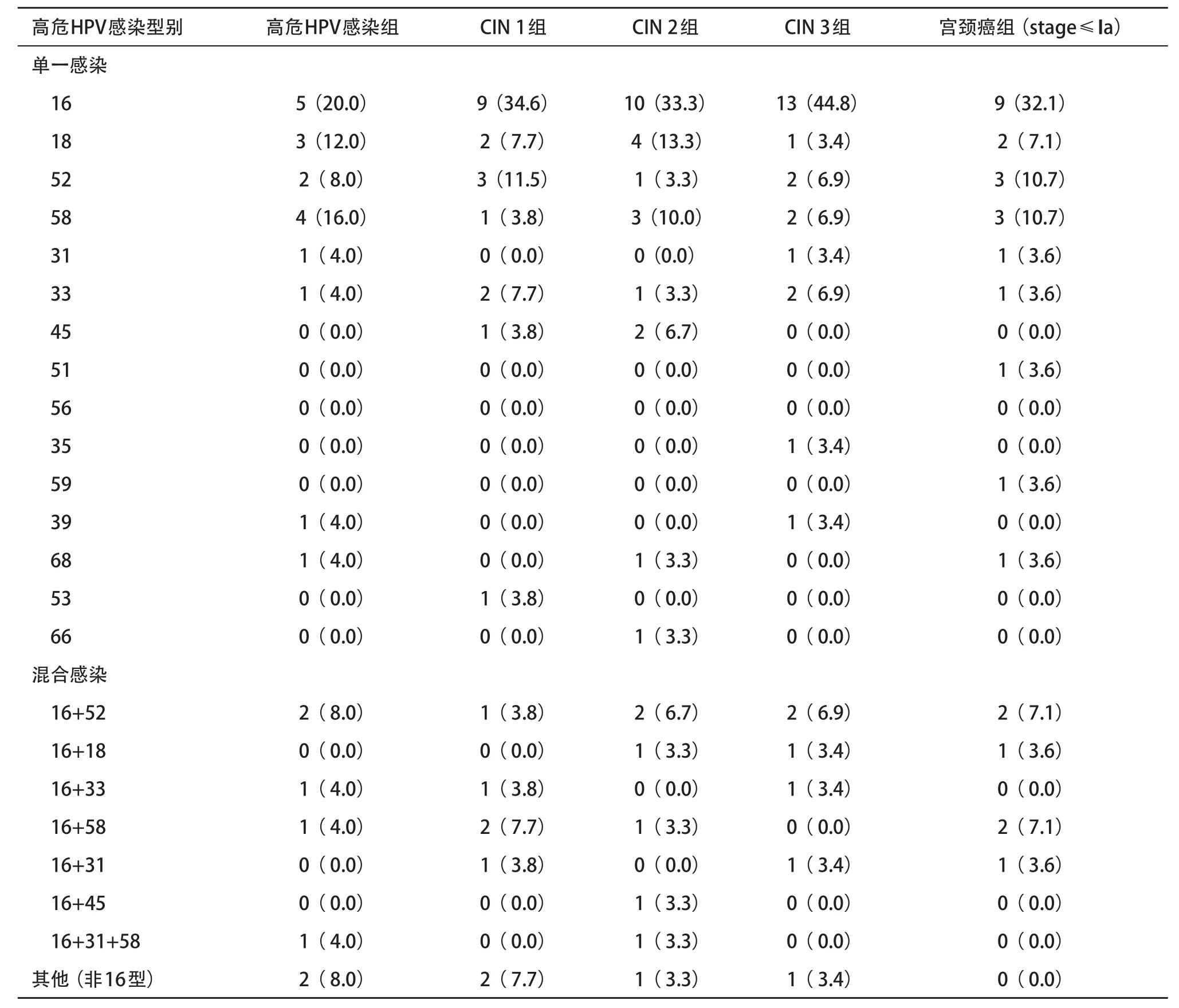
表2 各研究组宫颈高危HPV感染型别分布[ n(%)]
2.4 研究组与对照组外周血清中IL-17水平的比较
各组外周血清中IL-17表达水平随宫颈病变程度加重而有逐渐增加的趋势,差异有统计学意义(P<0.05),但组间两两比较,差异无统计学意义(P>0.05),见图4。
3 讨论
辅助性T细胞(helper T cell,Th细胞)是表达CD4分子、具有辅助功能的T细胞,是机体适应性免疫应答的主要参与者,在免疫调节中发挥关键作用。Th17亚群是一类新的Th细胞亚群,分泌以IL-17为主的细胞因子[4-5]。
近年来大量研究结果表明,Th17细胞在各种感染性疾病、肿瘤、自身免疫性疾病的发生和发展中起重要作用[6-11]。其中,关于病毒感染性疾病的研究发现,Th17细胞均存在高表达,且IL-17作为主要效应因子,参与整个免疫应答及病理生理过程[12-14]。在一项研究中,学者们发现Th17细胞及其所产生的IL-17参与了流感病毒感染引起胃肠道症状的过程[15]。流感病毒PR8感染可引起小肠Th17细胞的表达上升,并分泌IL-17引起小肠的损伤导致腹泻等症状,中和IL-17后可减少小肠的损伤。由此可见,宿主和病毒之间通过Th17细胞和IL-17介导的特异性免疫反应,最终导致了病理性免疫反应和机体损伤,而反过来通过中和IL-17的活性可阻断上述免疫反应的发生,有效控制疾病进展,而这种特殊的作用机制可能也参与了HPV感染的过程。
本研究采用流式细胞术检测各研究组与对照组外周血中Th17细胞的表达水平,结果显示,Th17细胞亚群所占CD4+T细胞比例随宫颈病变的进展有逐渐增加的变化趋势,研究组高于对照组,在宫颈癌组患者中比例最高,且各组间Th17细胞表达率的差异有统计学意义(P<0.05)。进一步两两比较结果提示,外周血Th17细胞表达率在CIN 3组>CIN 2组>CIN 1组,差异有统计学意义(P<0.05),但CIN 1组与高危HPV感染组,CIN 3组与宫颈癌组间差异无统计学意义(P>0.05),见图3,尚需进一步增加样本量及采用合适体外刺激培养方式扩大该组外周血清中Th17的变化差异。可见,随着高危HPV感染引起宫颈疾病的进展,Th17细胞的病理性免疫应答增强。
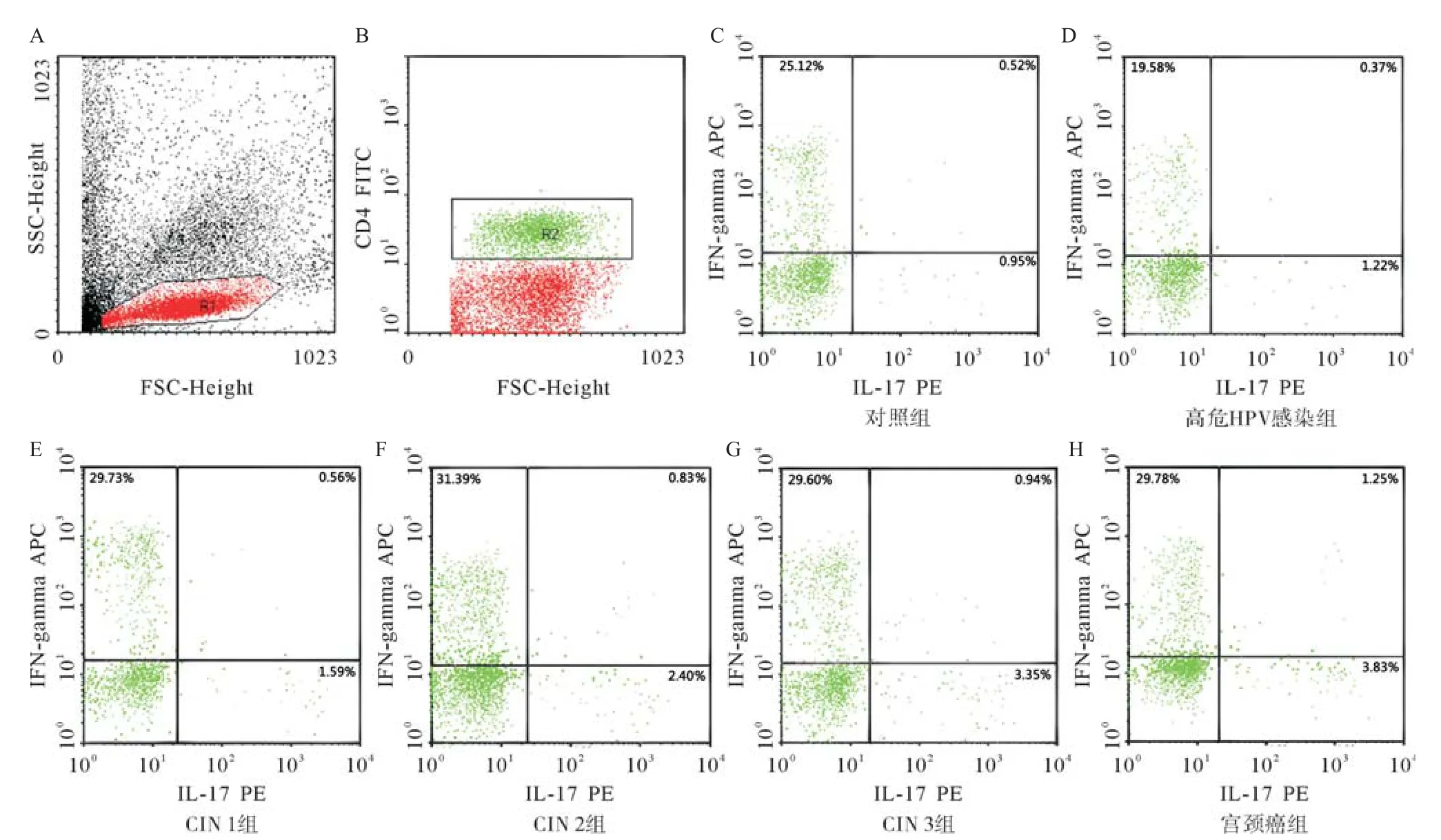
图1 流式细胞术检测对照组和研究组外周血循环中Th17细胞(CD4+IL-17A+IFN-γ-)、Th1细胞(CD4+IL-17A-IFN-γ+)及双阳性细胞(CD4+IL-17A+IFN-γ+)比例
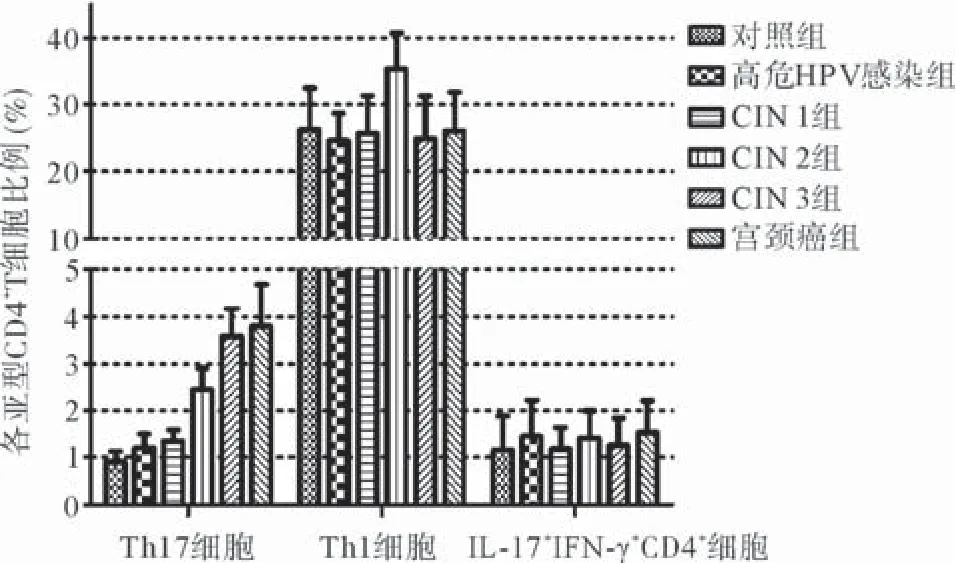
图2 研究组与对照组外周血中CD4+T细胞的构成比
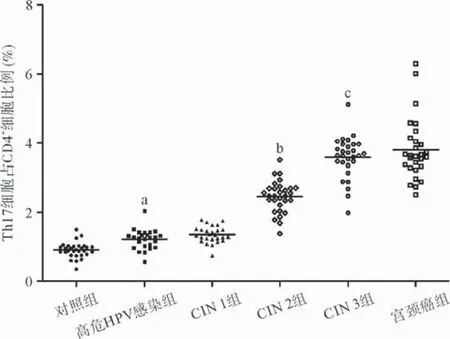
图3 研究组与对照组外周血中Th17细胞(IL-17A+IFN-γ-CD4+)所占CD4+T细胞比例比较
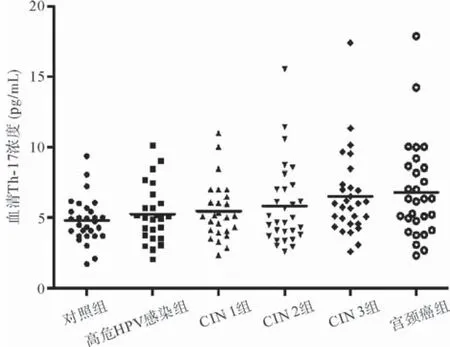
图4 研究组与对照组外周血清中IL-17水平比较
本研究同时采用ELISA法检测了各组外周血清中IL-17的表达水平,结果显示,随宫颈疾病的进展,各组外周血清中IL-17的表达水平有逐渐升高的变化趋势,宫颈癌组表达水平最高,差异有统计学意义(P<0.05),但两两比较结果提示,各组间差异无统计学意义(P>0.05),尚需进一步增加样本量及采用合适体外刺激培养方式扩大外周血清中IL-17的变化差异。由此提示,外周血清中IL-17的表达水平与外周血中Th17细胞的变化趋势基本一致,进一步证实了高危型HPV的感染能激活Th17细胞及IL-17的免疫应答过程,且与宫颈疾病的发生、发展进程相关。
高危型HPV的感染能够激活Th17细胞及其主要效应因子IL-17所介导的细胞免疫应答,从而引起病理反应并与宫颈疾病的发生、发展密切相关,可为进一步研究宫颈高危型HPV感染的免疫治疗措施提供新的理论依据。
[1] FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-386.
[2] SCHIFFMAN M, CASTLE P E, JERONIMO J, et al. Human papillomavirus and cervical cancer[J]. Lancet, 2007, 370(9590): 890-907.
[3] STEENBERGEN R D, SNIJDERS P J, HEIDEMAN D A, et al. Clinical implications of (epi) genetic changes in HPV-induced cervical precancerous lesions[J]. Nat Rev Cancer, 2014, 14(6): 395-405.
[4] HARRINGTON L E, HATTON R D, MANGAN P R, et al. Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J]. Nat Immunol, 2005, 6(11): 1123-1132.
[5] PARK H, LI Z, YANG X O, et al. A distinct lineage of CD4 T cells regulates tissue infl ammation by producing interleukin 17[J]. Nat Immunol, 2005, 6(11): 1133-1141.
[6] WHIBLEY N, GAFFEN S L. Brothers in arms: Th17 and
Treg responses in Candida albicans immunity[J]. PLoS Pathog, 2014, 10(12): e1004456.
[7] JHA R, SRIVASTAVA P, SALHAN S, et al. Spontaneous secretion of interleukin-17 and-22 by human cervical cells in Chlamydia trachomatis infection[J]. Microbes Infect, 2011, 13(2): 167-178.
[8] RATHORE J S, WANG Y. Protective role of Th17 cells in pulmonary infection[J]. Vaccine, 2016, 34(13): 1504-1514.
[9] FIALOVA A, PARTLOVA S, SOJKA L, et al. Dynamics of T-cell infiltration during the course of ovarian cancer: the gradual shift from a Th17 effector cell response to a predominant infi ltration by regulatory T-cells[J]. Int J Cancer, 2013, 132(5): 1070-1079.
[10] YOSHIDA N, KINUGASA T, MIYOSHI H, et al. A high RORyT/CD3 ratio is a strong prognostic factor for postoperative survival in advanced colorectal cancer: analysis of helper T cell lymphocytes (Th1, Th2, Th17 and regulatory T cells)[J]. Ann Surg Oncol, 2016, 23(3): 919-927.
[11] MIN H K, KIM S M, BAEK S Y, et al. Anthocyanin extracted from black soybean seed coats prevents autoimmune arthritis by suppressing the development of Th17 cells and synthesis of proinflammatory cytokines by such cells, via inhibition of NF-κB[J]. PLoS One, 2015, 10(11): e0138201.
[12] YANG W, DING X, DENG J, et al. Interferon-gamma negatively regulates Th17-mediated immunopathology during mouse hepatitis virus infection[J]. J Mol Med (Berl), 2011, 89(4): 399-409.
[13] CHANG Q, WANG Y K, ZHAO Q, et al. Th17 cells are increased with severity of liver infl ammation in patients with chronic hepatitis C[J]. J Gastroenterol Hepatol, 2012, 27(2): 273-278.
[14] SURYAWANSHI A, VEIGA-PARGA T, RAJASAGI N K, et al. Role of IL-17 and Th17 cells in herpes simplex virusinduced corneal immunopathology[J]. J Immunol, 2011, 187 (4): 1919-1930.
[15] WANG J, LI F, WEI H, et al. Respiratory infl uenza virus infection induces intestinal immune injury via microbiotamediated Th17 cell-dependent infl ammation[J]. J Exp Med, 2014, 211(12): 2397-2410.
(本文编辑:吴彬)
The immune response of Th17 cells in the cervical diseases with high-risk human papillomavirus infec-tion
XUE Jisen1, ZHU Hua1, ZHANG Shenghui2, LYU Jieqiang3, HU Yan1.
1.Department of Gynecology, the First Affi liated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Hematology, the First Affi liated Hospital of Wenzhou Medical University, Wenzhou, 325015; 3.Department of Gynecology, the Second Affi liated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective:To study the role of cellular immunity in patients of cervical cancer with high-risk human papillomavirus (HPV) infection mediated by Th17 cells and IL-17.Methods:The study groups included 28 cervical cancer patients, 29 CIN3 patients, 30 CIN2 patients, 26 CIN1 patients, 25 high-risk HPV infected healthy women and 30 patients with HPV negative. The percentage of Th17 cells in the peripheral blood was detected by fl ow cytometry. The concentration of IL-17 in serum was examined by ELISA.Results:During the disease progression of cervical lesions, the proportion of Th17 cells in the total CD4+cells showed a gradually increased tendency compared with the controls. The proportions differed signifi cantly among the study groups and the control group (P<0.05). During the disease progression of cervical lesions, levels of IL-17 in serum showed a gradually increased tendency and differed signifi cantly among all groups (P<0.05), but comparisons between any two groups were no signifi cant difference (P>0.05).Conclusion:This study indicates that the cellular immunoreaction mediated by Th17 cells and IL-17 may be related to the infection of high-risk HPV, which contributes to the disease progression of its associated cervical diseases.
Th17 cells; interleukin-17; uterine cervical diseases; human papillomavirus; T-cell immunity
R737.33
A
10.3969/j.issn.2095-9400.2017.07.008
2016-10-29
浙江省卫生厅科研基金资助项目(2011KYA107)。
薛纪森(1987-),男,浙江苍南人,住院医师,硕士。
胡燕,主任医师,Email:309200685@qq.com。
