青娥丸对去卵巢大鼠骨质疏松骨微循环的作用机制研究
2017-07-18王晓燕常时新李冠武何静王乐宋彦颖缪宇
王晓燕 常时新 李冠武 何静 王乐 宋彦颖 缪宇
青娥丸对去卵巢大鼠骨质疏松骨微循环的作用机制研究
王晓燕 常时新 李冠武 何静 王乐 宋彦颖 缪宇
目的 通过观察青娥丸对卵巢切除骨质疏松大鼠骨髓灌注及血管内皮生长因子的影响,探讨经典方剂青娥丸对绝经后骨质疏松骨微循环的作用机制。 方法 将6月龄SD雌性大鼠60只随机分为4组,即假手术组(SHAM组)、去势对照组(OVX组)、青娥丸组(QEW组)和雌激素组(E2组)。建模8周后,分别进行药物干预3个月,检测各组大鼠股骨远端、中端、近端的骨髓灌注参数以及血管内皮标志物血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1,CD31)、血管内皮生长因子(vascular endothelium growth factor,VEGF)表达情况。 结果 骨髓灌注参数:(1)股骨远端:治疗后OVX组容积转移常量(Ktrans)、速率常数(Kep)、渗漏空间(Ve)水平较治疗前均有明显降低(P<0.01),E2组和QEW组Ktrans、Kep、Ve水平较治疗前均有明显增加(P<0.05);与OVX组比较,治疗后E2组和QEW组Ktrans、Kep、Ve水平均显著增加(P<0.01);而QEW组Ktrans水平显著低于E2组(P<0.01)、两组Kep、Ve水平无明显统计学差异。(2)股骨中端:治疗后,OVX组Ktrans(P<0.01)及Ve(P<0.05)水平较治疗前显著降低,E2组Ktrans、Kep及Ve水平均明显增加(P<0.05);与OVX组比较,E2组Ktrans、Kep(P<0.05)及Ve(P<0.01)水平均显著增加,QWE组Ktrans(P<0.05)、Ve(P<0.01)水平显著增加。(3)股骨近端:E2组Ktrans(P<0.01)及Ve(P<0.05)水平较OVX组均显著增加,而QEW组Ktrans水平无明显差异。血管内皮标志物CD31、VEGF表达情况:E2组和QEW组CD31及VEGF蛋白表达及相对表达量较OVX组均显著上调(P<0.05、P<0.01)。结论 青娥丸治疗绝经后大鼠骨质疏松症,可能与提高骨髓灌注、改善骨髓微循环等作用机制相关。
绝经后骨质疏松症; 青娥丸; 骨髓灌注; 骨髓微循环
骨质疏松症(osteoporosis,OP)是以骨量降低和骨结构退化为特点,导致骨脆性和骨折风险增加的一种全身性骨骼疾病[1],往往易引起脊柱骨和髋骨骨折。骨质疏松性骨折的患病率和发病率持续增加,已成为许多国家的国民健康问题,原发性骨质疏松症主要发生在老年人群中,中老年女性最为常见,尤其是绝经后妇女[2],导致骨质疏松症的经济负担加重[3]。
目前,临床许多药物均可用于对骨质疏松症的治疗,特定化合物的使用选择应该通过疗效和安全性作为指导,新的和潜在的非常有效的药物目前正在研发,可能会提供新颖的治疗手段。中医药治疗本病具有多靶点、不良反应少等优势,是相对较安全的治疗途径。青娥丸是补肾生髓治疗骨质疏松的古代经典方剂,相关临床研究发现[4],青娥丸能够改善绝经后骨质疏松的临床症状。为进一步明确其作用机制,本研究拟通过卵巢切除术建立绝经后骨质疏松模型,通过观察药物对骨髓灌注和血管内皮标志物的研究,探析青娥丸对骨髓微循环的影响,为中医药治疗绝经后骨质疏松症提供新的理论支持。
1 材料与方法
1.1 实验动物
清洁级雌性SD大鼠60只,体重(350±15) g,购置于上海斯莱克实验动物有限公司,饲养于上海中医药大学附属岳阳中西医结合医院动物实验中心,合格证号:SYXK(沪)2006-0001。饲养观察室温度:(21±2)℃,相对湿度:45%~55%,给予标准光照周期。
1.2 实验药品
青娥丸由杜仲(盐炒)480 g、补骨脂(盐炒)240 g、核桃仁(炒)150 g、大蒜120 g制成大蜜丸(9 g/丸),购自上海雷允上封浜制药有限公司,批号:Z31020467;针剂β-雌二醇(β-Estradiol,≥98%),购自 Sigma公司,批号:E8875。
1.3 主要试剂与仪器
EDTA(pH 9.0) 抗原修复液(武汉谷歌生物科技有限公司,G1203)、BSA(Solarbio,A8020)、正常兔血清(Boster,AR1010)、二抗:HRP-山羊抗兔二抗(谷歌生物,GB23303)、一抗(VEGF)(abcam,ab1316)、二抗:HRP-山羊抗小鼠二抗(谷歌生物,GB23301)、一抗(CD31)(谷歌生物,GB13063)、二抗:HRP-兔抗山羊二抗(谷歌生物,GB23204)、组化试剂盒DAB显色剂(DAKO,K5007)、RIPA组织细胞快速裂解液(上海基尔顿生物,BYL40825)、BCA蛋白定量试剂盒(thermo,PICPI23223)、SYBRGreen PCR试剂盒(Invitrogen)、逆转录试剂盒(Invitrogen)等。
3.0T磁共振仪器(德国西门子股份公司)、3T老鼠线圈(上海辰光医疗科技有限公司)、电泳仪BIO-RAD 公司 (mini protean 3 cell)、电转仪(大连竞迈科技有限公司,PS-9)、酶标仪(芬兰雷勃酶标仪,MK3)、Real-time(检测仪ABI,ABI-7500)、脱水机(武汉俊杰电子有限公司,JJ-12J)、正置荧光显微镜(日本尼康,NIKON ECLIPSE TI-SR)、成像系统(日本尼康,NIKON DS-U3)、酶标仪(THERMO SCIENTIFIC MULTISKAN SPECTRUM)等。
1.4 分组及造模
将60只SD雌性大鼠按照随机数字法分为4组,即假手术组(SHAM组),去势(摘除卵巢)对照组(OVX组)、青娥丸组(QEW)、雌激素组(E2),每组15只。因实验过程中各组均有死亡,故每组均取8只。
采用卵巢切除术建立绝经后骨质疏松模型:实验动物适应环境1周后,采用戊巴比妥钠(30 mg/kg)腹腔注射麻醉,将动物仰卧位固定于手术台上,电动剃毛,手术区域皮肤消毒,保持无菌操作。正中部位打开腹腔,输卵管远端用血管钳固定、结扎,将子宫阔韧带分离,摘除双侧卵巢,将小肠等腹腔器官组织复位,关闭腹腔,并对手术切口进行缝合。假手术组仅切除卵巢周围等量脂肪组织即可[5]。
术后即刻肌注青霉素(40万U/kg),连续5天,每天2次,预防伤口感染。标准鼠笼分笼饲养,自由进食、进水。所有实验鼠术前及术后均称体重。术后密切观察,注意伤口感染征象。
1.5 给药方法
建模8周后,各组分别进行药物干预。青娥丸组:青娥丸按照9 g/kg临床剂量,根据动物间体表面积折算的等效剂量换算,予0.84 g/500 g,每天灌胃2次;雌激素组:予β-雌二醇0.2 mL/kg药物干预;正常组、假手术组及OVX对照组分别给予等量去离子水。根据每周体重调整药物剂量,共给药12周。
1.6 检测指标
动物处死前第14天和第13天腹腔注射盐酸四环素,处死前第4天、第3天腹腔注射钙黄绿素,进行骨荧光双标记。药物干预结束后,于次日腹主动脉取血后处死所有动物,剥离胫骨及腰椎,-80℃冰箱储存备用。
1.6.1 药代动力学两室模型DCE-MRI成像检测 使用3.0T临床全身扫描仪,专用大鼠线圈作为射频信号接收器。分别于基线(0周)、治疗前、治疗后对各组实验大鼠行股骨3.0T DCE-MRI扫描,对比剂为钆喷酸葡胺(gadopentetate dimeglumine,Gd-DTPA),剂量0.1 mL/500 g,尾静脉注射,速率1 mL/s,注射后常规1 mL生理盐水冲管。
扫描结束后,将数据依次导入系统自带的MR图像专用后处理工作站(版本号:syngo MR B17_43.1_1.0)[2],以盲法对DCE-MRI图像进行后处理:基于改进的“两室药物代谢动力学模型”,从采集到的动态组图像建立病灶区感兴趣区内的平均信号强度-时间曲线,建立动脉输入函数,采用非线性最小二乘拟合法对该曲线进行拟合,计算定量功能灌注参数[3],包括:(1)容积转移常量(Ktrans):对比剂在血管内向血管外间隙渗透的速率,单位为min-1;(2)速率常数(kep):血管外细胞外间隙的对比剂向血管内反渗透的参数,单位为min-1;(3)血管外细胞外容积比,即渗漏空间(Ve):成像区域的血管外间隙容量比例。且Ktrans、kep、Ve三者满足如下关系:kep =Ktrans/Ve。
1.6.2 免疫组化检测骨组织VEGF、CD31表达情况 石蜡切片脱蜡脱水后,将组织切片置于盛满EDTA抗原修复缓冲液(PH9.0)的修复盒中于微波炉内进行抗原修复,低火10 分钟,切片放入3%过氧化氢溶液,室温避光孵育25 分钟,阻断内源性过氧化物酶,用3%BSA室温封闭30分钟,加一抗湿盒内4°C孵育过夜,加与一抗相应种属的二抗(HRP标记)覆盖组织,室温孵育50分钟,DAB显色,Harris苏木素复染细胞核3分钟左右,1%的盐酸酒精分化数秒,自来水冲洗,氨水返蓝,流水冲洗,脱水封片,显微镜镜检,图像采集分析。
结果判读及形态计量学分析:显微镜下细胞胞浆着色呈棕黄色为阳性反应。随机挑选5个高倍视野(400×)进行细胞计数,后将每个镜下视野内胞浆着色呈棕黄色的阳性细胞计数,计算阳性细胞数占所测视野内细胞总数的百分比,以此作为阳性反应细胞的密度[6]。
1.6.3 免疫印迹法检测骨组织CD31、VEGF表达情况 将组织在液氮中迅速研磨成粉末,转移到含有蛋白酶和磷酸酶抑制剂的裂解液的离心管,4℃,12000 rpm,离心15分钟,取上清,进行蛋白质定量,配置BCA工作液(试剂A∶试剂B=50∶1),测定吸光度(562 nm),绘制标准曲线,制备PAGE胶,上样,电泳,膜上蛋白检测,膜封闭及抗体孵育,显色。

数据采用仪器自带软件ABI Prism 7300 SDS Software进行分析,将得到的Ct导出,利用2-△△Ct法[7],以GAPDH为内参,进行各样本基因表达的相对定量分析。
1.7 统计学处理
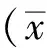
2 结果
2.1 治疗前后骨髓灌注参数比较
股骨远端:Ktrans水平:治疗后OVX组较治疗前明显降低(P<0.01),E2组和QEW组较治疗前均有明显增加(P<0.05);与OVX组比较,治疗后E2组和QEW组均显著增加(P<0.01);而治疗后,QEW组Ktrans水平低于E2组,且具有统计学差异(P<0.01)。Kep水平:治疗后OVX组较治疗前明显降低(P<0.01),E2组较治疗前显著增加(P<0.01),QEW组较治疗前也有明显增加(P<0.05);与OVX组比较,治疗后E2组和QEW组均显著增加(P<0.01),而E2组和QEW组无明显统计学差异。Ve水平:治疗后OVX组较治疗前明显降低(P<0.01),E2组和QEW组较治疗前均有明显增加(P<0.05);与OVX组比较,治疗后E2组和QEW组均显著增加(P<0.05),而E2组和QEW组无明显统计学差异。
股骨中端:Ktrans水平:治疗后OVX组较治疗前明显降低(P<0.01),E2组较治疗前明显增加(P<0.05);与OVX组比较,E2组显著增加(P<0.01),QWE组也明显增加(P<0.05)。Kep水平:治疗后E2组较治疗前显著增加(P<0.05);与OVX组比较,E2组显著增加(P<0.05)。Ve水平:治疗后OVX组较治疗前明显降低(P<0.05),E2组较治疗前显著增加(P<0.01),QWE组也明显增加(P<0.05);与OVX组比较,E2组显著增加(P<0.01),QEW组也显著增加(P<0.01);治疗后,QEW组Ve水平低于E2组,且具有统计学差异(P<0.01)。
股骨近端:Ktrans水平:E2组较OVX组显著增加(P<0.01),而QEW组Ktrans水平无明显差异;E2组治疗后Ve水平较治疗前显著增加(P<0.05)。具体结果见表1、图1。
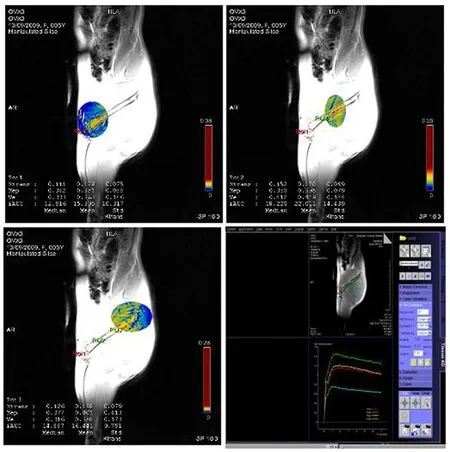
图1 DCE-MRI骨髓灌注后处理图像

表1 治疗前后各组实验鼠骨髓灌注参数变化±s,n=8)
注: 组内比较,aP<0.05,bP<0.01;与OVX组比较,cP<0.05,dP<0.01;与雌激素组比较,eP<0.05,fP<0.01。
2.2 免疫组化验证骨组织中CD31、VEGF蛋白表达情况
采用Qwin V3图像分析系统进行计数。结果显示: CD31蛋白和VEGF蛋白在各组实验鼠中均有表达。(1)与SHAM组比较,OVX组大鼠胫骨CD31蛋白阳性表达密度显著降低(P<0.01),而E2组CD31蛋白阳性表达密度明显降低(P<0.05),QEW组CD31阳性表达密度有所降低,但并无统计学差异;OVX组大鼠胫骨VEGF蛋白阳性表达密度显著降低(P<0.01),QEW组CD31阳性表达密度有所降低,但并无统计学差异。(2)与OVX组比较,E2组和QEW组CD31蛋白阳性表达密度显著增高(P<0.01),QEW组VEGF蛋白阳性表达密度显著增高(P<0.01),而E2组无明显变化。结果见表2、图2~3。
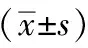
表2 各组大鼠骨组织CD31、VEGF蛋白表达阳性密度
注: 与SHAM组比较,aP<0.05;与OVX组比较,bP<0.01。

注:A.SHAM组;B.OVX组;C.青娥丸组;D.雌激素组
图2 骨组织CD31蛋白表达情况(×400)
2.3 免疫印迹测定骨组织中CD31、VEGF表达情况
CD31:与SHAM组比较,OVX组CD31蛋白表达下调(P<0.05);与OVX组比较,E2组和QEW组均使CD31蛋白表达上调(P<0.05),而E2组和QEW组无明显统计学差异。

注:A.SHAM组;B.OVX组;C.青娥丸组;D.雌激素组
图3 骨组织VEGF蛋白表达情况(×400)
VEGF:与SHAM组比较,OVX组VEGF蛋白表达下调(P<0.05);与OVX组比较,E2组VEGF蛋白表达上调(P<0.05),QEW组VEGF蛋白表达亦上调(P<0.01),而E2组和QEW组无明显统计学差异。结果见表3、图4。
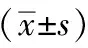
表3 各组大鼠骨组织中CD31、VEGF表达水平
注: 与SHAM组比较,aP<0.05;与OVX组比较,bP<0.05,cP<0.01。

图4 骨组织中CD31、VEGF表达情况
2.4 实时荧光定量PCR测定骨组织中CD31、VEGF表达情况
CD31:与SHAM组比较,OVX组CD31相对表达量下调(P<0.05);与OVX组比较,E2组和QEW组均显著上调CD31相对表达量(P<0.01),且E2组和QEW组无明显统计学差异。
VEGF:与SHAM组比较,OVX组VEGF相对表达量显著下降(P<0.05);与OVX组比较,E2组VEGF相对表达量上调(P<0.05),QEW组VEGF相对表达量显著上调(P<0.01),且E2组和QEW组无明显统计学差异。
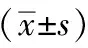
表4 各组大鼠骨组织中CD31、VEGF表达水平
注: 与SHAM组比较,aP<0.05;与OVX组比较,bP<0.05,cP<0.01。
3 讨论
本研究采用的是用于分析灌注过程最常用的药代动力学模型改良后的Tofts模型,Ktrans表示容量转移常数,Ve表示血管外细胞外间隙容积比,通过DCE-MRI药代动力学研究骨髓灌注和骨密度之间的关系,发现随着骨矿物质含量的丢失,血管壁的性质以及骨髓内容物也可能不同,由此产生的血流灌注变化反过来也可能影响骨骼的营养供给[8]。Kep表示速率常数,在骨质疏松大鼠的股骨和腰椎,其下降最为显著,在组织形态学中也可观察到稀疏和成熟的血管,尤其是在骨盆,血管密度显著降低,成熟血管显著增加。由于毛细血管稀疏和成熟,骨质疏松大鼠骨髓微循环发生改变[9]。以上结果提示,在绝经后骨质疏松发生发展过程中,青娥丸对股骨远端及中端骨髓灌注参数作用较为明显,其作用机制可能与骨髓微血管生成有关。
骨本身具有发达的血管网络,骨微血管在骨的形成、发展、修复和重建过程中起着重要的作用[10]。血管生成先于新骨形成,新骨形成与骨微血管的改变是成比例的。骨量的减少总是与骨微血管在骨髓腔中的低灌注伴随发生,这些现象表明,微循环障碍与骨形成能力下降密切相关[11-14]。在骨再生疗法血管生成过程中,CD31和VEGF均起到一定的协调作用[14]。
综上,青娥丸对去势大鼠具有治疗作用,其作用机制可能与通过提高骨髓灌注及改善骨髓微循环有关。
[1] Li GW, Tang GY, Liu Y, et al.MR spectroscopy and micro-CT in evaluation of osteoporosis model in rabbits: comparison withhistopathology[J]. Eur Radiol,2012(22):923-929.
[2] 龚健,李冠武,汤光宇,等.激素性骨质疏松模型兔骨髓脂肪分数及脂肪细胞时序性变化[J].中国骨质疏松杂志,2014,20(1):38-48.
[3] 邓振生,张娜,孟莉,等.利用T1加权DCE-MRI技术对脑胶质瘤分级[J].中国生物医学工程学报,2010,29(1):16-21.
[4] 夏雪,马陈,沈霖,等.古方青娥丸治疗绝经后骨质疏松症的临床疗效观察[J].中国中医骨伤科杂志,2016,24(7):20-22.
[5] 李冠武,常时新,秦玲娣,等.绝经后骨质疏松模型兔骨髓脂肪酸成分变化规律[J].临床放射学杂志,2014,33(3):451-455.
[6] 王斯晟,桂斌捷,周健,等.MMP-13在早期股骨头坏死滑膜中的表达[J].安徽医科大学学报,2014,49(4):502-505.
[7] 崔勇,陈静,王君玉,等.AKT2基因短发夹结构RNA慢病毒载体的构建及鉴定[J].现代生物医学进展,2011,11(8):1413-1416.
[8] Yang N, Wang G, Hu C, et al. Tumor necrosis factor α suppresses the mesenchymal stem cell osteogenesis promoter miR-21 in estrogen deficiency-inducedosteoporosis[J]. J Bone Miner Res,2013,28(3):559-573.
[9] Huang Q, Gao B, Jie Q, et al.Ginsenoside-Rb2 displays anti-osteoporosis effects through reducing oxidative damage and bone-resorbing cytokines during osteogenesis[J].Bone,2014, 66:306.
[10] 房梅霞.姜黄素对去卵巢大鼠骨丢失的影响[D].石家庄:河北医科大学,2014.
[11] Biffar A, Schmidt GP, Sourbron S, et al. Quantitative analysis of vertebral bone marrow perfusion using dynamic contrast-enhanced MRI: initial results in patients with osteoporotic acute vertebralfracture[J]. Magn Reson Imaging, 2011,33(3):676-683.
[12] Sojo K, Sawaki Y, Hattori H, et al. Immunohistochemical study of vascular endothelial growth factor(VEGF) and bone morphogenetic protein-2,-4 (BMP-2,-4) on lengthened rat femurs[J]. Craniomaxillofac Surg,2005,33(4):238-245.
[13] Ding WG, Wei ZX,Liu JB. Reduced local blood supply to the tibial metaphysis is associated with ovariectomy-induced osteoporosis in mice[J]. Connect Tissue Res, 2011,52(1):25-29.
[14] Inglis S, Christensen D, Wilson DI, et al. Human endothelial and foetal femur-derived stem cell co-cultures modulate osteogenesis andangiogenesis[J]. Stem Cell Res Ther,2016,7(1):13.
(本文编辑: 韩虹娟)
Effect and mechanism ofQing’Eformula on bone microcirculation of osteoporosis rats induced by ovariectomy
WANGXiaoyan,CHANGShixin,LIGuanwu,etal.
Guang’anmenHospital,ChinaAcademyofChineseMedicineSciences,Beijing100053,China
CHANGShixin,E-mail:shixinchang@126.com
Objective To observe the effects ofQing’Eformula on bone marrow perfusion and vascular endothelial grouth factor in Postmenopausal Osteoporosis(PMOP) rats induced by oophorectomy, explore the possible mechanism of classical prescriptionQing’Eformula on bone microcirculation. Methods Sixty female SD rats of 6 month-old infants were randomly divided into SHAM group, OVX group,Qing’Eformula group and E2group, PMOP model was established by oophorectomy, 8 weeks after modeling, rats were medicated once a day for 3 months. Detect the bone marrow perfusion parameters of distal femur, mid femur and proximal femur, as well as vascular endothelial marker expression. Results Bone marrow perfusion parameters: (1) Distal femur: The level of Ktrans, Kep, Ve in OVX group were significantly decreased while those were increased in E2group and QEW group after treatment, and significantly higher than OVX group. The level of Ktrans in QEW group were significantly lower than E2group, the level of Kep and Ve have no significant difference. (2) Mid femur: the level of Ktrans and Ve in OVX group were significantly decreased. The level of Ktrans, Kep and Ve in E2group were significantly increased and Ktrans and Ve increased in QEW group were significantly higher than OVX group. (3) Proximal femur: the level of Ktrans and Ve in E2group were significantly higher than OVX group, but no significant differences between two groups. Vascular endothelial marker CD31, VEGF expression: the protein expression and relative expression of CD31 and VEGF in E2group and QEW group were significantly increased compared with OVX group. ConclusionQing’Eformula can treat PMOP, which may be associated with increasing bone marrow perfusion and improving bone marrow microcirculation.
Postmenopausal osteoporosis;Qing’Eformula; Bone marrow perfusion; Bone marrow microcirculation
国家自然科学基金面上项目(81373856)
100053 北京,中国中医科学院广安门医院肿瘤科(王晓燕);上海中医药大学附属岳阳中西医结合医院放射科(常时新、李冠武、何静、王乐、宋彦颖、缪宇)
王晓燕(1986- ),女,博士,住院医师。研究方向:中医肿瘤。E-mail:xiaoyansh2010@126.com
常时新(1966- ),博士,主任医师,博士生导师。研究方向:中西医结合治疗老年病。E-mail:shixinchang@126.com
R285.5
A
10.3969/j.issn.1674-1749.2017.07.006
2016-10-13)
