玻璃扯旗鱼性别特征及其幼鱼性别分化的组织学初探
2017-07-18彭亚杨青邓植文董思远刘志伟
彭亚,杨青,邓植文,董思远,刘志伟*
(1.湖南农业大学动物医学院,湖南 长沙 410128;2.上海海洋大学水产与生命学院,上海 201306)
玻璃扯旗鱼性别特征及其幼鱼性别分化的组织学初探
彭亚1,2,杨青1,邓植文2,董思远2,刘志伟2*
(1.湖南农业大学动物医学院,湖南 长沙 410128;2.上海海洋大学水产与生命学院,上海 201306)
应用形态学、解剖学及组织学方法对玻璃扯旗鱼的性别特征及其幼鱼性别分化基本过程进行研究。结果显示:在6月龄玻璃扯旗雌鱼卵巢中能观察到各时相的卵母细胞,在雄鱼精小管管腔内有大量精子;4月龄以上玻璃扯旗雌鱼的腹部隆起,并有淡黄色颗粒状组织,而雄鱼无类似结构;100日龄以上雌鱼的臀鳍有钩状小齿,但2月龄前的幼鱼无该组织。5~50日龄幼鱼性腺发育状态显示:10日龄以下幼鱼的体内无分化明显的生殖腺;15日龄幼鱼体内有生殖包囊,且15日龄之前仅在腹腔一侧可观察到性腺组织,而25日龄幼鱼的腹腔两侧均有对称分布的类卵巢结构;至 30日龄时,部分幼鱼可观察到有棒状精巢,性腺开始分化。本研究中探明了玻璃扯旗鱼性别分化及性腺发育的关键时间节点,该结果可为进一步研究其分子调控机制提供参考。
玻璃扯旗鱼;性腺发育;性别分化;性别特征
目前,鱼类性腺发育及性别分化的研究多集中在性腺周期性变化、化学或物理因素对性腺发育及性别分化的影响以及成鱼性逆转等方面[1-3]。关于鲤科鱼类,如斑马鱼、墨西哥脂鲤、鲤鱼、青海湖裸鲤等的性腺发育研究均已有报道[4-7]。基于对模式动物斑马鱼的研究,人们对生殖干细胞的分化、迁移及其分子调控机制已有了比较深入的了解[8-10]。由于斑马鱼生长超过2周后就变得不透明,这使得性腺发育、性别分化及其分子调控机制等方面的研究开展困难。
黄扯旗鱼(Pristella maxillaris)属脊椎动物门辐鳍亚纲脂鲤目脂鲤科细锯脂鲤属,原产于南美洲亚马逊河下游的巴西和委内瑞拉、圭亚那等地,最早于1908年由EIGENMANN发现并鉴定出来,别名红尾玻璃鱼、细锯脂鲤鱼等。 该鱼体型侧扁,腹部较圆,眼大,尾鳍深叉形,背鳍和臀鳍上各有一块黑色斑点[11]。玻璃扯旗鱼是黄扯旗鱼的白化突变体。
玻璃扯旗鱼通体透明,骨骼和内脏清晰可见,其透明度远高于白化斑马鱼,可在循环水养殖条件下常年稳定繁殖,且产卵周期约为 9 d,世代间隔相差不大,这使得玻璃扯旗鱼在鱼类成体组织、器官发育及致病机制研究中具有显著优势,且其在脊椎动物发育研究中与斑马鱼具有很强的互补性,所以可将其作为一种较理想的模式动物进行活体动物功能分析,如脊椎动物的器官发育及疾病发生机制研究等。
性别分化及鉴定是亲鱼雌雄分养、培育及繁殖的基础。在鱼类的人工养殖工作中,精准判定鱼体的性别极为重要[12]。性腺发育研究是鱼类学和发育生物学相关研究的重要部分,包括幼鱼生殖干细胞的发生、迁移、定位以及后续性腺发育过程、性别分化机制、雌雄鱼体性状差异、性腺退化以及性逆转等[13-16]。
目前,关于玻璃扯旗鱼性别分化及其性腺发育的研究尚少。笔者对玻璃扯旗鱼不同发育时期的体型及臀鳍特征等进行分析,旨在找到鉴定其性别的简易方法,并探明玻璃扯旗鱼性腺发育及性别分化的时间节点。
1 材料与方法
1.1 材料
玻璃扯旗鱼为上海海洋大学神经发育研究室自繁自养;麻醉剂和多聚甲醛购自 Sigma;石蜡和中性树胶购自生工生物工程(上海)股份有限公司;无水乙醇和二甲苯购自国药(上海)集团;苏木精和伊红染色液购自鼎国生物技术有限公司。
1.2 方法
1.2.1 玻璃扯旗鱼的麻醉及性腺组织收集
向系统水中加入适量的0.03% MS222(E10505)麻醉剂,待鱼麻醉后将其沿腹部剪开,置于 4%的多聚甲醛中固定,待其性腺组织固定完全后,在1×PBS中取出性腺。
1.2.2 玻璃扯旗鱼的形态学观察及鱼体性状数据收集
将不同时期的鱼麻醉后,用体式显微镜(Leica,M205FA)对整鱼、性腺和臀鳍进行观察并拍照,测定其体长、体宽、体高及体质量等数据。
1.2.3 苏木素-伊红染色(H.E.染色)
将未成熟幼鱼的整鱼及成鱼性腺组织进行石蜡包埋,参照王晶等[17]和郑伟等[18]建立的方法,稍作修改。将样品用 4%多聚甲醛固定 12~24 h,用1×PBS溶液洗涤3次,经梯度乙醇脱水、二甲苯透明、浸蜡及包埋后,将蜡块组织连续切片(厚度6 μm),用于染色。组织切片经二甲苯脱蜡,梯度乙醇复水,H.E.染色,再脱水、透明,并用中性树胶封片。在显微镜(Olympus,BX53)下对组织切片进行观察并照相,用Photoshop 5.0软件处理图像。
1.2.4 数据分析
所有试验数据用Graphpad Prism 5软件进行统计分析,并用t-检验法进行比较。
2 结果与分析
2.1 玻璃扯旗鱼成熟性腺的特征
肉眼观察结果:玻璃扯旗鱼成体透明,肌肉骨骼清晰可见,可直接观察到其内脏(图1-A,F)。在部分4月龄的雌鱼腹部近尾处可见透明至黄色颗粒状结构,黄色颗粒所占区域随生长时间的推移逐渐增多,至5月龄时雌鱼腹部后上半部基本充满了黄色颗粒状结构,6月龄时雌鱼卵巢完全发育成熟(图1-B)。雄鱼的黄色颗粒状结构部位呈透明状态,至5~6月龄时发育成乳白色的精巢,且肉眼可见(图1-G)。解剖6月龄的成鱼,可获得完整的卵巢和精巢组织(图1-C,H)。雌鱼的卵巢呈椭球形,卵巢周围包裹着卵细胞和透明的脂肪组织,肝脏覆盖卵巢前半部,胆囊位于卵巢双叶中间(结果未显示)。石蜡切片结果显示,卵巢外围为肉眼可见颗粒状卵子,内部为各时相的卵母细胞,包括初级生长期(Ⅰ期)、皮质泡期(Ⅱ期)、卵黄增生期(Ⅲ期)、卵母细胞成熟期(Ⅳ期)以及成熟卵期(Ⅴ期)的卵母细胞(图1-D)。另外,还观察到核仁、放射膜、油滴、卵黄颗粒、卵黄核以及滤泡膜等组织学结构(图 1-E)。雄鱼精巢为长囊形(图1-I),呈乳白色,外围被透明的脂肪组织包被,多为成对出现,头部相连。H.E.染色为深紫色,精小管管腔前端可见初级精母细胞和次级精母细胞,管腔内充满大量精子(图1-J)。
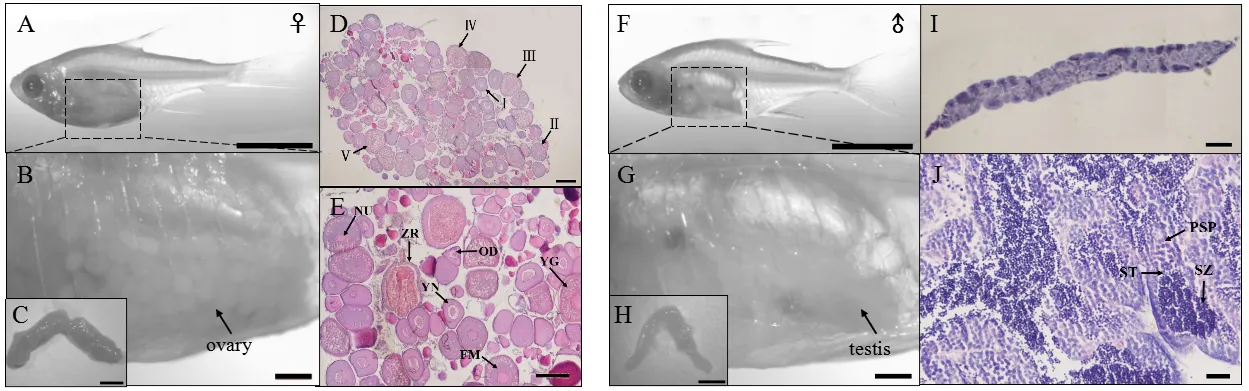
图1 玻璃扯旗鱼的成熟性腺Fig.1 Gonads of adult pristella maxillaries
2.2 不同日龄玻璃扯旗鱼的性别鉴定结果
观察结果(表1)表明:雌性成鱼的体宽明显大于雄鱼的,6月龄雌鱼的体宽、体长比值显著高于雄鱼的,且二者的差异极显著(P<0.01),而二者体高、体长比值间的差异无统计学意义(P>0.05);4月龄时,雌鱼的体高、体长比值显著高于雄鱼的(P<0.05),但二者的体宽、体长比值间差异无统计学意义(P>0.05)。
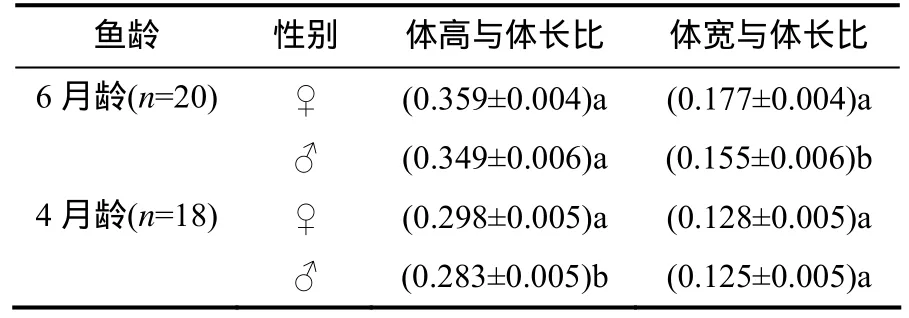
表1 玻璃扯旗鱼雌雄体型的参数比Table 1 Comparison on body parameters between female and male Pristella maxillaris
随机取出6月龄成鱼22条,根据体型进行初步判定,其中 10条为雄鱼, 12条为雌鱼。对这22条鱼进行解剖的结果表明,被初步判定为雄鱼的10条鱼的体内均能取出精巢,而被初步判定为雌鱼的12条中有9条能取出完整卵巢,另外3条鱼的卵巢发生了退化。小于4月龄的玻璃扯旗鱼仅在腹部可观察到透明组织,其体宽、体长及体高等形态特征也无差别,因此无法判断其性别。对 50~110日龄鱼进行解剖的结果显示:110日龄时,24条鱼中的9条有精巢,12条有卵巢,3条不能区分性别;90日龄时,24条鱼中的10条有精巢,13条有卵巢,1条不能区分性别;70日龄时,25条鱼中的8条有精巢,9条有卵巢,8条不能区分性别;50日龄时,20条鱼的性腺分布位置均为透明球状组织,无精巢或卵巢存在,均无法区分性别。
2.3 玻璃扯旗成鱼的性别特征
在显微镜下观察 6月龄玻璃扯旗鱼的臀鳍,发现雄鱼的臀鳍有小齿状结构(图2-A,B,C,D),而雌鱼的臀鳍无小齿状结构(图 2-E,F,G,H)。144条5月龄成鱼中,67条的臀鳍具有小齿,77条无小齿,且能根据该小齿状结构鉴别性别。100日龄的玻璃扯旗鱼难以通过体型辨别雌雄,在显微镜下观察42条鱼的臀鳍,其中14条鱼的臀鳍鳍条小结间有小齿,但数量明显比成年雄鱼的少,同时可观察到钩状小齿的生长过程(图2-C,图3-A,B)。进一步的解剖结果表明,臀鳍有小齿的14条鱼均为雄鱼,通过切片能观察到其典型的精巢组织(图3-C);臀鳍上无小齿的28条鱼均为雌鱼(图3-D,E)。卵巢结构石蜡切片中仅能观察到Ⅰ期至Ⅲ期时相的卵母细胞,未见到Ⅳ期和Ⅴ期时相的卵母细胞,表明100日龄雌鱼的卵巢发育未成熟(图3-F,G)。随机选取22条90日龄鱼、27条70日龄鱼和50日龄鱼进行显微镜观察,发现90日龄只有4条、27日龄仅有1条臀鳍上有类小齿结构(图3-H、I),而50日龄鱼均未观察到有小齿结构(图 3-J、K),表明这一特征只适用于鉴定100日龄之后玻璃扯旗鱼的性别。

图2 玻璃扯旗成鱼的性别特征Fig.2 Sex characteristics of adult Pristella maxillaris
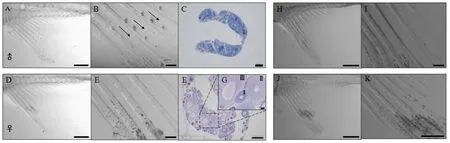
图3 玻璃扯旗鱼幼鱼的臀鳍及性腺Fig.3 Anal fin and gonads of larval Pristella maxillaris
2.4 玻璃扯旗幼鱼性腺发育的组织学特点
用石蜡切片法分析2月龄前玻璃扯旗鱼性腺发育的结果表明,5~10日龄幼鱼中未观察到明显分化的生殖腺;15日龄幼鱼只有一侧有性腺,其生殖细胞明显比周围的体细胞大(图4-A,B,C),石蜡切片的纵切结果显示其性腺组织位置与成鱼的一致(图4-G),且观察到由卵原细胞分裂所形成的“生殖包囊”(图4-H);25日龄时,腹腔两侧可观察到对称分布的类似卵巢结构(图4-D); 在15~25日龄的切片中未观察到类似精巢(睾丸)的结构,所有幼鱼性腺均为未分化状态;30日龄时有精巢,部分幼鱼的性腺组织从较为膨大的类卵巢结构变为细长的棒状精巢结构(图4-I),其余则继续发育为卵巢,此时玻璃扯旗鱼已开始性别分化;随着时间推移,卵巢体积不断增大,各级卵母细胞数量不断增多(图4-E,F),至3月龄时其雌雄性别比接近1∶1。
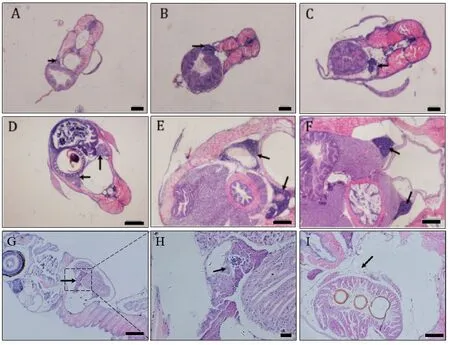
图4 5~50日龄玻璃扯旗幼鱼性别分化的组织学特征Fig.4 Histological characteristics of sex differentiation during 5~50 dpf in pristella maxillaries
3 结论与讨论
对青鱂、斑马鱼及赣昌鲫进行研究的结果表明,发育早期的雌、雄个体性腺并非双叶,此时生殖腺仅出现于体腔一侧[17,19-20]。本研究中玻璃扯旗鱼的性腺发育初期也具有类似现象。在斑马鱼性腺发育的早期,所有个体均有未分化的卵巢样结构生殖腺,即表现出幼年雌雄同体现象[21]。玻璃扯旗鱼的性腺组织在发育初期也是典型的“类卵巢”结构,属幼年雌雄同体。根据体型及相关参数可判断6月龄及以上玻璃扯旗鱼的性别,而无法判断4月龄前玻璃扯旗鱼的性别。对于4月龄前的玻璃扯旗鱼,尽管不能根据形态明确区分性别,但通过解剖可获得70日龄至4月龄的玻璃扯旗鱼的性腺结构,表明此时性别分化过程已基本完成,而 50日龄幼鱼仅能观察到透明结构而无法判断性别,该结果提示性别分化的关键时期发生在70日龄之前。
从解剖水平看,70日龄至4月龄玻璃扯旗鱼的性别分化已基本完成,但这一时期是否可以通过形态指标来区分其性别还有待探讨。墨西哥脂鲤成年雄鱼臀鳍上均存在小齿状结构,其小齿数量为7~78个,而雌鱼的臀鳍没有该结构,由此推断,雄鱼臀鳍的这种小齿在交配时可钩住雌鱼,从而减小精子的稀释,提高受精率[22]。类似的结构在其他脂鲤科鱼类及青鳉中也有报道[23-25]。本研究中发现,6月龄玻璃扯旗雄鱼、部分100日龄甚至70日龄的幼鱼臀鳍上也有类似小齿状结构。解剖带小齿的 100日龄鱼,通过组织切片可观察到精巢结构,推测这一结构可能与玻璃扯旗鱼性别分化密切相关,但该结构何时开始发育、何时发育成熟以及该结构是否与性别分化相关等仍有待研究。
对玻璃扯旗鱼的研究还处于初级阶段,其早期性腺发育及性别分化研究还有待完善:2~4月龄玻璃扯旗鱼的性腺从颗粒状结构转化成精巢或卵巢组织的比率不太稳定,这可能由同一批鱼的生长差异所致,后续研究中应同时综合年龄、体长以及饲养环境等多种因素来了解其性腺发育及性别分化的全过程;玻璃扯旗鱼性母细胞发育成类卵巢的过程也还需探究,后续可通过研究一系列性腺相关基因,如vasa、dnd来了解该过程。
玻璃扯旗鱼臀鳍上的小齿状结构能作为判别成鱼性别的第二性征,可为该鱼的繁殖及人工授精等提供技术支撑;对幼鱼性腺组织学特征的研究结果可为后期研究性别分化的分子调控机制提供参考。
参考文献:
[1] 赵春刚,范鹏,刘奕,等.甲基睾酮对雌性斑马鱼性腺发育的抑制作用[J].东北农业大学学报,2010,41(12):70-74.DOI:10.3969/j.issn.1005-9369.2010.12.0 15.
[2] 刘虹余,蔡静,饶剑军,等.EE2抑制斑马鱼雌性内源雌激素合成酶的表达[J].重庆师范大学学报(自然科学版),2016,33(1):24-28.
[3] FENSKE M,MAACK G,SCHÄFERS C,et al.An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish,Danio rerio[J].Environ Toxicol Chem,2005,24(5):1088-1098.DOI:10.1897/04-096r1.1.
[4] 张立涛.斑马鱼早期性腺发育及甲基睾酮对其性分化的影响[D].保定:河北大学,2010.10.7666/d.d079390.
[5] BOROWSKY R.Astyanax mexicanus,the blind Mexican cave fish:a model for studies in development and morphology[J].Cold Spring Harbor Protocols,2008(12):107.DOI:10.1101/pdb.emo107.
[6] DEGANI G,BOKER R,JACKSON K.Growth hormone,gonad development,and steroid levels in female carp[J].Comp Biochem Physiol C,Pharmacol Toxicol Endocrinol,1996,115(2):133-140.
[7] 唐洪玉,陈大庆,史建全,等.青海湖裸鲤性腺发育的组织学研究[J].水生生物学报,2006,30(2):166-172.DOI:10.3321/j.issn:1000-3207.2006.02.007.
[8] PAKSA Azadeh,BANDEMER Jan,HOECKENDORF Burkhard,et al.Repulsive cues combined with physical barriers and cell-cell adhesion determine progenitor cell positioning during organogenesis[J].Nat Comms,2016,7:11288.DOI:10.1038/ncomms11288.
[9] SIEGFRIED K R,NÜSSLEIN-VOLHARD C.Germ line control of female sex determination in zebrafish[J].Dev Biol,2008,324(2):277-287.DOI:10.1016/j.ydbio.2008.09.025.
[10] ORBAN L,SREENIVASAN R,OLSSON P E.Long and winding roads:testis differentiation in zebrafish[J].Mol Cell Endocrinol,2009,312(1/2):35-41.DOI:10.1016/j.mce.2009.04.014.
[11] 林巍靖,刘志伟.以黄彩旗鱼为模式研究突触发育[C]//2011年中国水产学会论文集,2011.
[12] 崔丹,刘志伟,刘南希,等.金钱鱼性腺发育及其组织结构观察[J].水产学报,2013,37(5):696-704.DOI:10.3724/SP.J.1231.2013.38442.
[13] 陈戟,胡炜,朱作言.鱼类生殖发育调控研究进展[J].科学通报,2013,58(2):103-114.
[14] BRAAT A K,SPEKSNIJDER J E,ZIVKOVIC D.Germ line development in fishes[J].Int J Dev Biol,1999,43(7):745-760.
[15] 李云航,孙鹏.鱼类性别决定机制及相关基因研究进展[J].现代渔业信息,2011,26(12):10-15.DOI:10.3969/j.issn.1004-8340.2011.12.003.
[16] 姜爱兰,刘俊得,丁辰龙,等.卡拉白鱼性腺发育组织学观察[J].青岛农业大学学报(自然科学版),2016,33(2):144-150.DOI:10.3969/J.ISSN.1674-148X.2016.02.013.
[17] 王晶,王冰,李纪同,等.斑马鱼性腺发育的组织学观察[J].基因组学与应用生物学,2011,30(2):168-174.
[18] 郑伟,严继舟.斑马鱼组织石蜡切片质量的优化[J].江苏农业科学,2013,41(11):260-262,263.DOI:10.3969/j.issn.1002-1302.2013.11.101.
[19] 张静,黄进强,李亚亚,等.青鳉(Oryzias latipes)性腺分化与发育的组织学观察[J].动物学研究,2013,34(5):464-470.
[20] 陈道印,李达,欧阳敏,等.赣昌鲫(日本白鲫♀×兴国红鲤♂)的性腺结构观察[J].水生生物学报,2013,37(4):698-704.DOI:10.7541/2013.83.
[21] WANG X G,BARTFAI R,SLEPTSOVA-FREIDRICH I,et al.The timing and extent of 'juvenile ovary' phase are highly variable during zebrafish testis differentiation[J].Journal of Fish Biology,2007,70:33-44.DOI:10.1111/j.1095-8649.2007.01363.x.
[22] ELIPOT Y,LEGENDRE L,PÈRE S,et al.Astyanax transgenesis and husbandry:how cavefish enters the laboratory[J].Zebrafish,2014,11(4):291-299.DOI:10.1089/zeb.2014.1005.
[23] CAMELIER P,ZANATA A M.A new species of Astyanax Baird & Girard (Characiformes:Characidae)from the Rio Paraguaçu basin,Chapada Diamantina,Bahia,Brazil,with comments on bony hooks on all fins[J].J Fish Biol,2014,84(2):475-490.DOI:10.1111/jfb.12295.
[24] BERTACO V A,MALABARBA L R.A new species of Hyphessobrycon (Teleostei:Characidae) from the upper rio Tocantins drainage,with bony hooks on fins[J].Neotropical Ichthyology,2005,3(1):83-88.DOI:10.1590/s1679-62252005000100004.
[25] OKA T B.On the processes on the fin-rays of the male of Oryzias latipes and other sex characters of this fish[J].J Fac Sci Tokyo Imp Univ Sec IV Zool,1931,2:209-219.
责任编辑:王赛群
英文编辑:王 库
Sexual characteristics of Pristella maxillaris and histological exploration on sex differentiation in its juveniles
PENG Ya1,2,YANG Qing1,DENG Zhiwen2,DONG Siyuan2,LIU Zhiwei2*
(1.College of Veterinary Medicine, Hunan Agricultural University, Changsha 410128, China; 2.College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China)
Analysis on sex differentiation and gonadal development of Pristella maxillaris was conducted in the study by morphological, anatomical and histological methods. The results showed that different stages of oocytes could be observed at 6-month-old female fish, and a large number of sperm filled in seminiferous tubules of male testis. The sexual characteristics emerged with appearance of yellow granular structure in abdomen or the uplifted abdomen when fishes were over 4-month-old. Hook-shaped teeth were also observed in the anal fins of fishes over 100- day-old age,however, they could not be observed when fishes were in less two months. Based on the analysis from the gonads in 5 to 50 day-old fishes, it showed that there was no differentiated gonads in both sides of dorsal abdominal cavity at 10 days post-fertilization (dpf); later, there was germline cysts found in the abdominal cavity at 15 dpf, and the gonadal tissue was only spotted at one side of the abdominal cavity before 15 days. The ovary-like structure (‘juvenile ovary’)symmetrically appeared at 25 dpf and the baculiform testis appeared at 30 dpf. All these facts could provide a further study reference for sex differentiation, gonadal development and their regulative mechanism.
Pristella maxillaris; gonadal development; sex differentiation; sex characteristics
S917;Q953+.4
A
1007-1032(2017)04-0427-06
2017-02-25
2017-04-01
国家自然科学基金项目(31572591,31101050 );上海市教委创新项目(13YZ094)
彭亚(1990—),男,湖南岳阳人,硕士研究生,主要从事鱼类生殖及性别分化研究,pengya182@163.com;*通信作者,刘志伟,博士,主要从事动物发育生物学研究,zwliu@shou.edu.cn
