芍药查尔酮异构酶基因CHI的表达特性分析
2017-07-18吴彦庆姜宇赵大球陶俊
吴彦庆,姜宇,赵大球,陶俊,*
(扬州大学 a.动物科学与技术学院;b.园艺与植物保护学院,江苏 扬州 225009)
芍药查尔酮异构酶基因CHI的表达特性分析
吴彦庆a,姜宇b,赵大球b,陶俊a,b*
(扬州大学 a.动物科学与技术学院;b.园艺与植物保护学院,江苏 扬州 225009)
为了揭示查尔酮异构酶基因(chalcone isomerase gene,CHI)在芍药花瓣中的表达规律与特点,以不同芍药托桂型品种(‘金辉’ ‘彤云金焰’‘红楼锦菊’)4个不同发育时期(花蕾期、初开期、盛开期、衰败期)中的内、外花瓣为对象,用qPCR分别检测CHI基因的表达水平,分析其在不同芍药品种、不同发育时期以及内外花瓣之间的表达差异。结果显示:不同发育时期同一品种芍药花瓣组织CHI基因的表达量存在一定差异,从花蕾期到衰败期整体表现为上升趋势;不同品种同一发育时期‘彤云金焰’花瓣组织(内瓣和外瓣)CHI基因的表达水平明显高于‘金辉’和‘红楼锦菊’的;同一芍药品种在相同发育时期内瓣组织的CHI基因表达量均明显高于外瓣组织的。鉴于不同芍药品种、不同发育时期内外花瓣间颜色存在差异,推测CHI基因表达量可能与芍药花瓣颜色的形成有关。该结果可为深入研究芍药CHI功能并开展芍药花色遗传改良分子育种研究提供技术支撑。
芍药;查尔酮异构酶基因CHI;花瓣;基因表达
芍药(Paeonia lactiflora Pall.)是中国传统名花,其花色优劣不仅影响到观赏植物的观赏价值,而且直接关系到其商业开发价值。中国芍药品种资源丰富,粉、红、紫色系等芍药品种诸多,而黄色品种极为稀少,因此,培育新奇花色如黄色的芍药品种已是中国观赏植物育种工作者当前面临的重要课题。目前所发现的与黄色形成有关的色素主要为类胡萝卜素(carotenoids)和类黄酮(flavonoids)二大类,而在类黄酮生物合成中,黄色的形成均与查尔酮异构酶基因(chalcone isomerase gene,CHI)有关[1]。在黄酮类生物合成中,CHI是一种非常稳定的酶,它参与黄酮类生物合成的早期步骤,它具有立体专一性,能大大加快环化的查尔酮形成黄烷酮。CHI活性影响花色素合成和黄烷酮前体、苯丙氨酸类植保素的生物合成[2],因此,CHI基因在黄色花的改良中起着十分重要的作用。鉴于CHI基因在黄色花改良中的重要性,有关学者对该基因开展了相关研究。1987年法国研究者第一次从蚕豆中分离出CHI基因的cDNA[3],随后,不同植物中的CHI基因被陆续分离出来,如茶树[4](Camellia sinensis)、金银花[5](Lonicera japonica)、大豆[6](Glycine max)、水仙[7](Narcissus tazetta)、银杏[8](Ginkgo biloba)等。虽然研究者们克隆得到了许多物种中的CHI基因,但是主要集中于观赏植物和草本植物,如乔中全等[5]成功克隆出金银花叶片CHI基因cDNA全长序列,长 725 bp;马春雷等[4]采用 ESTs测序技术和 T4RNA连接酶介导的 5′ RACE技术克隆了全长 1 163 bp的茶树CHI基因。对于芍药CHI基因而言,扬州大学园艺与植物保护学院花卉研究所前期采用RACE技术成功克隆出芍药CHI基因的DNA全长序列1 163 bp,并用生物信息学对其蛋白结构功能进行了预测[9]。此外, CHI基因表达量的多少会直接影响到上游黄色查尔酮、下游无色或淡黄色花黄素以及红色花色苷的积累,从而影响颜色或黄酮类化合物的变化。在矮牵牛突变体中,花药中CHI的启动子突变后使CHI表达下降,导致花粉颜色变成黄色或绿色[10];仙客来(Cyclamen persicum)中CHI基因的表达活性降低后,植物积累大量查尔酮,并产生黄色的花朵[11],转座子的插入失活造成CHI和DFR突变,从而导致康乃馨(Dianthus caryophyllus)的花色变为黄色[12];在洋葱(Allium cepa)中,CHI基因失活会导致黄酮类化合物槲皮素含量减少[13]。鉴于CHI基因表达量与花瓣黄色形成相关,本研究中选取3个芍药托桂型品种‘金辉’、‘彤云金焰’、‘红楼锦菊’,分别以 4个不同发育时期(花蕾期、初开期、盛开期、衰败期)中内外花瓣(外瓣红色,内瓣黄色)为试验材料,用qPCR检测 CHI基因在不同芍药品种、不同发育时期以及内外花瓣之间的表达差异,旨在揭示CHI基因在芍药花中的表达规律及作用机理,为深入开展芍药CHI基因功能验证提供参考。
1 材料与方法
1.1 试验植物
以芍药托桂型品种‘金辉’‘彤云金焰’‘红楼锦菊’为材料。3个品种芍药的外瓣均为红色,内瓣均为黄色。分别采其花蕾期、初开期、盛开期和衰败期的内、外花瓣作为基因表达的材料。所有植物花瓣均采自扬州大学园艺与植物保护学院芍药种质资源圃。花瓣经液氮速冻后,置于-80 ℃冰箱中,备用。
1.2 主要试剂
DL2000、dNTP、PCR Buffer、RNA纯化试剂盒DNase I、DNA凝胶回收试剂盒、LATaq DNA聚合酶等均购于 TaKaRa;逆转录酶 SuperScriptIII Reverse Transcriptase (R250-01)和荧光染料 SYBR Green I(CS7561)均购于Invitrogen;cDNA序列测定和引物合成均委托上海生物工程技术服务有限公司完成。
1.3 引物设计
根据文献[9]中方法获得芍药 CHI基因 cDNA序列。用Primer 5.0软件设计特异性表达引物(表1)。内参采用芍药的β-Actin基因(JN105299)。所有引物送上海生物工程技术服务有限公司合成。

表1 CHI基因的定量引物信息Table 1 Primer information of CHI gene
1.4 总RNA的提取及cDNA的合成
芍药总RNA采用Trizol法提取,用DEPC水溶解,-80 ℃保存备用。cDNA 合成体系 10 μL:1 μL总 RNA,1 μL 3′ RACE Adaptor(5 μmol),2 μL 5×M-MLV Buffer,1 μL dNTP Mixture(10 mmol/μL),0.25 μL RNase Inhibitor,0.25 μL Reverse Transcriptase M-MLV(RNase H-),4.5 μL RNase Free ddH2O。反应条件:42 ℃孵育60 min,70 ℃加热15 min后终止反应。反应液于-20 ℃保存。
1.5 qPCR分析
以反转录cDNA产物为模板进行荧光定量PCR反应。反应体系 25 μL:12.5 μL SYBR®Premix Ex TaqTM(2×),0.5 μL PCR Forward Primer,0.5 μL PCR Reverse Primer,0.5 μL Rox Reference Dye Ⅱ(50×),2 μL cDNA模板,最后补充ddH2O至25 μL。反应条件为:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸40 s,40个循环;72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳检测。
1.6 数据统计
采用 2-ΔΔCt法[14]进行处理。ΔΔCt =(待测组目的基因平均 Ct值-待测组看家基因平均 Ct值)-(对照组目的基因平均Ct值-对照组看家基因平均Ct值)。每份样本进行3次实时PCR检测,取平均值。用SPSS 16.0软件对不同品种、不同发育时期以及内外花瓣间 CHI基因表达量进行单因素方差分析。
2 结果与分析
2.1 同一发育时期不同芍药品种花瓣组织 CHI基因表达量的差异
由表2可见,在花蕾期,‘彤云金焰’内瓣组织的CHI基因表达量极显著高于‘金辉’和‘红楼锦菊’内瓣组织的(P<0.01),外瓣组织的CHI基因表达量显著高于‘金辉’和‘红楼锦菊’外瓣组织的(P<0.05);在初开期,‘彤云金焰’花瓣组织(内瓣和外瓣)的CHI基因表达量均极显著高于‘金辉’和‘红楼锦菊’花瓣组织的(P<0.01);在盛开期,‘彤云金焰’内瓣组织的CHI基因表达量极显著高于‘金辉’和‘红楼锦菊’内瓣组织的(P<0.01),外瓣组织的 CHI基因表达量极显著高于‘金辉’的(P<0.01),显著高于‘红楼锦菊’外瓣组织的(P<0.05);在衰败期,‘彤云金焰’内瓣组织的CHI基因表达量极显著高于‘金辉’和‘红楼锦菊’内瓣组织的(P<0.01),外瓣组织的 CHI基因表达量极显著高于‘红楼锦菊’的(P<0.01)。总体而言,在同一发育时期,‘彤云金焰’品种花瓣组织(内瓣和外瓣)CHI基因表达水平明显高于‘金辉’和‘红楼锦菊’的。
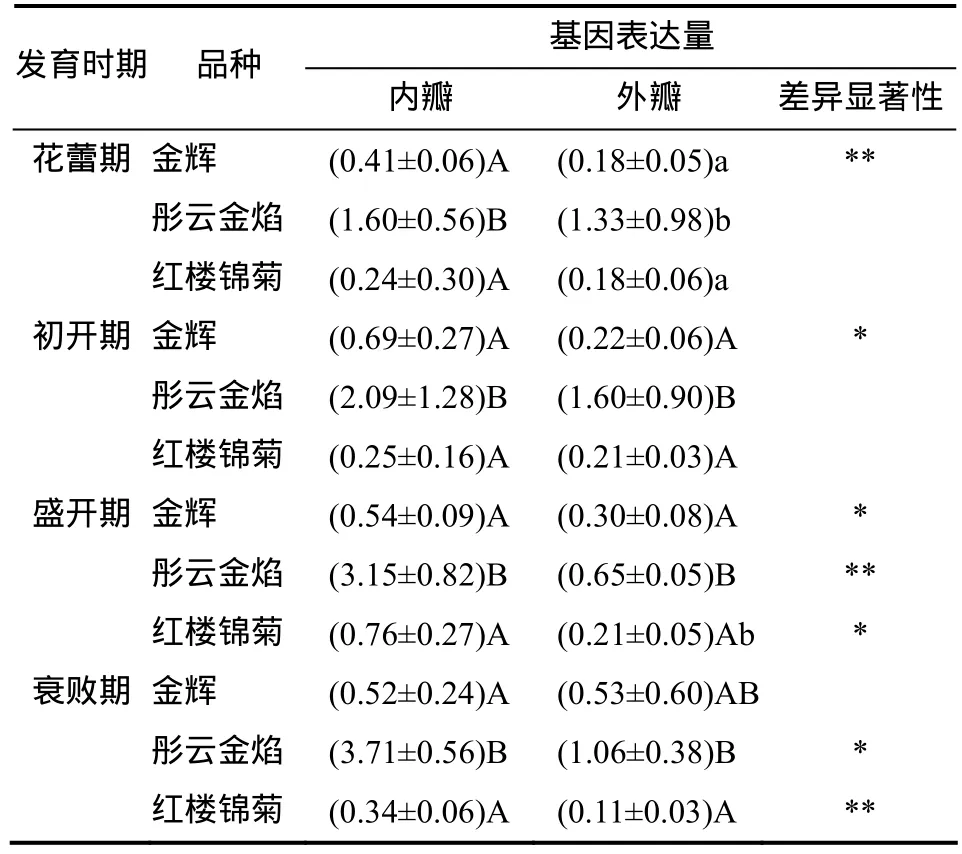
表 2 不同发育时期各品种芍药内瓣和外瓣组织 CHI基因的表达量Table 2 Expression level of CHI gene in inne r-petal and o uterpetal tissues from different Paeonia lactiflora cultivars at different growing stages
2.2 同一品种芍药不同发育时期花瓣组织中 CHI基因表达量的差异
‘金辉’品种花蕾期、初开期、盛开期和衰败期之间花瓣组织(内瓣和外瓣)CHI基因表达量间的差异无统计学意义(P>0.05);‘彤云金焰’花蕾期内瓣组织的 CHI基因表达量显著低于衰败期内瓣组织的(P<0.05),而4个时期外瓣组织CHI基因表达量间的差异无统计学意义(P>0.05);‘红楼锦菊’盛开期内瓣组织的CHI基因表达量显著高于花蕾期、初开期内瓣组织的(P<0.05),衰败期外瓣组织的CHI基因表达量显著低于盛开期、初开期外瓣组织的(P<0.05)。从整体来看,同一品种芍药花瓣组织的CHI基因表达量在不同发育时期存在一定的差异,从花蕾期到衰败期整体表现为上升趋势。
2.3 同一芍药品种在相同发育时期内、外花瓣组织CHI基因表达量的差异
由表2可见,在花蕾期,‘金辉’内瓣组织的CHI基因表达量极显著高于外瓣组织的(P<0.01);在初开期,‘金辉’内瓣组织的CHI基因表达量显著高于外瓣组织的(P<0.05);在盛开期,‘金辉’内瓣组织的CHI基因表达量显著高于外瓣组织的(P<0.05),‘彤云金焰’内瓣组织的 CHI基因表达量极显著高于外瓣组织的(P<0.01),‘红楼锦菊’内瓣组织的 CHI基因表达量显著高于外瓣组织的(P<0.05);在衰败期,‘彤云金焰’内瓣组织的CHI基因表达量显著高于外瓣组织的(P<0.05),‘红楼锦菊’内瓣组织的 CHI基因表达量极显著高于外瓣组织的(P<0.01)。整体而言,同一芍药品种在相同发育时期内瓣组织的CHI基因表达量明显高于外瓣组织的。
3 结论与讨论
CHI基因的表达具有发育阶段特异性、组织特异性和空间特异性。在‘巨峰’葡萄(Vitis vinifera)中,CHI基因在幼叶、幼根、果皮、果肉和种子中均有表达,但不同组织中的表达方式不同。CHI基因在花后30、90 d果皮和在花后90 d果肉及在花后45 d种子中均高度表达[15]。 果实成熟阶段,‘国庆4号’温州蜜柑(Citrus unshiu)果皮中 CHI的表达量均逐渐下降,而果肉中CHI的表达量均有一定程度的上升[16]。在金花茶(Camellia nitidissima)花芽发育过程中,CHI基因的表达呈现出先急剧上升而后平缓下降的趋势,金花茶CHI基因主要在花芽发育的早期进行表达;CHI基因在苞片、萼片、花瓣、雄蕊、雌蕊中均有表达,但在雌蕊中的表达量最高,其次是在雄蕊中的[17]。本研究中,芍药内瓣CHI基因的表达量显著高于外瓣的,在4个发育时期(花蕾期,初开期,盛开期,衰败期)大部分均呈现先增加后减少的表达趋势,且‘彤云金焰’的表达水平明显高于‘红楼锦菊’和‘金辉’的。由于其外瓣均为粉红色,内瓣为黄色,不同发育阶段颜色深浅也发生变化,‘彤云金焰’的颜色较深,因此,可推测 CHI基因的表达量与芍药花瓣黄色的调控密切相关。
牡丹 CHI基因过表达载体导入烟草高效遗传转化体系后,转基因烟草的总黄酮和黄酮含量比野生型的提高了3倍,其花色苷含量和花色强度均明显降低[18]。NISHIHARA等[19]用RNAi干涉技术抑制烟草内源CHI基因表达,烟草的花瓣和花粉颜色变淡,黄酮含量发生改变。甘油型油菜(Scutellaria baicalensis)CHI基因的RNAi载体通过农杆菌介导法导入甘蓝型油菜黑籽品种双 10号的下胚轴中,获得了转基因植株,转基因植株花瓣的颜色在花蕾早期明显变浅[20]。 采用超量表达引发共抑制和反义抑制的方法将水母雪莲(Saussurea medusa)的CHI基因导入到矮牵牛后,深红色的矮牵牛花色变浅,并出现深色网状纹路,部分还带有不同表达模式的白色斑块,柱头颜色也由深绿色变成浅绿色[21]。本研究中 CHI基因在不同芍药内外花瓣的表达差异和不同发育阶段表达规律的发生机理,还有待用RNAi[22]和过表达[23]等技术对CHI基因的功能进行验证。
芍药查尔酮异构酶(CHI)基因在芍药不同品种、不同发育时期、内外花瓣之间的表达水平均存在一定的差异,其中,内瓣组织CHI基因的表达水平显著高于外瓣的(P<0.05),‘彤云金焰’的表达量显著高于‘金辉’和‘彤云金焰’的(P<0.05),4 个不同发育时期的CHI基因表达量在一定程度上也存在差异。
[1] 周琳,王雁,彭镇华.黄色花形成机制及基因工程研究进展[J].林业科学,2009,45(2):111-119.DOI:10.3321/j.issn:1001-7488.2009.02.020.
[2] JEZ J M,BOWMAN M E,NOEL J P.Role of hydrogen bonds in the reaction mechanism of chalcone isomerase[J].Biochemistry,2002,41(16):5168-5176.DOI:10.1021/bi0255266.
[3] HEDRICK S A,BELL J N,BOLLER T,et al.Chitinase cDNA cloning and mRNA induction by fungal elicitor,wounding,and infection[J].Plant Physiol,1988,86(1):182-186.DOI:10.1104/pp.86.1.182.
[4] 马春雷,赵丽萍,张亚丽,等.茶树查尔酮异构酶基因克隆及序列分析[J].茶叶科学,2007,27(2):127-132.DOI:10.3969/j.issn.1000-369X.2007.02.006.
[5] 乔中全.金银花 chs、fls、chi基因全长克隆及序列分析[D].长沙:中南林业科技大学,2012.10.7666/d.Y2096849.
[6] 陈宣钦,张乐,徐慧妮,等.大豆异黄酮生物合成关键酶及其代谢工程研究进展[J].中国生物工程杂志,2012,32(7):133-138.
[7] 蔡雪玲,陈晓静,叶一江,等.中国水仙查尔酮异构酶基因的克隆与表达分析[J].热带作物学报,2011,32(12):2287-2292.DOI:10.3969/j.issn.1000-2561.2011.12.018.
[8] CHENG H,LI L,CHENG S,et al.Molecular cloning and function assay of a chalcone isomerase gene (GbCHI)from Ginkgo biloba[J].Plant Cell Rep,2011,30(1):49-62.DOI:10.1007/s00299-010-0943-4.
[9] 吴彦庆,赵大球,王静,等.芍药查尔酮异构酶基因(CHI)克隆、密码子偏好性分析以及蛋白结构功能预测[J].华北农学报,2016,31(2):71-80.DOI:10.7668/hbnxb.2016.02.013.
[10] VAN TUNEN A J,MUR L A,RECOURT K,et al.Regulation and manipulation of flavonoid gene expression in anthers of petunia:the molecular basis of the Po mutation[J].Plant Cell,1991,3(1):39-48.DOI:10.1105/tpc.3.1.39.
[11] MIYAJIMA I,MAEHARA T,KAGE T,et al.Identiocation of the main agent causing yellow color of yellow-flowered cyclamen mutant[J].Journal-Japanese Society for Horticultural Science,1991,60:409 -414.
[12] ITOH Y,HIGETA D,SUZUKI A,et al.Excision of transposable elements from the chalcone isomerase and dihydroflavonol 4-reductase genes may contribute to the variegation of the yellow-flowered carnation (Dianthus caryophyllus)[J].Plant Cell Physiol,2002,43(5):578-585.DOI:10.1093/pcp/pcf065.
[13] KIM S,JONES R,YOO KS,et al.Gold color in onions(Allium cepa):a natural mutation of the chalcone isomerase gene resulting in a premature stop codon[J].Mol Genet Genomics,2004,272(4):411-419.DOI:10.1007/s00438-004-1076-7.
[14] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J].Methods,2001,25(4):402-408.DOI:10.1006/meth.2001.1262.
[15] 周军,姚泉洪,彭日荷,等.巨峰葡萄查尔酮异构酶基因克隆及表达分析[J].西北植物学报,2009,29(9):1723-1729.DOI:10.3321/j.issn:1000-4025.2009.09.001.
[16] WANG Y,LI J,XIA R.Expression of chalcone synthase and chalcone isomerase genes and accumulation of corresponding flavonoids during fruit maturation of Guoqing No.4 satsuma mandarin (Citrus unshiu Marcow)[J].Scientia Horticulturae,2010,125(2):110-116.DOI:10.1016/j.scienta.2010.02.001.
[17] 周兴文,李纪元,范正琪.金花茶查尔酮异构酶基因全长克隆与表达的初步研究[J].林业科学研究,2012,25(1):93-99.DOI:10.3969/j.issn.1001-1498.2012.01.016.
[18] ZHOU L,WANG Y,REN L,et al.Overexpression of Ps-CHI1,a homologue of the chalcone isomerase gene from tree peony (Paeonia suffruticosa),reduces the intensity of flower pigmentation in transgenic tobacco[J].Plant Cell,Tissue and Organ Culture (PCTOC),2013,116(3):285-295.DOI:10.1007/s11240-013-0403-2.
[19] NISHIHARA M,NAKATSUKA T,YAMAMURA S.Flavonoid components and flower color change in transgenic tobacco plants by suppression of chalcone isomerase gene[J].FEBS Lett,2005,579(27):6074-6078.DOI:10.1016/j.febslet.2005.09.073.
[20] 曹廷.芸薹属查尔酮异构酶基因家族的克隆与功能鉴定[D].重庆:西南大学,2011.
[21] 祝钦泷.转查尔酮异构酶(CHI)基因矮牵牛花色改变及其花器官变异的研究[D].重庆:西南大学,2004.
[22] 李芳,邓子牛,赵亚,等.柑橘衰退病毒基因 RNAi载体的构建[J].湖南农业大学学报(自然科学版),2017,43(2): 386-390.
[23] 胡举伟,张会慧,孙广玉.过表达和抑制表达2-Cys Prx基因烟草的生长特性和叶片光合功能[J].湖南农业大学学报(自然科学版),2015,41(5):486-490.
责任编辑:王赛群
英文编辑:王 库
Expression pattern analysis on the chalcone isomerase (CHI) gene in Paeonia lactiflora cultivars
WU Yanqinga, JIANG Yub, ZHAO Daqiub, TAO Juna,b*
(a.College of Animal Science and Technology; b.College of Horticulture and Plant Protection, Yangzhou University,Yangzhou, Jiangsu 225009, China)
Chalcone isomerase (CHI) is a key gene in regulating the formation of yellow petals. Inner and outer petals from different Paeonia lactiflora cultivars including Jinhui, Tongyunjinyan, Hongloujinju at four growing stages(flower-bud stage, initiating bloom stage, bloom stage, wither stage) were selected as materials to study expression pattern and characteristic of CHI gene. Expression difference of CHI gene in inner and outer petal at four growing stages among different Paeonia lactiflora cultivars were conducted using qPCR technology. The results showed that the expression level of CHI gene exhibited difference in petal tissues from the same cultivar and showed a rise trend from flower bud stage to wither stage; For different cultivars, the expression level of CHI gene in petal tissues of Tongyunjinyan was apparently higher than that of Jinhui and Tongyunjinyan at the same growing stages, furthermore, it was apparently higher in inner petals than that in outer petals for the same cultivars at same growing stages. Considering color difference in inner and outer petals at different growing stages and different Paeonia lactiflora cultivars, it was speculated that the expression level of CHI gene might be related to the color formation of petals in Paeonia lactiflora.The result could provide theoretical guidance for further research on the CHI function and genetic improvement to flower color of Paeonia lactiflora.
Paeonia lactiflora; chalcone isomerase (CHI) gene; petal; gene expression
Q939.5
A
1007-1032(2017)04-0372-05
2016-12-05
2017-05-05
国家自然科学基金(31372097,31400592);江苏省高校自然科学研究重大项目(13KJA210005)
吴彦庆(1988—),男,江苏扬州人,硕士研究生,主要从事观赏园艺研究,yqwu19880928@126.com;*通信作者,陶俊,研究员,主要从事观赏植物栽培生理、遗传育种与分子生物学研究,taojun@yzu.edu.cn
