蒽环类药物心脏毒性分析及临床使用建议
2017-07-18王琳杨雪肖玲芳胡长平龚志成
王琳,杨雪,肖玲芳,胡长平,龚志成
(1.中南大学湘雅医院 药学部,湖南 长沙 410008;2.中南大学 药学院,湖南 长沙 410078)
蒽环类药物心脏毒性分析及临床使用建议
王琳1,杨雪1,肖玲芳1,胡长平2,龚志成1
(1.中南大学湘雅医院 药学部,湖南 长沙 410008;2.中南大学 药学院,湖南 长沙 410078)
目的 探讨蒽环类药物心脏毒性的预防、缓解措施,为其临床合理应用提供参考。方法对360例恶性肿瘤患者使用蒽环类药物化疗后,分析其心电图及心脏保护药使用情况,比较右丙亚胺单独使用、二丁酰环磷腺苷钙针和磷酸肌酸钠合用的心脏保护疗效。结果蒽环类药物心脏毒性发生率为11.2%,结果显示,右丙亚胺单独使用、二丁酰环磷腺苷钙针和磷酸肌酸钠合用对蒽环类药物心脏毒性有保护作用,2种心脏保护方案对蒽环类药物心脏毒性保护的疗效比较,差异无统计学意义(P>0.05)。结论蒽环类药物有致心脏毒性的作用,在化疗过程中对患者心脏功能进行监测、合理使用心脏保护药物是预防或减缓心脏毒性的有效方法。
蒽环类药物;心脏毒性;心电图;心脏保护
蒽环类化疗药物是一类常用的抗肿瘤药物,种类繁多,包括阿霉素、柔红霉素及表阿霉素等。其作为广谱抗癌药物,化疗指数高,可以联合应用其他化疗药或靶向药物,临床用于治疗多种恶性肿瘤。蒽环类药物抗肿瘤效果不可替代,但其不具有靶向性,在杀伤肿瘤细胞的同时也杀伤正常细胞,带来多种毒副作用,其中严重心脏毒性限制其临床应用,同时影响其抗肿瘤治疗效果[1-2]。
蒽环类药物的心脏毒性作用具有累积效应,在应用早期心脏结构和功能无明显变化,长期使用可致心力衰竭,对患者造成不可逆性及进展性的心脏毒性。有研究提示,首次使用蒽环类药物就会造成不可逆的心肌损害[3]。根据心脏毒性出现的时间不同,可分为急性、慢性及迟发性3种类型。急性心脏毒性多在静脉输注过程中或给药数小时后发生,表现为一过性的心电图异常,如QT间期延长,ST-T段改变,可迅速恢复正常。慢性心脏毒性常在用药1年内发生,表现为左心室功能受损,心肌一般发生不可逆改变,临床上最常见,但症状不明显,与剂量累积相关。迟发性心脏毒性与药物累积剂量及用药次数呈正相关,常在治疗结束后3~20年发生,表现为迟发性心室功能不全、心力衰竭、心律失常等[4-7]。
研究表明,蒽环类药物引起心功能不全的发生率可达13%~39%,治疗结束25年后,患者患心血管疾病的风险增加10倍,心脏性死亡的风险是正常人群的8.2倍,心力衰竭的风险是正常人群的15倍[8]。在接受多柔比星治疗的患者中,近10%患者在停止化疗近10年后还会出现心脏并发症[9]。化疗中使用心脏保护药可减轻或缓解蒽环类药物导致的心脏毒性。在蒽环类药物的临床使用过程中,对心脏功能进行监测及保护,对预防和缓解蒽环类药物所造成的心脏毒性十分重要。
1 资料与方法
1.1 基本资料
选取2013年12月-2015年12月在中南大学湘雅医院肿瘤科接受蒽环类药物(包括表柔比星针、米托蒽醌针、柔红霉素针、伊达比星针、阿柔比星针、多柔比星速溶针)治疗的患者3 213例。化疗前通过心电图、心肌酶谱、心肌肌钙蛋白Ⅰ等确定患者心脏健康。化疗过程中或化疗后再次住院过程中至少出现下列一项情况:①心肌酶谱异常;②心肌肌钙蛋白Ⅰ数值超正常值;③心电图异常波动。纳入所需蒽环类药物诱发心脏毒性的肿瘤患者360例(心脏毒性发生率为11.2%),其中男性84例(23.3%),女性276例(76.7%);年龄17~78岁,平均37岁。经诊断为乳腺癌182例(50.5%),白血病98例(27.2%),淋巴瘤59例(16.4%),骨髓瘤9例(2.5%),其他 12例(3.3%)。化疗前心电图检查均正常且无心脏病史,化疗后出现心电图、心肌酶或心脏彩色B超异常,判断为发生心脏毒性。
1.2 方法
191例患者使用心脏保护药物,常用药物有右丙亚胺、二丁酰环磷腺苷钙、磷酸肌酸钠、脂溶性维生素Ⅱ、美托洛尔等,可单独使用或多种药物联合使用。其中使用较多的用药方案为右丙亚胺单独使用、二丁酰环磷腺苷钙和磷酸肌酸钠合用,本研究将对这2种用药方案进行分析。
106例乳腺癌患者使用心脏保护药物,以右丙亚胺为主;73例血液系统恶性疾病(淋巴癌、白血病)患者使用心脏保护药物,以二丁酰环磷腺苷钙、磷酸肌酸钠合用为主,分别占总数的50.5%和43.6%。
1.3 统计学方法
数据分析采用SPSS 18.0统计软件,计数资料以率(%)表示,用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 患者化疗后心电图
360例患者化疗后出现心电图异常。恶性肿瘤患者使用蒽环类药物化疗后出现的心电图异常主要有:T波异常发生率为51.6%(186/360)、窦性心律失常为 39.7%(143/360)、ST 段异常为 21.6%(78/360)、PtfV1负值增大为13.6%(49/360)、肢导联QRS波群低电压为 8.9%(32/360)、传导阻滞为3.9%(14/360)、早搏为 3.3%(12/360)。
360例患者中20例(5.5%)进行超声心动图检查,结果均发现二、三尖瓣反流,9例患者出现左心室顺应性减退,其中5例患者心电图监测结果为正常。
2.2 患者化疗中使用心脏保护药比较
360例患者中,173例患者未使用心脏保护药物,其中60例(34.7%)心电图恢复正常;80例患者在化疗中出现心电图异常后使用右丙亚胺进行保护,其中58例心电图结局为正常,有效率为72.5%,与未使用心脏保护药物组疗效比较,经χ2检验,差异有统计学意义(χ2=31.437,P=0.000);74例患者联合使用二丁酰环磷腺苷钙、磷酸肌酸钠,其中43例心电图结局为正常,有效率为58.1%,与未使用心脏保护药物组疗效比较,经χ2检验,差异有统计学意义(χ2=11.700,P=0.001)。见表 1。
2.3 不同恶性肿瘤患者使用心脏保护用药方案比较
106例乳腺癌患者未使用心脏保护药物,其中45例(42.5%)心电图恢复正常;68例患者使用右丙亚胺,其中46例心电图恢复正常,有效率为67.6%,与未使用心脏保护药物组比较,经χ2检验,差异有统计学意义(χ2=10.540,P=0.001);8例患者使用二丁酰环磷腺苷钙、磷酸肌酸钠合用,其中6例心电图恢复正常,有效率为75.0%,与未使用心脏保护药物组比较,经χ2检验,差异有统计学意义(χ2=3.187,P=0.074)。见表 2。
73例血液系统疾病患者未使用心脏保护药物,其中28例(37.3%)心电图恢复正常;8例患者使用右丙亚胺,其中7例心电图恢复正常,有效率为87.5%,与未使用心脏保护药物组比较,经χ2检验,差异有统计学意义(χ2=7.460,P=0.006);66例患者使用二丁酰环磷腺苷钙、磷酸肌酸钠合用,其中41例心电图恢复正常,有效率为62.1%,与未使用心脏保护药物组比较,经χ2检验,差异有统计学意义(χ2=8.632,P=0.003)。见表 3。
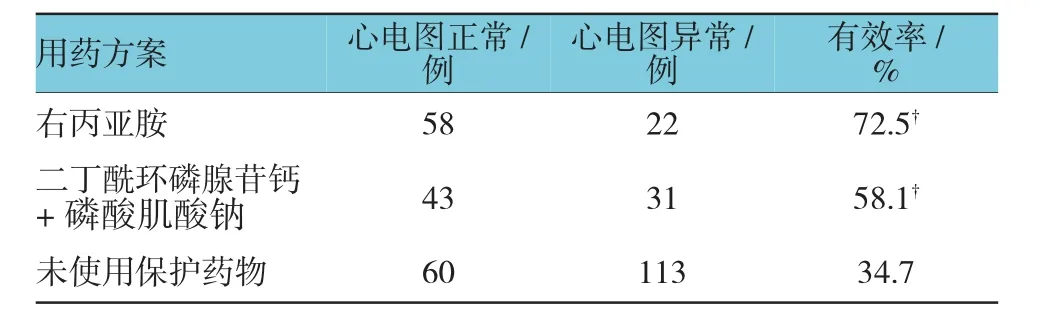
表1 不同心脏保护用药方案对恶性肿瘤患者心脏毒性的疗效比较
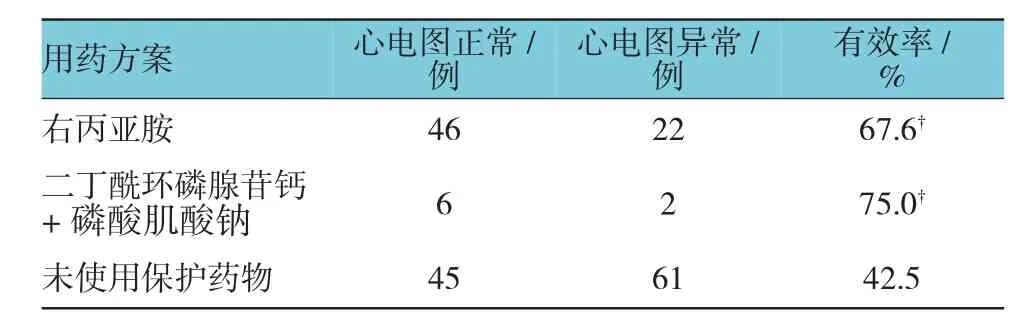
表2 不同心脏保护用药方案对乳腺癌患者心脏毒性的疗效比较
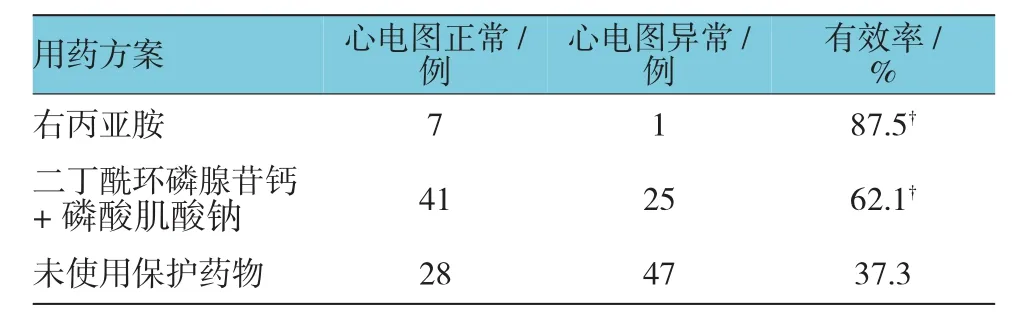
表3 不同心脏保护用药方案对血液系统恶性疾病患者心脏毒性的疗效比较
3 讨论
蒽环类药物导致心脏毒性的机制尚不十分清楚,目前研究认为与活性氧的过量产生、脂质的过氧化反应、DNA损伤和肿瘤抑制蛋白的累积等有关[10-13]。另外,铁离子代谢紊乱导致细胞膜功能损伤[11]、心肌细胞钙超载引起心律失常[14]等也是蒽环类药物诱发心脏毒性的可能机制。蒽环类药物所致心脏毒性在大多数患者是无症状或左室射血分数(left ventricular ejection fraction,LVEF)降低,因此在用药期间及用药后密切监测心脏功能有利于心脏毒性的早期发现与治疗[15]。弥漫大B细胞淋巴瘤患者使用蒽环类药物化疗后,心脏毒性的早期表现为ST-T异常、心律失常且LVEF下降[16]。
本研究中360例患者使用蒽环类药物化疗后出现心脏毒性,心脏毒性发生率为11.2%,主要变现为心电图异常,急性心脏毒性占较大比重,并且伴随着恶心、呕吐、胸闷等其他不良症状或反应。在数周或者数月后出现的毒性发生较少,但是会对患者心脏造成不可逆转的严重损伤,最终会影响正常的心脏功能。心脏毒性对患者心脏造成的损伤及以对化疗效果带来的影响不容忽视,如何在现有的医疗水平条件的基础上,预防或缓解蒽环类化疗药物所导致的心脏毒性具有重要的科研价值和实际意义。
3.1 控制危险因素
蒽环类药物心脏毒性除与累积药物剂量有关,年龄及性别、遗传因素、生活习惯、联合化疗及放射治疗等也是蒽环类药物导致心脏毒性的危险因素。在多柔比星累积剂量达550 mg/m2时,儿童心力衰竭发生率为6.0%,成人为1.3%[17],本研究中老年人和儿童患者更容易发生心脏毒性。因此,蒽环类药物化疗过程中应采取必要的预防措施,控制危险因素,对蒽环类药物所致心脏毒性进行预防。在用药前详细的了解患者身体状况及疾病史,评估心脏功能,治疗过程中密切监测心功能状态;在达到控制肿瘤的前提下,尽量减少药物剂量,将一次性给药更换为多次小剂量给药;两类药物联合使用时,注意用药顺序、延长用药间隔,选用心脏毒性较低的药物,这些方法有利于降低蒽环类药物所致的心脏毒性。
3.2 心脏功能监测
心电图是检测心脏损伤方便、有效的方法之一,可无创性的评估心脏功能,具有可重复、客观、简便、可靠等特点。本研究中,肿瘤患者心电图异常主要表现为T波、ST段、ST-T段异常,窦性心律失常,但并不仅以此判断肿瘤患者心脏毒性的发生,结合心电图、心肌酶学、肌钙蛋白结果,以及患者临床症状来判断患者的心脏损害情况。超声心动图是监测蒽环类药物所致心脏毒性的普遍方法之一,患者无需接触电离辐射,检测到LVEF、左室短轴缩短率(fraction shortening,FS)降低是蒽环类药物所致心脏毒性的主要表现[18-19]。但本研究中通过超声心动图检测蒽环类药物心脏毒性的患者有20例(5.5%),其中5例患者通过超声心动图监测发现心电图未监测到心脏功能异常,说明超声心动图是较为灵敏的心脏损伤监测手段,但并非常规应用。超声心动图价格稍高、临床医生对蒽环类药物心脏毒性关注度不够是本研究中超声心动图非常规使用的主要原因。此外,放射性核素心血管造影、心内膜心肌活检、血清生化指标检测也是蒽环类药物心脏毒性早期检测的有效方法。
3.3 联合使用心脏保护药物
铁离子螯合剂右丙亚胺、钙离子拮抗剂、血管紧张素抑制剂、β受体阻滞剂、抗氧化剂维生素C等是防治心脏损伤的常用药物。研究表明,使用血管紧张素抑制剂、β受体阻滞剂,可促进蒽环类药物导致的心脏损伤、LVEF异常恢复,减少心功能不全的发生[20]。右丙亚胺是目前唯一获得美国食品药品管理局批准上市的抗蒽环类药物心脏毒性的保护剂,能够预防蒽环类药物对心脏损害,可减轻蒽环类药物外渗所导致的组织坏死[21],早期使用能更好地预防左心室功能障碍[22]。研究结果显示,乳腺癌患者的心脏保护方案以右丙亚胺为主,且疗效显著,血液系统恶性疾病患者使用右丙亚胺也有明显的心脏保护作用。
二丁酰环磷腺苷钙是一种环磷腺苷的新型衍生物,属蛋白激酶激活剂,具有较强的细胞渗透性,可快速作用于病灶,进而抵抗机体内磷酸二酯酶的降解作用,具有显著地改善心肌缺氧、增强心肌收缩力、扩张冠脉及增加心排血量等作用[23]。磷酸肌酸钠用于心脏手术时加入心脏停搏液中,保护心肌缺血状态下的心肌代谢异常,通过2个高能磷酸键,给心肌细胞提供能量,改善心肌能量代谢,从而改善心肌缺血[24]。儿童白血病患者在蒽环类药物化疗过程中使用磷酸肌酸钠作为心脏保护药,治疗蒽环类抗生素所致心脏毒性,安全且疗效明显[25]。在本研究中,血液系统恶性疾病患者的心脏保护方案以二丁酰环磷腺苷钙针、磷酸肌酸钠合用为主,异常心电图的恢复疗效显著,二丁酰环磷腺苷钙针、磷酸肌酸钠合用的心脏保护作用与右丙亚胺对于蒽环类药物所致心电图异常的恢复并无明显差异。
根据蒽环类药物心脏毒性防治指南(2013年版)推荐右丙亚胺作为首选心脏保护药物。本研究中,乳腺癌患者的心脏保护方案以右丙亚胺为主,而血液系统恶性疾病以二丁酰环磷腺苷钙针、磷酸肌酸钠合用为主。二丁酰环磷腺苷钙、磷酸肌酸钠都是通过提供能量改善心肌缺血,联合使用属重复用药,加重患者的经济负担,且在大多数情况下属于超说明书使用。虽对蒽环类药物所致心脏毒性有保护作用,但其具体机制及使用的安全性、有效性仍需进一步研究。
综上所述,蒽环类药物是临床上使用最广泛的、高效的抗肿瘤化疗药物,其所致的心脏毒性不容忽视。本研究中,蒽环类药物所致的心脏毒性主要表现为急性心脏毒性,但在临床上并未引起足够的重视,对心脏的监测不够密切,如超声心动图等灵敏有效的监测手段并未常规使用。在化疗过程中,使用右丙亚胺等药物对心脏的保护作用有明显疗效,但心脏保护药使用率不高。关注蒽环类药物心脏毒性作用,采取有效措施如心电图、超声心动图等,密切监测患者的心脏功能变化,必要时使用安全有效的心脏保护药等措施,可有效减缓或预防蒽环类药物心脏毒性的发生,使蒽环类药物抗肿瘤作用得以安全、有效地发挥。
[1]OLIVEIRA G H,AL-KINDI S G,CAIMI P F,et al.Maximizing anthracycline tolerability in hematologic malignancies:Treat to each heart's content[J].Blood Reviews,2016,30(3):169-178.
[2]SHAIKH F,DUPUIS L L,ALEXANDER S,et al.Cardioprotection and Second Malignant Neoplasms Associated With Dexrazoxane in Children Receiving Anthracycline Chemotherapy:A Systematic Review and Meta-Analysis[J].J Natl Cancer Inst,2016,108(4):357.
[3]马军,沈志祥,秦叔逵.防治蒽环类抗肿瘤药物心脏毒性的中国专家共识(2011版)[J].临床肿瘤学杂志,2011,12:1122-1129.
[4]DESAI V G,HERMAN E H,MOLAND C L,et al.Development ofdoxorubicin-induced chronic cardiotoxicity in the B6C3F1 mouse model[J].Toxicol Appl Pharmacol,2013,266(1):109-121.
[5]GANDHI H,PATEL V B,MISTRY N,et al.Doxorubicin mediated cardiotoxicity in rats:protective role of felodipine on cardiac indices[J].Environ Toxicol Pharmacol,2013,36(3):787-795.
[6]RAHIMI B M,MOMENY M,BABAEIKELISHOMI R,et al.The modulatory effect of lithium on doxorubicin-induced cardiotoxicity in rat[J].Eur J Pharmacol,2010,641(2/3):193-198.
[7]DESAI V G,C K J,VIJAY V,et al.Early biomarkers of doxorubicin-induced heart injury in a mouse model[J].Toxicol Appl Pharmacol,2014,281(2):221-229.
[8]GARRONE O,CROSETTO N,LO N C,et al.Prediction of anthracycline cardiotoxicity after chemotherapy by biomarkers kinetic analysis[J].Cardiovasc Toxicol,2012,12(2):135-142.
[9]CARVALHO F S,BURGEIRO A,GARCIA R,et al.Doxorubicin-induced cardiotoxicity:from bioenergetic failure and cell death to cardiomyopathy[J].Med Res Rev,2014,34(1):106-135.
[10]OCTAVIA Y,TOCCHETTI C G,GABRIELSON K L,et al.Doxorubicin-induced cardiomyopathy:from molecularmechanisms to therapeutic strategies[J].J Mol Cell Cardiol,2012,52(6):1213-1225.
[11]STERBA M,POPELOVA O,VAVROVA A,et al.Oxidative stress,redox signaling,and metalchelation in anthracycline cardiotoxicity and pharmacological cardioprotection[J].Antioxid Redox Signal,2013,18(8):899-929.
[12]CARVALHO F S,BURGEIRO A,GARCIA R,et al.Doxorubicin-induced cardiotoxicity:from bioenergetic failure and cell death to cardiomyopathy[J].Med Res Rev,2014,34(1):106-135.[13]MERCURIO V,PIROZZI F,LAZZARINI E,et al.Models of heart failure based on the cardiotoxicity of anticancer drugs[J].J Card Fail,2016,22(6):449-458.
[14]KIM S Y,KIM S J,KIM B J,et al.Doxorubicin-induced reactive oxygen species generation and intracellular Ca2+increase are reciprocally modulated in rat cardiomyocytes[J].Exp Mol Med,2006,38(5):535-545.
[15]CARDINALE D,COLOMBO A,BACCHIANI G,et al.Early detection of anthracycline cardiotoxicity and improvement with heart failure therapy[J].Circulation,2015,131(22):1981-1988.
[16]赵芳,王娟,张睿,等.右丙亚胺对蒽环类药物所致心脏毒性的防治作用[J].中国药业,2015,7:86-87.
[17]van DALEN E C,CARON H N,DICKINSON H O,et al.Cardioprotective interventions for cancer patients receiving anthracyclines[J].Cochrane Database Syst Rev,2011,6:D3917.
[18]ROSA G M,GIGLI L,TAGLIASACCHI M I,et al.Update on cardiotoxicity of anti-cancer treatments[J].Eur J Clin Invest,2016,46(3):264-284.
[19]KOCABAS A,KARDELEN F,ERTUG H,et al.Assessment of early-onset chronic progressive anthracycline cardiotoxicity in children:different response patterns of right and left ventricles[J].Pediatr Cardiol,2014,35(1):82-88.
[20]CARDINALE D,COLOMBO A,LAMANTIA G,et al.Anthracycline-induced cardiomyopathy:clinical relevance and response to pharmacologic therapy[J].Journal of the American College of Cardiology,2010,55(3):213-220.
[21]DOROSHOW J H.Dexrazoxane for the prevention of cardiac toxicity and treatment of extravasation injury from the anthracycline antibiotics[J].Curr Pharm Biotechnol,2012,13(10):1949-1956.
[22]JIRKOVSKY E,LENCOVA-POPELOVA O,HROCH M,et al.Early and delayed cardioprotective intervention with dexrazoxane each show different potential for prevention of chronic anthracycline cardiotoxicity in rabbits[J].Toxicology,2013,311(3):191-204.
[23]NEUMANN S,BRADKE F,TESSIER-LAVIGNE M,et al.Regeneration of sensory axons within the injured spinal cord induced by intraganglionic cAMP elevation[J].Neuron,2002,34(6):885-893.
[24]NAKAE I,MITSUNAMI K,OMURA T,et al.Proton magnetic resonance spectroscopy can detect creatine depletion associated with the progression of heart failure in cardiomyopathy[J].J Am Coll Cardiol,2003,42(9):1587-1593.
[25]陈纯,周雪贞,范毅敏,等.磷酸肌酸钠治疗儿童急性白血病蒽环类抗生素致心脏毒性的疗效分析[J].中华肿瘤防治杂志,2008,15(19):1503-1505.
(童颖丹 编辑)
Analysis of cardiotoxicity of Anthracyclines and relevant proposals for their clinical use
Lin Wang1,Xue Yang1,Ling-fang Xiao1,Chang-ping Hu2,Zhi-cheng Gong1
(1.Department of Pharmacy,Xiangya Hospital,Central South University,Changsha,Hunan 410008,China;2.Department of Pharmacology,School of Pharmaceutical Sciences,Central South University,Changsha,Hunan 410078,China)
ObjectiveTo discuss the measures of prevention and mitigation of cardiotoxicity caused by Anthracyclines,so as to provide reference for reasonable clinical application.MethodsA total of 360 patients with malignant tumors were enrolled in the study.The results of electrocardiogram (ECG)and the use of cardioprotective drugs were analyzed when the patients were treated with Anthracycline chemotherapy.There were two heart protection schemes in the study,i.e.single use of Dexrazoxane,and combined use of Calcium Dibutyryladenosine Cyclophosphate and Sodium Phosphocreatine.Their protective effect on heart was compared by chi-square analysis.ResultsThe incidence of cardiac toxicity induced by Anthracyclines was 11.2%.Chisquare analysis showed that the heart protection effect of the two schemes was remarkable,but there was no significant difference between the two heart protection schemes (P>0.05).ConclusionsAnthracyclines may cause serious cardiotoxicity.Monitoring of cardiac function and appropriate use of cardioprotective drugs in the treatment are effective methods to prevent or slow down cardiac toxicity.
Anthracyclines;cardiotoxicity;ECG;cardioprotection
R969.3;R979.14
A
10.3969/j.issn.1005-8982.2017.12.021
1005-8982(2017)12-0101-05
2016-07-18
中南大学研究生创新项目(No:2016zzts528);湖南省科技计划项目(No:2015SK2035)
龚志成,Tel:0731-84327306,Email:gongzhicheng2013@163.com
