乳腺浸润性导管癌超声征象与生物学指标相关性的研究
2017-07-18姜文彬
姜文彬,任 甫
(锦州医科大学,辽宁 锦州 121001)
◁乳腺影像学▷
乳腺浸润性导管癌超声征象与生物学指标相关性的研究
姜文彬,任 甫
(锦州医科大学,辽宁 锦州 121001)
目的:探讨乳腺浸润性导管癌(Invasive ductal carcinoma,IDC)的超声征象与分子生物学标记物表达的相关性。方法:回顾性描述经手术病理证实为乳腺IDC的117例患者彩色多普勒超声征象,包括肿块大小、边缘、形态、钙化、后方回声和血流显像分级、淋巴结转移及侵犯周围组织,并采用免疫组化方法检测雌激素受体(Estrogen receptor,ER)、孕激素受体(Progesterone receptor,PR)、人类表皮生长因子受体 2(Human epidermal growth factor receptor,HER-2)、Ki67、p53 的表达情况,分析其与超声表现的相关性。结果:ER、PR、HER-2、Ki67、p53在乳腺IDC组织的阳性率分别为70.9%、59.0%、66.7%、70.1%、51.3%。乳腺IDC超声表现边缘“毛刺征”与ER、PR表达相关(P<0.05);肿块内微小钙化与HER-2、Ki67表达相关(P<0.05);后方回声衰减、血流分级2~3级与HER-2、Ki67、p53表达呈正相关,与ER、PR表达水平无明显相关性(P>0.05);发生淋巴转移及周围组织浸润与否与 ER、PR、HER-2、Ki67、p53 表达有相关性(P<0.05);而肿块大小、形态与 ER、PR、HER-2、Ki67、p53 表达无明显相关性(P>0.05)。Ki67 与 HER-2、p53 与 HER-2 的表达程度呈正相关(r=0.290,P=0.001;r=0.254,P=0.006)。Ki67 与 p53 表达程度呈正相关(r=0.222,P=0.016)。结论:乳腺IDC超声征象与ER、PR、HER-2、Ki67、p53表达存在相关性,超声征象显示的恶性程度在一定程度上与ER、PR的低表达和HER-2、Ki67、p53的高表达相关,为乳腺癌患者的个性化治疗及预后评估提供指导依据。
乳腺肿瘤;生物学;超声检查,多普勒,彩色
乳腺浸润性导管癌(Invasive ductal carcinoma,IDC)是乳腺癌最常见的类型,严重危害女性生命健康。彩色多普勒超声技术应用于乳腺肿瘤的诊断,在对乳腺肿瘤评价和鉴定乳腺肿瘤的良恶性方面发挥重要作用,同时也为临床的诊疗提供指导依据[1-2]。近年来,开始将乳腺癌的影像学与病理学相联合,利用生物学标记物和免疫技术,在分子水平研究乳腺癌的特征[3]。
雌激素受体(Estrogen receptor,ER)和孕激素受体(Progesterone receptor,PR)是甾体类激素受体中最具代表性的,乳腺癌组织中ER、PR有无表达及表达程度与患者治疗和预后判断紧密相关。人类表皮生长因子受体2(Human epidermal growth factor receptor,HER-2)作为一种原癌基因,是影响细胞生长、增殖和存活的重要因子。Ki-67抗原参与细胞周期性变化和细胞增殖[4];p53是调控肿瘤发生、细胞凋亡的重要抑癌蛋白[5]。 因此,ER、PR、HER-2、Ki-67、p53成为乳腺癌常用的生物学标志物,其基因表达的改变从不同层面体现乳腺癌的生物学行为,由此引发的病理组织学改变形成了多种影像学征象。本研究通过免疫组织化学技术对乳腺IDC进行分型,并对超声表现与分子标记物之间特征进行比较并分析相关性,以提高超声检查对IDC的诊断水平,为乳腺癌患者的个性化治疗及预后评估提供指导依据,进而优化超声检查在IDC诊疗中的作用。
1 资料与方法
1.1 标本来源
收集我院2014年6月—2015年12月期间保存的石蜡包埋的乳腺IDC组织标本117例,均经病理检查核实。患者均为女性,年龄22~78岁,平均(44.35±8.76)岁,中位年龄48岁。患者术前均行彩色多普勒超声检查,未行放化疗及生物治疗且无远处转移病灶,术后采用免疫组织化学染色法对标本进行 ER、PR、HER-2、Ki67、p53 指标的检测。
1.2 仪器及方法
应用LOGIQ P6彩色多普勒超声诊断仪 (美国GE公司)。检查时患者仰位,使用高频探头(探头为11L)经体表直接检查,以乳头为中心,从乳腺12点处沿顺时针方向,从乳腺边缘向乳头作连续性放射状检查,之后对腋窝检查,检查有无淋巴结肿大及形态、血流改变。发现肿块时记录肿块大小(直径≥2cm,<2 cm)、边缘(有毛刺,无毛刺)、形态(规则,不规则)、微小钙化(有,无)、后方回声(衰减,无衰减)、肿块边界是否清晰、血流分布(0~1级,2~3级)及有无淋巴结转移和周围组织侵润。彩色血流显像分级按Adler血流分级法,分为0~1级和2~3级。
1.3 主要试剂
兔抗人 ER、PR、HER-2、Ki67、p53 单克隆抗体购自Abcam公司,酶标羊抗兔IgG 聚合物(二抗),DAB显色试剂盒购自福州迈新生物技术开发有限公司。其余试剂均由锦州医科大学实验中心提供。
1.4 免疫组织化学方法
采用免疫组化方法检测组织ER、PR、HER-2、Ki67、p53的表达。组织标本用10%福尔马林固定24 h,常规石蜡包埋,制备5 μm厚连续切片,60℃烤片2 h。免疫组化染色:①石蜡切片常规二甲苯脱蜡。②对组织抗原进行高压热修复(220℃,2 min):柠檬酸抗原修复液(0.01M,PH 6.0)。③3%H2O2室温下孵育10 min,以消除内源性过氧化物酶活性。PBS冲洗 3 次 (5 min/次)。 ④滴加一抗:ER、PR、HER-2、Ki67、p53均采用即用型工作液。室温孵育60 min,PBS冲洗3次(5 min/次)。⑤滴加试剂:滴加聚合物增强剂(试剂A),孵育20 min,PBS冲洗后滴加酶标羊抗兔IgG聚合物(试剂B),孵育30 min。⑥滴加新鲜配制的DAB显色液,显微镜下观察显色满意后终止反应。⑦蒸馏水冲洗,苏木素复染3~5 min,1%盐酸酒精分化5 s,流水冲洗30 min。⑧梯度酒精脱水,二甲苯透明,中性树脂封片。每次以PBS替代一抗作为阴性对照。
1.5 判定标准
随机选取10个高倍视野(×400)进行统计,计数每个高倍镜视野中细胞阳性表达率。ER、PR、Ki67、p53定位于细胞核,HER-2定位于细胞膜。ER、PR、p53:高倍镜视野着色细胞<10%为阴性(-);阳性细胞数10%~25%为弱阳性 (+);阳性细胞数26%~50%为阳性(++);阳性细胞数>50%为强阳性(+++)。Ki67:高倍镜视野着色细胞<15%为阴性(-);阳性细胞数15%~25%为弱阳性 (+);阳性细胞数26%~50%为阳性(++);阳性细胞数>50%为强阳性(+++)。 HER-2:(-):细胞膜无阳性表达或非特异着色,或着色细胞<10%;(+):>10%的区域有胞膜染色,程度较弱且不连续;(++):>10%的区域有胞膜染色,染色强度中等且显色连续;(+++):>10%的区域有胞膜染色,染色强阳性且显色连续。
1.6 统计学分析
应用统计学软件SPSS 17.0进行统计分析,计数资料比较采用χ2检验和Spearman轶相关检验。P<0.05为差异有统计学意义。
2 结果
2.1 超声征象特征
117例乳腺IDC中,肿块大于2 cm 63例,边缘毛刺征95例,形态不规则74例,微小钙化61例,后方回声衰减41例,血流分级2~3级68例,淋巴结转移54例,侵犯周围组织37例。见图1。
2.2 细胞分子生物学指标表达及相关性
117例乳腺IDC患者癌细胞ER阳性表达83例(70.9%),PR 阳性表达 69例(59.0%);HER-2 阳性表达 78例 (66.7%),Ki67阳性表达 82例(70.1%)、p53阳性表达 60例(51.3%),见表 1和图2~6。117例患者癌细胞Ki67、p53与HER-2的表达程度比较,差异有统计学意义 (χ2=9.866,P=0.002;χ2=7.543,P=0.006)。 Ki67、p53 与 ER、PR 的表达程度比较,差异无统计学意义(P>0.05)。经相关分析,Ki67、p53与HER-2的表达程度呈正相关(r=0.290,P=0.001;r=0.254,P=0.006),见表 2。 Ki67 与 p53 同时阳性为48例,同为阴性表达23例;在Ki67阴性表达的35例中,p53阳性表达12例,阴性表达23例;经统计学检验,Ki67与P53表达程度呈正相关(r=0.222,P=0.016)。 由此可见,HER-2、Ki67、p53 三者之间呈正相关。

图1 彩色多普勒超声征象。图1a:肿块边界不清,形态不规则,2.5 cm×1.3 cm。图1b:实性肿块伴多发钙化,呈砂粒样。图1c:肿块边界不清,形态不规则,后方回声衰减。图1d:实性肿块,少许血流,后方回声略增强。图1e:肿块伴多发钙化及液化,血流较丰富。图1f:腋下淋巴结转移。Figure 1. Color Doppler ultrasonography.Figure 1a:Tumor with unclearly boundary and irregular-shaped by 2.5 cm×1.3 cm.Figure 1b:A solid-appearing mass with multiple grit calcification.Figure 1c:Tumor with unclearly boundary,irregular-shaped and posterior attenuation.Figure 1d:A solid-appearing mass with poor blood flow signal and slightly increased posterior acoustic.Figure 1e:Tumor with multiple calcification,liquidation and rich blood flow signal.Figure 1f:Axillary lymph node metastasis.

表 1 乳腺 IDC患者 ER、PR、HER-2、Ki67、p53的表达
2.3 超声征象与分子生物学指标的关系
乳腺IDC肿块超声表现边缘“毛刺征”与ER、PR表达相关,肿块内微小钙化与HER-2、Ki67表达相关,后方回声衰减、血流分级2~3级与HER-2、Ki67、p53表达相关,发生淋巴转移及周围组织浸润与否与 ER、PR、HER-2、Ki67、p53 表 达有 相关 性(P<0.05), 而肿块大小、 形态与 ER、PR、HER-2、Ki67、p53 表达无明显相关性(P>0.05)。见表 3,4。

图 2 乳腺 IDC 组织中 ER 的表达。 图 2a:阴性(-)。 图 2b~2d:ER 阳性表达于细胞核。 图 2b:(+),图 2c:(++),图 2d:(+++)。Figure 2. The expression of ER in breast IDC.Figure 2a:Negative(-).Figure 2b~2d:The positive expression of ER in the nucleus.Figure 2b:(+),Figure 2c:(++).Figure 2d:(+++).

图 3 乳腺 IDC 组织中 PR 的表达。 图 3a:阴性(-)。 图 3b~3d:PR 阳性表达于细胞核。 图 3b:(+),图 3c:(++),图 3d:(+++)。Figure 3. The expression of PR in breast IDC.Figure 3a:Negative(-).Figure 3b~3d:The positive expression of PR in the nucleus.Figure 3b:(+),Figure 3c:(++),Figure 3d:(+++).

图 4 乳腺 IDC 组织中 HER-2 的表达。 图 4a:阴性(-),图 4b~4d:HER-2 阳性表达于细胞膜。 图 4b:(+),图 4c:(++),图 4d:(+++)。Figure 4.The expression of HER-2 in breast IDC.Figure 4a:Negative(-).Figure 4b~4d:The positive expression of HER-2 in the cytomembrane.Figure 4b:(+),Figure 4c:(++),Figure 4d:(+++).

图 5 乳腺 IDC 组织中 Ki67 的表达。 图 5a:阴性(-),图 5b~5d:Ki67 阳性表达于细胞核。 图 5b:(+),图 5c:(++),图 5d:(+++)。Figure 5.The expression of Ki67 in breast IDC.Figure 5a:Negative(-).Figure 5b~5d:The positive expression of Ki67 in the nucleus.Figure 5b:(+),Figure 5c:(++),Figure 5d:(+++).
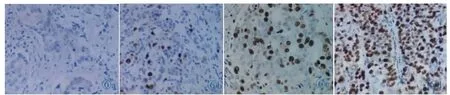
图 6 乳腺 IDC 组织 p53 中的表达。 图 6a:阴性(-),图 6b~6d:p53 阳性表达于细胞核。 图 6b:(+),图 6c:(++),图 6d:(+++)。Figure 6. The expression of p53 in breast IDC.Figure 6a:Negative(-).Figure 6b~6d:The positive expression of p53 in the nucleus.Figure 6b:(+),Figure 6c:(++),Figure 6d:(+++).
3 讨论
目前,国内外对乳腺癌的分子生物学指标与影像学之间的关系少有研究。从理论上讲,癌基因、抑癌基因及生物因子的表达可引起生物学和组织学变化,进而形成多种影像征象,肿瘤生物标志物和肿瘤影像学之间存在一定程度的内在关联[6]。ER和PR是目前乳腺癌研究最多的甾体类激素受体,其表达程度与临床治疗和预后相关。HER-2是细胞生长、增殖和分化的关键调节蛋白。Ki67、p53表达在乳腺癌发展进程中,从不同角度体现乳腺癌的生物学行为。因此,乳腺癌的超声表现与ER、PR、HER-2、Ki67、p53的表达可能存在一定关联。
本实验依据免疫组化结果和彩色多普勒超声分析,ER、PR阳性表达率在肿块≥2 cm的病例低于肿块<2 cm 的病例,HER-2、Ki67、p53 则在肿块≥2 cm病例中高表达,但差异均无统计学意义(P>0.05)。提示乳腺IDC中ER、PR表达下降与肿瘤分化差、生长速度快、激素受体合成能力低有关。边缘毛刺征是IDC典型超声征象,乳腺导管及周围纤维组织异常
增生形成边缘毛刺。有边缘毛刺征的乳腺IDC常常出现在侵袭性低,预后较好的肿瘤中。本研究结果显示:边缘毛刺征与ER、PR表达呈正相关,而与HER-2、Ki67、p53的表达水平无相关性,提示边缘毛刺征可能会限制癌细胞的扩散,具有早期的保护作用。HER-2、Ki67高表达于发生微小钙化的肿块,说明微小钙化的超声征象与HER-2、Ki67表达存在相关性。研究发现,HER-2过度表达常见于发生簇状钙化的乳腺导管原位癌,提示微钙化与恶性病变关系密切。后方回声衰减与HER-2、Ki67、p53阳性表达正相关,与ER、PR表达水平无明显相关性。癌组织高含量的胶原纤维导致其对声能的吸收量加大,进而导致后方回声衰减的现象。因此,肿块后方回声可用于评估癌细胞HER-2、Ki67、p53的表达情况,进而判断乳腺癌生物学行为和评估预后。ER、PR阳性率在血流信号分级为0~1级中较高 (P>0.05),而HER-2、Ki67、p53 阳性率在 2~3 级中显著增加(P<0.05), 说明 HER-2、Ki67、p53 阳性表达与血流丰富呈正相关。同时乳腺IDC超声征象表现为血流丰富者其恶性程度高,这一点与ER、PR低表达和HER-2、Ki67、p53高表达提示乳腺IDC高恶性程度相一致。ER、PR阳性表达率在发生淋巴转移和组织侵润病例中明显低于未发生者(P<0.05)。ER、PR阳性的乳腺IDC增生分数较低,分化较好,发生转移的几率也较少,内分泌治疗效果明显。据相关报道,淋巴结转移状态可作为预测乳腺IDC预后的独立因素[7]。Li等[8]研究显示发生淋巴结转移的乳腺癌细胞中ER表达多为阴性,可能是由于乳腺癌患者外周血中ER高含量,进而导致癌组织内ER减少,因此ER阴性率高常代表癌组织侵袭力强,分化度差,转移率高。HER-2、Ki67、p53在发生淋巴结转移组阳性表达率高(P<0.05)。
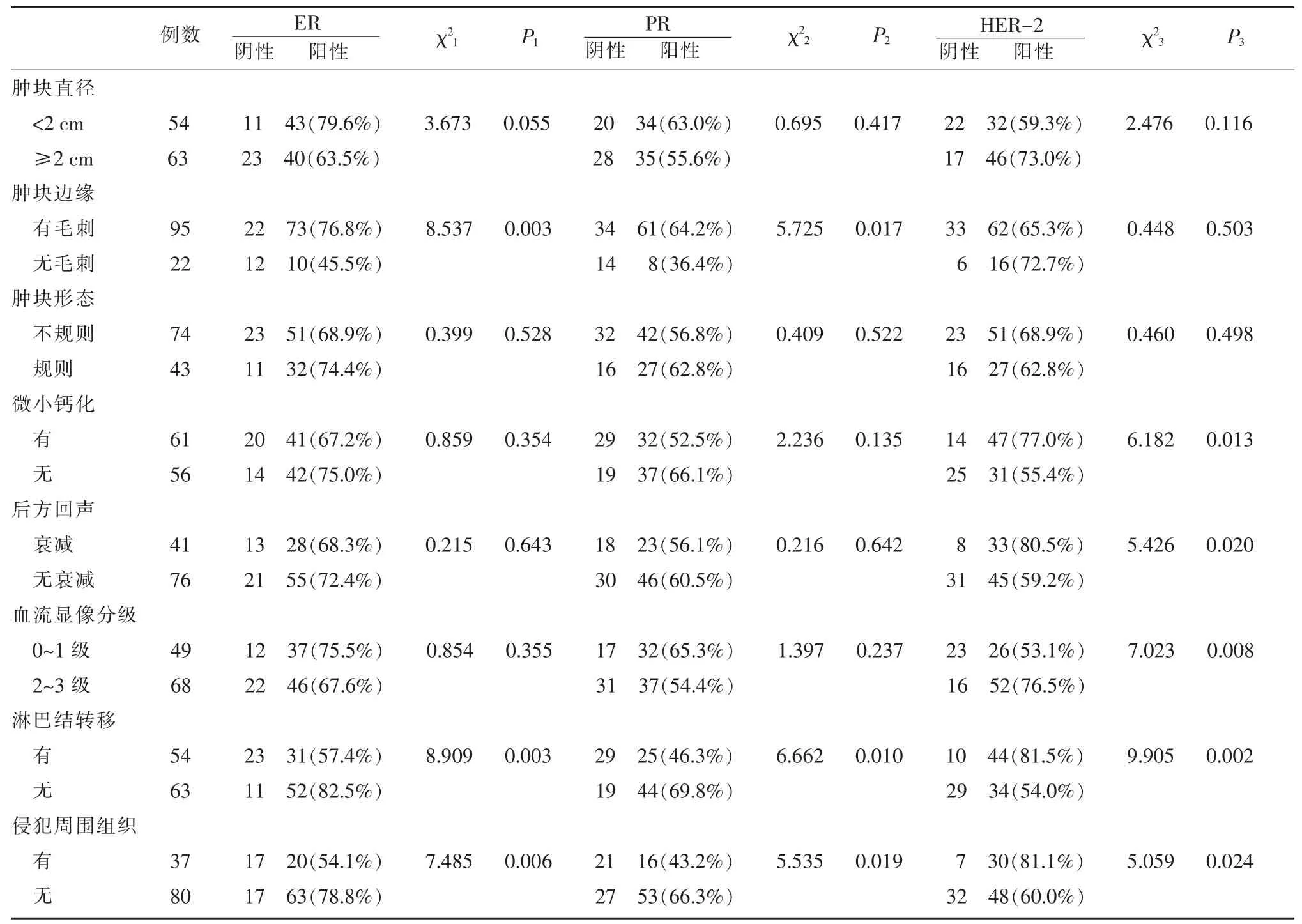
表3 乳腺IDC ER、PR、HER-2表达与超声征象的关系

表4 乳腺IDC Ki67、p53表达与超声征象的关系
本实验运用Spearman法进行相关性分析,结果显示乳腺 IDC中 HER-2与 Ki67、p53表达呈正相关。Shokouh等[9]研究显示年轻的乳腺癌患者中,HER-2高表达者Ki67、p53阳性表达率显著升高,肿瘤有较强的损害性和侵袭性。提示HER-2、Ki67、p53阳性表达是乳腺癌恶性的预警指标。Engels等[10]报道,由于p53的细胞增值指数低,在区分乳腺癌类型时应与Ki67联检。Laurinavicius等[11]实验发现Ki67和p53基因联检可有效区分管腔型IDC,在ER阳性患者的治疗过程中具有实用意义。Shapochka等[12]研究发现基底样肿瘤类型与p53表达增加和HER-2过表达相关联。本研究结果提示HER-2、Ki67、p53可作为乳腺IDC恶性转化的预警指标,客观反映乳腺IDC的恶性程度,对于诊断、个体化治疗以及判断预后效果发挥重要作用。HER-2、Ki67、p53三联检查有望成为乳腺IDC临床诊断和预测预后的新趋势及个性化治疗的新靶点。
综上所述,乳腺IDC超声特征在一定程度上反映 ER、PR、HER-2、Ki67、p53 表达水平。乳腺超声检查可作为预测乳腺IDC患者生物学指标表达水平的无创性手段,在乳腺IDC术前诊断、临床诊疗及评估预后等方面提供可靠数据。HER-2、Ki67、p53联检可以相互补充以评估乳腺IDC的恶性程度及预后效果。
[1]Sudarshan VK,Mookiah MR,Acharya UR,et al.Application of wavelet techniques for cancer diagnosis using ultrasound images:A Review[J].Comput Biol Med,2016,69(1):97-111.
[2]商晓光.高频彩色多普勒超声对乳腺肿瘤的诊断及良恶性的鉴别诊断[J]. 中国煤炭工业医学杂志,2011,15(12):1915-1916.
[3]Yang Q,Liu HY,Liu D,et al.Ultrasonographic features of triple-negative breast cancer:a comparison with other breast cancer subtypes[J].Asian Pac J Cancer Prev,2015,16(8):3229-3232.
[4]McCormick Matthews LH,Noble F,Tod J,et al.Systematic review and Meta-analysis of immunohistochemical prognostic biomarkers in resected oesophageal adenocarcinoma[J].Br J Cancer,2015,113(1):107-118.
[5]Kimiloglu sahan E,Erdogan N,Ulusoy I,et al.P53,KI-67,CD117 expression in gastrointestinaland pancreatic neuroendocrine tumours and evaluation of their correlation with clinicopathological and prognostic parameters[J].Turk J Gastroenterol,2015,26(2):104-111.
[6]王少春,陈东风,曹长军,等.乳腺癌患者超声钼靶X线表现及分子生物学指标临床观察 [J].济宁医学院学报,2013,36(4):261-271.
[7]Yuan P,Xu B,Wang C,et al.Ki-67 expression in luminal type breast cancer and its association with the clinicopathology of the cancer[J].Oncol Lett,2016,11(3):2101-2105.
[8]Li JW,Mo M,Yu KD,et al.ER-poor and HER2-positive:a potential subtype of breast cancer to avoid axillary dissection in node positive patients after neoadjuvant chemo-trastuzumab therapy[J].PLoS One,2014,9(12):e114646-114648.
[9]Shokouh TZ,Ezatollah A,Barand P.Interrelationships Between Ki67,HER2/neu,p53,ER,and PR Status and Their Associations With Tumor Grade and Lymph Node Involvement in Breast Carcinoma Subtypes:Retrospective Observational Analytical Study[J].Medicine(Baltimore),2015,94(32):e1359-1364.
[10]Engels CC,Ruberta F,de Kruijf EM,et al.The prognostic value of apoptotic and proliferative markers in breast cancer[J].Breast Cancer Res Treat,2013,142(2):323-339.
[11]Laurinavicius A,Laurinaviciene A,Ostapenko V,et al.Immunohistochemistry profiles of breast ductal carcinoma:factor analysis of digital image analysis data[J].Diagn Pathol,2012,7(27):1543-1549.
[12]Shapochka DO,Zaletok SP,Gnidyuk MI.Relationship between NF-κB,ER,PR,Her2/neu,Ki67,p53 expression in human breast cancer[J].Exp Oncol,2012,34(4):358-363.
Correlation between ultrasonographic features with biological indicators in breast invasive ductal carcinoma
JIANG Wen-bin,REN Fu
(Jinzhou Medical University,Jinzhou Liaoning 121001,China)
Objective:To investigate the correlation between ultrasonographic features with expression of biological indicators in breast invasive ductal carcinoma(IDC).Methods:The 117 cases of breast IDC tissues confirmed by pathology were described retrospectively by color Doppler ultrasound signs,including tumor size,edge,shape,distribution of calcification and morphology,rear echo,grade of flowing image,metastasis to lymph node and surrounding tissues invasion.We used immunohistochemical methods to detect the expression of ER,PR,HER-2,Ki67,p53 and analyze their correlations with ultrasonographic features.Results:The positive rate of ER,PR,HER-2,Ki67 and p53 in breast IDC were 70.9%,59.0%,66.7%,70.1%,51.3%respectively.Edge “glitches” sign of ultrasonographic features had correlation with the expression of ER,PR(P<0.05).The microcalcifications within the mass had correlation with the expression of HER-2,Ki67(P<0.05).The features of rear echo attenuation and flow grade level 2~3 had positive correlation with the expression of HER-2,Ki67,p53,but had no significant correlation with ER,PR(P>0.05).Whether lymph node metastasis and infiltration of surrounding tissue had correlation with the expression of ER,PR,HER-2,Ki67,p53(P<0.05),and tumor size,shape had no significant correlation with ER,PR,HER-2,Ki67,p53(P>0.05).The level of Ki67 and HER-2,p53 and HER-2 were positively correlated(r=0.290,P=0.001;r=0.254,P=0.006).The expression of Ki67 and p53 was positively correlated(r=0.222;P=0.016).Conclusion:There has correlation between ultrasonographic features and molecular biological markers,such as ER,PR,HER-2,Ki67,p53.Malignancy ultrasono-graphic features display a certain extent with the low level of ER,PR and high level of HER-2,Ki67,p53,then provide the guiding basis for individualized treatment and prognosis evaluation of patients with breast cancer.
Breast neoplasms;Biology;Ultrasonography,Doppler,color
R737.9;R445.1
A
1008-1062(2017)02-0089-06
2016-05-16;
2016-07-28
姜文彬(1980-),男,辽宁抚顺人,副主任医师。现工作单位为辽宁省抚顺市中心医院神经内科。E-mail:371181223@qq.com
任甫,锦州医科大学,121001。 E-mail:aroma83@126.com
辽宁省自然科学基金计划(20102138)。
