射干麻黄汤对哮喘小鼠模型气道炎症及血清IL-6、IL-10水平的影响*
2017-07-18隋博文李明虎翟平平李明爽王浩王达李
隋博文李明虎翟平平李明爽王 浩王 达李 成
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2.黑龙江中医药大学,黑龙江哈尔滨 150040;3.黑龙江省中医研究院,黑龙江 哈尔滨 150040)
·研究报告·
射干麻黄汤对哮喘小鼠模型气道炎症及血清IL-6、IL-10水平的影响*
隋博文1李明虎2翟平平2李明爽2王 浩2王 达2李 成3
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2.黑龙江中医药大学,黑龙江哈尔滨 150040;3.黑龙江省中医研究院,黑龙江 哈尔滨 150040)
目的 观察射干麻黄汤对哮喘小鼠模型气道炎症及血清白细胞介素6(IL-6)、白细胞介素10(IL-10)水平的影响。方法 健康雄性SD小鼠60只,随机分为6组:空白对照组、哮喘模型组、地塞米松组、射干麻黄汤高、中、低剂量组,每组10只。采用卵清白蛋白(OVA)腹腔注射致敏及气道雾化激发构建小鼠哮喘模型,每组给予相对应的处置。末次干预24 h后,采集腹主动脉血、支气管肺泡灌洗液(BALF)、右肺下叶组织标本,分别运用ELISA法测定血清IL-6、IL-10的含量;光镜观察肺组织病理变化;HE染色对BALF中的细胞分类和计数。结果 1)射干麻黄汤高、中、低剂量组与哮喘模型组相比:IL-10水平升高(P<0.05)、IL-6水平下降(P<0.05)。与地塞米松组变化趋势相近。2)射干麻黄汤能明显减轻BALF中的嗜酸性粒细胞、中性粒细胞、淋巴细胞含量,减轻程度与地塞米松组相似。3)肺组织病理学变化哮喘模型组较空白对照组显著改变,治疗组较空白对照组呈不同程度改变、与哮喘模型组相比有一定差异。结论 射干麻黄汤对哮喘小鼠的气道炎症具有一定的拮抗作用,其机制可能与降低血清IL-6、升高IL-10水平相关。
支气管哮喘 射干麻黄汤 气道炎症 IL-6 IL-10
支气管哮喘是多种细胞和细胞因子共同参与调节支气管黏膜的慢性呼吸道疾病,以气道炎性改变为本质[1],其发病机制十分复杂。炎症细胞及其炎性因子相互构成的网络性改变是哮喘研究的重要领域。相关研究表明,白细胞介素6(IL-6)及白细胞介素10(IL-10)与支气管哮喘的发生密切相关[2]。射干麻黄汤是中医学治疗支气管哮喘(寒哮证)的代表方剂之一,能有效缓解患者的临床症状[3]。本实验旨在通过观察射干麻黄汤对哮喘模型小鼠肺组织的病理学改变、支气管肺泡灌洗液(BALF)中炎性细胞的分类及计数水平变化、IL-6及IL-10的含量变化,初步探讨其炎症细胞及炎性因子的网络性改变,揭示射干麻黄汤治疗哮喘的作用机制。现报告如下。
1 材料与方法
1.1 实验动物 健康SD小鼠60只,雄性,体质量20~24 g,合格证号SCXK(黑)2013-005,购自于黑龙江中医药大学实验动物中心。饲养环境SPF级,室温20.3~22.5℃,湿度40%~50%,饲喂鼠粮,自由饮用清洁自来水。
1.2 试药与仪器 卵清白蛋白 (OVA)(美国Sigma公司生产)、地塞米松注射液(1 mL∶5 mg,国药准字H20133353,天津天药药业股份有限公司生产)、射干麻黄汤药物 (黑龙江中医药大学附属第一医院天江药局)。小鼠IL-6 ELISA试剂盒、IL-10 ELISA试剂盒(上海乔羽生物有限公司);BSW-2A型超声雾化吸入器(鞍山贝尔思科技科技有限公司);H-2050R型超速冷冻离心机 (湖南湘仪实验室仪器开发有限公司);光学显微镜(OLYMPUS U-LBD-2,日本制造)。中药制备:射干麻黄汤药物组成为射干6 g,麻黄9 g,款冬花6 g,细辛3 g,紫菀6 g,五味子3 g,半夏9 g,生姜9 g,大枣3枚,使用中药配方颗粒(江阴天江药业),然后根据体表等效计量换算法进行换算[4],将天江制剂溶解于蒸馏水,配置成18.720 g/mL、7.488 g/mL、3.744 g/mL的混悬液,即射干麻黄汤高、中、低剂量溶液,存储于4℃条件下,备用。
1.3 分组与造模 60只SD小鼠适应性喂养7 d后,按数字表随机分为6组:空白对照组、哮喘模型组、地塞米松组、射干麻黄汤高、中、低剂量组,每组10只。采用OVA腹腔注射致敏和雾化吸入激发构造哮喘模型。除空白对照组外,其余各组小鼠均在第1、8日对小鼠行2 mL的OVA悬液 (包含100.00 mg的卵蛋白、100.00 mg的氢氧化铝充分溶解)腹腔注射而使小鼠致敏。从第15日开始,采用超声雾化器雾化1%OVA悬液对小鼠进行激发,每天雾化1次,每次0.5 h,直到小鼠出现神态异常、呼吸频率加快、腹肌抽搐、以足扰鼻等动作,连续雾化21 d。空白对照组:按哮喘模型组方法及步骤,使用等量的生理盐水代替OVA悬液行小鼠腹腔注射和雾化吸入。地塞米松组:于第15日雾化激发小鼠前30 min,开始每日灌服地塞米松,剂量为1 mg/kg。各射干麻黄汤组,于第15日雾化激发小鼠前30 min,开始给予灌服射干麻黄汤,高剂量组药物剂量为18.720 mg/kg、中剂量组药物剂量为7.488 mg/kg、低剂量组药物剂量为3.744 mg/kg。空白对照组和哮喘模型组从第15日雾化激发小鼠前30 min,用等体积的生理盐水灌服。所有小鼠每日灌服2次,连续给药21 d。
1.4 标本采集与检测 各组小鼠在最后1次灌胃给药24 h后,在小鼠腹腔内注射10%水合氯醛(0.35 mL/kg)进行麻醉,行无菌开胸手术,术中尽可能避开小鼠主要血管及内脏组织。用22 G静脉穿刺针的套针部分行小鼠气管插管,医用丝线结扎小鼠右肺门根部,缓慢注射3 mL生理盐水进入肺腔,轻力按摩胸部1 min,以充分灌洗,缓慢回抽,收集BALF,放置于离心管中备用,如此反复操作5次。采取右肺下叶组织,并且选用4%多聚甲醛溶液进行组织固定。用注射器从腹主动脉血管内采集3 mL血液,并收集新鲜血液于离心管中,同时加入肝素钠抗血液凝集,静置2 h后,3500 r/min,离心5 min,提取血清保存在-80℃条件的冰箱中。1)肺组织病理学观察:4%多聚甲醛溶液固定肺组织24 h后,梯度脱水,石蜡包埋48 h,5 μm厚度切片,HE染色,光镜下观察肺组织的病理改变。2)BALF中炎症细胞分类及计数测定:将少量的充分摇匀的BALF滴在细胞计数板上,光学显微镜下统计细胞总含量,统计后将BALF进行离心操作,2500 r/min离心15 min,并将沉渣制备成细胞涂片,采用HE染色法染色,镜下统计200个细胞并分类计数。3)血清IL-6和IL-10含量水平测定:采用ELISA法测定其含量水平。具体操作方法及步骤严格按照试剂盒说明书进行。
1.5 统计学处理 应用SPSS17.0统计软件分析。计量资料以(±s)表示。采用单因素方差分析,组间两两比较方差齐者用LSD法,方差不齐者用Dunnett T3法进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠行为学改变及死亡情况 各组小鼠激发前精神状况良好,无异常行为学表现。给药并激发后,空白对造组小鼠较给药激发前无明显变化。哮喘模型组精神亢奋、呼吸深快、腹肌抽搐、以足扰鼻等异常动作。与哮喘模型组相比,治疗组小鼠哮喘行为呈现不同程度减轻,以地塞米松组与空白对照组行为表现差异最小,哮喘模型组与空白对照组行为表现差距最大。本次实验过程中哮喘组模型组小鼠死亡2只,射干麻黄汤低剂量组小鼠死亡1只,地塞米松组小鼠死亡1只,其余存活。
2.2 小鼠肺组织病理学的影响 见图1。空白对照组镜下显示气道结构完整,纤毛分布均匀,黏膜及平滑肌未见炎性细胞浸润,肺泡结构正常,肺泡腔无渗出物,肺组织未见病理性改变。哮喘模型组气道壁出现褶皱,管腔变窄,杯状细胞增多,黏液增加,纤毛部分脱落,黏膜下出现大量炎性细胞,毛细血管扩张、充血,周围组织水肿,肺泡内出现炎性渗出物。治疗组较哮喘模型组肺组织病理改变呈现出不同程度减轻,其中射干麻黄汤低剂量组肺组织破坏重,地塞米松组最轻。

图1 各组小鼠肺组织比较 (HE染色,400倍)
2.3 各组BALF中炎性细胞计数及分类 见表1。哮喘模型组BALF中细胞总数、嗜酸性粒细胞、中性粒细胞、淋巴细胞含量水平明显较空白对照组高(P<0.05),以嗜酸性粒细胞组最为显著。射干麻黄汤高、中、低剂量组和地塞米松组中细胞总数及各类炎症细胞数量水平较哮喘模型组显著减少 (P<0.05),4组治疗组间数据两两对比,结果显示差异无统计学意义(P>0.05)。
表1 各组BALF中炎性细胞计数比较(×109/L,±s)

表1 各组BALF中炎性细胞计数比较(×109/L,±s)
与空白对照组比较,*P<0.05;与哮喘模型组比较,△P<0.05。下同。
组别 n空白对照组 10哮喘模型组 8射干麻黄汤高剂量组 10细胞总数 嗜酸性粒细胞 中性粒细胞 淋巴细胞11.80±2.14 1.90±0.73 5.00±1.24 2.60±1.07 29.50±5.87*4.87±1.24*15.50±4.14*9.12±2.29*20.0±3.26△3.20±1.13△9.20±2.54 5.20±1.68△射干麻黄汤中剂量组 10 20.50±3.83△3.40±1.26△9.30±2.54△5.70±1.70△射干麻黄汤低剂量组 9 20.66±4.12△3.44±1.01△9.33±1.73△6.00±1.41△地塞米松组 9 17.44±3.04△2.55±1.33△7.33±1.00△4.44±1.13△
2.4 各组血清IL-6、IL-10和IL-6/IL-10水平比较见表2。哮喘模型组与空白对照组相比较,哮喘模型组小鼠血清IL-6含量上升 (P<0.05),IL-10含量下降(P<0.05),IL-6/IL-10比值升高(P<0.05),其中以IL-6含量上升趋势最明显。地塞米松组和射干麻黄汤高、中、低剂量组与哮喘模型组相比较,IL-6水平降低(P<0.05),IL-10水平升高(P<0.05),IL-6/IL-10比值下降。治疗组组间相互比较,结果显示差异无统计学意义(P>0.05)。
表2 各组小鼠血清IL-6、IL-10水平和IL-6/IL-10比较(pg/mL,±s)
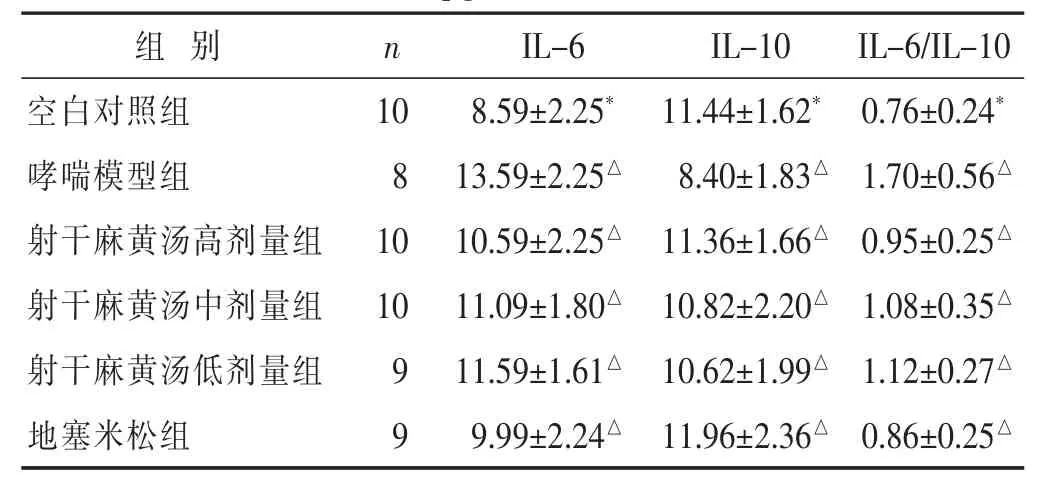
表2 各组小鼠血清IL-6、IL-10水平和IL-6/IL-10比较(pg/mL,±s)
组别 n空白对照组 10哮喘模型组 8射干麻黄汤高剂量组 10 IL-6 IL-10 IL-6/IL-10 8.59±2.25*11.44±1.62*0.76±0.24*13.59±2.25△8.40±1.83△1.70±0.56△10.59±2.25△11.36±1.66△0.95±0.25△射干麻黄汤中剂量组 10 11.09±1.80△10.82±2.20△1.08±0.35△射干麻黄汤低剂量组 9 11.59±1.61△10.62±1.99△1.12±0.27△地塞米松组 9 9.99±2.24△11.96±2.36△0.86±0.25△
3 讨 论
支气管哮喘是一种以慢性气道炎性病理改变为特征的多发性呼吸系统疾病。其慢性气道炎性病理改变与多种免疫细胞异常分化、激活以及细胞因子水平紊乱有关[5]。相关研究表明,除外辅助性T细胞2(Th2)细胞异常活化导致的Th1/Th2免疫失衡是支气管哮喘发生的机制之一,最新发现的调节性T细胞(Treg)/辅助性T细胞17(Th17)亦是哮喘的重要免疫学基础[6-7]。
Th17细胞是通过特异性转录调控因子ROR-yt调控以高水平分泌IL-17的一类不同于Th1、Th2的CD4+辅助性细胞亚群[8]。IL-6是Th17细胞通过分泌IL-17炎症介质来诱导产生的重要炎性细胞因子[9]。相关研究表明:在炎性反应及免疫应答过程中,IL-6作为重要炎症介质,对急性蛋白及IgE生成有促进作用[10]。T细胞是通过Marker Foxp3调控的一类功能性淋巴细胞群,是细胞维持稳态的关键因素,可防止自身免疫性疾病[8]。IL-10是Treg细胞分泌的特异性细胞因子。相关研究表明:在哮喘反应中,IL-10对炎性反应和自身免疫应答起抑制作用[10-11]。
支气管哮喘属于中医学“哮病”的范畴。中医学认为“哮病”的产生机制是内有痰饮伏肺、外有邪气入侵导致痰气交阻,以致肺气机紊乱,失于宣降而出现发作性痰鸣气喘症状,临床上尤以冷哮证居多。其以反复发作性喘息、呼吸困难、胸闷,伴咳嗽及痰鸣为主要临床表现。射干麻黄汤是中医学临床上治疗冷哮证的名方之一,通过外散表寒、内化痰饮而发挥平喘作用。方中射干开结消痰,配伍麻黄,能宣肺利咽、降逆平喘;紫菀、款冬花、半夏温肺化痰、降逆化饮;细辛温逐饮邪,配伍生姜,辛温发散,又加五味子固敛上逆之气,镇咳平喘;大枣益脾养胃。诸药相配,具温肺、利气、开痰的作用,共奏温肺散寒、化痰平喘之功。相关资料表明[11-12]:射干麻黄汤能有效减轻哮喘的气道炎性病理改变。西医药理学研究证实,其主要是通过降低炎症细胞数目[13-14]、加速气管内纤毛运动、降低痰液黏稠度来发挥祛痰、平喘、抗炎的功效[15-16],进而减轻哮喘患者上述临床症状,改善肺功能。
通过本实验观察发现,哮喘模型组BLAF中嗜酸性粒细胞、中性粒细胞含量明显上升,同时镜下肺组织黏膜及平滑肌出现大量炎性细胞浸润,给予射干麻黄汤与地塞米松干预后,无论BLAF及肺组织中炎性细胞均出现明显减少,且与射干麻黄汤的剂量呈正相关,表明射干麻黄汤能有效减轻气道炎性细胞浸润组织。对腹主动脉血中IL-6、IL-10的含量测定、比较中发现药物干预哮喘小鼠后,IL-10水平上升(P<0.05)、IL-6水平下降(P<0.05)、IL-6/IL-10比值减少。表明射干麻黄汤能抑制Th17细胞生成,促进Treg细胞产生,导致Treg/Th17的平衡受到破坏。
本实验观察到射干麻黄汤对哮喘小鼠气道炎症及IL-6、IL-10的水平影响,表明射干麻黄汤可能是通过抑制IL-6表达、加强IL-10表达,进一步调节Treg/ Th17的失衡,来减轻哮喘小鼠气道慢性炎症,但其复杂的炎症细胞与炎性因子构成的网络性改变,有待进一步的研究。
[1] 张业清,苏克雷,庞中化,等.宣肺平喘方对哮喘小鼠气道炎症及Th17/Treg平衡的影响[J].中国实验方剂学杂志,2016,22(6):119-123.
[2] 黄东晖,王慧贤,吴少丽,等.喘可治注射液对小鼠气道炎症Th17与Treg的影响[J].北京中医药大学学报,2014,37(5):333-336.
[3] 王芳,王敏.射干麻黄汤治疗哮喘的疗效及机制研究进展[J].医学研究生学报,2013,26(7):754-756.
[4] 熊远珍.实验动物与人用药量的新换算[J].南昌大学学报:医学版,1997,37(4):41.
[5] 何飞,徐俭朴,杨明华,等.芍药甘草汤对哮喘大鼠Treg/ Th17比例失衡的影响[J].中华中医药杂志,2016,31(11):19-21.
[6] 赵红,王长海,魏亚强.射干麻黄汤对哮喘小鼠气道炎症及外周血Th1/Th2平衡的影响[J].中国中医急症,2010,19(3):466-468.
[7] 乔靖,侯少贞,余翔,等.苏子降气汤对豚鼠哮喘模型Th17/ Treg平衡的影响[J].动物医学进展,2013,34(11):89-91.
[8] 韩根成,沈倍奋.Th17细胞分化、调节及效应研究进展[J].生物化学与生物物理进展,2008,35(2):117-123.
[9] 刘光伟,赵勇.CD4+T细胞的新亚型:Th17细胞及其生物效应[J].生物化学与生物物理进展,2007,34(4):348-353.
[10]龙正寅,朱慧志,朱舜之,等.阳和平喘颗粒对哮喘小鼠血清TNF-α和IL-6水平的影响[J].辽宁中医杂志,2016,43(7):1522-1524.
[11]王宏丽,郝小惠,王袁,等.白细胞介素-10和12在哮喘发病机制中的作用[J].广东医学,2015,36(12):1838-1841.
[12]祝丁,张超,赖天文,等.中药对支气管哮喘气道重塑干预机制研究进展[J].中国实用内科杂志,2016,36(8):694-697.
[13]林永廉,林求诚.射干麻黄汤对实验性哮喘豚鼠嗜酸性粒细胞凋亡的影响[J].实用中医药杂志,2007,23(1):3-5.
[14]王明明,项晓人,徐建亚.补肺益肾方对幼龄哮喘豚鼠肺内嗜酸粒细胞凋亡和IL-5受体表达的影响[J].医学研究生学报,2010,23(7):697-699.
[15]吴娜娜,张禹,李梅霞.射干麻黄汤治疗难治性哮喘患者的临床疗效研究[J].中国继续医学教育,2015,7(32):184-185.
[16]陈照南,陈昭玲.加减射干麻黄汤治疗支气管哮喘29例临床研究[J].内蒙古中医药,2014,33(16):4.
Effect of Shegan Mahuang Decoction on Asthma Mouse Model of Airway Inflammation and Serum IL-6and IL-10 Levels
SUI Bowen,LI Minghu,ZHAI Pingping,et al. The First Affiliated Hospital of Heilongjiang University of TCM,Heilongjiang,Harbin 150040,China.
Objective:To observe the effect of Shegan Mahuang Decoction on asthma mouse model of airway inflammation and serum IL-6 and IL-10 levels.Methods:60 healthy male SD mice were randomly divided into 6 groups:control group,asthma model group,Shegan Mahuang Decoction high,medium and low dose group and dexamethasone group with10 mice in each group.Mice models of asthma were established by intraperitoneal injection of OVA and airway atomization.Each group was given corresponding treatment.In 24 h after the last intervention,abdominal aortic blood,bronchoalveolar lavage fluid(BALF),right lower lobe tissue specimens were collected;the serum levels of interleukin(IL-6)and interleukin(IL-10)were measured by ELISA method.The pathological changes of lung tissue were observed by light microscopy,and the HE staining was used to classify and count the cells in BALF.Results:1)Compared with asthma model group,IL-10 level increased(P<0.05),IL-6 decreased(P<0.05)in Shegan Mahuang Decoction high,medium and low dose group.The trend of change was similar to that of dexamethasone group.2)Shegan Mahuang Decoction could significantly reduce eosinophils,neutrophils,lymphocytes content in BALF,but not as effective as dexamethasone.3)The pathological changes of lung tissue in model group was significantly more obvious than that in normal group,and the treatment groups were significantly different than the normal group,and there was a certain difference compared with the model group.Conclusion:Shegan Mahuang Decoction has certain antagonism on airway inflammation in asthmatic mice. Its mechanism may be related to the decrease of serum IL-6 and increase IL-10 level.
Bronchial asthma;Shegan Mahuang Decoction;Airway inflammation;IL-6;IL-10
R285.5
A
1004-745X(2017)05-0783-04
10.3969/j.issn.1004-745X.2017.05.009
2017-02-06)
黑龙江省自然科学基金项目(H201317)
