二氧化硫性质的探究教学及实验创新
2017-07-16马庆华宋焕民
马庆华+宋焕民
摘 要:教学过程中,尽量创设直观形象、生动有趣的情景,引导学生自主发现、提出富有挑战性的问题;组织学生分析讨论,提出假设;指导学生验证、证明假设;然后和学生共同归纳总结,得出结论。以力求实现:“以问题为线索,以实验活动为基础,以问题解决为形式,以能力培养为核心。”的宗旨。
关键词:探究性;思考;讨论;评价
著名教育心理学家布鲁纳指出“知识乃是一个过程,不是结果”。按照这一理念我在实际教学过程中,尽量创设直观形象、生动有趣的情景,引导学生自主发现、提出富有挑战性的问题;组织学生分析讨论,提出假设;指导学生验证、证明假设;然后和学生共同归纳总结,得出结论。以力求实现:“以问题为线索,以实验活动为基础,以问题解决为形式,以能力培养为核心。”的宗旨。下面,我想就高中化学课堂教学的一些实践,浅谈化学课堂中的探究教学。
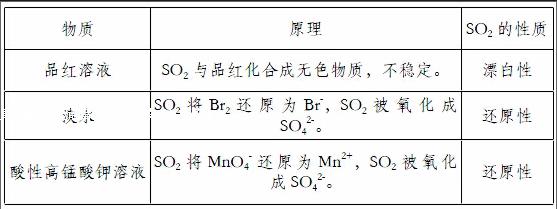
我结合高一学生的学情,在学习二氧化硫的性质时,我做了如下实验,将二氧化硫分别通入盛有品红溶液、酸性高锰酸钾溶液、溴水溶液、氢氧化钠的酚酞溶液的a、b、c、d四支试管,来证明二氧化硫具有漂白性、还原性以及酸性氧化物的性质,实验结果溶液均褪色。实验后学生提出疑问:为什么SO2使品红溶液褪色称为漂白性,SO2使溴水、酸性高锰酸钾溶液褪色称为还原性,而SO2使滴有酚酞的氢氧化钠溶液褪色却是酸性氧化物的性质?这时我组织学生思考、讨论,并设计了以下三个实验。
【学生实验1】取上述实验中a、b、c三支试管,在试管口各套上一只干瘪的气球,用细绳扎紧,分别放在酒精灯火焰上加热。a试管中的溶液变红后,再将a试管放入水中冷却。观察现象。
【实验现象】加热时,只有a试管中的溶液变红,气球变鼓,冷却后,溶液又变成无色,同时气球变瘪。其它试管中无明显现象。
【学生实验2】取c试管中的溶液,先滴加稀盐酸,再滴加BaCl2溶液。
【实验现象】滴加稀盐酸没有明显现象,再滴入BaCl2溶液产生白色沉淀。
【结论】溶液中含SO42-。
这时,学生提出,取b试管中的溶液,滴加BaCl2溶液和稀盐酸,产生白色沉淀,且白色沉淀不溶于稀盐酸,证明溶液中含SO42-可以吗?学生经过讨论得出,酸性高锰酸钾溶液是用稀硫酸酸化的,本来就含有SO42-。所以不能取b试管中的溶液。
为了使学生更好地掌握SO2的漂白性和还原性,我设计了如下表格引导学生填写:
【学生实验3】将d试管中的溶液分成4份,将其中一份加热、一份中滴入NaOH溶液、一份中滴入酚酞溶液,另一份作对比。观察现象。
【实验现象】加热时溶液不变红,滴入酚酞溶液时溶液也不變红;滴入NaOH溶液时溶液变红。
【结论】SO2使滴有酚酞的氢氧化钠溶液褪色不是因为SO2具有漂白性,而是SO2与氢氧化钠溶液反应使溶液碱性减弱的缘故。
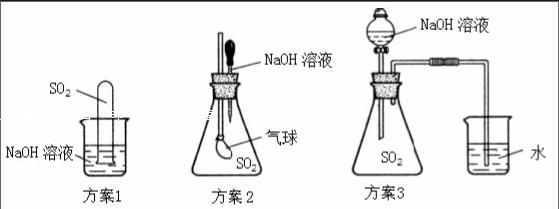
这时我引导学生思考,还可以设计那些实验证明SO2与NaOH溶液确实发生了化学反应?同学们经思考并讨论设计出了以下方案,我选取了几种典型的方案:
方案1:若试管内液面上升,说明锥形瓶内压强减小,即二氧化硫与氢氧化钠溶液发生了反应。
方案2:若气球鼓起来,说明锥形瓶内压强减小,即二氧化硫与氢氧化钠溶液发生了反应。
方案3:若烧杯中的水倒吸入盛有二氧化硫的锥形瓶中,说明锥形瓶内压强减小,即二氧化硫与氢氧化钠溶液发生了反应。
然后再组织学生讨论并作出评价。通过实验设计、探究且不断深入,学生自己独立思考,大胆探索 ,真正掌握了SO2的化学性质。
探究性教学从教学主体的角度强调学生的主观能动性和创造性。让学生在探究性学习的课题研究中和实验的设计中有更多的创造机会,让学生在探究中感受成功的体验,在成功中感受到学习的乐趣,是探究性学习的归宿和追求,我们必须通过一次次的探究性学习激发学生思维的灵活性和创造性。endprint
