双歧杆菌对溃疡性结肠炎小鼠肠损伤及肠道菌群的影响
2017-07-12郭慧慧宋慧李婷王淑媛卫佳丽
郭慧慧+宋慧+李婷+王淑媛+卫佳丽


摘要:本文探讨双歧杆菌MIMBb75对溃疡性结肠炎小鼠肠损伤及肠道菌群的影响。试验采用葡聚糖硫酸钠(DSS)诱导小鼠溃疡性结肠炎,随机分成7组:正常对照组、模型组、MRS-L培养基阴性对照组、美沙拉嗪阳性对照组、MIMBb75高剂量组、MIMBb75中剂量组及MIMBb75低剂量组,给药7天后处死小鼠,进行结肠长度、血中血红蛋白浓度及肠道菌群检测。结果显示:双歧杆菌能够有效抑制溃疡性结肠炎引起的小鼠血中血红蛋白浓度的下降,可以抑制溃疡性结肠炎引起的结肠长度的缩短;可以增加肠道菌群多样性,提高拟杆菌属及柔嫩梭菌的数量。说明双歧杆菌通过调节肠道微生态失调,对溃疡性结肠炎发挥治疗作用。
关键词:双歧杆菌MIMBb75;结肠炎;結肠损伤;DGGE;肠道菌群
中图分类号: R574.62 文献标识码: A DOI编号: 10.14025/j.cnki.jlny.2017.13.016
溃疡性结肠炎(ulcerative colitis,UC)是一种无地域差异、无种族差异的人群多发性肠道炎症疾病,主要表现在结肠、直肠的粘膜和粘膜下层受损引发炎症[1]。UC的临床表现主要以腹痛、腹泻、粘液脓血便以及不同程度的全身症状[2],其病因尚不明确,目前认为,UC的发病可能与肠腔内部抗原诱导免疫反应过度激活相关[3]。随着微生态学的发展,肠道微环境作为一个复杂的微生态系统与UC的发病有着紧密的联系。研究发现,UC患者肠道菌群失调,致病菌和条件致病菌增多,导致肠道粘膜通透性增加,而细菌代谢产物向粘膜固有层移位,引起免疫细胞的激活,诱发炎症反应[4]。一系列研究发现,溃疡性结肠炎患者体内双歧杆菌及乳酸菌等有益菌数量下降,大肠杆菌肠球菌等有害菌数量增多,提示肠道菌群可能参与溃疡性结肠炎的发生与发展。双歧杆菌是近年来被认可的益生菌,具有增强免疫力、抗衰老、抗肿瘤等生理功能,尤其是对肠道菌的平衡有很好的作用。本试验旨在研究双歧杆菌对UC小鼠结肠损伤及肠道菌群的影响。
1材料
1.1试验动物
清洁级昆明小鼠64只,体重18~22克,雌雄对半。来源:吉林大学动物实验室。昆明鼠在理科楼分子病学研究室进行为期7天的适应性喂养。
1.2药品
美沙拉嗪肠溶片购于葵花药业有限公司;双歧杆菌(MIMBb75)由吉大药厂馈赠,调节为108CFU/mL,107CFU/mL,106CFU/mL三个不同的浓度。
1.3 主要试剂
文-齐氏液(HiCN化高铁血红蛋白转化液)购于上海榕柏生物技术有限公司;葡聚糖硫酸钠(DSS,分子量36000~50000),购自美国MP Biomedicals公司。
1.4 主要仪器
低速离心机,购自上海安亭科学仪器厂;立式压力蒸汽灭菌器,购自上海申安医疗器械有限公司;水浴锅,购自上海贝凯生物化工设备有限公司;PCR仪,购自Thermo SCIENTIF
IC;电泳仪,购自北京君意东方电泳设备有限公司;DGGE电泳仪,购自北京君意东方电泳设备有限公司;凝胶成像仪,购自上海器仁仪器仪表有限公司。
2方法
2.1 试验动物分组及给药
63只清洁级昆明小鼠随机分为7组,每组9只。分别为空白组、DSS模型组、MRS-L培养基阴性对照组、美沙拉嗪阳性对照组、双歧杆菌高剂量组、双歧杆菌中剂量组及双歧杆菌低剂量组。各组小鼠适应性喂养7天,空腹处理4小时,除空白组外,其余各组自由饮用3%葡聚糖硫酸钠(DSS)且分别灌胃0.4mLMRS-L培养基,美沙拉嗪以及不同浓度的MIMBb75培养液。
2.2 结肠损伤相关指标检测
结肠长度测定:取整段结肠,量取长度并记录;血红蛋白测定:文-齐氏液检测各小鼠血中血红蛋白浓度,具体操作依照说明书进行。
2.3 肠道菌群检测
样品预处理:从-80℃冰箱中取出肠道菌群检测样品,将样品置于-20℃冰箱中1小时,再在冰盒上解冻20分钟。灭菌的2亳升离心管除皮称重,挑取0.2克左右混合物于离心管中,采用酚/氯仿/异戊醇法提取进行肠道内容物肠道菌DNA提取。PCR-DGGE检测肠道菌群多样性,取DGGE图谱的共性条带及特异性条带进行克隆测序,具体方法参照曾巧莉等人研究结果[5]。
2.4 统计学方法
采用spss23.0软件对实验数据进行统计分析,试验数据以“平均值±标准差”表示,采用F检验对正交试验结果进行差异性分析,用P<0.05表示差异显著。
3 结果与分析
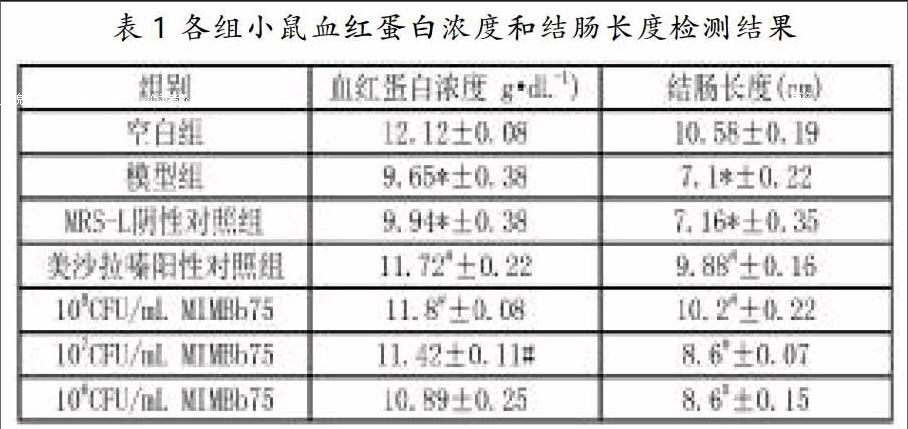
3.1各组小鼠结肠损伤相关指标测定
饮用DSS以后,与对照组相比,模型组与MRS-L阴性对照组小鼠血中血红蛋白浓度及结肠长度发生明显改变,血红蛋白浓度下降,结肠长度缩短,与空白组相比具有统计学意义(P<0.05),说明模型组小鼠结肠炎相关指标发生改变,并且MRS-L对DSS引起的结肠损伤无明显的改善作用,见表1。与模型组相比,美沙拉嗪阳性对照组及双歧杆菌(MIMBb75)各处理组血红蛋白浓度及结肠长度发生改变,血红蛋白浓度升高,结肠长度增加,与模型组相比具有统计学意义(P<0.05),说明双歧杆菌(MIMBb75)对DSS引起的结肠损伤具有一定的抑制作用,见表1。
3.2 MIMBb75对DSS诱导的结肠炎小鼠肠道菌群的影响
3.2.1 MIMBb75对DSS诱导的结肠炎小鼠肠道菌群多样性的影响 将PCR-DGGE图谱(图1)各组的条带数进行分析(表2),与空白组相比,MIMBb75高剂量组及中剂量组DNA条带数均显著升高(P<0.05);与DSS模型组相比MIMBb75高剂量组、中剂量组、低剂量组及美沙拉嗪组DNA条带数均显著升高(P<0.05);而与DSS对照组相比,MRS处理组DNA条带数无显著差异。
3.2.2 MIMBb75对DSS诱导的结肠炎小鼠肠道菌群相似性的影响
由图2可看出,MIMBb75中剂量组与MIMBb75高剂量组相似性系数为49.8%,MIMBb75低剂量组与MIMBb75高剂量组相似性系数为45%,美沙拉嗪对照组与MIMBb75高剂量组相似性系数为33.9%,MRS对照组与MIMBb75高剂量组相似性系数为41%,DSS模型组与MIMBb75高剂量组相似性系数为39%,空白组与MIMBb75高剂量组相似性系数为39.4%,由结果可以看出,MIMBb75不同剂量组间的相似性均高于与空白组、美沙拉嗪组及DSS模型组的相似性。
3.2.3 MIMBb75对DSS诱导的结肠炎小鼠肠道微生物种类的影响
表3可见,由于扩增出细菌的16SrDNA的V3区片段大小为200bp,而克隆仅能测出170bp左右。本实验并未检测出乳酸杆菌、双歧杆菌和大肠杆菌等优势菌群,主要以擬杆菌属、柔嫩梭菌属、多形杆菌为主,对比结果显示,1、6、12、14和16作为共性条带,分别为拟杆菌属Barnesiella intestinihominis、多形杆菌Bacteroides、柠檬酸杆菌[Citrobacter],MIMBb75处理组特异性条带为4、5、7、8、9、10、11、13、15、16、17、19和20,主要为拟杆菌属Barnesiella intestinihominis、柔嫩梭菌[Clostridum] leptum strain 及乳酸发酵梭菌[Clotridium]polysaccharolyticum strain,可以看出柔嫩梭菌及乳酸发酵梭菌在各组都存在,且在MIMBb75处理组更具优势。
4结论与讨论
溃疡性结肠炎(UC)的发病机制目前尚不清楚。近年来,随着遗传学、免疫学以及分子生物学等学科的发展,人们对UC的认识不断深入[6]。已有研究证明,UC的发病与环境因素、遗传因素、免疫因素以及肠道微生物密切相关。目前认为,肠道微生物屏障与机体的相互作用可能是UC发生的重要原因之一[7]。据报道显示,益生菌通过抑制NF-kB信号通路发挥抗溃疡性结肠炎的作用[8]。而本试验结果显示,MIMBb75高剂量组、中剂量组与低剂量组DNA条带数显著升高且MIMBb75高剂量组与MIMBb75中剂量组、低剂量组的相似性均较与空白组、MRS培养基阴性对照组、美沙拉嗪组及DSS组相似性高,说明MIMBb75各剂量组对小鼠肠道菌群结构有着相似的调节作用。分析可能的原因:双歧杆菌是益生菌,能够参与短链脂肪酸的合成,从而增强上皮细胞的屏障功能,阻止致病性的大肠杆菌入侵。张玲等研究发现,双歧杆菌三联活菌能有效抑制肠道内致病菌的生长[9]。徐俊燕等研究发现,美沙拉嗪联合双歧杆菌四联活菌能明显改善UC的临床症状,促进肠粘膜的愈合[10]。根据本实验结果初步推测,MIMBb75可以与肠道内原有的宿主微生物竞争,抑制有害菌生长,促进有益菌生长,增加小鼠肠道微生物多样性。
研究发现,益生菌能给上皮细胞(IECs)提供重要的能源物质,同时共生菌的代谢产物也促进IECs平衡。微生物能够介导膳食纤维及糖类物质的加工产生短链脂肪酸,如乙酸、丙酸和丁酸,而丁酸信号通过G蛋白偶联手提(GPR)109A诱导IEC IL-18的表达,从而抑制结肠炎相关性结肠癌(CAC)[11]。其他相关研究证明双歧杆菌能有衍生乙酸增强肠道上皮细胞抗凋亡反应,对肠道损伤发挥保护作用[12]。本实验的结果显示,MIMBb75处理组出现了特异性的柔嫩梭菌、乳酸发酵梭菌及柠檬酸杆菌等,降低肠道pH值,抑制病原微生物的入侵。由此可见,本试验小鼠结肠阻止损伤结果显示:MIMBb75各剂量组小鼠血中血红蛋白浓度升高,结肠长度增加,结肠损伤有所改善,这可能与MIMBb75添加衍生乙酸,降低肠道pH值,营造肠道酸性环境,抑制有害菌的生长有关。徐敏等研究发现益生菌可能通过抑制NF-kB 信号通路降低小鼠集体肠道炎症,改善结肠炎小鼠的病理学损伤。根据本实验结果初步推断,MIMBb75能够通过营造有益的肠道微环境降低肠道pH值,从而有利于肠道有益菌的定制,减少肠道有害菌,改善肠道菌微生态分布,从而抑制结肠炎小鼠的结肠损伤。
参考文献
[1]陈璐,CHENLu.溃疡性结肠炎发病机制的研究进展[J].疑难病杂志,2016,15(06):650-654.
[2]罗凤燕,白爱平.溃疡性结肠炎动物模型的研究进展[J].世界华人消化杂志,2013(07):607-613.
[3]Comito D, Romano C. Dysbiosis in the Pathogenesis of Pediatric Inflammatory Bowel Diseases[J].International Journal of Inflammation,2012,2012(14):687143.
[4] Fava F,Danese S.Intestinal microbiota in inflammatory bowel disease: friend of foe[J]. World journal of gastroenterology,2011,17(05):557.
[5]曾巧莉,宋慧,郭慧慧,等.金针菇菇脚对肉鸡盲肠菌群及短链脂肪酸的影响[J].中国农业大学学报,2016,21(05):104-114.
[6]金博. 肠道菌群移植与溃疡性结肠炎[J]. 世界华人消化杂志, 2017(01):23-30.
[7] Borody T J,Campbell J.Fecal microbiota transplantation: current status and future directions[J].Expert Review of Gastroenterology & Hepatology,2011,5(06):653.
[8]徐敏,赵莉,杜金城,等.益生菌混合物通过抑制NF-κB信号通路发挥抗溃疡性结肠炎功效的研究[J].食品工业科技,2016,37(17).
[9]张玲,李昌平,姜政,等.双歧杆菌三联活菌联合英夫利昔单抗治疗中重度溃疡性结肠炎的临床观察[J].中国药房,2017,28(05):629-632.
[10]徐俊燕,吴建业.美沙拉嗪联合双歧杆菌四联活菌片对溃疡性结肠炎患者脂质过氧化损伤保护作用的观察[J].药物流行病学杂志,2015(12):712-714.
[11]Singh N,Gurav A,Sivaprakasam S,et al.Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis[J]. Immunity,2014,40(01):128-39.
[12]Fukuda S, Hidehiro Toh, Koji Hase, et al. Bifidobacteria
can protect from enteropathogenic infection through production of acetate[J].Nature,2011.
作者简介:郭慧慧,在读硕士研究生,研究方向:微生物资源开发与利用。
通讯作者:宋慧,博士,教授,研究方向:生物大分子结构与功能。
