樟树幼苗根系分泌物中有机酸对PAHs胁迫的响应
2017-07-12张力刘益君陈毅
张力+刘益君+陈毅


摘要:根据当地PAHs自然沉降成分特点,设置了4个PAHs混合物浓度梯度:C(总PAHs含量为0 mg/kg),L(总PAHs含量为1.5 mg/kg)、M(总PAHs含量为7.5 mg/kg)和H(总PAHs含量为75 mg/kg),对樟树幼苗进行胁迫,提取培养基中根系分泌物,利用MALDI TOF/TOF测定了其中低分子有机酸,以探求根系分泌物中有机酸的变化规律。研究结果显示:乙酸、丙二酸分子量相对较低的有机酸含量随着PAHs胁迫程度的增加一直表现出上升趋势;对羟基苯甲酸、香草酸、没食子酸和柠檬酸分子量相对较高的有机酸含量随着PAHs胁迫程度的增加在M处理下达到峰值,但随着胁迫程度的继续升高在H处理下迅速降低;羟基苯甲酸、香草酸、没食子酸含量与植物根系活性和TOC、TN变化一致可以作为说明根系生长状况的指标。
关键词:根系分泌物;多环芳烃;有机酸;飞行时间质谱
中图分类号:S731.2
文献标识码:A 文章编号:16749944(2017)11007404
1 引言
环芳烃(PAHs)排放量随着能源消耗增加而迅速增长,由于其性质稳定,自然环境中降解周期长,因此在表层土壤积累量不断增加[1],并通过生态系统物质循环最终进入人体体内,对人类健康产生危害[2~5]。根系分泌物(root exudate)在微生物降解污染物中可作为基质并产生协同作用,而其中有机酸会在不同条件下对植物生长、土壤环境等产生影响,以及对矿物中某些元素释放产生促进。植物通过根系分泌有机酸是改善根际环境的重要手段,也是体现植物生长情况的重要指标[6~9]。
由于地下化学的不可见性和复杂性,以及根系分泌物成分的多样性,研究对PAHs根系分泌物的胁迫还存在一定困难。目前研究主要集中在根际环境对PAHs的降解,且研究对象多为农作物或一年生草本[10,11],而根系分泌物具体组分与PAHs之间的研究并不多见。樟树作为中国南方主要绿化树种,研究樟树根系分泌物中有机酸对PAHs的响应,阐明PAHs胁迫下根系分泌物中有机酸的响应机理,探寻根系分泌物有机酸在不同浓度PAHs下的动态变化规律,为解释根系分泌物对PAHs降解机理提供理论基础。
2 研究方法
2.1 试验地概况
实验地设在湖南省长沙市中南林业科技大学城市生态站实验室内。实验室地处东经112°48′,北纬28°03′,年均气温16.8 ℃,降雨量1400 mm,无霜期为270~300 d,属典型的亚热带湿润季风气候。实验室系不锈钢微框架结构的温室,面积1400 m2。
2.2 实验材料和方法
为了模拟当地土壤中多环芳烃对樟树幼苗产生的影响,需要对胁迫源进行选择和配比。本研究参照张引文对当地樟树林根际土多环芳烃的研究,确定用于胁迫的多环芳烃成分为PHE(菲)、FLA(荧蒽)、PYR(芘)、NAP(萘)、FLO(芴),各比例分别为,26∶9∶8∶8∶5。研究共设置500 g对照浓度和1500 g处理浓度,分别为C(总PAHs含量为0),L(总PAHs含量为1.5 mg/kg)、M(总PAHs含量为7.5 mg/kg)和H(总PAHs含量为75 mg/kg),其分别约为当地土壤中多环芳烃含量的1倍、5倍和50倍。
试验于2015年4月选取樟树1年生且苗高和长势基本一致的幼苗进行栽培,植物根系进行适当修剪后用0.15%的福尔马林溶液表面灭菌,用自来水轻轻冲洗掉附于根部的泥沙将幼苗移植到Φ10cm塑料盆中,每盆装灭菌蛭石350 g,每种处理3盆,每盆3株。缓苗40 d后,拔出幼苗测定其根系活性。培养基使用纯水在4 ℃条件下浸泡24 h,浸泡液过滤后浓缩至50 mL以下定容,测定根系分泌物中有机酸、TOC、TN含量。TOC及TN利用日本岛津TOC-500测定仪进行测定。有机酸采用飞行时间质谱测定,质谱分析使用5800基质辅助激光解离飞行时间质谱(MALDI TOF/TOF,Applied Biosystems, 美国) 配备200Hz Nd:YAG激光源 (355 nm),用二级MS/MS激光激发200次,并去除信噪比低于50的信号。
3 结果与分析
3.1 根系活性和TOC、TN的测定
测定根系活性和TOC、TN目的是研究吸收能力和根系分泌物的总量特征,是辅助说明根系分泌物有机酸在PAHs胁迫下响应特征的重要指标。根据图1可知,总吸收面积测定的结果M处理最大(P<0.05),达到了4.96 m2,其次是C处理和L处理,两者之间没有显著差异(P>0.05),H处理最小,为3.84 m2。活跃面积测定的结果显示,L处理和M处理在4个处理中最大(P<0.05),但两者差异不显著(P>0.05),分别达到了4.21 m2和4.33 m2,H处理最小(P<0.05),为2.23 m2。比表面积的测定结果表明,M处理下最大(P<0.05),达到0.44,其余处理没有显著差异(P>0.05)。
TOC的测定结果表明(图2),各处理之间差异显著(P<0.05),依次为L处理10.24 m/L>C处理5.23 m/L >M处理4.47 m/L >H处理2.21 m/L。TN反映的规律和TOC相似,同样为L处理7.74 m/L>C处理6.31 m/L >M处理2.15 m/L >H处理1.13 m/L(P<0.05)。
對根系活性和TOC、TN的测定表明与对照(C处理)相比,PAHs对植物根系活性和产生有机酸能力的影响因处理方式不同而不同,较低的PAHs添加会在一定程度上促进植物的生长,而较高的PAHs添加会抑制植物在这两个方面的能力。
3.2 根系分泌物中有机酸的测定
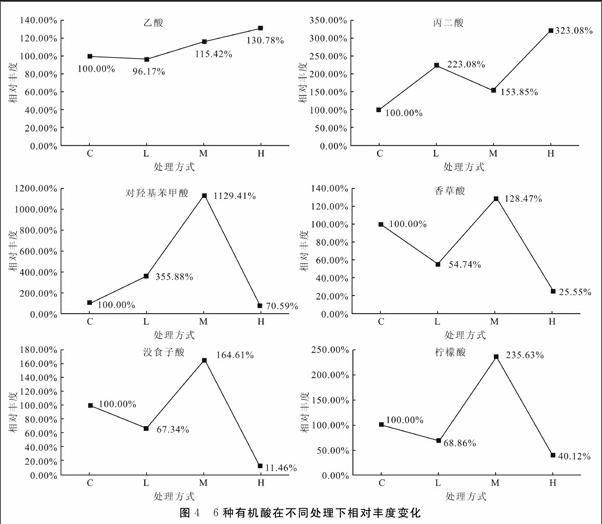
本研究分别对4种处理的根系分泌物进行了测定,质谱图见图3。通过对波峰出现时的质合比及其分子离子峰,共判读出6种含量一致且常见的低分子有机酸,详见表1。6种有机酸的相对丰度因处理方式不同而表现出差异性,其变化趋势见图4。
乙酸隨着PAHs胁迫程度的增加显示出先降低后增高的趋势,并在H处理达到最高,达到130.78%,但总体变化程度相较其他5种有机酸较小。丙二酸在M处理下较L处理有所降低,但仍高于对照处理,总体上随着PAHs胁迫程度的增加整体呈现上升趋势,并在H处理达到最高,达到323.08%。对羟基苯甲酸随着PAHs胁迫程度的增加呈现先升高后降低的现象,在M处理下最高1129.41%,并在H处理下迅速下降至70.59%。香草酸、没食子酸、柠檬酸3种有机酸表现相似,都为降低-升高-降低,在M处理下最高H处理下最低。
4 结语
根系活性和对根系分泌物TOC、TN的测定表明,M处理下根系的活性最高,根系分泌物中TOC、TN含量也最大,说明PAHs的添加在一定程度上促进了樟树幼苗的生长,根系分泌物质的能力增加,但在H处理下根系的活性最低,根系分泌物物质的能力也最低。这与已有一些PAHs的添加实验的表现一致。陆志强[12]对秋茄幼苗的研究结果指出;低浓度(0.1 mg/L)的奈和芘对进幼苗生长有促进作用,高浓度组(10 mg/L)则显著抑制了幼苗生长;沈小明[13]研究玉米生长对菲的响应时指出,低浓度的菲(1 mg/L)显著促进玉米生物量的增加,随着菲浓度升高(5 mg/L)玉米正常生长会受到抑制;王姣龙[14]等在对4中绿化树种幼苗进行芘添加时也发现相似现象。由于本研究胁迫使用的PAHs是以当地自然沉降的成分为基础,所以也可以说明当前PAHs沉降水平会对研究地樟树的根系活性产生一定的影响,总体上不显著,在未来一段时间内随着沉降量的增高,可能会在一定程度对植物生长继续产生促进作用,如果沉降量继续上升超过樟树的耐受极限,会极大抑制樟树的根系活性。
6种有机酸对PAHs响应在不同的方面既表现出差异性也表现出一致性。总体上看,可根据分子量解释其变化特征:乙酸、丙二酸分子量相对较低的有机酸含量随着PAHs胁迫程度的增加表现出上升趋势;对羟基苯甲酸、香草酸、没食子酸和柠檬酸分子量相对较高的有机酸含量随着PAHs胁迫程度的增加在M处理下达到峰值,但随着胁迫程度的继续升高在H处理下迅速降低。同时,在羟基苯甲酸、香草酸、没食子酸和柠檬酸中有3种含有环状结构。Baker的研究结果[15]表明浓度较低的PAHs对植物生长有促进作用,可能是由于PAHs的苯环与植物一些生长激素具有类似环状结构。结合本研究根系活性和TOC、TN的测定结果可知这3种含环状结构的有机酸的变化规律与之相同,这个现象表明这3种有机酸可以作为说明樟树幼苗根系活性的指标,同时也可能对樟树幼苗生长产生促进作用。
本研究根据当地PAHs自然沉降成分特点,通过模拟添加不同浓度PAHs混合物对樟树幼苗进行胁迫,提取培养基中根系分泌物,研究了根系分泌物中6种有机酸的变化规律。研究虽然取得了较好的结果,但由于地下化学的不可见性和复杂性,以及根系分泌物成分的多样性,根系分泌物中有机酸对PAHs的响应尚不能使用明确的数学关系表达,需要在未来进一步展开研究。
参考文献:
[1]Abbott M B, Bathurst J C, Cunge J A, et al. An introduction to the European Hydrological System — Systeme Hydrologique Europeen, “SHE”, 1: History and philosophy of a physically-based, distributed modelling system[J]. Journal of Hydrology, 1986,87(1-2):45~59.
[2]Brette, Fabien, Cros, et al. Crude Oil Impairs Cardiac Excitation-Contraction Coupling in Fish[J]. Science, 2014,343(6172):772~776.
[3]Modi B G, Neustadter J, Binda E, et al. Langerhans cells facilitate epithelial DNA damage and squamous cell carcinoma[J]. Science, 2012,335(6064):104~108.
[4]Zhang Z, Rengel Z, Meney K. Polynuclear aromatic hydrocarbons (PAHs) differentially influence growth of various emergent wetland species.[J]. Journal of Hazardous Materials, 2010,182(1-3):689~695.
[5]Wilcke W. SYNOPSIS Polycyclic Aromatic Hydrocarbons (PAHs) in Soil — a Review[J]. Journal of Plant Nutrition & Soil Science, 2000,163(3):229~248.
[6]D Souza R, Varun M, Lakhani A, et al. PAH Contamination of Urban Soils and Phytoremediation[M].Phytoremediatio-Management of Environmental Contaminants,2014.
[7] Ling W, Sun R, Gao X, et al. Low-molecular-weight organic acids enhance desorption of polycyclic aromatic hydrocarbons from soil[M].European Journal of Soil Science,2015.
[8] Bardgett R D, Putten W H V D. Belowground biodiversity and ecosystem functioning[J]. Nature, 2014,515(7528):505~511.
[9] 孫天然. 植物强化微生物修复多环芳烃污染土壤研究[D].济南:山东师范大学, 2009.
[10] Sun B, Gao Y, Liu J, et al. The Impact of Different Root Exudate Components on Phenanthrene Availability in Soil[J]. Soil Science Society of America Journal, 2012,76(6):2041.
[11] Yan W, Wang S, Luo C, et al. Influence of rice growth on the fate of polycyclic aromatic hydrocarbons in a subtropical paddy field: A life cycle study[J]. Chemosphere, 2015,119C(1):1233~1239.
[12] 陆志强. 多环芳烃对秋茄幼苗的生理生态效应及其在九龙江口红树林湿地的含量与分布[D].厦门:厦门大学, 2002.
[13] 沈小明, 王梅农, 代静玉. 不同浓度条件下玉米吸收菲的水培实验研究[J]. 农业环境科学学报, 2006,25(5):1148~1152.
[14] 王姣龙, 谌小勇, 闫文德, 等. 4种绿化树种根系分泌物中的化学成分分析[J]. 西北农林科技大学学报自然科学版, 2016,44(10):107~113.
[15] Baker J M. The effects of oils on plants.[J]. Environmental Pollution, 1970,1(1):27~44.
Abstract: In this study, according to the PAHs local composition characteristics of natural sedimentation, 4 PAHs mixture concentration gradient C (total PAHs0 mg/kg), L (total PAHs 1.5mg/kg), M (total PAHs 7.5mg/kg) and H (total PAHs 75mg/kg) were set and stressed to extract the root exudates of the camphor tree seedlings. The low molecular organic acids were determined by MALDI TOF/TOF to explore the changes of organic acids in root exudates. The results showed that the content of organic acid acetic acid, malonic acid, relatively low molecular weight increased with the degree of PAHs stress showing an upward trend. The molecular weight of p-hydroxybenzoic acid, vanillic acid, gallic acid and citric acid was relatively high. The acid content reached the peak at the M treatment with the increase of PAHs stress, but decreased with the increase of stress level under H treatment. The content of hydroxy benzoic acid, vanillic acid and gallic acid were consistent with the changes of plant root activity and TOC, TN.
Key words: root exudate;PAHs;organic acids;MALDI TOF/TOF
