局部晚期周围型非小细胞肺癌后装插植放疗
2017-07-12吴敬波
吴敬波
646000四川 泸州,西南医科大学附属医院 肿瘤科
•专家述评•
局部晚期周围型非小细胞肺癌后装插植放疗
吴敬波
646000四川 泸州,西南医科大学附属医院 肿瘤科
肺癌在我国仍保持发病率及死亡率首位[1]。其中非小细胞肺癌占肺癌总数的80%~85%[2], 而且30%~40%的患者诊断时已为局部晚期(AJCC分期为IIIA~IIIB期)。同期放化疗成为这部分患者的首选治疗手段[3]。虽然现代放疗技术提高,但治疗效果仍然不理想,局部复发是肺癌放疗目前面临的最大困难。美国肿瘤放射治疗协会(Radiation Therapy Oncology Group,RTOG) 关于肺癌同期放化疗的11个临床试验统计显示,局部等效生物学剂量为72Gy~77.95Gy,2年及5年局部复发率分别为46%和52%,并且BED每增加1Gy,其局部复发风险会下降3%,死亡风险下降4%[4]。局部生物学剂量超过100Gy,局控率将到达80%以上[5-8]。过去研究证实患者局部复发及远处转移各占患者治疗失败的1/3,因此可以通过改变分割方式提高局部等效生物学剂量,从而达到提高局控率及改善患者生存的目的。在过去的20年里,随着现代放疗技术的发展,有关学者希望通过现代图像引导放疗来解决呼吸带来的误差,立体定向治疗、大分割放疗技术实现肿瘤高剂量和危及器官低剂量之间的完美平衡,在早期肺癌中取得了可喜的成果,但对于局部晚期患者,由于靶区过大,难以安全实现剂量突破。组织间插植后装放疗可以将放射源准确地直达肿瘤病灶。由于其遵循平方反比定律,可以使高剂量集中于局部很小的区域,同时满足周围危及器官低剂量,为局部晚期非小细胞肺癌的阳性淋巴结照射提供了很大的剂量空间。此外,在治疗过程中,放射源还能保持相对于肿瘤无运动位移的正确位置。同其他放射治疗技术相比,近距离治疗的疗程更短,有助于降低在每次治疗间隙存活癌细胞分裂与生长的概率,使肿瘤细胞出现致死性损伤。因此组织间插植后装放疗由于其单次高剂量和与肿瘤之间无相对运动的优势已开始在局部晚期周围型肺癌的治疗中展露锋芒。本文将从放疗剂量、运动误差、未来与展望等几方面阐述与讨论组织间插植后装放疗在局部晚期非小细胞肺癌治疗中的已知与将来研究的方向。
1 怎样实现靶区高剂量与危及器官低剂量的完美结合?
近年来放射治疗已进入瓶颈期。三维适形放疗使放疗三维剂量分布与靶区形状一致,减少正常器官照射,而调强放疗在三维适形的基础上调节靶区剂量强度,成为目前主流放疗技术。精确治疗在降低正常器官剂量方面显示出一定优势,但相对于常规放疗,并没有明显提高患者的局控率及生存率。在临床工作中,因为毗邻危及器官限量导致无法满足肿瘤靶区获得满意的致死剂量,这是生存率无法明显提高的主要原因。
1.1 外照射治疗的困境
对于早期非小细胞肺癌,多项研究已证实可以通过增加肿瘤剂量,提高局控而达到延长患者生存的目的。立体定向放疗可以提供等效生物学剂量>100Gy,给予肿瘤细胞致死性打击,使早期肺癌的生存率与手术相当。但立体定向治疗只适用于肿瘤直径小于5cm,淋巴结阴性的早期患者,这样靶体积相对较小,能较好地将正常肺组织剂量控制在可耐受的范围之内。立体定向治疗仍有25.3%~26.1%患者出现胸痛,21%~24.1%患者有肋骨骨折风险[9-11]。即使对于T1的周围型肺癌仍有20%~25%淋巴结转移的几率[12-13],而且随着肿瘤体积增大,淋巴结转移风险会增高[14]。因此立体定向治疗不适用于局部晚期周围型非小细胞肺癌。对于晚期非小细胞肺癌常规放疗技术照射剂量在60~68Gy之间,即使联合同期化疗,其5年生存率不超过20%。RTOG0617是一项III期随机对照试验,评估局部晚期周围型非小细胞肺癌接受60Gy及74Gy患者的生存率及不良反应,试验结果显示:1年、2年总生存率74Gy和60Gy组分别为74%和80%,44.6%和57.6%[15],令人遗憾的是高剂量组的生存率反而低于60Gy剂量组,分析其原因,与高剂量组引起正常肺组织及心脏毒性相关性死亡有关。在一项RTOG关于三维适形放疗剂量爬坡试验中,结果显示83.8Gy为最大耐受剂量,其III度放射性肺炎发生率为16%,但由于没有达到肿瘤的致死剂量,因此局部控制率仍仅有55%[16]。新兴的质子放疗与光子线和高能X线的主要区别在于它进入体内的剂量分布,其他低LET射线进入人体后逐渐衰减,而质子射线进入体内衰减不明显,当它达到射程末端时能量全部释放,形成Bragg峰。将Bragg峰置于肿瘤,可以明显降低周围危及器官剂量(见图1)。在三维适形或调强放疗的基础上,质子治疗将III期非小细胞肺癌的2年生存率提高到57%,在提高局部照射剂量的同时似乎降低了晚期不良反应发生率,III度放射性肺炎发生率为7%[17]。然而由于质子Bragg峰前方的正常组织仍有不低的照射剂量,而且治疗费用高昂,技术仍存在一定挑战,和其他外照射技术一样存在呼吸运动问题,因此并不适用于多数的局部晚期非小细胞肺癌[18]。
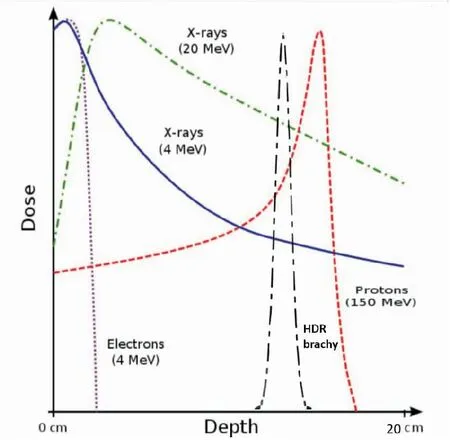
图1 不同射线剂量吸收曲线
1.2 近距离治疗的优势
大分割外照射放疗对于晚期肿瘤势必会明显增加其严重毒副反应发生几率,与外照射相比,近距离治疗避免了射线穿透周围危及器官而可以直接达到肿瘤,肿瘤周围正常组织处于低剂量,高剂量可以聚集在肿瘤所在的区域,而且由于遵循平方反比定律,肿瘤周围剂量迅速跌落,肿瘤旁周围正常组织剂量明显低于靶区剂量,可以实现肿瘤高剂量的同时满足危及器官低剂量的要求。
近距离治疗包括组织间插植放疗、腔内治疗、放疗粒子植入及模治疗。对于周围型晚期非小细胞肺癌常采用后装组织间插植放疗及粒子植入治疗。
1.2.1 放射粒子植入治疗 目前多采用I125粒子植入治疗晚期周围型非小细胞肺癌,其原理是种植在肿瘤组织间的放射性核素可以持续释放低能量光子产生的γ射线,减少肿瘤的氧增比和乏氧细胞的比例,不断地杀伤肿瘤干细胞而使肿瘤细胞凋亡。但部分研究显示临床治疗效果不尽人意,完全缓解率仅为28.6%,部分缓解率为42.8%, III期患者1年及2年生存率为33.3%和0%[19]。曾有报道高达90%患者出现粒子迁移[20],及损伤大动脉导致肺动脉破裂等严重后果[21]。由于放射粒子在体内需经过长时间衰减,因此同样存在辐射暴露的问题。同样粒子植入治疗也不适用于有淋巴结转移的患者。
1.2.2 组织间插植放疗联合区域阳性淋巴结调强放疗 CT引导下组织间插植放疗可以根据肿瘤位置,通过肋间隙准确将施源管放置入肿瘤内,插植针间隔1~1.5cm,使高剂量曲线尽量包绕整个肿瘤组织。国内外有学者尝试采用插植放疗治疗肺部恶性肿瘤,并且取得了满意的局部控制率。但存在以下不足:1)多数研究入选病例主要为肺转移癌[22-24],2)采用单次20Gy照射剂量,等效生物学剂量为60Gy, T1患者1年局控率为90%,但由于局部剂量不足,导致直径大于4cm的患者在6个月时局控率仅为75%[25-26]。3)主要针对淋巴结阴性的早期患者[23,25]。局部晚期周围型非小细胞肺癌患者多数伴有纵隔、肺门淋巴结转移,如果原发灶和阳性淋巴结都采用高剂量外照射治疗,那么势必会明显增加肺、食管、心脏、脊髓等重要危及器官的剂量,而且由于上述危及器官限量,使肿瘤区域放疗剂量很难提高到65Gy以上。而从理论上推测65Gy放疗剂量对于超过1cm的肿瘤难以达到满意的控制效果。因此原发灶采用后装插植放疗,在保证肺剂量控制在可耐受范围内给予肺门、纵隔淋巴结70Gy调强外照射,为引流区阳性淋巴结照射提供了很大的剂量空间。纵隔淋巴结在左右,上下及前后的平均运动幅度为0.21cm,0.52cm及0.20cm[27],在整个治疗过程中淋巴结运动不明显[28],淋巴结位置深,多与血管伴行,插植放疗风险较大,基于以上原因,针对区域阳性淋巴结可采用调强放疗。我们在局部晚期周围型非小细胞肺癌插植放疗联合区域阳性淋巴结调强放疗的I期临床试验中,对肺原发灶采用后装插植放疗,单次予以30Gy照射剂量(BED=120Gy), 肺V20为4.1%~11.1%,为淋巴结调强放疗创造了机会,使原发灶和转移淋巴结2年局控率分别为83.3%和77.6%。患者2年生存率为67%[29]。即使予以高剂量的照射,没有出现放射性肺炎、放射性心脏毒性等不良反应,在提高治疗效果的同时使患者生存获益。插植放疗操作过程没有出现严重血胸、气胸、感染等并发症。I期临床试验结果已经证明原发灶插植放疗联合区域淋巴结调强放疗的安全性及有效性。其实用范围广,即使高龄患者或伴有肺部基础疾病者仍能较好地耐受。由于巴黎系统需要施源管间距为1~1.2cm,对于原发灶超过8cm的患者,由于需要植入的施源管较多,会增加操作时间及近距离治疗时间,以及剂量曲线分布不均匀导致局部复发。因此对于原发灶超过8cm以上患者,为达到满意的剂量分布及缩短治疗时间,可考虑诱导化疗,使原发灶缩小后再接受近距离治疗。
2 放疗过程中的运动问题
靶区移动是影响肺癌放疗过程中靶区精确性最重要的因素之一,存在脱靶的风险,导致肿瘤靶区的低剂量照射。而引起靶区运动的原因包括呼吸运动,心脏收缩和舒张,大血管搏动,食管蠕动以及治疗过程中肿瘤退缩等原因,而呼吸运动是最主要的原因。有学者将金属粒子植入患者肺部肿瘤,观察肿瘤组织活动的范围。在平静呼吸的状态下,肿瘤活动范围为:X轴上(两侧)5.5~10.0mm,Y轴上(前后)6.8~15.9mm,Z轴上(身体纵轴)8.1~14.6mm[30]。为了避免运动导致脱靶漏照,解决方法之一是扩大照射靶区,这势必会增加正常组织受照体积。因此解决肿瘤靶区随呼吸运动问题成为肺癌外照射治疗的重要问题。解决呼吸运动造成靶区移动的另一重要措施时呼吸门控技术,以及图像引导技术来减少运动位移及治疗间摆位误差。呼吸门控技术可以重现40%(30%~70%)的呼吸轨迹[31],呼吸门控技术包括同步呼吸放疗技术和呼吸控制技术两种。
同步呼吸放疗技术的优势是可以直接实时监测肿瘤运动,并指导门控技术,及时发现并解决治疗过程中的器官或肿瘤运动导致的系统和随机误差,以及摆位误差。但由于其为有创操作,需要特殊的跟踪设备和门控设备,同时在肿瘤内或附近植入金属标识,不能识别肿瘤变形或旋转运动,还要求金属标记要代表整个靶区的空间位置,因此由于整个技术繁琐,患者接受度不高。
呼吸控制技术指控制呼吸运动,使之在特定时相暂停,从而固定肿瘤位置。常采用的是主动呼吸控制(active breathing control,ABC)。利用呼吸面罩控制患者呼吸,当患者呼吸动度达到一定程度时,通过仪器使呼吸暂停,开始放疗,减少呼吸运动对靶区的影响。
呼吸门控技术都要求治疗前长时间训练以及治疗过程中患者充分配合,同时还要求患者能够耐受长时间的屏气,而肺癌患者多数系老年患者,有吸烟病史,不能长时间承受屏气动作。另外,该技术的设备昂贵,技术复杂,延长治疗时间,因此运用受到限制。
图像引导放疗是将放射治疗机与成像设备结合,在患者治疗时采集有关图像信息,确定治疗靶区和重要结构的位置、运动,并在必要时校正位置和剂量分布,减少器官运动造成靶区位移和摆位误差,这些方法都只能尽量减少运动对靶区影响,无法真正实现靶区与肿瘤之间相对静止。而且复杂的成像设备与加速器的结合在机械学上难度加大,制造和维护成本提高。
CT引导下的三维组织间插植后装放疗,施源器与肿瘤组织位置固定,即使在自主呼吸运动中也没有插植针相对于肿瘤的运动。在整个放疗过程中,没有外照射治疗时肿瘤相对于照射野运动产生的系统误差和随机误差,也可以避免摆位误差,因此无需外扩PTV以增加正常肺组织照射剂量。参照RTOG关于立体定向放疗对靶区勾画的要求及既往治疗经验,肿瘤靶区GTV可以等同于临床靶区CTV,从而进一步减少肿瘤毗邻正常组织或器官的照射。
3 近距离治疗用于非小细胞肺癌治疗的适应症及操作要求
近距离治疗适用于Ia~IIIb期的无手术指征或因基础疾病无法耐受手术的周围型非小细胞肺癌;肺原发病灶距离支气管树2cm以上;无凝血功能障碍;HIV(-);血常规正常。近距离治疗周围型非小细胞肺癌属于微创操作,在CT定位机下确定好进针方向,避开肋骨及血管、心脏,进针过程中患者避免呼吸,以减少划伤胸膜的可能性。
4 未来与展望
4.1 增加放射源数目
目前后装治疗机多为单源,对于局部肿块较大,插植针与驻留点众多,势必大大延长治疗时间,如果开发出多源后装机,几个放射源同时进行治疗,将大大缩短整个插植后装放疗治疗时间,从而提高局部大肿块患者的耐受性。
4.2 操作智能化
徒手操作插植是一个比较费时的微创手术,且植入的准确性不高,因而导致肿瘤靶区剂量分布不够理想。随着3D打印技术的开展以及医学影像技术的日新月异,在插植后装放疗的操作过程方面可以实现智能化。目前为保证治疗精确及缩短整个操作时间,采用操作前与治疗时完全一致的模拟定位,扫描获得患者影像,在后装计划系统上虚拟插植针分布范围及轨迹,以指导实际插植操作时的进针方向与深度。3D打印技术可以通过计算机影像系统打印出与肿瘤形状更适形的插植针通道及深度,从而可以大大缩短插植操作时间。
4.3 大剂量放疗对免疫功能的调控
近几年研究认为放疗通过加强抗原递呈,可以促进免疫应答。放疗促进树突状细胞(DC)的成熟、迁移,识别和吞噬外来物质;诱导细胞因子例如CTCL16的产生,加强免疫细胞的运输作用,吸引效应T细胞到达肿瘤的放疗位点[32];诱导内皮粘附分子的表达,从而加强细胞毒性T细胞(cytotoxic T-lymphocyte ,CTL)通过内皮到达肿瘤位点的能力;加强CD8+T细胞依赖性的免疫作用;大剂量放疗还能够增加TNF表达,促进诱导肿瘤细胞凋亡和激活免疫系统,进而引起机体非特异性的炎性应答和参与肿瘤特异性的免疫反应;能够清除CD4+抑制性T细胞,保留完整CD8+抗肿瘤效应细胞,从而抑制肿瘤生长。关于大剂量放疗与免疫功能的进一步研究将是后装放疗未来研究的方向。
5 结 语
插植放疗联合区域阳性淋巴结调强放疗在周围型局部晚期非小细胞肺癌的研究表明,插植放疗以其剂量学突破和解决运动误差方面的优势,为局部晚期非小细胞肺癌患者带来一种根治的新方法。如何更加合理地设计治疗计划,评价靶区剂量,怎样联合化疗及大剂量放疗,怎样与免疫治疗有效地结合都将需要大量的多中心基础和临床研究。机遇与挑战并行,在未来,组织间插植放疗技术通过不断改进,将为更多的周围型局部晚期非小细胞肺癌患者提供个体化治疗的方案。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Chen WQ, Zheng RS, Baade PD, Cancer statistics in China, 2015[J].CA Cancer J Clin, 2016,66(2):115-132.
[2] Jemal A, Siegel R, Xu J, et al. Cancer statistics 2010[J]. CA Cancer J Clin, 2010, 60(5): 277-300.
[3] van Diessen JN, Chen C, van den Heuvel MM,et al. Differential analysis of local and regional failure in locally advanced non-small cell lung cancer patients treated with concurrent chemotherapy[J]. Radiother Oncol, 2016,118(3):447-452.
[4] Machtay M, Bae K, Movsas B, et al. Higher biologically effective dose of radiotherapy is associated with improved outcomes for locally advanced non-small cell lung carcinoma treated with chemoradiation: An analysis of the Radiation Therapy Oncology Group[J]. Int J Radiat Oncol Biol Phys, 2012,82(1):425-434.
[5] Baumann P, Nyman J, Hoyer M, et al. Outcome in a prospective phase trial of medically inoperable stage I non-small-cell lung cancer patients treated with stereotactic body radiotherapy[J]. J Clin Oncol,2009,27(20):3290-3296.
[6] Haasbeek CJ, Lagerwaard FJ, Antonisse ME, et al. Stage I nonsmall cell lung cancer in patients aged ≥75 years: Outcomes after stereotactic radiotherapy[J]. Cancer ,2010,116(2):406-414.
[7] Hof H, Muenter M, Oetzel D, et al. Stereotactic single-dose radiotherapy(radiosurgery) of early stage nonsmall-cell lung cancer (NSCLC) [J]. Cancer, 2007,110(1):148-155.
[8] Lagerwaard FJ, Haasbeek CJ, Smit EF, et al. Outcomes of risk-adapted fractionated stereotactic radiotherapy for stage I non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys,2008,70(3):685-692.
[9] Voroney JP, Hope A, Dahele MR, et al. Pain and rib fracture after stereotactic radiotherapy for peripheral non-small cell lung cancer[J]. J Thorac Oncol, 2009,4(8):1035-1037.
[10]Asai K, Shioyamay Y, Nakamura K, et al. Radiation-induced rib fractures after hypofractionated stereotactic body radiation therapy:Risk factors and dose volume relationship[J]. Int J Radiat Oncol Biol Phys, 2012,84(3):768-773.
[11]Welsh J, Thomas J, Shah D, et al. Obesity increases the risk of chest wall pain from thoracic stereotactic body radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2011,81(1):91-96.
[12]Seely JM, Mayo JR, Miller RR, et al. T1 lung cancer: Prevalence of mediastinal node metastases and diagnostic accuracy of CT[J]. Radiology, 1993,186(1):129-132.
[13]Conces DJ Jr., Klink JF, Tarver RD, et al. T1N0M0 lung cancer:Evaluation with CT[J]. Radiology, 1989,170(3):643-646.
[14]Ketchedjian A, Daly BD, Fernando HC, et al. Location as an important predictor of lymph node involvement for pulmonary adenocarcinoma[J].J Thorac Cardiovasc Surg, 2006,132:544-548.
[15]Bradley JD,Paulus R, Komaki R,et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatinplus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer(RTOG 0617): a randomised, two-by-two factorial phase 3 study[J].Lancet Oncol, 2015,16(2):187-199.
[16]Bradley JD, Graham MV, Winter KW, et al. Acute and late toxicity results of RTOG 9311: a dose escalation study using 3D conformal radiation therapy in patients with inoperable non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2005, 61(2):318-322.
[17]Hoppe BS,Henderson R,Pham D,et al. A phase 2 trial of concurrent chemotherapy and proton therapy for stage III non-small cell lung cancer: results and reflections following early closure of a single-institution study[J].Int J Radiat Oncol Biol Phys, 2016, 95(1):517-522.
[18]Chang JY, Jabbour SK, De Ruysscher D,et al.Consensus statement on proton therapy in early-stage and locally advanced non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2016, 95(1):505-516.
[19]Wang ZM,Lu J, Liu T, et al. CT-guided interstitial brachytherapy of inoperable non-small cell lung cancer[J]. Lung Cancer,2011,74(2):253-257.
[20]Sommerkamp H, Rupprecht M, Wannenmacher M. Seed loss in interstitial radiotherapy of prostatic carcinoma with I-125[J]. Int J Radiat Oncol Biol Phys, 1988,14(2):389-392.
[21]Powell JW,Dexter E,Scalzetti EM. Treatment advances for medically inoperable non-small-cell lung cancer: emphasis on prospective trials[J]. Lancet Oncol, 2009,10(9):885-894.
[22]Sharma DN, Rath GK, Thulkar S,et al. Computerized tomography-guided percutaneous high-dose-rate interstitial brachytherapy for malignant lung lesions[J]. J Cancer Res Ther,2011,7(2):174-179.
[23]Ricke J, Wust P,Wieners G, et al. CT-guided interstitial single-fraction brachytherapy of lung tumors: Phase I results of a novel technique[J].Chest, 2005,127(6):2237-2242.
[24]Seely JM, Mayo JR, Miller RR, et al. T1 lung cancer: Prevalence of mediastinal node metastases and diagnostic accuracy of CT[J]. Radiology,1993,186(1):129-132.
[25]Peters N, Wieners G, Pech M, et al. CT-guided interstitial brachytherapy of primary and secondary lung malignancies: Results of a prospective phase 2 trial[J]. Strahlenther Onkol, 2008,184(6):296-301.
[26]Sharma DN, Rath GK, Thulkar S, et al. Computerized tomography guided percutaneous high-dose-rate interstitial brachytherapy for malignant lung lesions[J]. J Cancer Res Ther, 2011,7(2):174-179.
[27]Schaake EE, Belderbos JS, Buikhuisen WA,et al. Mediastinal lymph node position variability in non-small cell lung cancer patients treated with radical irradiation[J]. Radiother Oncol, 2012,105(2):150-154.
[28]Bosmans G,van Baardwijk A,Dekker A,et al.Time trends in nodal volumes and motion during radiotherapy for patients with stage III non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2008,71(1): 139-144.
[29]Xiang L,Zhang JW,Lin S, et al. Computed tomography-guided interstitial high-dose-rate brachytherapy in combination with regional positive lymph node intensity-modulated radiation therapy in locally advanced peripheral non-small cell lung cancer: A phase 1 clinical trial[J]. Int J Radiat Oncol Biol Phys, 2015,92(5):1027-1034.
[30]Shimizu S,Shirato H, Ogura S,et al. Detection of lung tumor movement in real-time tumor-tracking radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2001,51(2):304-310.
[31]Oh SA,Yea JW,Kim SK,et al. Statistical determination of the gating windows for respiratory-gated radiotherapy using a visible guiding system[J].PLoS One, 2016, 26,11(5):e0156357.
[32]Matsumura S, Wang B, Kawashima N. Radiation-induced CXCL16 release by breast cancer cells attracts effector T cells[J]. J Immunol, 2008 ,181(5):3099-3107.
2017- 02- 23
吴敬波,E-mail:wjb6147@163.com
吴敬波,男,教授,主任医师,博士生导师。中华医学会放射肿瘤治疗学专委会、国家卫计委全国医用设备资格考试LA医师专业委员会、中国抗癌协会神经肿瘤专委会、全国后装治疗协作组、中华医学会放射肿瘤治疗专委会放射生物学组等多个全国性学会、学术组织委员, 中华医学会放射肿瘤治疗分会近距离治疗学组副组长,泛珠江地区放射肿瘤协作组、西部放射肿瘤协会常务执行委员,四川省医学会、四川省抗癌协会、四川省中西医结合会等学术团体的5个肿瘤相关省级学会副主任委员,四川省有突出贡献优秀专家,四川省卫生厅学术技术带头人,国家自然科学基金评审专家,《中华放射肿瘤学》、《肿瘤预防与治疗》等多个国内杂志编委及国际性英文杂志《Journal of Nasopharyngeal Carcinoma》、《Austin Oncology》编委,Oncotarget、Med Phycs等国外肿瘤学SCI杂志审稿人。 独创性开展了具有国际领先水平的宫颈癌单管施源器研制和肺癌三维插植后装放疗技术的临床实践。 发表论文80余篇,SCI/EI收录20余篇, 编写肿瘤相关专著4部。培养肿瘤研究生60余名。主持国家、省级课题6项,获部省级、厅市科技进步成果奖8项,国家专利6项,发明专利3项。
R734.2; R730.55
A
10.3969/j.issn.1674- 0904.2017.03.001
Wu JB. Interstitial brachytherapy for locally advanced peripheral non-small cell lung cancer[J]. J Cancer Control Treat, 2017,30(3):153-157.[吴敬波. 局部晚期周围型非小细胞肺癌后装插植放疗[J].肿瘤预防与治疗,2017,30(3):153-157.]
