芹菜叶中芹菜素的提取工艺优化及其体外抗氧化性研究
2017-07-10李霄薛成虎高立国刘晓菊弓莹王二荣李改琴
李霄 薛成虎 高立国 刘晓菊 弓莹 王二荣 李改琴
摘 要: 以芹菜叶为原料,对芹菜叶中芹菜素的提取工艺进行了优化,并研究芹菜素的抗氧化性能。通过单因素实验,分别考察提取剂、溶剂浓度、料液比、提取温度、提取时间、原料颗粒度等因素对芹菜素得率的影响。在单因素的基础上,设计四因素三水平的正交实验对芹菜叶中芹菜素提取工艺进行优化。研究结果表明,回流提取芹菜素的最佳工艺条件为90%乙醇为提取剂、提取温度为80 ℃、料液比1:45 (g/mL)、提取时间150 min、原料粒径40目,芹菜素的得率为20.675 mg/g。抗氧化活性研究表明芹菜叶中芹菜素提取液对DPPH自由基、超氧阴离子自由基和羟基自由基均有良好的清除能力。
关 键 词:芹菜叶;芹菜素;正交实验;抗氧化性
中图分类号:R285; R281.5; R284.2 文献标识码: A 文章编号: 1671-0460(2017)07-1293-06
Optimization of Extraction Process of Apigenin in
Celery Leaves and Its Antioxidant Activity in Vitro
LI Xiao,XUE Cheng-hu,GAO Li-guo,LIU Xiao-ju,GONG Ying,WANG Er-rong,LI Gai-qin
(School of Chemistry and Chemical Engineering, Yulin University, Shaanxi Yulin 719000, China)
Abstract: Using fresh celery leaves as raw material, experiment optimization of the extraction process of apigenin from celery leaves was carried out, the antioxidant activity of apigenin was studied. Through single factor experiments, the effect of solvent and solvent concentration, solid-liquid ratio, extraction temperature and time, particle size on the yield of apigenin was investigated. On the basis of single factor experiments, the four-factor three-level orthogonal experiment was designed to optimize the extraction process of apigenin.The results show that the optimum conditions for extraction of apigenin from celery leaves are as follows: extraction solvent 90% ethanol, extraction temperature 80 ℃, solid-liquid ratio 1:45 (g/mL), extraction time 150 min, raw material particle size 40 mesh; under above conditions, the yield of apigenin can reach to 20.675 mg/g. The antioxidant activity study shows that apigenin extract from celery leaves can scavenge DPPH radical and superoxide anion and hydroxyl radical.
Key words: Celery leaves; Apigenin; Orthogonal experiment; Oxidation resistance
芹菜为伞形科植物,芹菜叶甘苦、性凉,有清热、止血、平肝、祛风、利湿等功效,自古有“药芹”之誉[1]。根据大量实验所得芹菜中主要含有芹菜素、芹菜苷、木栓酮、木犀黄酮等化合物。其中芹菜素又称芹黄素,为4,5,7—三羟基黄酮,属黄酮类化合物,广泛存在于多种水果、蔬菜、豆类等植物中,芹菜中含量最高。其4,5,7位置的3个C2C3双键决定了其特有的药理学效应[2]和生物学特性,还是天然的抗氧化剂[3,4]。据报道,芹菜素可以对多种癌细胞具有抑制作用[5],如鼻咽癌[6],肺癌[7-9],胰腺癌[10],肝癌[11],结肠癌[12,13]等。并可以降血糖[14],降低血压[15],抗炎症[16,17]等作用。本课题通过对芹菜叶中芹菜素的最佳提取工艺和抗氧化作用进行研究,为提高芹菜叶的利用率,并为其作为天然抗氧化剂和食品添加剂的开发提供理论依据,为合理利用芹菜叶资源提供理论依据。
1 实验部分
1.1 材料和仪器
1.1.1 材料
芹菜叶:榆林市市售。芦丁标准品:西安汇林生物科技有限公司;对二苯基苦基苯肼(DPPH)、邻菲罗啉、硫酸亚铁铵、磷酸氢二钠、磷酸二氢钠、三(羟甲基)氨基甲烷(Tris)、抗坏血酸(VC)、焦性没食子酸、硫代硫酸鈉、亚硝酸钠、硝酸铝、可溶性淀粉、过氧化氢、碘化钾、氢氧化钠、盐酸(36%~38%)、冰乙酸、三氯甲烷、无水乙醇、石油醚、乙腈、乙酸乙酯、丙酮、甲醇等均为分析纯。
1.1.2 仪器
循环水真空泵(SHZ-D);小型高速粉碎机(WK-200B);电子天平(ESG60-4);台式电热干燥箱(202-O);数控超声波清洗器(KQ2200DV);集热式恒温加热磁力搅拌器(DF-101S);数显智能控温磁力搅拌器(SZCL-2);旋转蒸发器(RE-2000A);紫外可见分光光度计(UV-2450);可见分光光度计(JH722S);数显恒温水浴锅(HH-1)。
1.2 实验方法
1.2.1 芦丁标准曲线的绘制
精确称取芦丁标准品20 mg,加30%乙醇溶解,置于100 mL容量瓶,稀释至刻度,精确量取25 mL,置50 mL容量瓶中,稀释至刻度,摇匀,即得0.1 mg/mL的芦丁标准溶液。
准确量取标准溶液0、2.5、5.0、7.5、10.0、12.5 mL,分别置于25 mL容量瓶,补30%乙醇至12.5 mL,分别加0.75 mL 5%亚硝酸钠溶液,摇匀后静置5 min,加0.75 mL 10%硝酸铝溶液,摇匀后静置5 min,再加10.0 mL 4%氢氧化钠溶液,用30%乙醇定容至刻度,摇匀。以空白试剂为对照,在510 nm下测定吸光度A,以芦丁浓度为横坐标,吸光度A为纵坐标,绘制标准曲线[18]。
1.2.2 样品芹菜素得率的测定
将芹菜叶提取液浓缩后,用30%的乙醇溶解稀释定容至100 mL容量瓶。吸取5.0 mL上述溶液于25 mL容量瓶中,用30%的乙醇定容至刻度。吸取此溶液10 mL置于25 mL的容量瓶中,加入2.5 mL 30%乙醇溶液。再加入5%亚硝酸钠溶液0.75 mL,摇匀后静置5 min,加10%硝酸铝溶液0.75 mL,摇匀后静置5 min,加4%氢氧化钠溶液10.0 mL,用30%的乙醇定容。以空白试剂为对照,在510 nm下测定吸光度,根据如下公式计算芹菜叶中芹菜素的得率[19,20]。
芹菜叶中芹菜素得率(M)=CD×稀释倍数/W
其中: C—芹菜素浓度,mg/mL;
D—样品溶液稀释后的总体积,mL;
W—芹菜叶质量,g。
1.2.3 提取芹菜叶中芹菜素的单因素实验
分别考察提取剂蒸馏水、丙酮、甲醇、乙醇、乙酸乙酯、乙腈、石油醚;提取剂浓度(体积比)分别为30%、40%、50%、60%、70%、80%、90%的乙醇溶液;料液比分别为1:20、1:25、1:30、1:35、1:40、1:45、1:50;提取温度分别为60、70、80、90 ℃;提取时间60、90、120、150、180 min;原料粒径20、40、60、80目对芹菜叶中芹菜素的影响。根据实验结果,设计正交实验。
1.2.4 正交实验优化提取工艺
应用正交试验设计原理,优化芹菜叶中芹菜素的提取工艺,在单因素实验结果的基础上,选定乙醇浓度、料液比、提取温度、粒径四个因素,每个因素选3 个水平,设计L9(34)正交实验,因素水平见表1。
1.2.5 芹菜叶芹菜素提取液的抗氧化能力测定
(1)DPPH·自由基的生成及清除率测定
以二次蒸馏水做空白对照。制备0.1 mmol/L DPPH· 无水乙醇溶液,取3.0 mL DPPH·溶液,加入0.1 mL不同浓度芹菜素提取液或不同浓度的VC溶液,室温下反应5 min后在519 nm 处测得吸光度A1;取3.0 mL DPPH·溶液,加入0.1 mL 无水乙醇,反应5分钟后在519 nm 处测得吸光度A2,清除率计算公式为[21,22]:
DPPH·清除率(%)=
(2)超氧阴离子的生成及清除率测定
吸取4.4 mL 0.05 mol/L pH为8.2的Tris-HCl缓冲溶液,置于25 ℃恒温水浴中预热20 min,分别加入0.1 mL不同浓度的样品溶液,再加入已在25 ℃恒温水浴中预热的2.50 mmol/L的邻苯三酚5.50 mL开始反应,混匀后继续置于25 ℃水浴反应4 min后,加入浓度为10.0 mol/L的HCl溶液2滴终止反应,用蒸馏水作参比,于325 nm处测定吸光值,再以相同浓度的VC作对照实验[23-25]。超氧阴离子清除率按如下公式计算:
清除率(%)=
其中:A0—不含样品溶液的吸光值;
A1—含有样品溶液的吸光值;
A2—含样品溶液但不含邻苯三酚的吸光值。
(3)羟自由基的生成及清除率的测定
取8支50 mL具塞试管,依次加入1.0 mL 7.5 mmol/L的邻二氮菲,2.0 mL的PBS緩冲溶液(pH值为7.4,下同)和1.0 mL 7.5 mmol/L的FeSO4,边加边摇匀后,加入1.0 mL 0.1%H2O2,再用蒸馏水定容至50 mL刻度线,置37 ℃恒温水浴锅反应60 min,在510 nm处测其吸光度A3,按上述操作步骤,用蒸馏水代替1.0 mL 0.1% H2O2,定容至50 mL刻度线,置37 ℃水浴锅反应60 min,在510 nm处测其吸光度A2,在测损伤组的基础上再加不同体积的皂苷提取液,按上述步骤一样,PBS缓冲溶液作为参比,在510 nm处测其吸光度A1;以Vc作对照[26]。
清除率=(A1-A3)/(A2-A3)×100%
式中:A1─样品组吸光值;
A2─未损伤组吸光值;
A3─损伤组吸光值。
2 结果与分析
2.1 标准曲线绘制
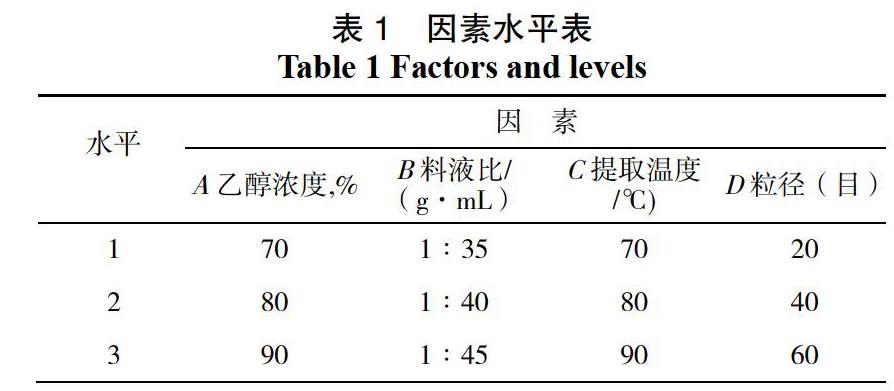
芦丁标准曲线如图1所示,回归方程为:y=10.23714x-0.00176,相关系数为R2=0.999 8。芹菜叶中芹菜素溶液在0~0.05 mg/mL浓度范围内,呈现良好的线性关系。
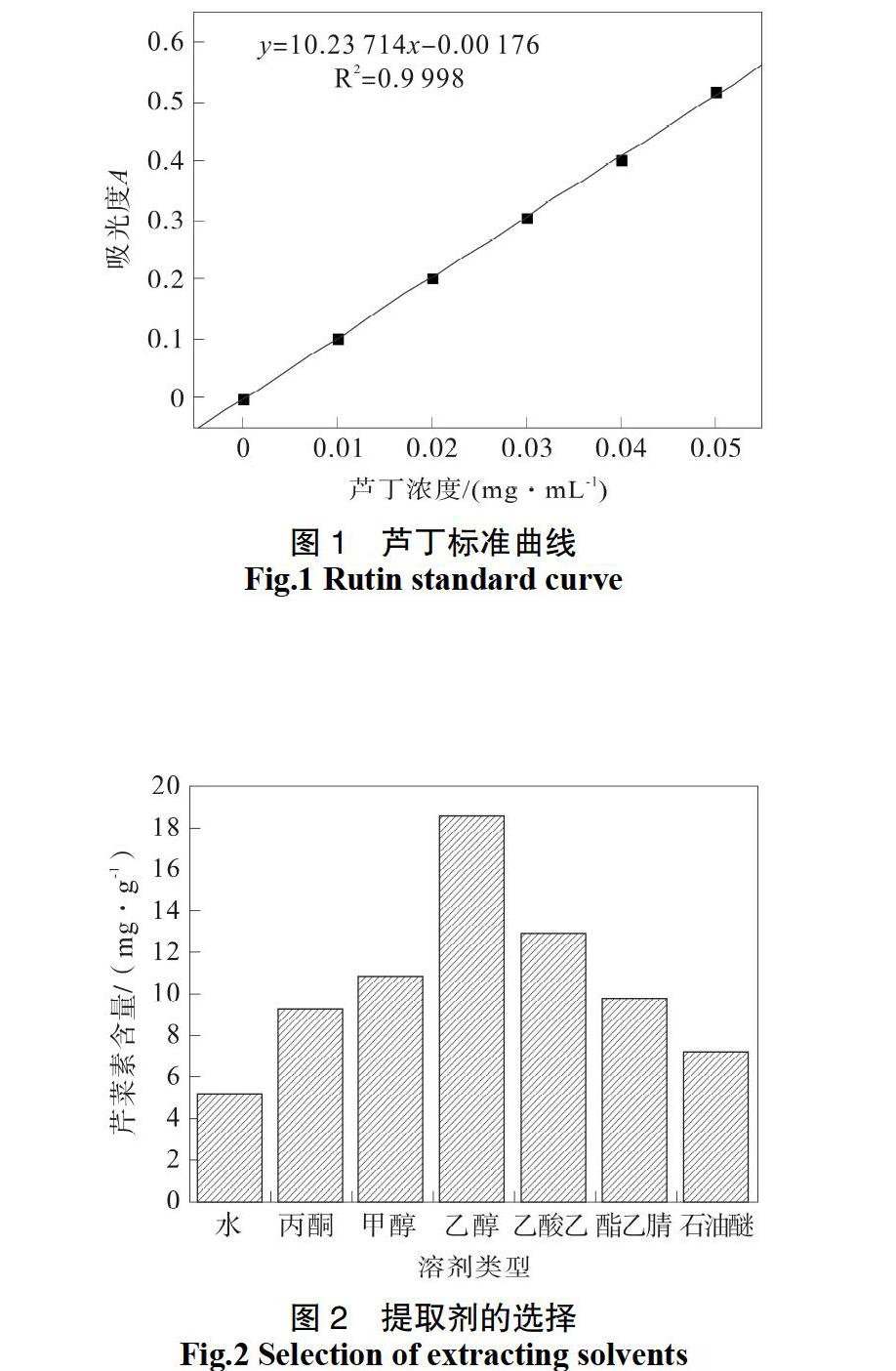
按原料粒径为40目,料液比1∶20 g/mL,分别采用蒸馏水、丙酮、甲醇、无水乙醇、乙酸乙酯、乙腈、石油醚,温度80 ℃,回流60 min,对黑豆中皂苷进行提取,在波长510 nm下测提取液的吸光度(A),以芹菜素得率比较不同提取剂的效果如图2所示。实验结果表明:提取剂类型对芹菜素得率影响比较大,其中无水乙醇的提取效果最好。因此,以下实验均采用无水乙醇作为提取剂。
2.2.2 乙醇浓度的选择
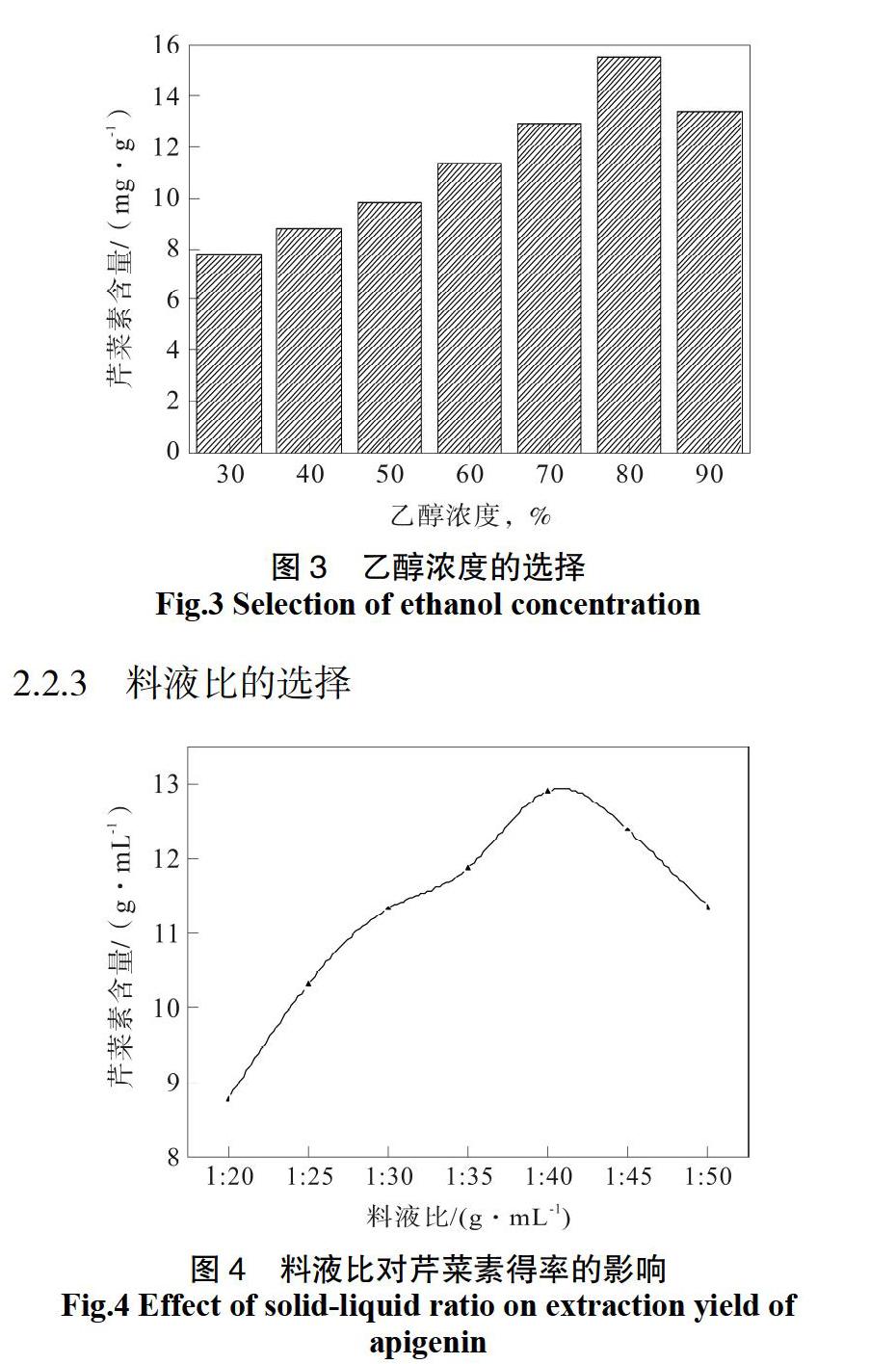
按原料粒径为40目,料液比1:40 g/mL,分别采用乙醇浓度分别为30%、40%、50%、60%、70%、80%、90%,温度80 ℃,回流60 min的条件下,对芹菜叶中芹菜素进行提取,比较乙醇浓度对芹菜素得率的影响如图3所示,结果表明:芹菜素得率随乙醇浓度的升高而升高,乙醇浓度达80%,得率达最大值。乙醇浓度进一步增大,芹菜素含量反而下降,这可能是由于高浓度的乙醇会增加其中蛋白質和糖类等杂质的出现,与芹菜素竞争乙醇,从而导致芹菜素得率下降,因此,本实验选80%的乙醇作为提取芹菜素的最佳提取浓度,并选定乙醇浓度在70%、80%、90%作为正交实验的水平。
按原料粒径为40目,料液比分别为1∶20、1∶25、1∶30、1∶35、1∶40、1∶45、1∶50 g/mL,温度80 ℃,回流60 min的条件下,对芹菜叶中芹菜素进行提取,比较料液比对芹菜素得率的影响如图4所示,结果表明:随着料液比的增加,乙醇水混合体系对芹菜叶中芹菜素的的含量呈上升趋势。但当料液比达到1∶40 g/mL时,芹菜素含量达到最高,之后随着料液比的增加,芹菜素含量又有减小的趋势,这可能是由于随着料液比的的增加,其他醇溶性成分溶出,从而使含量下降。同时,料液比过大也会造成溶剂和能源的浪费,并给后续工作造成困难。因此,本实验选取1∶40 g/mL作为提取芹菜素的最佳料液比。并选定料液比在1∶35、1∶40、1∶45 g/mL作为正交实验的水平[27]。
2.2.4 提取温度的选择
按原料粒径为40目,料液比为1:40 g/mL,温度分别在60、70、80、90 ℃,回流60 min的条件下,对芹菜叶中的芹菜素进行提取,比较提取温度对芹菜素得率的影响如图5所示,芹菜叶中芹菜素的提取率随着温度的升高而增加,但当温度达到80 ℃时,芹菜素含量达到最大值,进一步提高温度,芹菜素含量不再增加,考虑到温度过高会增加杂质的溶出量,且耗能较多,因此选择80 ℃为最佳提取温度,并选定温度70、80、90 ℃作为正交实验水平[27]。
2.2.5 芹菜叶粒径的选择
按原料粒径分别为20、40、60、80目,料液比为1:40 g/mL,温度分别为80 ℃,回流60 min的条件下,对芹菜叶中芹菜素进行提取,以芹菜素得率比较不同颗粒度的效果如图6所示,实验结果如图6表明:原料颗粒度大小对芹菜素得率影响明显,随着芹菜叶粒径的减小,芹菜素得率先增加后减小,原料粒径为40目时,芹菜素得率达到最大,这是因为随着原料粒径逐渐减小,杂质逐渐被分出,原料可以与溶剂充分混合,使提取率明显增加,但是,粒径进一步减小,提取液粘度增加,不利于芹菜素溶出,且部分芹菜叶颗粒也被阻隔,造成一定的浪费,综合考虑,原料颗粒度为40目是提取芹菜素的最佳粒径,并选定20、40、60目作为正交实验水平。
2.2.6 提取时间的选择
按原料粒径为40目,料液比为1:40 g/mL,分别回流60、90、120、150、180 min,温度为80 ℃的条件下,对芹菜叶中芹菜素进行提取,以芹菜素得率比较不同提取时间的效果如图7所示,实验结果表明:芹菜叶中芹菜素的得率在2 h内,随着时间的增加,提取含量减少,可能是因为芹菜叶中的植物细胞壁在低温没有被完全破裂,导致其中的有效成分溶出较少。2 h后随着回流时间继续增加,150 min芹菜素得率达到最高,但进一步延长提取时间,芹菜素得率又有所下降。这可能是随着浸提时间的增长,脂溶性物质增加,芹菜素得率减少。因此,本实验选150 min作为芹菜素提取的最佳提取时间[19]。
2.3 正交实验分析
在单因素实验的基础上,确定以颗粒度为40目的芹菜叶为原料,提取时间为150 min,分别以乙醇浓度、料液比、提取温度以及粒径为考察因素,以芹菜素得率为实验指标,设计4因素3水平正交实验,结果如表2所示。
表2结果显示:在9组实验中,第9组实验中芹菜叶中芹菜素的含量最高为20.124 mg/g;第1组最低,仅有10.320 mg/g。对芹菜素含量的极差分析可以看出,四个因素对提取效果的影响顺序为:A>C>D>B,即:乙醇浓度对提取效果的影响最大,温度次之,其次是粒径,料液比对实验结果的影响最小。
由实验数据可知,4个因素的最佳水平组合为A3B3C2D2,即:乙醇浓度为90%,料液比为1:45 (g/mL),提取温度为80 ℃,粒径为40目。在此最佳工艺条件下,进行芹菜素的提取实验,三组平行实验,求平均得率为20.675 mg/g。
2.4 芹菜素提取液的抗氧化活性研究
2.4.1 芹菜叶中芹菜素对DPPH·自由基清除作用
由图8可以看出芹菜素提取液对DPPH·清除率随芹菜素提取液的浓度的增加而增大,当芹菜素提取液含量为0.027 mg/mL时清除率为48.78%,VC含量为0.027 mg/mL时,清除率为75.68%。结果表明,芹菜叶中芹菜素和VC都对DPPH·具有一定的清除能力,芹菜叶中的芹菜素提取液的清除率略小于同浓度的VC的清除率,但也有较好的清除效果。
2.4.2 芹菜叶中芹菜素对羟自由基的清除作用
由图9可知,随着芹菜叶中芹菜素浓度的增加,对羟基自由基的清除率增大,当芹菜素浓度为0.3125 mg/mL时对羟基自由基的清除率为38.04%。芹菜叶中的芹菜素提取液的清除率略小于同浓度的VC的清除率,但也有较好的清除效果。
2.4.3 芹菜叶中芹菜素对超氧阴离子的清除作用
从图10中可以看出,芹菜叶中芹菜素对O2-·的清除率随着其浓度的增加而增强,当芹菜素浓度达到0.463 mg/mL时,芹菜素提取液对O2-·的清除率为56.65%,随着芹菜素浓度的增大,对超氧阴离子的清除能力越来越接近同浓度的VC,说明芹菜叶中的芹菜素是一种很好的天然抗氧剂。
图10 芹菜素提取液和VC对超氧阴离子的清除效果
Fig.10 Scavenging effect of celery extract and VC on superoxide anion
3 结 论
回流提取芹菜叶中芹菜素的适宜提取条件为:芹菜叶颗粒度为40目,90%乙醇溶液于80 ℃,料液比为1∶45 (g/mL),提取150 min时,重复提取一次,最佳得率为20.675 mg/g。
芹菜叶中芹菜素对DPPH·自由基,超氧阴离子,羟基自由基都有明显的清除效果,且随着芹菜素提取液的浓度增加而增大,浓度越大,清除效果越接近于同浓度的VC,因此芹菜素提取液是良好的天然抗氧化剂。
参考文献:
[1] 赵学敏,闫冰.本草纲目拾遗[M].北京:中国中医药出版社,1998.
[2] 王海娣,刘艾林,杜冠华.芹菜素药理作用的研究进展[J].中国新药杂志,2008,17(18):1561-1565.
[3] 孙秀琴,李荣华, 唐涛.芹菜素抗氧化作用研究进展[J].中国现代医生,2009,47(27):34-35.
[4] 刘佳微.芹菜素亚慢性暴露对小鼠、大鼠肝脏功能及脂质过氧化的影响[D].兰州:兰州大学,2014.
[5] 陈况况,章宏慧,陈健初.芹菜素对癌细胞作用机理的研究进展[J].食品工业科技,2013,34(3):392-395.
[6] 李明勇,黄培春.芹菜素对人鼻咽癌CNE-2Z细胞化疗敏感性的增强作用[J].中国药理学通报,2012,28(1):88-92.
[7] 任环宇,唐修文.芹菜素对肺癌细胞的抗增殖作用和抗肿瘤药物的增敏作用[J].浙江大学学报,2011,40(5):508-514.
[8] 刘军,阎维维,刘文博.芹菜素诱导肺癌A549细胞凋亡及其机制研究[J].中草药,2011,42(7):1393-1395.
[9] 潘雪刁,杨周萍,周四桂,等.芹菜素对人肺癌A549细胞凋亡及相关蛋白Bax、Bcl-2表达的影响[J].中国医药生物技术,2013,8(4):259-263.
[10]帅卫,全梅芳,黄秋林.芹菜素诱导胰腺癌PANC-1细胞凋亡与GSH耗竭的关系[J].肿瘤药学,2011,1(3):197-199+208.
[11]蔡婧,劉安文,赵向丽,等.芹菜素对肝癌细胞生长及基因表达的影响[J].世界华人消化杂志,2010,18(6):542-549.
[12]孟勇,李华,马清涌,等.芹菜素对结肠癌SW480细胞MMP及CD44v6作 用 的 实 验 研 究[J].中华全科医学,2011,9(8):1165-1166.
[13]孟勇,李华,马清涌,等.芹菜素对人结肠癌细胞株SW480体外侵 袭 能 力 的 抑 制 作 用[J].现代肿瘤医学,2011,19(8):1522-1524.
[14]刘俊法.芹菜素对糖尿病大鼠降血糖、调节血脂和抗氧化能力的影响[J].中药药理与临床, 2014,30(5):44-47.
[15]隋海霞,支媛,刘海波,等.芹菜素舒张血管作用及其机制研究[J].卫生研究,2011,40(4):416-419,422.
[16]阚伟娟,喻婉莹,于鹏霞,等.芹菜素的抗炎作用及其机制[J].亚太传统医药,2012,8(1):17-19.
[17]鄂裘恺,谢焕松,周鸣鸣.芹菜素镇痛消炎作用研究[J].辽宁中医药大学学报,2008,10(7):145-146.
[18]郭文莉.葡萄皮色素提取、纯化与抗氧化活性的研究[D].乌鲁木齐:新疆农业大学食品科学学院,2007.
[19]王凯.宁夏沙枣中总黄酮的提取工艺研究[J].安徽农业科学,2011,39(14): 8343-8344+8347.
[20]何微,朱捷.枸杞叶中总黄酮及芦丁提取工艺的研究[J].当代化工,2015,44(11):2723-2725.
[21]李霄,曹艳萍,马向荣,等.陕北红枣多酚抗氧化性研究与比较[J].应用化工,2012,41(8):1368-1371.
[22]王俏,邹阳,钟耕,等.多酚类单体物质抗氧化活性的研究[J].食品工业科技,2011,32(1):137-145.
[23]郭雪峰,岳永德,汤锋,等.用清除超氧阴离子自由基法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008,28(8):1823-1826.
[24]于丽娜,宫清轩,杨庆利,等.花生杆水溶性膳食纤维的超声波提取及抗氧化活性研究[J].花生学报,2011,40(2):1-6.
[25]姚曦.梁山慈竹(Dendrocalamus farinosus)竹秆化学成分及生物活性研究[D].北京:中国林业科学研究院,2014.
[26]郭雪峰,岳永德,孟志芬,等.用清除羟自由基法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2010,30(2):508-511.
[27]韩芸,梁伟玲,徐迎涛,等.广藿香总黄酮提取工艺及抑菌活性研究[J].食品研究与开发,2016,37(23):65-69..
