显微介导河蟹总DNA导入镜鲤的检测与分析
2017-07-10闫学春栾培贤何立川
闫学春,栾培贤,何立川
(中国水产科学研究院黑龙江水产研究所,淡水鱼类育种国家地方联合工程实验室,淡水水产生物技术与遗传育种重点实验室,黑龙江 哈尔滨 150070)
显微介导河蟹总DNA导入镜鲤的检测与分析
闫学春,栾培贤,何立川
(中国水产科学研究院黑龙江水产研究所,淡水鱼类育种国家地方联合工程实验室,淡水水产生物技术与遗传育种重点实验室,黑龙江 哈尔滨 150070)
利用显微介导远缘杂交技术将河蟹总DNA直接导入镜鲤受精卵内,再利用AFLP分子标记技术检测显微介导河蟹基因镜鲤的外源DNA。在30对AFLP引物中,有3对引物扩增出供体基因片段,即在显微介导河蟹基因镜鲤中均有和河蟹基因相同而对照镜鲤没有的条带。对6尾阳性显微介导河蟹基因镜鲤的扩增产物进行回收、克隆和测序验证。结果表明:阳性显微介导河蟹基因在镜鲤中均含有供体基因目的片段。本研究在分子和基因水平上验证了河蟹总DNA可通过显微介导方式整合到镜鲤基因组中,为显微介导外源总DNA转化技术的应用提供新的思路。
显微介导;河蟹;总DNA;镜鲤
远缘杂交(distanthybridization)是亲缘关系较远的种间、属间的生物个体间杂交,可促进种属间的基因交流,创造新物种[1],是鱼类育种基本手段之一[2,3]。而显微介导远缘杂交技术就是利用外源总DNA导入技术,将超远缘异源供体总DNA导入受体基因组来改善鲤科鱼类的品质。显微介导远缘杂交与转化载体构建的基因工程不同,而机理与自然的渐渗杂交有相同之处,都是实现外源DNA分子片段的杂交,其供体染色体和受体染色体很少发生配对现象[4-6]。利用供体基因资源进行远缘杂交可以引入大量具有供体性状的功能基因,特别是一些新基因有可能重组进入受体,而进入受体的供体遗传物质可以调控基因表达,如启动子、增强子等[7,8]。利用转基因技术将供体基因组DNA导入受体基因组中而实现外源基因片段的杂交,克服种属间远缘杂交的不亲和性、杂种不育,而外源基因的高水平表达可以克服品质性状的低遗传力特征,使供体的优良性状在受体鱼中得以体现,可以有计划有目的的选择供体总DNA片段[9]。利用显微介导总DNA导入技术产生有供体片段存在的大量原代和子代个体,再结合分子标记辅助育种技术,可加快鱼类品种改良和新种产生的过程。
德国镜鲤CyprinuscarpioL.鳞片少,核型与鲤核型基本一致,从原西德引进后,经多年的系统选育,已成为我国主要的鲤养殖品种之一。德国镜鲤由于生长速度超过其他鲤,已被全国水产良种审定委员会审定为适合在我国推广的水产优良养殖品种[10,11]。河蟹(中华绒螯蟹)Eriocheir sinensis肉味鲜美,营养价值丰富,含有丰富的蛋白质、微量元素和维生素A,是优良的遗传资源[12,13]。如果将这些有益的营养特性导入镜鲤,创造出新的镜鲤品种,对获得一个肉质优良镜鲤养殖新品种很有帮助。
本研究通过对显微介导河蟹基因的镜鲤进行AFLP分析,在分子水平和基因水平上证明显微介导河蟹基因镜鲤已整合了河蟹DNA,从而证明本方法的实际应用效果,为淡水养殖鱼类的改良提供一种全新的途径和方法。
1 材料和方法
1.1 材料
1.1.1 样本采集
河蟹购于哈尔滨市水产市场,镜鲤取自黑龙江水产研究所松浦试验站。显微介导河蟹基因镜鲤由黑龙江水产研究所遗传育种与生物技术研究室制备。
1.1.2 引物与试剂
在上海生工生物技术服务有限公司购买Taq酶和T4-DNA连接酶;在大连宝生物公司购买DNA Marker(DL2000);接头及引物由上海生工生物工程技术服务有限公司提供合成。AFLP接头和通用引物序列及选择性引物序列见表1。

表1 AFLP接头及引物序列Tab.1 Adapter and primer sequences of AFLP
1.1.3 河蟹总DNA的制备
河蟹基因组DNA的提取依毛瑞鑫等的方法[12]稍加改动。取约100mg河蟹肌肉经液氮磨碎,放入1.5mL离心管中;在管中加入 500μL缓冲液(100mmol/LNaCl;10mmol/LTris-Cl,pH8.0;100mmol/L EDTA,pH8.0)混匀,再加入终质量浓度为0.5μg/mL的SDS和100μg/mL的蛋白酶K;在55℃水浴锅内消化至液体透明;待冷却后加入等体积的饱和酚(pH8.0)抽提1次,用酚∶氯仿∶异戊醇(25∶24∶1)抽提1次,再用氯仿∶异戊醇(24∶1)抽提1次;离心后提取上清液,加入2倍体积的冷冻无水乙醇沉淀DNA,收集絮状沉淀;70%的乙醇洗涤沉淀 2次,7 500r/min离心5min,自然干燥后加入TE溶解。取出其中的l管DNA,用超声波(TH-800B型数控超声波仪)打断大片段DNA,将样品DNA稀释至终浓度200ng/μL,-20℃保存备用。
1.1.4 试验鱼基因组DNA提取
显微介导河蟹基因镜鲤DNA的提取方法参见闫学春等[14]。在加有裂解液的试管中加入100mg鳍条,55℃消化,中间不时轻轻摇动,待组织完全消化后取出,加入酚-氯仿混合液抽提2次;加入RNA酶,37℃保温30min,再用等体积氯仿抽提1次,然后透析16h,直至透析液OD270<0.05,加入2倍体积的无水乙醇沉淀,70%乙醇洗涤1次,自然干燥,加入0.1×TE溶解,置4℃冰箱备用。
1.2 方法
1.2.1 外源基因导入
参见闫学春等[15]。每年5~6月繁殖季节,选择性成熟的镜鲤亲鱼,注射鲫脑垂体和促黄体释放激素类似物的混和合物进行人工催产,采集一定数量的高质量镜鲤卵子和4℃冰箱中保存的精液,进行干法授精,受精卵分散粘附在培养皿上,以国产可三维移动的显微操作仪,用自制的玻璃注射针给1~2细胞期的镜鲤受精卵显微注射。每个受精卵注射量为1nL。对照受精卵仅注射生理盐水。注射后的鲤受精卵于22~23℃水族箱孵化,同时用气泵充气直至出膜。共导入镜鲤受精卵1 600粒,获得试验鱼288尾,放入池塘强化培育。
1.2.2 AFLP试验
AFLP试验采用闫学春等[15]的方法。
1.2.2.1 酶切反应
在37℃水浴中,利用Mse I/Eco R I对DNA样品双酶切(3~6h),电泳检测酶切效果(1%的琼脂糖凝胶),再将DNA样品放于65℃水浴20min(使酶失活),4℃下保存备用。
1.2.2.2 连接反应
连接反应体系包括T4-DNA连接酶2μL,酶切DNA样品 4μL,MseⅠ接头 1.0μL,Eco RⅠ接头1.0μL,PEG 2μL,Buffer2μL,加无菌水至反应总体积20μL。16℃连接过夜。
1.2.2.3 预扩增反应
PCR反应条件为:72℃2min,94℃30s,56℃30s,72℃2min,共30个循环,72℃温育10min。反应混合液体系为:Buffer 18μL,MseⅠ引物(M-C 10mmol/L)1μL,Eco RⅠ引物(E-A 10mmol/L)1μL,Taq酶(5U/μL)0.3μL,无菌水2.7μL。在23μL反应混合液中加入连接产物2μL。PCR扩增后用无菌水稀释40倍,-20℃保存。
1.2.2.4 选择性扩增反应
反应混合液为:Buffer 18μL,MseⅠ引物(10mmol/L)1μL,Eco RⅠ引物(10mmol/L)1μL,Taq酶(5U/μL)0.3μL,2μL稀释的预扩增产物,无菌水2.7μL,反应体积为25μL。PCR反应条件:先94℃ 2min,再94℃30s,65℃30s(每循环退火温度降低0.7℃),72℃90s,13个循环后变为:94℃30s,56℃30s,72℃90s,23个循环。
1.2.3 变性聚丙烯酰胺凝胶电泳
参见闫学春等[15]的方法。缓冲液为:98%甲酰胺,10mmol/LEDTA,0.25%溴酚蓝,0.25%二甲苯青。6%的变性聚丙烯酰胺配制为:丙烯酰胺/甲叉丙烯酰胺19∶1,7mol/L尿素,1×TBE。利用6%的变性聚丙烯酰胺凝胶电泳检测选择性扩增产物。AFLP扩增产物加入等体积的上样缓冲液,经95℃变性10min后,立即冰浴,每个样品上样量为5μL,上样前(凝胶55W恒功率条件下)预电泳30min至温度达到55℃。电泳结束后银染、照相、分析。
2 结果与分析
2.1 显微介导河蟹基因镜鲤基因组DNA提取
提取的显微介导河蟹基因镜鲤基因组DNA的OD260/OD280为1.8~2.0(紫外分光光度计和EB染色的荧光强度双重测定),所测个体DNA含量为3~4μg/μL。琼脂糖凝胶(1.5%)电泳检测结果显示:DNA条带清晰无弥散现象,表明提取的显微介导河蟹基因镜鲤基因组DNA纯度高,蛋白质和RNA等杂质含量少,可以用于AFLP后续试验(图1)。

图1 显微介导河蟹基因镜鲤基因组DNA琼脂糖电泳Fig.1 Agarose electrophoresis of the genom ic DNA in m irror carpm icro-injected w ith Chinese m itten handed crab genom ic DNA
2.2 显微介导河蟹基因镜鲤AFLP扩增
以河蟹基因组DNA为阳性对照,以普通镜鲤基因组DNA为阴性对照,检测59尾显微介导河蟹基因镜鲤基因组。在30对AFLP引物中,有3对引物对25尾显微介导河蟹基因镜鲤扩增出供体基因片段,即和河蟹基因相同的带,而对照镜鲤没有,阳性率为42.37%。图2是引物E-ACC,M-CTT扩增显微介导河蟹基因镜鲤的结果,箭头所指是扩增的供体基因组片段。
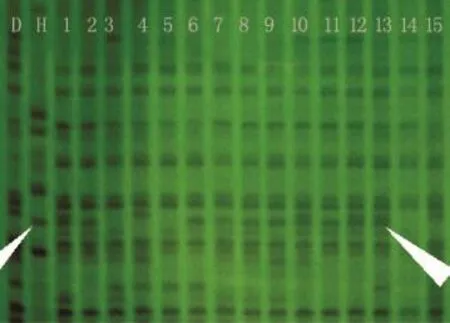
图2 显微介导河蟹基因镜鲤的AFLP电泳图Fig.2 AFLP electrophoresis of the genom ic DNA in m irror carp m icro-injected w ith Chinesem itten handed crab genom ic DNA
2.3 显微介导河蟹基因镜鲤产物凝胶测序
在AFLP试验结果中,显微介导河蟹基因镜鲤与河蟹有相同的条带,而在对照镜鲤中没有的目的条带进行回收,回收产物浓度均为20ng/μL。对其中6尾阳性显微介导河蟹基因镜鲤的扩增产物进行回收、克隆和测序验证。结果表明:阳性显微介导河蟹基因镜鲤中均含有供体基因目的片段(图3)。

图3 供体基因序列与显微介导河蟹基因镜鲤序列比对Fig.3 Sequence alignments of donor and the genom ic DNA in m irror carp m icro-injected w ith Chinesem itten handed crab genom ic DNA
3 讨论
AFLP是由荷兰科学家Pieter Vos等[16]于1995年发明的一种DNA分子标记,基因组经限制性内切酶切割、连接接头,再进行PCR扩增,每个反应能提供大量的多态性片段。该方法信息含量大、效率高,无需Southern杂交,没有放射源的风险,已广泛应用在鱼类研究中。如Rubinstein等[17]研究AFLP分子标记在斑马鱼Barchydaniorerio的野生型和突变体不同组织及发育时期的表达;Young等[18]利用476个 AFLP分子标记构建虹鳟Oncorhynchus mykiss遗传连锁图谱,经过遗传连锁分析分别得到主连锁群和小连锁群32个和11个;王志勇等[19]用5对AFLP引物对大黄鱼Larimichthyscrocea野生种群和养殖群体进行分析,野生种群和养殖种群在多态性比例和个体遗传差异存在显著差异,野生种群显著高于养殖群体;David等[20]利用AFLP技术对两个鲤CyprinuscarpioL.种群进行遗传分析,发现AFLP的多态性在草鱼Ctenopharyngodonidella和鲤中为6.7%,而在观赏鲤中为59.9%。说明草鱼和鲤与被检测的其他鱼有相当远的亲缘关系;刘必谦等[21]利用AFLP技术把岱衢族大黄鱼分为岱衢族大黄鱼Ⅰ型和Ⅱ型;季士治等[22]为开展大鳞鲆分子研究,建立AFLP分子体系。利用AFLP技术在外源基因的检测方面也得到应用。佟广香等[23]利用AFLP技术评估转基因鲤的生态安全性,检测不同比例转基因鲤亲本子一代基因组的分子遗传学特征,结果表明逃逸转基因鲤数量与生态安全直接相关;闫学春等[15]利用AFLP技术对显微介导中国对虾Fenneropenaeuschinensis基因鲤进行外源DNA检测,证明受体鲤中含有供体基因片段。本研究所获得的AFLP指纹图谱表明:显微介导河蟹基因镜鲤中存在河蟹特异性AFLP指纹,表明河蟹的供体基因成功渗入到受体镜鲤基因组中。为进一步找到精确的遗传证据,本研究将与河蟹相同的AFLP条带进行回收、测序。结果表明:显微介导河蟹基因镜鲤片段序列与供体片段序列完全一致,进一步证明河蟹基因在受体镜鲤中存在的可靠性。
依靠显微介导远缘杂交技术,导入的外源基因和其他转基因鱼的的操作方法是一样的,都采用显微注射方法,其优势在于所导入的外源基因是未经遗传修饰的基因组DNA。用这种方法得到的鱼与远缘杂交相近,只不过是基因组水平的远缘杂交。该技术方法简便,不受受体水产动物种类限制,可任意选择当家优良品种进行外源DNA导入,为远缘杂交不亲和的水产动物之间的基因重组创造了条件。而周光宇等[4]针对远缘杂交提出假说,即“DNA片段杂交假说”。该假说提出,远缘杂交通过与母本DNA部分同源的DNA片段重组进入母本,实现远远杂交,使母本性状出现变异。供体总DNA在显微介导的辅助下导入母本,并且包含全部供体遗传信息,因此存在发生远缘杂交概率。在对与鱼类品质相关基因知之甚少的情况下,通过显微介导外源总DNA的转化,将一些有益营养特性基因导入鲤,再通过对后代的筛选,就可以获得拥有高品质的新性状个体。
[1] 闫学春,梁利群,葛彦龙.两种鲤鲫杂交回交子代染色体核型分析及比较[J].水产学杂志,2011,24(2):4-8.
[2] 楼允东.鱼类育种学[M].北京:中国农业出版社,1993.
[3] 闫学春,孙效文,梁利群,等.鲤鲫杂交(♀)×鲫(♂)回交子代的形态特征研究[J].水产学杂志,2006,19(1):6-10.
[4] 周光宇,龚蓁蓁,王自芬,等.远缘杂交的分子基础-DNA片段杂交假说的一个例证[J].遗传学报,1979,6(4):405-413.
[5] 卞坡.离子束介导外源全DNA转化拟南芥菜的若干问题研究[D].郑州:郑州大学博士论文,2003.
[6] 卞坡,霍裕平,秦广雍,等.离子束介导外源全DNA转化对作物改良的原理初探[J].河南农业科学,2002,12(2): 8-10.
[7] 万文举,邹冬生,彭克勤.论生物诱变[J].湖南农学院学报,1992,18(4):866-890.
[8] 钟莎莎.草鱼卵泡抑素(Follistatin)重复基因的克隆和功能研究[D].上海:上海海洋大学硕士论文,2012.
[9] 杜科,闫学春,李超,等.显微介导远缘基因鲤家系的建立及遗传多样性分析[J].安徽农业大学学报,2013,40(1): 100-106.
[10] 刘明华,沈俊宝,张铁奇,等.黑龙江野鲤、散鳞镜鲤良种选育技术[J].水产学报,1992,16(1):7-15.
[11] 尹洪滨.四种鲤鱼染色体核型比较研究[J].水产学杂志,2001,14(1):7-10.
[12] 毛瑞鑫,鲁翠云,刘福军,等.中华绒螯蟹部分基因组文库构建和微卫星位点的筛选[J].上海海洋大学学报, 2009,18(2):129-135.
[13] 叶金云,王友慧,郭建林,等.中华绒螯蟹对赖氨酸、蛋氨酸和精氨酸的需要量[J].水产学报,2010,34(10):1541-1548.
[14] 闫学春,钟莎莎,徐鹏,等.Tgf2转座子介导鲤Fst1基因原件在鲤中的转基因效率研究[J].上海海洋大学学报, 2014,23(1):1-7.
[15] 闫学春,张晓峰,刘翠,等.显微介导的远缘基因渐渗技术在鲤育种中的应用[J].中国水产科学,2011,18(2): 275-282.
[16] Vos P,Hogers R,BleekerM,etal.AFLPa new technique for DNA fingerprint[J].Nucl Acids Res,1995,23(21): 4407-4414.
[17] Rubinstein A L,Lee D,Luo R,etal.Genes dependenton zebrafish cyclops function identified by AFLP diferential geneexpression screen[J].Genesis,2000,26(1):86-97.
[18] YoungW P,Wheeler PA,Coryell V H,etal.A detailed linkage map of rainbow trout produced using doubled haploids[J].Genetics,1998,148(2):839-850.
[19] 王志勇,王艺磊,林利民,等.福建官井大黄鱼AFLP指纹多态性的研究[J].中国水产科学,2002,9(3):198-202.
[20] David L,Rajasekaran P,Fang J,et al.Polymorphism in ornamentaland common carp strains(Cyprinus carpio L.)as revealed by AFLPanalysisand anew setofmicrosatellitemarkers[J].MolGeneGenomics,2001,266(3):353-362.
[21] 刘必谦,懂闻琦,王亚军,等.岱衢族大黄鱼种质的AFLP分析[J].水生生物学报,2005,29(4):413-416.
[22] 季士治,王伟继,雷霁霖,等.大菱鲆AFLP分析体系的建立[J].海洋水产研究,2007,28(1):6-12.
[23] 佟广香,匡友谊,梁利群,等.转基因鲤的生态安全检测[J].吉首大学学报:自然科学版,2010,31(1):96-103.
Detection and Analysis of Mirror Carp Micro-injected with Total DNA in Chinese Mitten Handed Crab
YAN Xue-chun,LUAN Pei-xian,HE Li-chuan
(National Local JointEngineering Laboratory of Freshwater Fish Breeding,Key Laboratory of Freshwater Aquatic Biotechnology and Genetic Breeding,Heilongjiang River FisheriesResearch Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China)
In thisstudy,totalDNA of Chinesemitten handed crab(Eriocheirsinensis)was injected intomirror carp(Cyprinuscarpio)bymicro-injected distanthybridization technique,and the exogenous DNA inmirror carpmicro-injected Chinesemitten handed crab wasdetected by AFLPmolecularmarker technology.In the30 pairsof AFLPprimers,3 pairsof primershave amplified thegene fragmentsof donor,indicating that there is themicro-injected Chinesemitten crab gen found in only crab.The results showed that,cloned and sequenced amplification products revealed that there were transgene fragments in all the positive three scales of 6 positivemicro-injectedmirror carp.The findings verified that the totalDNA of crab was injected into three scales genome atmolecular and gene levels,providing a new strategy for theapplication ofm icro-injected exogenous totalDNA.
m icro-injected;Chinesem itten handed crab;totalDNA;m irror carp
Q959;S917
A
1005-3832(2017)03-0019-05
2017-02-06
中央级公益性科研院所基本科研业务费专项(HSY201707M);国家高技术研究发展计划(863计划)项目(2011AA100404);国家水产种质资源平台项目.
闫学春(1964-),男,研究员,从事分子生物学与基因工程育种研究.E-mail:yanxc8@163.com
