PD-1/PD-L1阻断剂免疫治疗不良反应及其处理原则
2017-07-07黄乐富徐小寒孙元元王苗苗贺子轩周心娜王小利
黄乐富,邸 岩,徐小寒,孙元元,王苗苗,贺子轩,景 句,周心娜,王小利,任 军
(首都医科大学附属北京世纪坛医院肿瘤内科,肿瘤治疗性疫苗北京市重点实验室,北京 100038)
·药学进展·
PD-1/PD-L1阻断剂免疫治疗不良反应及其处理原则
黄乐富,邸 岩,徐小寒,孙元元,王苗苗,贺子轩,景 句,周心娜,王小利,任 军
(首都医科大学附属北京世纪坛医院肿瘤内科,肿瘤治疗性疫苗北京市重点实验室,北京 100038)
免疫治疗成为继手术、放疗、化疗后又一种重要的抗肿瘤手段。其中抗程序细胞死亡蛋白1(programmed death-1,PD-1)及配体(PD-1 ligand,PD-L1)免疫检查点阻断剂,在肿瘤治疗中取得了突破性进展,已被美国食品药品管理局(FDA)批准用于恶性黑色素瘤、转移性鳞状非小细胞肺癌、晚期肾癌、头颈鳞状细胞癌、尿路上皮癌等治疗,但随着PD-1/PD-L1阻断剂在临床上逐步推广,越来越多的免疫相关副反应(immune-related adverse events,irAEs)引起关注。本文对PD-1/PD-L1阻断剂治疗引起的各器官的免疫相关不良反应以及对应临床处理方法进行综述,有助于临床医护工作者诊断、预防及治疗其相关不良反应。[关键词] 免疫检查点;PD-1;PD -L1;不良反应;免疫治疗
随着肿瘤学、免疫学等相关学科的迅速发展和交叉渗透,肿瘤免疫治疗取得了突飞猛进的发展,成为继手术、放疗、化疗后又一种重要的抗肿瘤手段。其中抗程序细胞死亡蛋白1(programmed death-1,PD-1)及配体(PD-1 ligand,PD-L1)免疫检查点抑制剂,在肿瘤治疗中取得了突破性进展。美国食品药品管理局(FDA)已批准nivolumab和pembrolizumab用于治疗恶性黑色素瘤、转移性鳞状非小细胞肺癌、晚期肾癌、头颈鳞状细胞癌、霍奇金淋巴瘤、尿路上皮癌,且针对胃癌、结肠癌、肝癌的临床研究也在进行中。
但随着PD-1/PD-L1阻断剂在国内外临床试验和应用的逐步推广,越来越多的不良反应引起关注。PD-1受体抑制剂阻断T细胞负性调控信号解除免疫抑制,增强T细胞抗肿瘤效应的同时,也可能异常增强自身正常的免疫反应,导致免疫耐受失衡,累积到正常组织时表现出自身免疫样的炎症反应,称为免疫相关副反应(immune-related adverse events,irAEs),涉及皮肤、消化道、肝脏、内分泌、肺部等在内的多个器官。但目前仍没有针对irAEs的特定分级标准,其分类及分级,仍遵循美国国立癌症研究所常规不良事件评价标准(CTCAE)第4版。
本文综述了应用PD-1/PD-L1阻断剂引起各器官的irAEs及对应临床处理方法,有助于临床医护工作者诊断、预防及治疗相关不良反应。
1 皮肤毒性
最常见也是最早发生的的irAEs是皮肤毒性,高峰期出现在PD-1/PD-L1阻断剂治疗两个周期后,包括滤泡性皮炎、红斑性皮炎、丘疹性皮炎等。以轻度皮肤毒性最为常见,有28% ~ 50%患者出现不同程度的皮肤瘙痒,皮疹和湿疹[1-4],通常见于躯干与四肢。严重的皮肤毒性有苔藓样皮肤反应、Sweet综合征、大疱性类天疱疮等[1],且文献报道苔藓样皮肤反应及湿疹可诱发白癜风[5],机制可能与阻断在肿瘤及皮肤均表达某种抗原有关[7]。此外,PD-1阻断剂增加放疗敏感性,因此两者联合可能诱发急性皮肤反应[6]。
轻度皮肤毒性可不进行治疗或局部外用糖皮质激素、口服止痒剂(例如抗组胺药物,NK-1受体抑制剂等);而干预后不改善、口腔粘膜受累或发生3级及以上皮肤毒性的患者,应暂停PD-1抑制剂,并请皮肤科会诊行皮肤病学评估,包括临床评估、皮肤活检等[8],治疗上口服泼尼松(1 mg·kg-1·d-1),必要时静脉给药治疗,直到毒性严重程度≤1级。如果48 h内恶化,考虑加用免疫抑制剂(如英夫利昔单抗,环磷酰胺,霉酚酸酯)。
1级皮肤不良反应可持续免疫治疗;2级皮肤不良反应可在改善后恢复免疫治疗,但若连续治疗12周后病情仍无改善,则应停止免疫治疗。对于严重皮肤不良反应的患者,干预治疗好转后是否继续PD-1阻断剂治疗,目前仍有争议。
2 腹泻与结肠炎
肠道不良反应多发生于PD-1抑制剂应用后的5 ~10周[9-10]。以腹泻及结肠炎为主。
中学生接受时事政治的场所有家庭、学校和社区等,其中中学政治课堂是学生了解时事政治的主要途径和场所。接受的途径也较为单一,主要有电视新闻、报刊阅读、上网获取和教师宣讲、学生传播等。课堂上时事政治的宣讲只有政治、语文两课的老师进行,其余学科几乎不涉及。认识不到位是影响时事教学实施和政治课堂教学效果的一个重要原因。
腹泻发生率为8% ~ 19%,以轻中度为主,3/4级的重度腹泻多发生于联合伊匹单抗治疗,且为剂量依赖性[11],在Ⅱ期研究中显示10 mg·kg-1组的重度腹泻发生率(10%)显著高于3 mg·kg-1组(1%)[12]。
结肠炎是指腹泻的同时伴有腹痛,或伴有直肠出血或分泌粘液增多,或内窥镜下取病理检查明确有结肠炎改变,发生率为1.3%,联合用药时上升至11.8%[13]。早发现及时干预对减少中重度胃肠道不良事件、改善症状尤为重要。
腹泻或结肠炎相关症状持续超过3 d,排除感染因素后根据腹泻程度及时评估病情予以应用糖皮质激素。轻微症状的1级(每天< 4次)对症予以结肠炎饮食和胃肠动力抑制剂(洛派丁胺或复方地芬诺酯)。调整饮食并应用止泻药2 ~ 3 d后症状仍持续但无加重时可应用布地奈德。2级中度腹泻(每天4 ~ 6次)时结肠镜有助于明确诊断,一旦镜下明确结肠炎应暂停PD-1抗体,立即予以糖皮质激素1 ~ 2 mg·kg-1·d-1治疗。对严重甚至危及生命的结肠炎(3或4级,每天7次及以上或伴有并发症)的患者永久停用免疫检查点抑制剂治疗,并予以大剂量糖皮质激素(2 ~ 4 mg·kg-1·d-1)。如果应用糖皮质激素3 d后症状仍无改善者,推荐每2周加用一次英夫利昔单抗[14-16]。英夫利昔单抗的剂量和周期参照炎症性肠病中的治疗原则[17]。对英夫利昔单抗耐药的患者可应用麦考酚酯。
根据随机双盲对照试验的结果,长效糖皮质激素不能降低腹泻发生率或减轻症状[18],因此,不推荐应用长效糖皮质激素如布地奈德预防腹泻。
3 肝脏毒性
PD-1阻断剂引起的免疫介导性肝炎也称自身免疫性肝毒性,其发生率< 5%[19-20],多发生于用药8 ~13周。有报道其延迟副反应可持续至服药后1年至数年,医生随访时应重视[1,21-22]。
每次用药期间均应行肝功能监测(liver function tests),irAEs相关肝毒性的症状可表现为黄疸、上腹痛、呕吐等,也可表现为无症状或其他非特异性症状,如发热、乏力、消化不良等。一旦肝功能有恶化趋势应及时评估,排除感染、非感染性疾病以及肿瘤进展引起的肝功能异常。推荐的实验室检查有:抗核抗体(ANA)、平滑肌抗体(SMA)、全代谢分析、胆红素、r-谷氨酰转肽酶(GGT)、乳酸脱氢酶(LDH)、抗线粒体抗体、乙丙型病毒性肝炎等抗体。irAEs肝毒性患者血清学检查ANAs、抗平滑肌抗体、抗肝细胞胞质抗体通常是阴性的。肝功能异常升高至正常范围的3倍以上时需引起重视,需每天复查监测肝功能动态变化,可行CT扫描或肝活检,与其他自身免疫性肝炎相鉴别[21,23]。irAEs肝毒性影像学表现不典型,在严重的情况下,CT扫描示轻度肝肿大、门静脉周围淋巴结肿大。IrAEs病理表现为[24-25]汇管区水肿、肝窦内外或胆小管口周边淋巴细胞浸润。肝毒性具体分级及治疗见表1(ULN为正常值上限)[8,26]。
大多数病例经糖皮质激素治疗均获得缓解。即使症状很快改善,长期激素维持逐渐减量是必要的步骤。如果类固醇激素治疗后4 ~ 7 d无缓解,需加用英夫利昔单抗治疗。激素难治性病例,依据自身免疫性肝炎的处理原则可给予硫唑嘌呤或霉酚酸酯[27]。
4 免疫治疗相关性肺炎
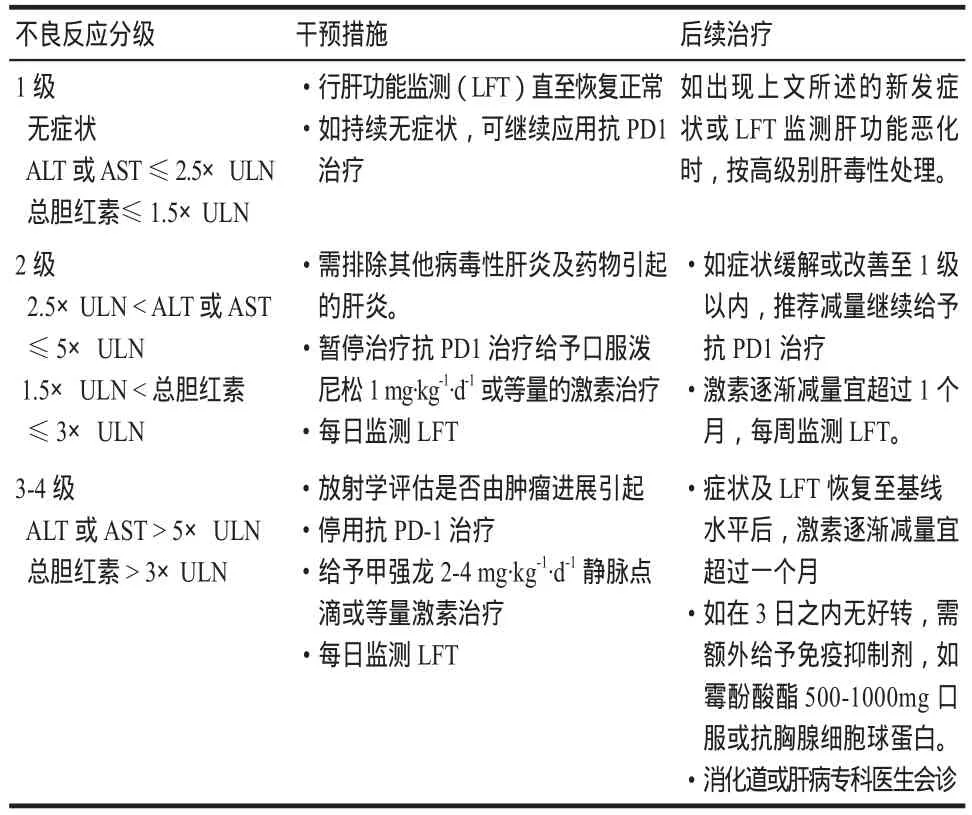
表1 irAEs肝毒性具体分级及治疗原则Tab 1 Grading and treatment of immune-related hepatotoxicity
使用PD-1/PD-L1阻断剂时,早期试验发生irAEs肺炎约为10%,且偶有危及生命报道[30-32]。一项nivolumab治疗晚期实体瘤的临床试验出现了3例(入组296例)免疫相关性肺炎导致的死亡[33]。也有报道肺癌患者或既往存在肺气肿、哮喘、肺纤维化、肺部放疗病史的患者发生免疫相关性肺炎的可能越大、程度更重[34]。
irAEs肺炎的表现为干咳、进行性呼吸困难、发热、胸痛等症状。当怀疑患者出现irAEs肺炎时,需行肺CT检查,最常见为机化性肺炎的影像学表现,呈双肺内多发病灶,如磨玻璃样改变、网格状改变、肺实变等[35],而其他免疫检查点抑制剂导致的irEAs肺炎病灶多位于下肺[36-37]。
对于irAEs肺炎的治疗,医生需根据副反应严重程度的分级,采取不同的治疗方案。轻度irAEs肺炎采取对症药物治疗,如口服强的松1 ~ 2 mg·kg-1·d-1或甲泼尼龙0.5 ~ 1 mg·kg-1·d-1。对于中度及以上的患者应首先停用PD-1受体抑制剂,严重的永久终止免疫治疗,并行支气管镜检查,请呼吸科医生会诊,以除外肺部感染和恶性肿瘤肺转移可能。中度患者给予口服或静脉注射激素治疗,病情不缓解或重度免疫相关性肺炎的患者需住院持续应用大剂量的皮质激素,如甲泼尼龙2 ~ 4 mg·kg-1·d-1,必要时还需联合应用免疫抑制剂,如霉酚酸酯、环磷酰胺、英夫利昔单抗[38]。
5 内分泌系统
接受PD-1抑制剂治疗的患者中,10%被观察到出现了不同级别免疫相关内分泌病症。较为常见的是甲状腺功能异常及下垂体炎,1型糖尿病也有相关报道。
由自身免疫介导的内分泌毒性主要影响甲状腺,导致1 ~ 2级甲状腺功能减退(4% ~ 8%)和甲状腺功能亢进(2% ~ 3%),以及少见的急性甲状腺炎(1%)。在临床上,如果出现TSH降低(< 0.5×正常值下限)或升高(> 2×正常值上限),或既往甲状腺功能障碍,在应用PD-1抗体期间应监测游离三碘甲腺原氨酸(fT3)和游离甲状腺素(fT4)[39]。对于2级甲减,可应用L-甲状腺素替代治疗。有症状的2级甲亢应优先使用甲巯咪唑治疗,必要时应用β受体阻滞剂。3级甲状腺功能障碍,可给予泼尼松龙1 ~ 2 mg·kg-1。如果发生4级的甲状腺功能障碍则需要紧急停止PD-1抗体治疗并给予泼尼松龙1 ~ 2 mg·kg-1[40-41]。由于大多数甲状腺毒性可以通过激素替代治疗得到妥善处理,PD-1抑制剂通常无需中断。对于激素替代治疗无法控制的甲状腺功能障碍,应考虑甲状腺切除术。
下垂体炎的发生率为1% ~ 6%,通常发生在6和13周之间[8,40-41],包括垂体功能减退及肾上腺皮质功能不全,症状可表现为模糊,伴有轻微疲劳,关节痛,行为改变和由于激素不足而导致的性欲丧失,也可能是严重的头痛和视觉变化,症状多不典型,难以诊断[42-43]。因此,需要定期监测TSH,fT3和fT4,因为低TSH可能是症状出现前先兆指标。
下垂体炎是少数几乎不可逆的irAEs之一,通常需要长期激素替代[41]。临床表现为疲乏或化验提示皮质醇减少,如果已排除原发性下垂体炎和由此引起的垂体功能减退或自身免疫性肾上腺炎引起的皮质醇减少,可考虑诊断免疫相关性下垂体炎。对于无症状的1级的下垂体炎,行MRI垂体扫描并与内分泌专家共同评估是否开始激素替代治疗;对于2级及以上的下垂体炎,应考虑停用PD-1抗体免疫治疗,泼尼松龙(或等效物)应立即以1 mg·kg-1开始使用并逐周减少10 mg·d-1。泼尼松龙达到10 mg·d-1后,必须用氢化可的松替代,通常推荐剂量为25 ~ 40 mg·d-1。在极少数情况下,垂体后叶可能会受到影响,导致出现尿崩症,出现多饮和尿量增多,目前推荐使用人工合成抗利尿激素(ADH)。
最近有报道PD-1抗体后可诱发1型糖尿病[44-45]。一名没有任何个人或家族糖尿病史的癌症患者,使用PD-1抗体治疗7周后,出现自身免疫性1型糖尿病、糖尿病酮症酸中毒[46]。1型糖尿病作为严重胰岛素缺乏症,血糖极易波动难控制,甚至危及生命。一经确诊,应立即终止PD-1抗体治疗,并积极胰岛素替代治疗。但由于潜在危险性,医生应加强警惕。
6 PD-1/PD-L1阻断剂其它罕见毒性
6.1 肾脏毒性
肾毒性报道较少,发病率约1%[47-48],主要表现为免疫介导相关肾炎及肾功能不全。在PD-1抗体联合ipilimumab(CTLA-4单抗)治疗晚期黑色素瘤的临床试验,可见肾小管间质性肾炎的报道,病理活检示肉芽肿型急性间质性肾炎等,严重者可至肾脏衰竭。单用PD-1抑制剂引起肾功能不全的病例中,多以血肌酐升高为主,间质性肾炎少见。治疗上,均对类固醇激素治疗反应较好,早发现早诊断及时予以激素为主的治疗,可使血肌酐迅速下降避免透析治疗。
6.2 胰腺毒性
约1% ~ 2%的应用PD-1抑制剂的患者可出现免疫相关胰酶水平的升高[1,19]。但确诊胰腺炎的病例极少[19]。也有合并2型糖尿病的患者治疗后出现胰腺β细胞功能衰竭,需要胰岛素替代治疗[1]。
PD-1单抗治疗期间,不推荐常规监测胰酶水平[3];若发现单纯胰酶水平的升高而没有其他症状怀疑胰腺炎时,可以监测指标变化并注意观察临床症状;必要时行MRI检查有助于早期诊断。如果有腹痛等临床症状且酶升高水平较明显时,建议先停用PD-1抑制剂,并给予静脉激素治疗(甲强龙1.0 ~ 2.0 mg·kg-1·d-1)。必要时请专科医师协助诊治。
6.3 眼部毒性
眼色素层炎在单用PD-1抑制剂或联合治疗中均有报道。症状为眼睛发红,畏光,疼痛,视力改变等[47-48]。出现上述症状时应请眼科医师完善专科检查,外用类固醇滴眼可缓解症状。较重的眼科炎症推荐使用口服类固醇。
6.4 关节炎
PD-1抑制剂的患者中小部分可出现关节痛,且既往有关节炎病史者症状加剧[7,49]。抗核抗体(ANA)、抗环瓜氨酸肽的检测有助于免疫相关性关节炎发作时的诊断,低剂量口服类固醇(0.5 mg·kg-1·d-1)可有效控制症状[12]。
6.5 神经系统疾病
在PD-1/PD-L1抗体联合ipilimumab(CTLA-4单抗)治疗肺癌的报道中,有散在出现重症肌无力、免疫介导性脑炎等神经系统毒性出现[11,17,50],单用PD-1/ PD-L1抑制剂暂时未见相关神经系统毒性报道。使用糖皮质激素可有效缓解毒副反应,并及时请神经科医师协助诊治。另外,也有推荐静脉应用免疫球蛋白或血浆置换[8]。
其他irAEs还包括疲乏、心肌炎、胃炎、结节病、葡萄膜炎,风湿性多肌痛,脱髓鞘、血管炎、粒细胞减少等造血系统综合征等。轻中度可行保守对症治疗,3/4级或迁延不愈的2级不良反应需停用PD-1抗体,并应用糖皮质激素治疗改善症状。
综上,PD-1/PD-L1阻断剂因对常规疗法无效的晚期肿瘤具有确切疗效而备受瞩目[51]。尽管其耐受性良好,3-4级严重不良反应少见,但因其阻断免疫抑制通路的同时,可累及绝大多数正常组织,引起免疫相关不良反应多且复杂,对于临床医师而言应该提供高警惕,不仅仅关注抗肿瘤疗效,对不良反应,也要予以重视,掌握常见种类、分级、诊断及治疗管理方法,做到早诊断早治疗,将不良反应控制在低级别,降低危险,改善预后。大多数irAEs早期足量激素治疗是可逆的,有效控制病情后可逐渐减量至完全停用。如果类固醇激素治疗后无缓解,需联用英夫利昔单抗治疗。
此外,临床试验时自身免疫性疾病人群多被排除在外,因此免疫检查点抑制剂治疗具有潜在的自身免疫性疾病患者的安全性尚不可知。而且免疫治疗与其他疗法联合,以达到最佳的临床疗效是未来肿瘤综合治疗的发展方向,因此是否会增加不良反应的发生及严重程度,或出现新的irAE,都值得临床密切关注,可进行分层研究,深入探讨其发生机理,以便进一步提高肿瘤综合治疗水平,提高晚期肿瘤患者的生活质量。
致谢:在此特别感谢杜克大学(Duke University)H. Kim Lyerly教授对本文给予的支持与指导。
[1] Hofmann L, Forschner A, Loquai C, et al. Cutaneous, gastrointestinal, hepatic, endocrine, and renal side-effects of anti-PD-1 therapy[J]. Eur J Cancer, 2016, 60: 190-209.
[2] Robert C, Thomas L, Bondarenko I, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma[J]. N Engl J Med, 2011, 364(26): 2517-2526.
[3] Postow MA. Managing immune checkpoint-blocking antibody side effects[J]. Am Soc Clin Oncol Educ Book, 2015, 35: 76-83.
[4] Weber JS, Yang JC, Atkins MB, et al. Toxicities of immunotherapy for the practitioner[J]. J Clin Oncol, 2015, 33(18): 2092-2099.
[5] Hwang SJ, Carlos G, Wakade D, et al. Cutaneous adverse events (AEs) of anti-programmed cell death (PD)-1 therapy in patients with metastatic melanoma: A single-institution cohort[J]. J Am Acad Dermatol, 2016, 74(3): 455-461.
[6] Sibaud V, David I, Lamant L, et al. Acute skin reaction suggestive of pembrolizumab-induced radiosensitization[J]. Melanoma Res, 2015, 25(6): 555-558.
[7] Topalian SL, Sznol M, Mcdermott DF, et al. Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab[J]. J Clin Oncol, 2014, 32(10): 1020-1030.
[8] Naidoo J, Page DB, Li BT, et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies[J]. Ann Oncol, 2015,26(12): 2375-2391.
[9] Weber JS, Kähler KC, Hauschild A. Management of immune-related adverse events and kinetics of response with ipilimumab[J]. J Clin Oncol, 2012, 30(21): 2691-2697.
[10] Weber JS, Dummer R, de Pril V, et al. Patterns of onset and resolution of immune-related adverse events of special interest with ipilimumab[J]. Cancer, 2013, 119(9): 1675-1682.
[11] Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma[J]. N Engl J Med, 2015, 373(1): 23-34.
[12] Wolchok JD, Neyns B, Linette G, et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, double-blind, multicentre, phase 2, dose-ranging study[J]. Lancet Oncol, 2010, 11(2): 155-164.
[13] Kähler KC, Hassel JC, Heinzerling L, et al. Management of side effects of immune checkpoint blockade by anti-CTLA-4 and anti-PD-1 antibodies in metastatic melanoma[J]. J Dtsch Dermatol Ges, 2016, 14(7): 662-681.
[14] Pagès C, Gornet JM, Monsel G, et al. Ipilimumab-induced acute severe colitis treated by infliximab[J]. Melanoma Res, 2013, 23(3): 227-230.
[15] Minor DR, Chin K, Kashani-Sabet M. Inf l iximab in the treatment of anti-CTLA4 antibody (ipilimumab) induced immune-related colitis[J]. Cancer Biother Radiopharm, 2009, 24(3): 321-325.
[16] Merrill SP, Reynolds P, Kalra A, et al. Early administration of inf l iximab for severe ipilimumab-related diarrhea in a critically ill patient[J]. Ann Pharmacother, 2014, 48(6): 806-810.
[17] Stidham RW, Lee TC, Higgins PD, et al. Systematic review with network meta-analysis: the efficacy of anti-TNF agents for the treatment of Crohn's disease[J]. Aliment Pharmacol Ther, 2014, 39(12): 1349-1362.
[18] Weber J, Thompson JA, Hamid O, et al. A randomized, doubleblind, placebo-controlled, phaseⅡstudy comparing the tolerability and efficacy of ipilimumab administered with or without prophylactic budesonide in patients with unresectable stage Ⅲ or Ⅳ melanoma[J]. Clin Cancer Res, 2009, 15(17): 5591-5598.
[19] Robert C, Ribas A, Wolchok JD, et al. Anti-programmeddeath-receptor-1 treatment with pembrolizumab in ipilimumabrefractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial[J]. Lancet, 2014, 384(9948): 1109-1117.
[20] Hamid O, Robert C, Daud A, et al. Safety and Tumor Responses with lambrolizumab (anti–PD-1) in melanoma[J]. N Engl J Med, 2013, 369(2):134-44.
[21] Linardou H, Gogas H. Toxicity management of immunotherapy for patients with metastatic melanoma[J]. Ann Transl Med, 2016, 4(14): 272.
[22] Michot JM, Bigenwald C, Champiat S, et al. Immunerelated adverse events with immune checkpoint blockade: a comprehensive review[J]. Eur J Cancer, 2016, 54: 139-148.
[23] Rizvi NA, Mazières J, Planchard D, et al. Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): a phase 2, single-arm trial[J]. Lancet Oncol, 2015, 16(3): 257-265.
[24] Johncilla M, Misdraji J, Pratt DS, et al. Ipilimumab-associated hepatitis: clinicopathologic characterization in a series of 11 cases[J]. Am J Surg Pathol, 2015, 39(8): 1075-1084.
[25] Kim KW, Ramaiya NH; Krajewski KM, et al. Ipilimumab associated hepatitis: imaging and clnicopathologic findings[J]. Invest New Drugs, 2013, 31(4): 1071-1077.
[26] Naidoo J, Page DB, Li BT, et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies[J]. Ann Oncol, 2015, 26(12): 2375-2391.
[27] Abdel-Wahab N, Shah M, Suarez-Almazor ME. Adverse events associated with immune checkpoint blockade in patients with cancer: a systematic review of case reports[J]. PLoS One, 2016, 11(7): e0160221.
[28] Nishino M, Sholl LM, Hodi FS, et al. Anti-PD-1-related pneumonitis during cancer immunotherapy[J]. N Engl J Med, 2015, 373(3): 288-290.
[29] Nishino M, Giobbie-Hurder A, Hatabu H, et al. Incidence of programmed cell death 1 inhibitor-related pneumonitis in patients with advanced cancer: a systematic review and meta-analysis[J]. JAMA Oncol, 2016, 2(12): 1607-1616.
[30] Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer[J]. N Engl J Med, 2015, 373(17): 1627-1639.
[31] Garon EB, Rizvi NA, Hui R, et al. Pembrolizumab for the treatment of non-small-cell lung cancer[J]. N Engl J Med, 2015, 372(21): 2018-2028.
[32] Gettinger SN, Horn L, Gandhi L, et al. Overall survival and longterm safety of nivolumab (anti-programmed death 1 antibody, bms-936558, ono-4538) in patients with previously treated advanced non-small-cell lung cancer[J]. J Clin Oncol, 2015, 33(18): 2004-2012.
[33] Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer[J]. N Engl J Med, 2012, 366(26): 2443-2454.
[34] Gulley JL, Rajan A, Spigel DR, et al. Avelumab for patients with previously treated metastatic or recurrent non-small-cell lung cancer (JAVELIN Solid Tumor): dose-expansion cohort of a multicentre, open-label, phase 1b trial[J]. Lancet Oncol, 2017, pii: S1470-2045(17)30240-1.
[35] Nishino M, Chambers ES, Chong CR, et al. Anti-PD-1 inhibitorrelated pneumonitis in non-small cell lung cancer[J]. Cancer Immunol Res, 2016, 4(4): 289-293.
[36] Nishino M, Brais LK, Brooks NV, et al. Drug-related pneumonitis during mammalian target of rapamycin inhibitor therapy in patients with neuroendocrine tumors: a radiographic pattern-based approach[J]. Eur J Cancer, 2016, 53: 163-170.
[37] Nishino M, Boswell EN, Hatabu H, et al. Drug-relatedpneumonitis during mammalian target of rapamycin inhibitor therapy: radiographic pattern-based approach in waldenström macroglobulinemia as a paradigm[J]. Oncologist, 2015, 20(9): 1077-1083.
[38] Postow MA, Chesney J, Pavlick AC, et al. Nivolumab and ipilimumab versus ipilimumab in untreated melanoma[J]. N Engl J Med, 2015, 372(21): 2006-2017.
[39] Eigentler TK, Hassel JC, Berking C, et al. Diagnosis, monitoring and management of immune-related adverse drug reactions of anti-PD-1 antibody therapy[J]. Cancer Treat Rev, 2016, 45: 7-18.
[40] Corsello SM, Barnabei A, Marchetti P, et al. Endocrine side effects induced by immune checkpoint inhibitors[J]. J Clin Endocrinol Metab, 2013, 98(4): 1361-1375.
[41] Spain L, Diem S, Larkin J. Management of toxicities of immune checkpoint inhibitors[J]. Cancer Treat Rev, 2016, 44: 51-60.
[42] Ryder M, Callahan M, Postow MA, et al. Endocrine-related adverse events following ipilimumab in patients with advanced melanoma: a comprehensive retrospective review from a single institution[J]. Endocr Relat Cancer, 2014, 21(2): 371-381.
[43] Torino F, Barnabei A, Paragliola RM, et al. Endocrine side-effects of anti-cancer drugs: mAbs and pituitary dysfunction: clinical evidence and pathogenic hypotheses[J]. Eur J Endocrinol, 2013, 169(6): R153-164.
[44] Jing H, Vudattu N, Sznol M, et al. Precipitation of autoimmune diabetes with anti-pd-1 immunotherapy[J]. Diabetes Care, 2015, 38(4): e55.
[45] Martin-Liberal J, Furness AJ, Joshi K. Anti-programmed cell death-1 therapy and insulin-dependent diabetes: a case report[J]. Cancer Immunol, 2015, 64(6): 765-767.
[46] Mellati M, Eaton KD, Brooksworrell BM, et al. Anti-PD-1 and Anti-PDL-1 monoclonal antibodies causing type 1 diabetes[J]. Diabetes Care, 2015, 38(9): e137.
[47] Robert C, Schachter J, Long GV, et al. Pembrolizumab versus ipilimumab in advanced melanoma[J]. N Engl J Med, 2015, 372(26): 2521-2532.
[48] Wolchok JD, Kluger H, Callahan MK, et al. Nivolumab plus ipilimumab in advanced melanoma[J]. N Engl J Med, 2013, 369(2): 122-133.
[49] Powles T, Eder JP, Fine GD, et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer[J]. Nature, 2014, 515(7528): 558-562.
[50] Loochtan AI, Nickolich MS, Hobson-Webb LD. Myasthenia gravis associated with ipilimumab and nivolumab in the treatment of small cell lung cancer[J]. Muscle Nerve, 2015, 52(2): 307.
[51] 胡毅,陶海涛.晚期非小细胞肺癌的药物治疗进展[J].中国药物应用与监测,2014,11(6):329-333.
Optimal management of immune-related adverse events associated with PD-1/PD-L1 inhibitors immunotherapy
HUANG Le-fu, DI Yan, XU Xiao-han, SUN Yuan-yuan, WANG Miao-miao, HE Zi-xuan, JING Ju, ZHOU Xin-na, WANG Xiao-li, REN Jun
(Cancer Center, Beijing Shijitan Hospital Aff l iated to Capital Medical University; Beijing Key Laboratory of Cancer Therapeutic Vaccine, Beijing 100038, China)
Immunotherapy has become an important anti-tumor means following surgery, radiotherapy and chemotherapy. (PD-1) and PD-1 (PD-L1) immune checkpoint blockers have made a breakthrough, the US Food and Drugs Administration (FDA) has approved the use of nivolumab and pembrolizumab for the treatment of malignant melanoma and nivolumab for squamous non-small cell lung cancer, urothelium carcinoma, etc. However, as PD-1/PD-L1 blockers become more widely used clinically, the inevitable more immune-related adverse events (irAEs) should be addressed. In this paper, immune-related adverse effects of PD-1/ PD-L1 blockers in various organs and the corresponding clinical treatment methods are reviewed, which will help clinicians to diagnose, prevent and treat their related adverse reactions.
Immune checkpoint; PD-1; PD-L1; Adverse event; Immunotherapy
R969.3
A
1672 – 8157(2017)03 – 0177 – 06
2017-03-03
2017-05-01)
北京市医院管理局临床技术创新项目扬帆计划项目资助(XMLX201413)
任军,男,主任医师,教授,研究方向:肿瘤学、免疫学。E-mail:renjun9688@yahoo.com
黄乐富,男,医学博士研究生,研究方向:肿瘤免疫治疗。E-mail:aile0921@163.com
