抗HPV16E6全蛋白单克隆抗体的制备及鉴定
2017-07-06胡仁建王玲玲周康森吴胜昔蔡家利
顾 盼,胡仁建,王玲玲,周康森,吴胜昔,蔡家利
(重庆理工大学 药学与生物工程学院, 重庆 400054)
抗HPV16E6全蛋白单克隆抗体的制备及鉴定
顾 盼,胡仁建,王玲玲,周康森,吴胜昔,蔡家利
(重庆理工大学 药学与生物工程学院, 重庆 400054)
为了制备特异性识别HPV16E6蛋白的单克隆抗体,为建立HPV早期诊断试剂盒提供有效试剂,通过细胞融合、间接ELISA方法筛选阳性克隆、多次亚克隆得到稳定分泌抗体的单克隆杂交瘤细胞株,体内诱生法大量制备腹水,过UNOsphere SuPrATM柱和ENrichTMSEC650分子筛柱纯化,通过蛋白电泳鉴定其纯度并测定抗体浓度,并采用Western Blot法和间接免疫荧光法验证纯化后HPV16E6抗体与HPV16型阳性Caski细胞和HPV18型阳性Hela细胞特异性结合。建立了亚型为IgG2a的单克隆HPV16E6-4D4杂交瘤细胞株,两步纯化后得到纯度较高的抗体,可特异性识别HPV16型阳性的Caski细胞中的E6蛋白,不与Hela细胞反应,为在蛋白水平上检测HPV16型病毒提供了新手段。
HPV16E6全蛋白;单克隆抗体;纯化;蛋白免疫印迹;间接免疫荧光法
根据中国国家癌症登记中心报道[1],2000年到2011年以来,我国女性宫颈癌发病率及致死率呈逐年上升趋势。据估计,2015年新增 98 900 病例并造成30 500人死亡,严重威胁女性健康。高危型人乳头瘤病毒(human papillomavirus,HPV)的持续感染是宫颈癌发生的根本原因,其中HPV16型占到54.4%[2]。
轻微的损伤会暴露皮肤或黏膜的上皮基质细胞,使病毒得以侵入机体以游离基因随染色体共同复制,此时E6原癌蛋白的表达水平较低;在被侵袭的基底细胞中,病毒DNA可整合到细胞基因组,E6蛋白进而参与细胞周期调控;在上皮细胞的最顶层,病毒的所用基因进行表达。病毒粒子壳体化,并从细胞中释放出来[3]。因此,HPV16 E6原癌蛋白在宫颈癌癌变进程中是持续表达的。E6是目前HPV检测及治疗的理想靶向抗原,本文成功筛选出了针对HPV16E6全蛋白的单克隆抗体,可特异性诊断HPV16,以期为在蛋白水平上检测HPV16提供依据。
1 材料与方法
1.1 实验动物及细胞株
Blab/c小鼠(雌性,8~10周龄,质量达20 g以上)和 昆明小鼠(雄性,8~10周龄,质量达20 g以上)均由重庆医科大学实验动物中心提供。人宫颈癌细胞系Hela细胞(HPV18型阳性)、Caski细胞(HPV16型阳性)由重庆理工大学生物制药实验室保存。
1.2 主要试剂
工程菌株pET28a(+)-HPV16E6-BL21 star-DE3 plyS诱导表达的带His-tag的HPV16E6全蛋白由重庆理工大学生物制药实验室保存,鼠源单克隆抗体亚型鉴定试剂盒、弗氏佐剂(Sigma公司),PEG1500(Roche Diagnostics公司),BCA蛋白定量试剂盒、100×双抗溶液、带HRP标记羊抗鼠IgG(H+L)二抗、考马斯亮蓝R250、商品化HPV16E6抗体(北京鼎国昌盛生物有限公司),带荧光标记Alexa Fluor®647的羊抗小鼠IgG(ThermoFisher Scientific公司),新生牛血清(杭州四季青公司),DMEM(Corning公司),Trypsin-EDTA(Gibco),PDVF膜、UNOsphere SuPrATM柱、ENrichTMSEC650分子筛柱(Bio-rad公司)。
1.3 方法
1.3.1 免疫程序
由工程菌株pET28a(+)-HPV16E6-BL21 star-DE3 plyS诱导表达的带His标签的HPV16E6全蛋白为免疫原免疫3只小鼠,与等量的弗式完全佐剂通过注射器互推法充分混匀乳化后,按100 μg/只的抗原量对小鼠进行腹腔注射;2周后采用同样的方法改用弗式不完全佐剂进行第2次免疫,充分乳化后,多位点注射小鼠皮下,每只100 μg;经3次免疫后内眦静脉采血分离血清,iELISA检测小鼠血清效价达10 000以上,对小鼠进行纯抗原冲击免疫,抗原量为100 μg,于3 d后取小鼠脾脏进行细胞融合。
1.3.2 细胞融合、亚克隆和腹水大量制备[4]
[4],制备抗HPV16型备单克隆抗体。选取形态良好、生长旺盛、可稳定分泌抗体的阳性单克隆孔扩大培养。采用鼠源单克隆抗体亚型鉴定试剂盒对杂交瘤细胞培养上清进行亚型鉴定。以0.5 mL/只腹腔注射Balb/c小鼠弗氏不完全佐剂致敏,3~7 d后接种2~3×106个单克隆细胞,接种细胞7~10 d后可产生腹水,收获腹水后20 000×g离心去除红细胞,加入等量甘油后-20 ℃ 保存待用。
1.3.3 抗体纯化
经饱和硫酸铵法初纯腹水后,将其稀释后15 000×g离心5 min,以0.02 mol/L pH值7.0 PB溶液重新溶解沉淀,利用PD-10脱盐柱进行缓冲液的置换后,过UNOsphere SuPrATM 柱。利用NGC蛋白纯化系统(Bio-rad),以0.02 mol/L pH值7.0 PB溶液A为平衡缓冲液,流速1.0 mL/min平衡,上样流速为0.8 mL/min。以溶液B(0.1 mol/L pH值3.0 Gly-HCl)为洗脱缓冲液,A液和B液混合线性梯度洗脱,流速1.0 mL/min, 1mmol/L pH值9.0 Tris-HCl作为中和缓冲液,按60~200 μL中和缓冲液/1 mL蛋白收集液进行蛋白峰的收集。将收集的蛋白样品经PEG20000浓缩后经PD-10脱盐柱进行缓冲液的置换后,过ENrichTM SEC650分子筛柱。以0.01 mol/L pH值7.4PBS溶液为缓冲液,流速为0.8 mL/min,收集主蛋白峰,合并样品甘油透析浓缩后分装,-20 ℃ 保存。以分离胶浓度为12%的SDS-PAGE蛋白电泳,对蛋白纯度进行鉴定。
1.3.4 间接ELISA法检测小鼠腹水纯化抗体效价[5]
以2 μg/mL的HPV16E6重组抗原以100 μL/孔包被ELISA酶标板,37 ℃孵育1 h,4 ℃孵育过夜后,含0.05% Tween-20的0.01 mol/L pH7.4值PBST溶液洗涤3次;用 5%的脱脂奶粉(TBST配置,现配现用)37 ℃条件下封闭2 h,弃去封闭液,PBST洗涤3次; 2倍比稀释纯化后的抗体依次加入96孔酶标板中,37 ℃条件下作用1 h后,以PBST溶液洗涤3次;加入带HRP标记的羊抗鼠IgG(H+L)二抗(1∶5 000稀释),以PBST溶液洗涤3次;TMB显蓝色5 min, 1N H2SO4终止反应,测定纯化后抗体在450 nm波长下的吸光值(optical density,OD)。空白对照不加一抗二抗并设只加二抗对照,阴性对照为接种SP2/0细胞的Blab/c小鼠腹水,阳性对照为1∶8 000稀释的商品化HPV16E6抗体。以样品OD450比阴性对照OD450大2倍以上的最高稀释对为样品ELISA检测效价。
1.3.5 蛋白定量[6]
根据BCA试剂盒说明书操作,具体为:先配置BCA工作液,即将A液与B液按50∶1的比例配置,于96孔板中,分别加入0、1、2、4、6、8、10 μL蛋白标准品,作为蛋白标准孔,加灭菌的0.01 mol/L pH值7.4 PBS补足到10 μL,取10 μL待测样品加入96孔板,加200 μL/孔工作液于待测样品孔和蛋白标准品孔中,混匀,37 ℃条件下避光孵育30 min,冷却至室温,于酶标仪(Thermo Scientific公司)测定562 nm下OD值,绘制标准曲线后计算纯化后抗体浓度。
1.3.6 Western blot鉴定纯化后单抗的特异性[7]
据相关文献所报道的方法,提取Caski和Hela细胞蛋白,经还原型SDS-PAGE电泳后,以120 mA恒流电泳转膜30 min,将蛋白条带转印至PVDF膜上,用 5%的脱脂奶粉(TBST配置,现配现用)室温条件下封闭2 h,弃去封闭液,TBST洗涤3次;纯化的单抗以5%的脱脂奶粉按1∶250稀释,4 ℃孵育过夜,TBST洗涤3次;加入带HRP标记的羊抗鼠IgG(H+L)二抗(1∶5 000稀释),室温条件下摇床孵育1 h,TBST洗涤3次;适量化学发光液孵育5 min后,利用Amersham Imager 600超灵敏多功能成像仪(美国GE公司)扫描成像。
1.3.7 纯化后单抗的特异性鉴定[8]
利用细胞间接免疫荧光法测定特异性,具体步骤为:培养Caski和Hela细胞并制备细胞爬片,0.01 mol/L pH值7.4 PBS洗涤3次后,4%的多聚甲醛(PBS配置,预先在4 ℃预冷)固定玻片20 min,然后用PBS洗涤3次;0.3%TritonX-100室温下作用30 min,PBS洗涤3次;加入适量3%的H2O2(体积分数),室温放置15 min,以消除内源性过氧化酶,然后用PBS洗涤3次;以10%山羊血清(用1%BSA配)37 ℃封闭2 h,不洗;以4%山羊血清按1∶80稀释纯化后单抗4D4,4 ℃过夜后37 ℃复温45 min,PBS洗涤6次;按1∶1 000比例稀释羊抗鼠荧光二抗(Alexa Fluor®647),室温条件下避光孵育1 h,PBS洗涤6次;用PBS以1∶2 000比例稀释DAPI,室温条件下避光孵育45 min,PBS洗涤6次,于Olympic全自动荧光显微镜下观察。同时设置不加一抗二抗空白对照及只加荧光二抗对照,接种SP2/0细胞的Blab/c小鼠腹水为一抗为阴性对照。
2 结果
2.1 免疫结果
由工程菌株pET28a(+)-HPV16E6-BL21 star-DE3 plyS诱导表达的带His标签的HPV16E6全蛋白为免疫原免疫3只小鼠,经3次免疫后Balb/c小鼠体内均产生较高的抗体水平(表1),选取ELISA效价较高的小鼠进行细胞融合。
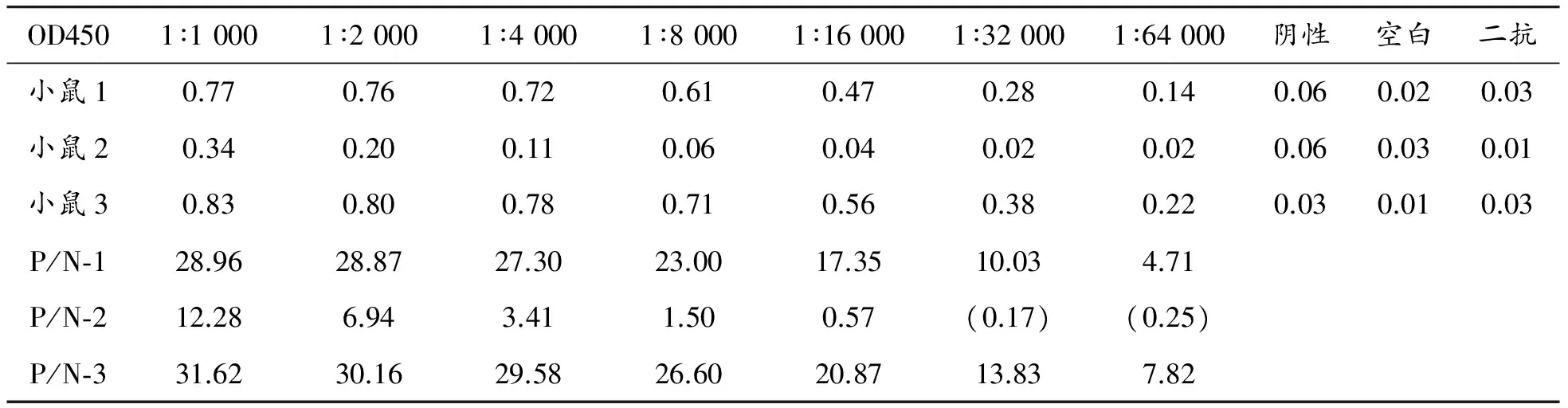
表1 3次免疫后小鼠血清OD450值
注:空白对照不加一抗及二抗,并设置只加二抗对照,取较大值,此处二抗对照较大;阳性对照加商品化的E6抗体(1∶8 000稀释)。P/N为(测定值-二抗对照)/(阴性值-二抗对照)重组蛋白HPV16E6对B细胞表位产生了较高的活性。
2.2 杂交瘤细胞系的建立
以2 μg/mL的HPV16E6全蛋白抗原以100 μL/孔包被酶标板,以2 μg/mL的HPV18E6全蛋白抗原进行复筛,挑取HPV16E6阳性值较高且HPV18E6为阴性的克隆,得到多株可稳定分泌抗体的杂交瘤细胞株,选取一株开展下续实验并命名为4D4,抗体亚型检测结果为IgG2a型。
2.3 抗原纯化结果
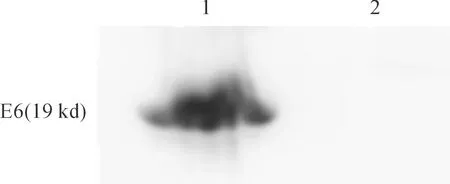
单抗腹水经UNOsphere SuPrATM 柱及ENrichTM SEC650分子筛柱纯化后,测定蛋白浓度达1.20 mg/mL,经ELISA检测效价可达1∶25.6万以上,SDS-PAGE电泳后经考马斯亮兰染色鉴定纯度(图1),变性胶可见清晰的25 kD和50 kD条带,无明显杂带。
2.4 纯化后单抗的特异性鉴定结果
提取HPV16型阳性的Caski细胞和HPV18型阳性的Hela细胞蛋白, SDS-PAGE电泳后转膜,以纯化后的4D4腹水单抗反应。HPV16E6-4D4单抗可特异性识别Caski细胞中的E6蛋白,不与Hela细胞反应(图2)。

M:Marker;1:ENrichTM SEC650分子筛柱纯化收集样品;2-9:UNOsphere SuPrATM柱纯化收集样品
1:培养Caski细胞裂解后提取的总蛋白;2:Hela细胞裂解后提取的总蛋白
细胞间接免疫荧光反应结果如图3可见,Caski细胞的细胞核红色荧光明显,细胞质有浅红色荧光;Hela细胞质有少许红色荧光着色,荧光不明显,可能是非特异性反应造成的。纯化的E6单抗仅与HPV16型的Caski细胞反应,并且E6主要集中在细胞核表达,与文献报道相符[9]。
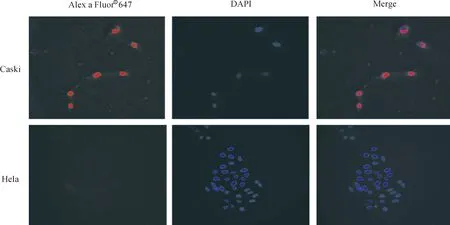
图3 HPV16E6-4D4间接免疫荧光反应结果图(×400)
3 讨论
目前, DNA检测广泛应用于临床上HPV的检测,然而80%~90%的HPV DNA检测结果为阳性的女性并不会持续感染进而恶化[10]。而目前用于初级筛查的HPV检测所面临的主要困难是找到明确的靶标及配套的检测方法,这一点在资源匮乏地区显得尤为重要[11]。HPVE6/E7蛋白参与HPV恶性转化[12]。在整个过程中,HPV16 E6/E7协同表达并且蛋白表达水平持续增高以促进宫颈上表皮细胞恶性转化的发生发展。在绝大多数HPV感染病例中,当病毒粒子在微量水平表达时,HPV某些基因(如E2基因)的缺失或突变将导致E6/E7蛋白表达激增。由于E6蛋白在HPV感染、恶性转化及宫颈癌发展中均持续表达,而在正常宫颈细胞中不表达,因此E6蛋白是目前针对宫颈癌癌前诊断及治疗方向研究的热点。
HPV的检测主要是DNA、RNA以及一些与恶性转化相关的细胞标志物的检测。绝大部分检测的目标为HPV的L1或E6/E7蛋白对应的基因序列。测定病毒载量(viral load)具有十分重要的临床意义[13],当病毒载量低于10个拷贝数时可能反映了HPV感染是暂时的;病毒载量高于10个拷贝数时可认为有细胞不典型增生的存在。 现有检测HPV DNA主要基于两种原理:一是通过杂交捕获并放大信号;二是放大目标,通过PCR技术对目的片段扩增。要想对HPV分型,杂交捕获时就需要特异性的探针。目前还有一种基于高危型HPV的E6、E7 mRNA的检测手段。
在蛋白质水平上检测HPV,可大大浓缩高危人群。本研究设计以HPV16E6全蛋白为抗原,构建稳定分泌抗体的单克隆杂交瘤细胞株,成功筛选出针对HPV16E6全蛋白的单克隆抗体,可特异性诊断HPV16,这为在蛋白水平上检测HPV16型病毒提供了新手段。
参考文献:
[1] CHEN W Q,PETER D,ZHANG S W,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2] CROW J M.HPV:The global burden[J].Nature,2012,488(7413):S2-S3.
[3] DOORBAR J,QUINT W,BANKS L,et al.The biology and life-cycle of human papillomaviruses[J].Vaccine,2012,30 Suppl 5:F55-70.
[4] YOKOYAMA W M,CHRISTENSEN M,SANTOS G D,et al.Production of monoclonal antibodies[J].2013:2.5.1-2.5.29.
[5] HORNBECK P V.Enzyme-Linked Immunosorbent Assays[J].Curr Protoc Immunol,2015,110:211-223.
[6] SMITH P K,KROHN R I,HERMANSON G T,et al.Measurement of protein using bicinchoninic acid[J].Anal Biochem,1985,150(1):76-85.
[7] NI D,XU P,GALLAGHER S.Immunoblotting and Immunodetection[J].Curr Protoc Immunol,2016,114:8101-81036.
[8] HOFMAN F M,TAYLOR C R.Immunohistochemistry[J].Curr Protoc Immunol,2013,103:Unit 21.4.
[9] JACKSON R,TOGTEMA M,ZEHBE I.Subcellular localization and quantitation of the human papillomavirus type 16 E6 oncoprotein through immunocytochemistry detection[J].Virology,2013,435(2):425-432.
[10]VALASOULIS G,STASINOU S M,NASIOUTZIKI M,et al.Expression of HPV-related biomarkers and grade of cervical intraepithelial lesion at treatment[J].Acta Obstet Gynecol Scand,2014,93(2):194-200.
[11]ZHAO F H,JERONIMO J,QIAO Y L,et al.An evaluation of novel,lower-cost molecular screening tests for human papillomavirus in rural China[J].Cancer Prev Res (Phila),2013,6(9):938-948.
[12]HOWLEY P M.Warts,cancer and ubiquitylation:lessons from the papillomaviruses[J].Trans Am Clin Climatol Assoc,2006,117:113-26; discussion 126-127.
[13]EKLUND C,FORSLUND O,WALLIN K L,et al.Global improvement in genotyping of human papillomavirus DNA:the 2011 HPV LabNet International Proficiency Study[J].J Clin Microbiol,2014,52(2):449-459.
(责任编辑 何杰玲)
Preparation and Identification of Monoclonal Antibody of Anti-HPV16E6
GU Pan, HU Ren-jian, WANG Ling-ling, ZHOU Kang-sen, WU Sheng-xi, CAI Jia-li
(College of Pharmacy and Biological Engineering,Chongqing University of Technology,Chongqing 400054,China)
To prepare monoclonal antibodies specific to HPV16E6 protein, and to provide an effective reagent for the early diagnosis of HPV, HPV16E6 recombinant protein which was antigen inoculated Balb/c mouse, the hybridoma cells were obtained from cell fusion, and Indirect ELISA(iELISA) was adopted to select the positive clones as well as subcloning. After large-scale preparation of ascites, UNOsphere SuPrATMcolumn and ENrichTMSEC650 size exclusion column were adopted to purify antibody. Coomassie blue staining was adopted to identify the purity and the standard curve to calculate the concentration of antibody. Western blot and indirect immunofluorescence were adopted to verify the specific bind of purified antibody E6 to Caski (HPV16 positive) and Hela(HPV18 positive) cells. The obtained hybridoma cells named HPV16E6-4D4 which was IgG2a has better antibody purity after two-steps puritification, and could specifically recognize HPV16E6 protein in Caski cells, and not react with Hela cells. The monoclonal antibody against HPV16E6 whole protein has been successfully selected and it provided a new way for the detection of HPV E6 protein at the protein level for its specificity.
HPV16 E6 whole protein; monoclonal antibody; purification; western blot; indirect immunofluorescence assay
2016-03-12
重庆理工大学研究生创新基金资助项目 (YCX2015225);重庆高校优秀成果转化资助项目(KJZH14212)
顾盼(1991—),女,江苏常州人,硕士研究生,主要从事疫苗与诊断技术研究,E-mail:641490780@qq.com;通讯作者:蔡家利,男,教授,主要从事疫苗与诊断技术研究,E-mail:cjl@cqut.edu.cn。
顾盼,胡仁建,王玲玲,等.抗HPV16E6全蛋白单克隆抗体的制备及鉴定[J].重庆理工大学学报(自然科学),2017(6):107-112.
format:GU Pan, HU Ren-jian, WANG Ling-ling, et al.Preparation and Identification of Monoclonal Antibody of Anti-HPV16E6[J].Journal of Chongqing University of Technology(Natural Science),2017(6):107-112.
10.3969/j.issn.1674-8425(z).2017.06.016
R731
A
1674-8425(2017)06-0107-06
