Urocortin I后处理对缺氧/复氧大鼠心肌细胞线粒体膜电位及活性氧自由基的影响
2017-07-06邓胜利
刘 为,张 琳,田 伟,邓胜利
(1.遵义医学院 麻醉学系 贵州省麻醉与器官保护重点实验室,贵州 遵义 563099;2.遵义市播州区人民医院 麻醉科,贵州 遵义 563100;3 遵义医学院附属医院 麻醉科, 贵州 遵义 563099)
基础医学研究
Urocortin I后处理对缺氧/复氧大鼠心肌细胞线粒体膜电位及活性氧自由基的影响
刘 为1,张 琳1,田 伟2,邓胜利3
(1.遵义医学院 麻醉学系 贵州省麻醉与器官保护重点实验室,贵州 遵义 563099;2.遵义市播州区人民医院 麻醉科,贵州 遵义 563100;3 遵义医学院附属医院 麻醉科, 贵州 遵义 563099)
目的 观察Urocortin I后处理对缺氧/复氧大鼠心肌细胞线粒体膜电位及活性氧自由基的影响。方法 利用ALC-HP型离体心脏灌注装置分离成年大鼠心肌细胞,将培养1 d后存活状态良好的细胞随机分为正常组(N组)、缺氧/复氧组(HR组)、UrocortinⅠ后处理组(Ucn I组)、5-羟葵酸拮抗Urocortin Ⅰ组(5-HD+UcnⅠ组)。N组:37 ℃培养箱中持续培养150 min;HR组:缺氧40 min后,复氧110 min;Ucn Ⅰ组:缺氧40 min复氧10 min,然后Ucn Ⅰ处理30 min再复氧70min;5-HD+Ucn Ⅰ组:特异性线粒体ATP敏感性钾通道(mitoKATP)拮抗剂5-HD处理10 min后,在含Ucn Ⅰ的培养基中处理30 min,余处理同Ucn Ⅰ组。各组于复氧末加入荧光探针并用倒置相差显微镜观察细胞线粒体膜电位(MMP)及活性氧自由基(ROS)的变化。结果 ①MMP变化:N组心肌细胞MMP较其余各组高(P<0.01);Ucn I组虽低于N组,但高于HR组及5-HD+Ucn I组(P<0.05);5-HD+Ucn I组与HR组比差异无统计学意义(P>0.05)。②ROS变化:N组心肌细胞ROS荧光强度低于其余各组(P<0.01); Ucn I组及5-HD+Ucn I组较HR组低(P<0.01),但5-HD+Ucn I组高于Ucn I组(P<0.01)。结论 Urocortin I后处理能抑制缺氧/复氧心肌细胞活性氧自由基的生成,并抑制线粒体膜电位的衰减,其机制与其开放线粒体ATP敏感性钾通道有关。
Urocortin I后处理;活性氧自由基;线粒体膜电位;线粒体敏感性钾通道
心肌缺血再灌注损伤(ischemia-reperfusion injury,IRI)是各种缺血心脏疾病治疗时共有的病理生理过程,如何减轻或者避免IRI一直被临床广为关注。线粒体活性氧自由基(reactive oxygen species,ROS)的爆发及膜电位(mitochondrial membrane potential,MMP)的下降与心肌IRI关系密切。Urocortin I是一种在心脏中表达的内源性神经肽,无论在离体或者在体条件下均被证实具有心肌保护作用[1]。但其保护作用与ROS及MMP的关系尚不清楚。本实验拟通过分离成年大鼠心肌细胞并模拟临床缺氧/复氧损伤过程,观察Ucn I后处理对心肌细胞线粒体ROS生成及MMP的影响,探讨其心肌保护作用的可能机制。
1 材料与方法
1.1 实验动物 健康清洁级雄性SD大鼠20只,周龄为16~20周,体重约200 g左右,由第三军医大学大坪医院实验动物中心提供。许可证号:SCXK(渝)2012-0005。
1.2 试剂与仪器 UrocortinⅠ、5-羟葵酸、M199培养基、牛血清白蛋白(BSA)、Ⅱ型胶原酶、乙二醇双四乙酸(EGTA)、层黏连蛋白(Laminin) 均从美国Sigma公司购置,活性氧检测试剂盒(碧云天生物技术公司,中国)、活体细胞线粒体内膜功能/膜电位红色荧光测定试剂盒(杰美基因医药科技有限公司,中国);ALC-HP型离体心脏灌注装置(北京吉安得尔科技有限公司,中国)、超净台(苏州净化设备有限公司,中国)、高压灭菌锅(TOMY公司,日本)、BS224S电子天平(赛多利思公司,德国)、纯水处理器(Millipore,美国)。
1.3 实验分组与处理 参照文献[2]分离成年大鼠心肌细胞。将分离培养1 d后的心肌细胞随机分为正常组(N组)、缺氧/复氧组(HR组)、Urocortin I后处理组(Ucn I组)、5-羟葵酸拮抗Urocortin Ⅰ组(5-HD+Ucn Ⅰ组)。N组:37 ℃ 95%O2+5%CO2培养箱中持续培养150 min;HR组:缺氧40 min后,复氧110 min;UcnⅠ组:缺氧40 min后给予10 min的正常复氧过程,然后在含Ucn Ⅰ的培养基中处理30 min后复氧70 min;5-HD+Ucn Ⅰ组:缺氧后先用特异性线粒体ATP敏感性钾通道(mitoKATP)拮抗剂5-HD处理10 min后行Ucn Ⅰ后处理30 min,余处理同UcnⅠ组。各组细胞于复氧末进行ROS和MMP检测。
1.4 检测ROS变化 ROS检测按碧云天活性氧检测试剂盒进行操作:实验前,先按照1∶1 000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/升。吸除培养皿中的细胞培养液,加入1 mL稀释好的DCFH-DA,覆盖细胞孔表面,37 ℃细胞培养箱内孵育20 min,然后用无血清细胞培养液洗涤细胞3次。DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成DCFH。而DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF。检测DCF的荧光就可以知道细胞内活性氧的水平。其倒置显微镜观察条件:488 nm激发波长,525 nm发射波长。若绿色荧光增强,表明ROS生成增多;同时在相同波长下使用多功能酶标仪检测各组心肌细胞相对荧光单位(relative fluorescence units,RFU):若RFU增高,表明ROS生成增多。
1.5 检测MMP变化 于复氧末按照杰美基因GENMED活体细胞线粒体内膜功能/膜电位红色荧光(TMRM)测定试剂盒产品说明书进行操作:染色液A置入冰槽里融化,稀释液B放入37 ℃恒温水槽里预热。移出10 μL染色液A到1.5 mL离心管,加入890 μL稀释液B,混匀后标记为染色工作液,置入暗室里进行如下操作。吸出培养皿中的细胞培养液到15 mL锥形离心管(收集悬浮细胞),加入1 mL清理液C到细胞培养孔,作用30 s后移出清理液C到同一个15 mL锥形离心管(收集洗脱细胞),加入0.25%胰蛋白酶乙二胺四乙酸混合液500 μL,37 ℃培养箱避光孵育3 min,轻轻抖动细胞板,使细胞脱落。吸尽胰酶后,加入1 mL细胞培养液,移入15 mL离心管,台式离心机离心5 min,速度300 g,吸去上清液,加入50 μL清理液C,混匀细胞颗粒群,转入1.5 mL离心管中,加入450 μL染色工作液,轻度涡旋振荡2 s,37 ℃细胞培养箱中避光孵育20 min后,离心5 min,速度300 g,吸去上清液,加入500 μL清理液C。混匀后移出50 μL至载玻片上,即刻行载玻片压片并观察荧光变化;移出100 μL到黑色96孔板里即刻用荧光酶标仪测定相对荧光单位(RFU)。四甲基罗丹明甲酯染料(TMRM),可选择性地聚集在线粒体内呈现荧光染色,通过荧光的增强或减弱说明线粒体膜电位的变化,即内膜电负性的增高或降低。电位高,TMRM聚集于线粒体,显示为强力红色或桔红色;电位破坏,TMRM则弥散在胞浆内,导致荧光减弱。其倒置显微镜观察条件:540 nm激发波长,580 nm发射波长。红色或桔红色荧光减弱表明线粒体膜电位受到损害;于相同波长下使用多功能酶标仪测得的RFU值降低则表明线粒体膜电位受到破坏。

2 结果
2.1 各组心肌细胞MMP变化情况 各组心肌细胞MMP荧光结果(见图1、表1)。其荧光强度变化:N组心肌细胞MMP荧光强度高于其余各组(P<0.01);Ucn I组虽较正常组低,但高于 HR组及5-HD+Ucn I组(P<0.05),而5-HD+Ucn I组与HR组之间差异无统计学意义(P>0.05,见表1)。

A:N组;B:HR组;C:Ucn I组;D:Ucn I+5-HD组图1 各组心肌细胞MMP荧光图(×100)


组别相对荧光强度N2.314±0.359HR0.283±0.045aUcnI1.043±0.064abUcnI+5-HD0.289±0.064ac
a:与N组相比,P<0.01;b:与HR组相比,P<0.05;c:与Ucn I组相比,P<0.05。
2.2 各组心肌细胞ROS变化情况 各组心肌细胞ROS荧光结果(见图2、表2)。其荧光强度变化:与其余各组相比,N组心肌细胞荧光强度相对较低(P<0.01);Ucn I组及5-HD+Ucn I组虽高于N组,但低于HR组,且差异具有统计学意义(P<0.01);Ucn I组低于5-HD+Ucn I组,两者之间仍表现出统计学意义(P<0.01,见表2。)
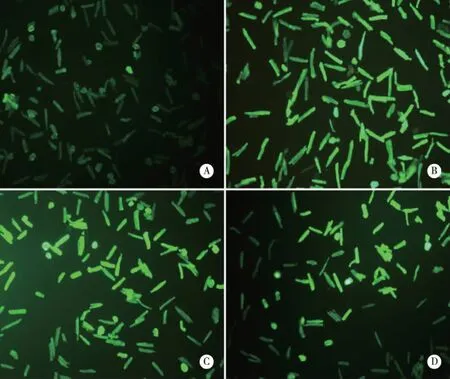
A:N组;B:HR组;C:Ucn I组;D:Ucn I+5-HD组。图2 各组心肌细胞ROS荧光图(×100)


组别相对荧光强度N0.835±0.058HR1.341±0.077aUcnI1.157±0.054abUcnI+5-HD1.249±0.091abc
a:与N组相比,P<0.01;b:与HR组相比,P<0.01;c:与Ucn I组相比,P<0.01。
3 讨论
如何减轻或者避免IRI一直是临床与科研工作的重点。目前研究发现:在缺血后再给予几次短暂、反复的“缺血-再灌注”处理可以显著减少缺血心肌梗死面积且能有效地防止内皮细胞功能的紊乱,从而对缺血心肌产生保护作用[3];这种策略被称为“缺血后处理”(ischemic postconditioning,IPC)。随着研究的深入,学者又发现给予某些作用于特异靶点的药物进行药物后处理同样具有抗IRI作用[4]。因此近来研究逐渐围绕着药物后处理进行,并逐渐成为研究的新热点与新方向[5]。
线粒体作为细胞活动的“能量工厂” ,细胞的多种需能过程及生长与凋亡均受到线粒体的调控。其膜上线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)在生理状态下的周期性开放与维持线粒体内外电化学的平衡状态及线粒体膜电位的形成等方面具有重要的意义[6]。线粒体氧化磷酸化生成ATP、运输线粒体蛋白、维持钙离子稳态、回收质子等功能的实现有赖于正常线粒体膜电位的维持。此外,线粒体也是ROS产生的主要场所。生理状态下,ROS是线粒体呼吸链的必然产物,在体内抗氧化酶和抗氧化剂的作用下保持着动态平衡。而在缺血再灌注过程中,线粒体通透性转换孔(mPTP)在大量ROS产生的不利因素下开放,造成线粒体膜电位降低,最终使细胞在增多的细胞色素C等促凋亡蛋白的影响下趋于凋亡[7-8]。本实验前期研究证实:Urocortin I可通过保持线粒体呼吸功能与呼吸酶的活性[9]及稳定线粒体膜电位[10-11]从而发挥抗IRI效应。但其心肌保护效应与ROS及MMP的相关性尚不明确。
本研究发现:与HR组相比,N组心肌细胞MMP荧光强度相对较高,说明缺氧复氧可导致线粒体膜电位下降,这与王亚东等[12-13]研究结果一致。而Ucn I组较HR组及5-HD+Ucn I组高,但5-HD+Ucn I组与HR组相比MMP荧光值无统计学差异。说明Ucn I后处理能在一定程度上抑制MMP的下降,且抑制作用与mitoKATP通道有关。其机制可能是:mitoKATP通道的活性在Ucn I的作用下增强,K+顺电化学梯度进入线粒体,线粒体基质由于基质内渗透压的增高而发生肿胀,维持了膜间隙结构的相对稳定,阻止腺嘌呤核苷酸进入细胞内,从而维持了缺氧复氧过程中的能量供给;同时,肿胀的线粒体基质使肌酸激酶和腺嘌呤核苷酸移位酶的功能性耦联增强,更多的肌酸将被线粒体磷酸化,这有利于能量向细胞浆的转移,从而减少了线粒体ATP的耗竭,两者均能抑制mPTP开放[14],从而维持线粒体膜电位的稳定。
本实验研究发现:与其余各组相比,N组心肌细胞ROS浓度相对较低,HR组较其余各组高,表明缺氧复氧可导致ROS生成增多。而Ucn I组ROS浓度低于HR组,提示Ucn I后处理能在一定程度上抑制缺氧复氧心肌细胞 ROS的生成。同时,5-HD+Ucn I组心肌细胞ROS浓度较Ucn I组高,但低于HR组,表明Ucn I后处理抑制ROS的生成与其开放mitoKATP通道有关。因mitoKATP的开放可促进钾离子内流,增加线粒体基质容积,使钙离子内流受到抑制,从而减轻钙超载,提高氧代谢率和促进线粒体呼吸,呼吸功能的增强则能显著减少ROS的产生[15];另mitoKATP通道的开放,可改善线粒体电子传递链,减少ROS等过氧化物生成,同时可激活SOD2等抗氧化酶的活性,起到抗氧化应激的作用[16]。而既往通过基因芯片已经证实Ucn I可使mitoKATP通道的Kir6.2亚基表达增强[17],这为Ucn I能开放mitoKATP通道打下了分子基础。此外,表2结果显示:5-HD并没有完全消除Ucn I后处理抑制ROS生成的作用,这是否与细胞膜ATP敏感性钾通道(sarcKATP)相关还有待进一步研究。
综上所述,Urocortin I后处理能抑制缺氧/复氧心肌细胞活性氧自由基的大量生成,并抑制线粒体膜电位的衰减,其机制与其开放线粒体ATP敏感性钾通道有关。
[1] Calderón-Sánchez E M,Ruiz-Hurtado G,Smani T,et al.Cardioprotective action of urocortin in postconditioning involves recovery of intracellular calcium handling[J].Cell Calcium,2011,50(1):84-90.
[2] 张琳,邓胜利,姚刚,等.Urocortin-Ⅰ对缺氧复氧损伤心肌细胞钙离子的影响[J].遵义医学院学报,2012,35(3):193-195.
[3] Heusch G,FESC,FACC.Old wine in a new bottle?[J].Anaesthesia,2015,57(9):926-943.
[4] Gong J S,Yao Y T,Fang N X,et al.Sevoflurane postconditioning alleviates action potential duration shortening and L-type calcium current suppression induced by ischemi-a/reperfusion injury in rat epicardial myocytes[J].Chin Med J (Engl),2012,125(19):3485-3491.
[5] Maslov L N, Gorbunov A S, Lishmanov Y B.Cardioprotective effect of ischemic postconditioning on the model of isolated heart[J].Bull Exp Biol Med,2012,153(3):313-314.
[6] Green D R,Kroemer G.The Pathophysiology of Mitochondrial Cell Death[J].Science,2004,305(5684):626-629.
[7] Wang Z H,Liu J L,Wu L,et al.Concentration-dependent wrestling between detrimental and protective effects of H2O2during myocardial ischemia/reperfusion[J].Cell Dea-th and Disease,2014,5:e1297.
[8] Devon S,Carly S,Israel B,et al.Mdivi-1, a novel mitochondrial fission inhibitor, exertscardioprotective effects in myocardial ischemia/reperfusion (MI/R) injury[J].The Faseb J,2015,9(Meeting Abstracts):1049-1050.
[9] 刘雪,顾燕,田伟,等.Urocortin-I预处理对离体大鼠心肌线粒体呼吸功能及呼吸酶活性的影响[J].中国病理生理杂志,2016,32(11):1928-1933.
[10] 顾燕,孙文婷,邓胜利,等.UrocortinⅠ预处理对缺氧/复氧大鼠心肌线粒体膜电位的影响[J].遵义医学院学报,2013,36(4):336-338.
[11] 田伟,顾燕,邓胜利,等.Urocortin Ⅰ后处理对缺氧/复氧大鼠心肌线粒体膜电位的影响[J].遵义医学院学报,2015,38(1):64-66.
[12] Sharikabad M N,Ostbye K M,Brors O,et al.Increased Mg2+reduces Ca2+influx and disruption of mitochondrial membrane potential during reoxygenation[J].Am J Physiol Heart Circ Physiol,2001,281(5):2113-2123.
[13] 王亚东,李澜,魏静,等.大株红景天注射液对心肌细胞缺氧/复氧损伤的保护作用[J].天津中医药,2016,33(3):160-163.
[14] Kowaltowski A J,Seetharaman S,Paucek P,et al.Bioenergetic consequences of opening the ATP sensitive K+channel of heart mitochondria[J].Am J Physiol,2001,280(2):649-657.
[15] Jin C,Wu J,Watanabe M,et al.Mitochondrial K+channels are involved in ischemic postconditioning in rat hearts[J].J Physiol Sci,2012,62(4):325.
[16] Farahini H,Ajami M,Mirzay R J,et al.Nitric oxide is necessary for diazoxide protection against ischemic injury in skeletal muscle[J].Iran J Pharm Res,2012,11(1):375-381.
[17] Latchman D S.Urocortin protects against ischemic injury via a MAPK-dependent pathway Peptides[J].Trends Cardiovas Med,2001,11(5):167-169.
[收稿2017-04-20;修回2017-05-10]
(编辑:王静)
The effect of urocortin I postconditioning on mitochondrial membrane potential and reactive oxygen species in rat heart during hypoxia/reoxygenation
LiuWei1,ZhangLin1,TianWei2,DengShengli3
(1 Department of Anesthesiology of Zunyi Medical University,Guizhou Key Laboratory of Anesthesia and Organ Protection ,Zunyi Guizhou 563099,China;2 Department of Anesthesiology of People’s Hospital of Bozhou District, Zunyi Guizhou 563100,China ;3.Department of Anesthesiology,Affiliated Hospital of Zunyi Medical University, Zunyi Guizhou 563099,China)
Objective To explore the effect of urocortin I postconditioning on mitochondrial membrane potential and reactive oxygen species in rat heart during hypoxia/reoxygenation.Methods Isolated rat myocytes by using ALC-HP type isolation heart perfusion device. Myocytes after being continuously cultivated 24 h were randomly divided into four groups: Nor group,HR group,UcnI postconditioning group and mitochondrial ATP-sensitive potassium channel blocker 5-HD+Ucn I group. Nor group: cultivated in a 37 ℃ incubator continuously for 150 min; HR group: suffered from hypoxia for 40 min, then reoxggenation for 110 min;Ucn I group: reoxygenation for 10 min after being hypoxia for 40 min, then cultivated in a nutrient medium containing Ucn I for 30 min, and then reoxygenation for 70 min. 5-HD+Ucn I group: cultivated in the nutrient medium containing 5-HD for 10 min before reoxygenation, the rest managements were the same as Ucn I group. Observing the change of MMP and ROS by using inverted phase contrast microscope at the end of reoxygenation.Results 1)Fluorescence intensity change of MMP:Nor group was higher than other three groups(P<0.01);Ucn I group was lower than Nor group,but higher than groups HR and 5-HD+Ucn I(P<0.05);but there was no significant difference between groups HR and 5-HD+Ucn I(P>0.05. 2)Fluorescence intensity change of ROS: Nor group was lower than other three groups(P<0.01); HR group was higher than groups Ucn I and 5-HD+UcnI(P<0.01); while 5-HD+Ucn I group was higher than Ucn I group(P<0.01).Conclusion Urocortin I postconditioning can restrain the excessive generation of ROS and attenuation of MMP,these effects relate to the opening of mitochondrial ATP-sensitive potassium channel.
Urocortin I postconditioning;reactive oxygen species;nitochondrial membrane potential;mitochondrial ATP-sensitive potassium channel
贵州省科学技术基金资助项目( NO:黔科合SY 字[2013]3024) 。
邓胜利,男,教授,硕士生导师,研究方向:心肌保护,E-mail:zydsl2004@163.com。
R614
A
1000-2715(2017)03-0268-05
