雷帕霉素对APP/PS1转基因小鼠学习记忆能力及海马Aβ1-42表达的影响
2017-07-06王春梅
林 茂,王 敏,张 木,王春梅
(1.遵义医学院 珠海校区生理学教研室,广东 珠海 519041;2.遵义医学院 珠海校区药学教研室,广东 珠海 519041)
基础医学研究
雷帕霉素对APP/PS1转基因小鼠学习记忆能力及海马Aβ1-42表达的影响
林 茂1,2,王 敏2,张 木1,王春梅1
(1.遵义医学院 珠海校区生理学教研室,广东 珠海 519041;2.遵义医学院 珠海校区药学教研室,广东 珠海 519041)
目的 初探雷帕霉素(RAPA)对APP/PS1转基因小鼠学习记忆及海马β淀粉样蛋白1-42(Aβ1-42)表达的影响。方法 APP/PS1转基因小鼠雌雄各半,随机分为模型组、RAPA低剂量组、RAPA中剂量组和RAPA高剂量组,野生型C57BL/6小鼠作为对照组,每组10只。RAPA各组小鼠每天分别灌胃1.12、2.24和4.48 mg/kg的RAPA,连续4周。跳台和Morris水迷宫实验检测小鼠学习记忆能力,Western Blot检测海马神经元Aβ1-42、磷酸化蛋白激酶B(p-PKB)和磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)的表达。结果 模型组较对照组小鼠跳台学习成绩下降、潜伏期缩短、错误次数增加;Morris水迷宫逃避潜伏期延长、目标象限停留时间缩短、穿环次数减少;海马Aβ1-42和p-mTOR表达增多、p-PKB表达减少(P<0.05)。与模型组比较,RAPA各组小鼠跳台学习成绩提高、潜伏期延长、错误次数减少;Morris水迷宫逃避潜伏期缩短、目的象限停留时间延长、穿环次数增多;海马Aβ1-42和p-mTOR表达减少、p-PKB表达增多(P﹤0.05)。RAPA各组组间比较,各指标均无统计学差异(P>0.05)。结论 RAPA可降低海马Aβ1-42的表达,对APP/PS1转基因小鼠学习记忆具有改善作用,其机制可能与调节PKB/mTOR信号通路活性有关。
雷帕霉素;APP/PS1转基因小鼠;学习记忆;β淀粉样蛋白;阿尔茨海默病
阿尔茨海默病(Alzheimer’s disease,AD)是以渐进性记忆和认知功能减退为特征的弥漫性中枢神经系统退行性疾病,表现为进行性认知障碍和痴呆[1-2]。随着世界人口老龄化,AD患者人数逐年上升,在严重影响老年人生活质量的同时,也给社会医疗带来了沉重的经济负担[3]。脑内β淀粉样蛋白(beta-amyloid protein,Aβ)异常沉积、寡聚形成AD重要的病理变化老年斑,Aβ亦是造成神经损伤的主要毒性物质[4-7]。近年来研究发现,哺乳动物雷帕霉素靶蛋白(Mammalian Target Of Rapamycin,mTOR)调控异常与AD的发生发展密切相关,抑制mTOR相关的信号转导通路能够降低Aβ的沉积,改善AD模型认知功能[8-10]。雷帕霉素(Rapamycin,RAPA)作为一种mTOR的特异性抑制剂,早期其主要作为移植免疫抑制药物应用于临床。现有研究发现,RAPA可通过提高自噬水平,改善AD特征性病理[11-12]。但是,RAPA是否还可以通过其他途径改善AD尚有待进一步研究。本课题组前期研究发现[13],RAPA能提高Aβ25-35损伤的PC12细胞的存活率,降低细胞凋亡率,对Aβ25-35所致PC12细胞损伤有保护作用,其机制可能与其负反馈调节胰岛素/磷脂酰肌醇-3激酶(phosphatidyl inositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB)信号转导通路有关,但尚未在动物模型上证明。故本实验采用APP/PS1转基因小鼠,进一步探讨RAPA防治AD的作用及可能机制。
1 材料与方法
1.1 材料与仪器 APP/PS1双转基因AD小鼠40只,C57BL/6小鼠10只,SPF级,雌雄各半,体重(20±2)g,均由广东省医学实验动物中心提供[许可证号:SCXK(粤)2013-0002]。RAPA购自Sigma,Aβ1-42抗体和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH )抗体购自Millipore,磷酸化雷帕霉素靶蛋白(phosphorylated rapamycin target protein,p-mTOR)和磷酸化蛋白激酶B(phosphorylated protein kinase B,p-PKB)抗体购自Epitomics,羊抗小鼠IgG购自武汉博士德。
STT-2小鼠跳台仪购自北京医学科学院药物研究所,Morris水迷宫购自成都泰盟,蛋白电泳及电转移装置和全自动凝胶分析系统购自BIO-RAD,TS-200B恒温摇床购自上海乔跃电子有限公司,电子分析天平购自Mettler Toledo,-80 ℃度超低温冰箱购自三洋公司。
1.2 方法
1.2.1 动物分组与给药 APP/PS1转基因小鼠随机分为模型组、RAPA低剂量组、RAPA中剂量组和RAPA高剂量组,野生型C57BL/6小鼠作为对照组,每组10只。RAPA低、中、高剂量组分别每天灌胃1.12、2.24和4.48 mg/kg的RAPA,对照组和模型组灌胃等体积的生理盐水,连续4周。
1.2.2 跳台实验 末次给药2 h后进行跳台实验。让小鼠在实验箱内适应5 min,随后底部铜栅通电36 V,小鼠遭受电击后,正常反应是返回绝缘台,如此监测5 min,记录小鼠遭受电击次数即学习成绩。24 h后将小鼠置实验箱绝缘台上,记录其在台上停留的时间即潜伏期。同时,记录5 min内小鼠双足同时接触铜栅触电的次数即错误次数。
1.2.3 Morris水迷宫实验 给药结束前5 d,进行Morris水迷宫实验。实验包含2个部分,首先进行定位航行实验:随机将小鼠从不同象限置入水池内,记录其游到水池中平台上的时间即逃避潜伏期,若小鼠120 s内仍未到达平台,则将其引导到平台上停留5 s,并将潜伏期记为120 s。每次测试4个象限,每象限间隔10 min,连续测试4 d。第5天撤走平台,进行空间探索实验:固定一入水点,记录120 s内小鼠在原平台象限即目的象限内停留时间和小鼠游经原平台位置的次数即穿环次数。
1.2.4 Western Blot检测Aβ1-42、p-PKB、p-mTOR蛋白表达 小鼠断头取脑,分离海马,组织匀浆,BCA法测定样品的蛋白浓度。上样、SDS-聚丙烯酰胺凝胶电泳、电转膜。5%脱脂牛奶封闭1 h,加一抗4 ℃过夜。TBS洗3次,加二抗(羊抗小鼠IgG),37 ℃孵育2 h。PBS漂洗3次,曝光。以GAPDH作为内参。Quantity-One软件分析,以相对光密度值(目的条带光密度值与GAPDH光密度值的比值)作为蛋白相对表达量。

2 结果
2.1 各组小鼠学习记忆的变化 跳台实验结果如图1A和表1所示,与对照组比较,模型组小鼠学习成绩下降,潜伏期缩短,记忆错误次数增多(P<0.05)。与模型组比较,RAPA各组小鼠学习成绩提高,潜伏期延长,记忆错误次数减少(P<0.05)。Morris水迷宫定位航行实验结果如图1B所示,与对照组比较,第1~4天模型组小鼠逃避潜伏期延长(P<0.05)。与模型组比较,第1天RAPA各组小鼠逃避潜伏期缩短,但无统计学差异(P<0.05);第2天RAPA中剂量和高剂量组小鼠逃避潜伏期、第3和第4天RAPA各组小鼠逃避潜伏期均明显缩短(P<0.05)。Morris水迷宫空间探索实验结果如表1所示,与对照组比较,模型组小鼠目的象限停留时间缩短,穿环次数减少(P<0.05)。与模型组比较,RAPA各组小鼠目的象限停留时间延长,穿环次数增多(P<0.05)。RAPA各组间比较,无统计学差异(P>0.05)。
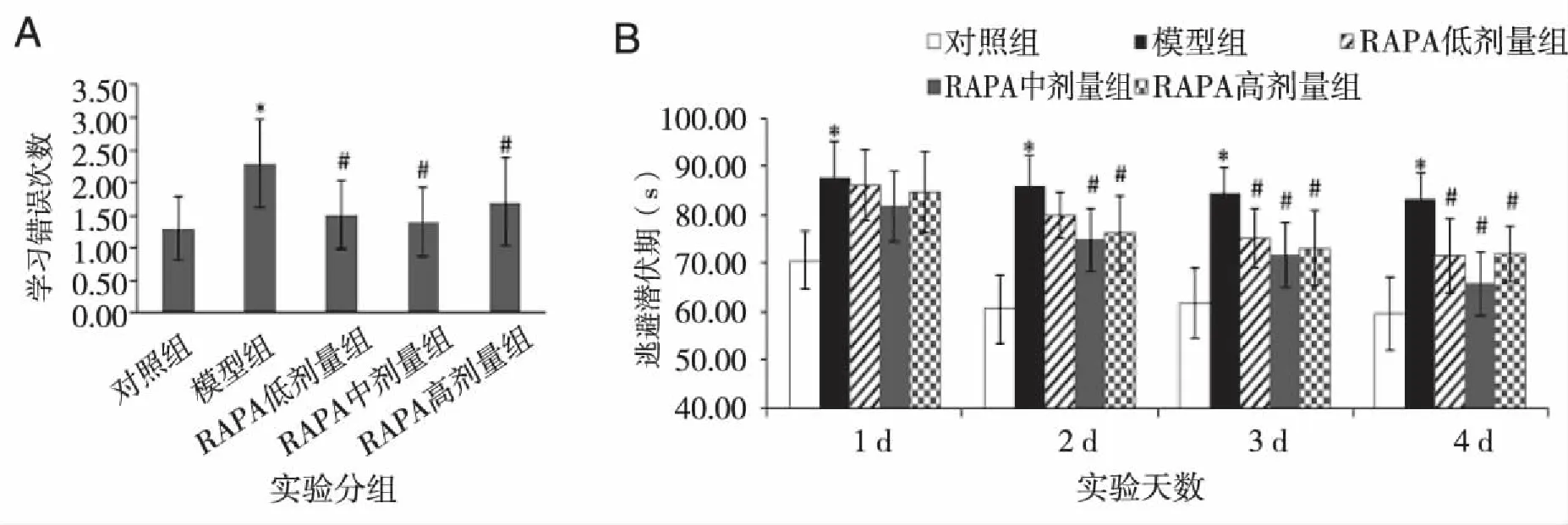
与对照组比较,*P<0.05;与模型组比较,。图1 各组小鼠跳台学习成绩(A)和Morris水迷宫逃避潜伏期(B)的变化


组别跳台记忆成绩潜伏期(s)错误次数(次)Morris水迷宫记忆成绩目的象限停留时间(s)穿环次数(次)对照267.40±10.311.40±0.5227.80±1.834.30±0.48模型77.50±9.32*2.20±0.42*16.54±1.41*1.80±0.42*RAPA低剂量182.90±10.09#1.60±0.52#23.27±2.54#3.20±0.78#RAPA中剂量175.50±9.85#1.50±0.53#23.41±2.55#3.30±0.82#RAPA高剂量177.20±9.05#1.70±0.48#21.67±4.19#3.10±0.87#
与对照组比较,*P<0.05;与模型比较,#P<0.05。
2.2 各组小鼠海马Aβ1-42、p-PKB和p-mTOR蛋白表达变化 如图2所示,与对照组比较,模型组小鼠海马Aβ1-42和p-mTOR表达增多、p-PKB表达减少(P﹤0.05)。与模型组比较,RAPA各组小鼠海马Aβ1-42和p-mTOR表达减少、p-PKB表达增多(P﹤0.05)。RAPA各组间比较,无统计学差异(P>0.05)。
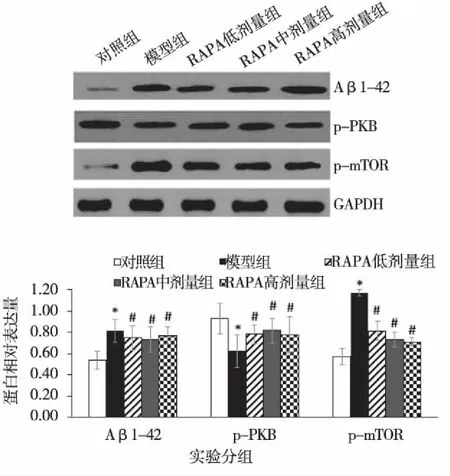
与对照组比较,*P<0.05;与模型组比较,。图2 各组小鼠海马Aβ1-42、p-PKB和p-mTOR蛋白相对表达量
3 讨论
AD动物模型是在实验动物身上模拟AD患者脑组织的病理变化和行为异常,这是研究AD发病机制和筛选防治AD药物与方法的基础。因AD的病因和发病机制复杂,完全理想的模拟,重现AD的动物模型尚不存在。但是,随着研究的深入和技术的发展,具有一定代表性的AD动物模型,尤其是针对AD特征性病理[1,4]脑内Aβ沉积形成的老年斑(senile plaques,SP)和tau蛋白异常聚集形成神经元纤维缠结(neurofibrillary tangles,NFTs)的模型相继被制作,并在研究中得到广泛应用[14]。本实验选用的APP/PS1双转基因小鼠模型是将APPswe和PSEN1de9两个基因整合在一起,来最大程度的模拟AD特征性病理改变,如Aβ沉积、神经元缺失和中枢炎症损伤等[14]。因此,本实验采用该模型判断RAPA防治AD的作用。结果显示,与对照组比较,模型组小鼠学习和记忆评估成绩下降,海马Aβ1-42表达增多。说明模型可靠,成功模拟了部分AD病理变化。
近年来研究发现,AD患者中枢胰岛素信号传导通路存在异常[15-17]。AD患者脑组织分析显示,即使没有罹患糖尿病,大部分患者脑内胰岛素受体(insulin receptor,IR)表达减少,胰岛素信号通路敏感性减低[16]。而胰岛素样生长因子受体(insulin like growth factor receptor,IGF-1R)和IR在海马中表达降低时,会引起神经元的凋亡增多。PI3K/PKB/mTOR信号通路在此发挥了重要作用。经由该通路激活PI3K,可使mTOR处于持续的激活状态,后者可通过负反馈调节使胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)异常磷酸化,从而抑制胰岛素的信号传导,发生胰岛素抵抗,而Aβ过度沉积产生的神经毒性恰恰与之正相关[15,17]。mTOR作为该信号通路下游的关键蛋白,在AD发生发展中发挥了重要的作用。靶向调控mTOR的表达对防治AD具有重要意义。
目前已知的mTOR特异性抑制剂RAPA,作为一种从真菌中分离出来的大环内酯类抗生素,早期被广泛应用于临床移植免疫。随着其抗衰老、抗肿瘤、心血管保护,尤其是其可以通过调节细胞周期,调节细胞自噬,继而改善AD病程的作用的发现,引起了学者的重视[11-12]。而本课题组前期研究显示[13],RAPA对Aβ25-35所致PC12细胞损伤有保护作用,其机制可能与其抑制mTOR活性,增强IGF-1R表达,实现负反馈调节胰岛素/PI3K/PKB信号通路有关。故为进一步探究其作用机制,本实验通过给予APP/PS1转基因小鼠低、中、高三个剂量的RAPA,以在体评估RAPA的药理作用并探讨其作用机制。结果显示,RAPA干预的模型小鼠学习记忆能力增高,海马Aβ1-42和p-mTOR表达减少、p-PKB表达增多。说明RAPA可降低海马Aβ1-42的表达,对APP/PS1转基因小鼠学习记忆具有改善作用,结合前期细胞实验结果[13],可以推测这一作用机制可能与RAPA负反馈调节胰岛素信号通路活性有关。这一发现补充了RAPA防治AD的药理机制。此外,本研究也对不同剂量RAPA组之间的作用效果进行了分析,发现中剂量组效果较好,但是与其他两组比较无统计学差异。提示对于RAPA防治AD的药物剂量研究还有待于做进一步的补充实验。
[1] 姜琳珊,李菲,聂晶,等.金钗石斛总生物碱对APP/PS1转基因小鼠学习记忆能力的影响[J].遵义医学院学报,2016,39(3):246-249.
[2] 倪南珍,王敏,林茂,等.白藜芦醇对阿尔茨海默病小鼠记忆能力及脑组织NOS和NO含量的影响[J].遵义医学院学报,2014,37(1):99-102.
[3] Alzheimer's Association.2016 Alzheimer's disease facts and figures[J].Alzheimers Dement,2016,12(4):459-509.
[4] Thal D R,Walter J,Saido T C,et al.Neuropathology and biochemistry of Aβ and its aggregates in Alzheimer’s disease[J].Acta Neuropathol,2015,129(2):167-182.
[5] Sharma S,Verma S,Kapoor M,et al.Alzheimer's disease like pathology induced six weeks after aggregated amyloid-beta injection in rats:increased oxidative stress and impaired long-term memory with anxiety-like behavior[J].Neurol Res,2016,38(9):838-850.
[6] Obulesu M,Lakshmi M J.Apoptosis in Alzheimer's disease:an understanding of the physiology,pathology and therapeutic avenues[J].Neurochem Res,2014,39(12):2301-2312.
[7] Han J,Qu Q,Qiao J,et al.Vincamine alleviates amyloid-β 25-35 peptides-induced cytotoxicity in PC12 cells[J].Pharmacogn Mag,2017,13(49):123-128.
[8] Khayati K,Antikainen H,Bonder E M,et al.The amino acid metabolite homocysteine activates mTORC1 to inhibit autophagy and form abnormal proteins in human neurons and mice[J].FASEB J,2017,31(2):598-609.
[9] Li C,Guo X D,Lei M,et al.Thamnolia vermicularis extract improves learning ability in APP/PS1 transgenic mice by ameliorating both Aβ and Tau pathologies[J].Acta Pharmacol Sin,2017,38(1):9-28.
[10] Velazquez R,Shaw D M,Caccamo A,et al.Pim1 inhibition as a novel therapeutic strategy for Alzheimer's disease[J].Mol Neurodegener,2016,11(1):52-65.
[11] Caccamo A,Magi A,Medina D X,et al.mTOR regulates tau phosphorylation and degradation:implications for Alzheimer’s disease and other tauopathies[J].Aging Cell,2013,12(3):370-380.
[12] 郝明,仝嘉庆,张军,等.雷帕霉素对淀粉样β蛋白所致大鼠工作记忆和突触可塑性损伤的作用观察[J].中国应用生理学杂志,2016,32(1):18-21.
[13] 金小小.雷帕霉素对Aβ25-35致PC12细胞损伤的干预作用[D].遵义:遵义医学院,2016.
[14] Drummond E,Wisniewski T.Alzheimer's disease:experimental models and reality[J].Acta Neuropathol,2017, 133(2): 155-175.
[15] De la Monte S M,Tong M,Schiano I,et a1.Improved Brain Insulin/IGF Signaling and Reduced Neuroinflammation with T3D-959 in an Experimental Model of Sporadic Alzheimer's Disease[J].J Alzheimers Dis,2017,55(2):849-864.
[16] 赵静,董齐,伊然,等.利西拉肽对阿尔茨海默病保护作用机制的研究进展[J].中国临床神经科学,2016,24(2):233-238.
[17] Norambuena A,Wallrabe H,McMahon L,et al.mTOR and neuronal cell cycle reentry:How impaired brain insulin signaling promotes Alzheimer's disease[J].Alzheimers Dement,2017,13(2):152-167.
[收稿2017-03-29;修回2017-04-20]
(编辑:王静)
Effect of Rapamycin on the learning and memory and the expression of Aβ1-42in hippocampus of APP/PS1 transgenic mice
LinMao1,2,WangMin2,ZhangMu1,WangChunmei1
(1.Department of Physiology,Zhuhai Campus of Zunyi Medical University,Zhuhai Guangdong 519041,China;2.Department of Pharmacy,Zhuhai Campus of Zunyi Medical University,Zhuhai Guangdong 519041,China)
Objective Explore the effects of Rapamycin(RAPA)on the learning and memory and the expression of Aβ1-42in hippocampus of APP /PS1 transgenic mice.Methods APP/PS1 transgenic mice were randomly divided into the model group and RAPA groups(low dose RAPA,middle dose RAPA,and high dose RAPA),wild-type C57BL/6 mice were used as the control group with ten mice in each group and half male and half female.RAPA groups were given 1.12,2.24,4.48 mg/kg RAPA for four weeks by gavage.Step down test and Morris water maze test were used to investigate the learning and memory ability.The expression of Aβ1-42(beta-amyloid peptides 1-42)of hippocampal neurons,p-PKB(protein kinase B with phosphorylation)and p-mTOR(mammalian target of rapamycin with phosphorylation)were detected by Western blot.Results Compared the model group with the control group,the achievement of step down test was decreased,latent period was shorter,the number of mistakes was increased;the escape latency was longer,the target quadrant time were shorter and the number of quadrant entries were less,the expression of Aβ1-42in hippocampus and p-mTOR were increased while the expression of p-PKB was decreased(P<0.05).Compared RAPA groups with the model group,the result of step down test was increased,latent period was longer,the number of mistakes was decreased;the escape latency was shorter,the target quadrant time were longer and the number of quadrant entries were more,the expression of Aβ1-42in hippocampus and p-mTOR were decreased while the expression of p-PKB was increased(P<0.05).Comparisons among RAPA groups showed that there were no statistical differences in each index(P>0.05).Conclusion RAPA may decrease the expression of Aβ1-42in hippocampus and improve the learning and memory ability of APP/PS1 transgenic mice,which may be related to the regulation of PKB/mTOR signaling pathway.
Rapamycin;APP/PS1 transgenic mice;learning and memory;Beta-amyloid protein;Alzheimer’s disease
贵州省科技厅基金资助项目(NO:黔科合LKZ字[2012]17);贵州省科技厅基金资助项目(NO:黔科合LKZ字[2011]43);贵州省教育厅自然科学研究项目(NO:黔教科[2009]0108)。
王春梅,女,教授,硕士生导师,研究方向:神经退行性疾病发病机制及药物防治,E-mail:295446806@qq.com。
R741
A
1000-2715(2017)03-0254-05
