黄原胶对大豆蛋白营养棒体系质地及微观结构的影响
2017-07-05巫雨婷
巫雨婷
周 鹏1
李 娟1
刘昌树2
王 赛2
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 佳格投资﹝中国﹞有限公司,上海 201103)
黄原胶对大豆蛋白营养棒体系质地及微观结构的影响
巫雨婷1
周 鹏1
李 娟1
刘昌树2
王 赛2
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 佳格投资﹝中国﹞有限公司,上海 201103)
通过质构仪、激光共聚焦显微镜、电子扫描显微镜和低场核磁共振技术等手段,研究了添加1%黄原胶对含有大豆蛋白的营养棒模型体系质构、微观结构、水分子及亲水小分子的迁移等的影响。结果表明:黄原胶的添加改变了体系微观网状结构,同时影响了体系内水及糖醇等小分子的分布,从而对大豆蛋白模型体系的质构有明显的软化效果,改善其质构和口感。
黄原胶;营养棒;大豆蛋白;质地;微观结构
高蛋白营养棒(或蛋白棒)的蛋白含量可达15%~45%,其水分活度控制在0.5~0.6左右,在此条件下可有效防止微生物的生长繁殖,可在室温下长期贮藏12个月以上[1]。由于高蛋白营养棒具有营养丰富、货架期长、便于携带等优点,不仅用于军用、航天和急救食品,还用于休闲和运动营养食品。在国内外运动营养类食品市场上高速发展,每年以9.8%的速率增长[2],其中,大豆蛋白、乳清蛋白等是此类食品的主要蛋白质来源。
目前市面上的高蛋白营养棒存在的最大问题是其质地在贮藏初期(即前24 h)容易发生硬化,从而影响其口感甚至难以食用[3]。现有研究表明,其硬化机理主要包括水分迁移[4]、相分离[5]、蛋白聚集[6-7]等。实际上,这类食品的硬化往往并不是由单一因素造成的,而是由多种不同因素共同导致。为了改善该类食品的质地,国内外学者已经开展了大量相关研究,比如在体系中用蛋白水解产物来部分替代原有蛋白质,通过降低体系的玻璃化转变温度来软化体系质地[7];通过添加半胱氨酸来防止二硫键诱导蛋白聚集[8];以及通过向体系中添加非还原糖(例如麦芽糖醇)作为增塑剂和湿润剂来减轻美拉德反应诱导的蛋白聚集[2],从而改善质地等。
黄原胶是一种在食品领域应用十分广泛的亲水胶体,属于生物大分子,能与蛋白质、盐和酸等多种食品生物分子兼容[9],常常作为增稠剂、乳化剂和成型剂等应用于食品生产中。其分子的侧链通过与主链之间的氢键形成双螺旋结构,并且往往以多重螺旋聚合结构存在于水溶液中,导致其水溶液即使在低浓度下也具有较高的黏度以及较好的黏弹性[10]。前期研究表明,添加黄原胶可以降低某些产品的硬度,例如可使面包在烘焙后更加柔软,并具有更好的内聚性[11]。本研究旨在利用添加黄原胶来改善基于大豆蛋白的高蛋白营养棒模型体系(简称大豆蛋白模型体系)质地的初期硬化,从而达到改善其口感的目的,并采用激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)、电子扫描显微镜(scanning electronic microscopy,SEM)和低场核磁共振技术(low-field nuclear magnetic resonance,LF-NMR)等手段研究添加黄原胶对该体系微观结构、水分子及亲水小分子的迁移等的影响,为日后更深入地研究高蛋白营养棒质地的改善方法打下良好的应用基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
大豆分离蛋白(Soy protein isolate,SPI):南通光合生物技术有限公司;
黄原胶(Xanthan gum,XG):美国CP Kelco公司;
Fluorescein isothiocyanate(FITC)荧光染料:美国Sigma公司;
甘油、山梨醇、罗丹明B:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器与设备
质构仪:TA-XT plus型,英国Stable Micro System公司;
激光共聚焦显微镜:TCS SP5型,德国Leica公司;
台式扫描电镜:TM 3030型,日本Hitachi公司;
核磁共振分析仪:PQ001型,上海纽迈电子科技股份有限公司;
喷金仪:Model MSP-1S型,日本Vacuum Device公司;
生化培养箱:SHP-250型,上海森信实验仪器有限公司。
1.2 方法
1.2.1 大豆蛋白营养棒模型体系的制备 具体制备步骤(配方见表1):将山梨醇、甘油和水按质量比25∶17.5∶12.5进行混合溶解至完全均匀。将此混合液与黄原胶粉末按质量比55∶1混合溶解,制备成黄原胶液。取5.5 g山梨醇、甘油和水的混合液或5.6 g黄原胶液,分别与4.5 g大豆蛋白粉混合并揉捏2 min,分别制备成对照组(不含黄原胶的大豆蛋白营养棒模型体系)和黄原胶组(含1%黄原胶的大豆蛋白营养棒模型体系)。将样品揉制成均匀的面团后放入塑料小盒中。为防止水分蒸发,塑料小盒用封口膜进行双层密封。将其置于室温(25 ℃)下平衡0.5 h后,进行第0天的取样。取样完毕后重新封口,并置于25 ℃培养箱贮藏,到第3天再进行取样。
表1 大豆蛋白营养棒模型体系配方Table 1 The formula of soy protein bar model system g
1.2.2 硬度的测定 利用模具将样品分割成直径1 cm,高1 cm的圆柱体。采用质构仪对样品的应力进行测定。具体测试条件:选取直径为36 mm 的圆柱探头(P/36R)进行TPA测试,以下压过程中受到的最大应力表征样品的硬度。其中:测试速度 1.0 mm/s,测试后速度1.0 mm/s,触发力5 g,形变量50%。每种样品做3个平行样。
1.2.3 激光共聚焦显微镜(CLSM)观测
(1) 双染色:参照文献[12]。黄原胶用FITC进行共价标记,大豆蛋白用罗丹明B进行非共价标记。制备样品时,将2滴0.02%罗丹明B的丙酮溶液滴于制样容器中,待丙酮完全挥发后,将其与0.3 g大豆蛋白模型体系样品混合均匀,其中黄原胶经FITC共价标记。最后,将混合均匀的样品平铺在玻底皿中,盖上盖玻片并封边。
(2) 显微镜观察:将盛有样品的玻底皿置于载物台上,选用20倍物镜进行观测。为防止FITC和罗丹明B染料受光照射后导致荧光淬灭,样品的制备、贮藏及观测均在避光环境下进行。
1.2.4 电子扫描显微镜(SEM)观测 样品的制备参照文献[13]。取0.05~0.10 g样品制成扁平状,浸没在质量分数为2.5%的戊二醛固定液中固定24 h。将固定后的样品取出,用PBS缓冲液浸洗,乙醇水溶液梯度脱水后自然晾干。最后,将样品掰裂并对截面喷金,置于样品台上观测,放大倍数为500倍。
1.2.5 横向弛豫时间(T2)的测定 利用低场核磁共振分析仪对大豆蛋白营养棒模型体系横向弛豫时间(T2)的分布情况进行分析检测。仪器测试条件为:磁场强度0.54 T,质子共振频率18 MHz,测量温度25 ℃。具体操作:首先将4 g左右待测样品用聚四氟乙烯纸(无氢信号)包好,以防止样品在测试过程中发生水分蒸发。随后将样品放入直径25 mm的核磁管底部,将核磁管置于射频线圈的中心位置。采用硬脉冲序列(Hard Pluse FID)调节中心频率结合多脉冲回波序列(CPMG)对样品进行扫描。制备3个平行样,每个样品重复测定3遍,按顺序轮流采样[14]。CPMG序列的参数设定为:采样点数TD=30 118,回波个数C0=2 000,弛豫衰减时间D0=1 s,90°脉宽5.4 μs,180°脉宽10.6 μs,重复扫描次数NS=8。将扫描所得到的回波衰减曲线利用自带软件Multi ExpInv Analysis进行反演,即可得到每个样品的横向弛豫时间T2的连续分布图。不同波峰代表水分的不同形态,各峰所覆盖范围信号幅值的总值为对应形态水分的数量,峰顶点和所对应的峰面积分别代表了该状态下小分子的T2常数和与之对应的比例。按照T2值的大小,从小到大依次标记为T21,T22,T23。
2 结果与讨论
2.1 大豆蛋白营养棒模型体系的质构变化
研究首先观测了添加黄原胶对大豆蛋白营养棒模型体系质构的影响。图1为模型体系的TPA全质构变化曲线图,表2为与之对应的TPA全质构各参数值。由图1和表2可知,对照组第0天的硬度值为1 791 g,经过3 d的贮藏后硬度值增加到16 106 g,可见大豆蛋白模型体系在贮藏3 d之后硬度迅速上升。而黄原胶组,其在第0天的硬度值为256 g,并且贮藏3 d后增加到4 869 g,远小于对照组的硬度值。可见,黄原胶对于大豆蛋白模型体系具有显著的软化效果。

表2 大豆蛋白营养棒模型体系在贮藏0 d和3 d的TPA质构变化Table 2 TPA texture profiles of soy protein bar model systems stored for 0 d and 3 d
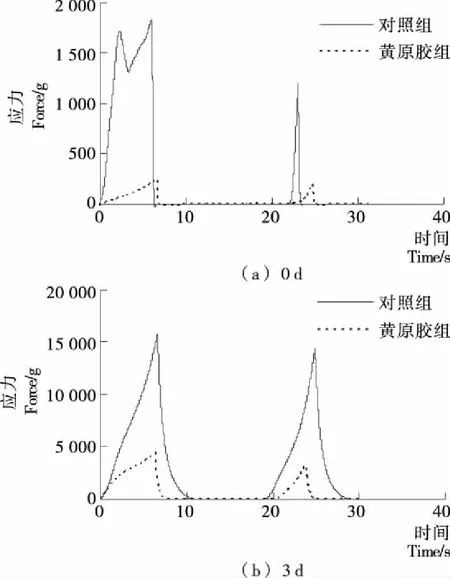
图1 贮藏0 d和3 d大豆蛋白营养棒模型体系的 质构变化图Figure 1 Changes in TPA profiles of soy protein bar model system storage for 0 and 3 d
由图2可知,对照组在第0天受到外力下压后破裂且完全变形,当贮藏3 d后,其在受到外力下压后出现了明显的回复现象且保持完整的外形,说明对照组具有较强的弹性和回复性。而黄原胶组在第0天受到外力下压后仍保持完整,并且在第3天受到外力下压后外形回复性较差,仍保持扁平的形状。结合图2与表2的结果,对比对照组和黄原胶组的弹性和回复性,随着时间的延长,对照组具有更高的弹性和回复性,而加入黄原胶后模型体系的弹性和回复性被明显削弱;对比体系的黏附性可知(数值的绝对值越大,说明黏附性越强),添加了黄原胶的模型体系的黏附性明显大于对照组,且随着时间延长样品的黏附性减小,可能是体系中蛋白颗粒逐渐吸收了胶液中的水分子以及其他小分子导致的。以上结果表明,黄原胶的添加不仅导致大豆蛋白模型体系的硬度减小,且体系的弹性减少、回复性变差及黏附性增加。因黄原胶是一种在低浓度下也具有高黏性的亲水胶体,并且具有双螺旋结构很有可能使体系内蛋白质的结构发生改变,从而导致大豆蛋白模型体系的质构特性发生明显的变化。

(a) 第0天对照组 (b) 第0天黄原胶组 (c) 第3天对照组 (d) 第3天黄原胶组图2 贮藏0 d和3 d的大豆蛋白营养棒模型体系的 TPA下压图Figure 2 TPA compression test of soy protein bar model system stored for 0 and 3 d
2.2 大豆蛋白营养棒模型体系的微观结构
根据质构变化初步推测,黄原胶的加入可能参与了体系内部结构的重新排布,导致体系微观结构改变,进而影响了质构特性。为了验证这一推测,对模型体系的微观结构进行了双染色CLSM观测和SEM观测。由图3可知,对照组为罗丹明B单染图,黄原胶组为罗丹明B和FITC双染图,在双染图中,颜色较为明亮的区域为FITC染色部分,颜色较暗的区域为罗丹明B染色部分,具体见图3中的指示箭头。第0天对照组中可以看到已吸水膨胀的大豆蛋白颗粒(a’)、未溶解的大豆蛋白颗粒(b’)以及大豆蛋白颗粒间的空隙(c’);贮藏3 d后,大豆蛋白干粉颗粒吸水膨胀,相互黏结并逐渐形成较为明显的蛋白颗粒结构。相对于对照组,黄原胶组在第0天与对照组具有相似的蛋白质网络结构,并且大量的蛋白质颗粒散布在黄原胶胶液中,而在贮藏3 d后,黄原胶组却有显著不同,不仅大豆蛋白颗粒的溶胀程度明显减小,而且大量的黄原胶液(d’)均匀地包裹于已吸水膨胀的大豆蛋白颗粒(a’)外部或存在于蛋白颗粒的间隙中,相互交错黏结,形成新的微观网络结构,说明黄原胶的加入对大豆蛋白模型体系的微观结构产生明显的影响,同时由于黄原胶具有很高的黏着性,有助于其在体系内形成新的网络结构,并部分主导体系的质构特性。

(a) 第0天对照组 (b) 第0天黄原胶组 (c) 第3天对照组 (d) 第3天黄原胶组
a’. 溶胀的蛋白颗粒 b’. 未溶解的蛋白颗粒 c’. 空隙 d’. 黄原胶液
图3 贮藏0 d和3 d的大豆蛋白营养棒模型体系的CLSM图
Figure 3 CLSM of soy protein bar model system stored for 0 and 3 d
由图4可知,第0天对照组的内部存在大量轻微溶胀的蛋白质颗粒,而贮藏3 d后蛋白颗粒吸水膨胀,形成更加致密的蛋白质交互结构。而黄原胶组在第0天其内部不仅存在大量轻微溶胀的蛋白质颗粒,还有明显的白色丝状物质黏附在蛋白质颗粒表面,以及纱丝状的物质分布在蛋白质颗粒间隙中,表明蛋白颗粒间存在较多的黄原胶液。而贮藏3 d后,黄原胶组模型体系的蛋白质颗粒吸水膨胀,形成比第0天更大的颗粒,但是仍然可以明显看见溶胀的蛋白质颗粒之间的丝状物质。对比第3天对照组和黄原胶组的蛋白质微观结构可以发现,黄原胶组的微观结构中具有更多的空隙,蛋白质颗粒溶胀程度明显低于对照组,且蛋白质颗粒皱缩程度也明显高于对照组。SEM与CLSM结果说明,在大豆蛋白模型体系中黄原胶处于大豆蛋白颗粒表面和溶胀的蛋白颗粒间隙中,极强的亲水性和持水性[5,15]有利于抑制大豆蛋白颗粒的吸水溶胀程度,减少了蛋白颗粒体积分数,进一步改变了大豆蛋白模型体系的质构特性,起到软化效果。

(a) 第0 天对照组 (b) 第3天黄原胶组 (c) 第3天对照组 (d) 第3天黄原胶组图4 贮藏0 d和3 d的大豆蛋白营养棒模型体系 的SEM图Figure 4 SEM of soy protein bar model system stored for 0 and 3 d
2.3 大豆蛋白营养棒模型体系中小分子迁移
黄原胶的强亲水性和强持水性[5,15]可能会影响体系内亲水小分子的迁移。LF-NMR利用氢质子在磁场中的自旋—弛豫特性,通过横向弛豫时间T2的变化来分析样品中氢质子的化学环境。T2越小,说明样品中的氢质子与非水组分结合越紧密,其自由度越小,反之,样品中的氢质子与非水组分结合越疏松,其自由度越强[14]。
由图5(a)可知,第0天小分子物质存在3种状态:T21(0.28~1.00 ms)表示与蛋白颗粒水合程度最高、自由度最差的深层结合小分子;T22(1.32~4.64 ms)表示与蛋白颗粒水合程度较高、不易流动性的弱结合小分子;T23(4.64~49.77 ms)表示存在于蛋白颗粒空隙间、自由度最强的自由小分子。其中,T23峰为主峰,说明体系内小分子的自由程度很高,是因为高蛋白模型体系是一个非热力学平衡体系[16],新鲜样品中蛋白质颗粒还未完全水合,体系内小分子的自由程度较高。而黄原胶组的T23峰信号更强,表明添加1%黄原胶的模型体系内,存在于大豆蛋白质颗粒间隙的小分子更多。
由图5(b)可知,当模型体系样品贮藏3 d后,T2分布发生显著改变。体系中各组分仍呈3种状态:T21(0.19~0.50 ms),T22(0.50~4.64 ms)以及T23(4.64~14.17 ms)。经过3 d的贮藏,体系内的小分子自由度明显降低,即体系内发生了明显的小分子迁移现象。其中T22峰为主峰,说明此时体系内主要以流动性较差的弱结合小分子为主。而这正好与CLSM结果相符,表明大豆蛋白颗粒在贮藏期间吸水膨胀,形成蛋白质颗粒交互结构,增强了体系的硬度。而黄原胶组的T21峰信号明显减弱,T22和T23峰位置略微左移,但T23峰信号更强,说明黄原胶组模型体系内的小分子整体上具有更强的自由度和流动性。由于黄原胶与蛋白质共同竞争水分,改变了蛋白质吸水溶胀程度以及蛋白质颗粒间隙中的小分子含量,从而改变体系内的小分子迁移状态,进而间接影响大豆蛋白模型体系的硬度。

图5 贮藏0 d和3 d的大豆蛋白营养棒模型体系贮藏 过程中的T2变化图
Figure 5 Changes inT2relaxation time of soy protein bar model system stored for 0 and 3 d
3 结论
黄原胶对大豆蛋白营养棒模型体系具有显著的软化效果。黄原胶的加入使大豆蛋白模型体系由蛋白质颗粒溶胀形成的紧密交互结构转变为黄原胶包裹蛋白质颗粒的结构。此外,亲水性极强的黄原胶与蛋白质颗粒竞争水分,并使得更多的小分子保留在溶胀的蛋白质颗粒间隙,使得蛋白溶胀率降低,因此蛋白颗粒体积分数降低,从而达到软化的效果。综上所述,黄原胶通过改变大豆蛋白营养棒模型体系的微观结构和小分子分布实现其质地的软化。此外,营养棒食品是一类具有较长保质期的食品,所以在今后的研究中可以适当延长贮藏时间,从而更加有效地验证黄原胶对其质地改善的最终应用价值。
[1] BANACH J C, CLARK S, LAMSAL B P. Texture and other changes during storage in model high-protein nutrition bars formulated with modified milk protein concentrates[J]. LWT- Food Science and Technology, 2014, 56(1): 77-86.
[2] RAO Qin-chun, KAMDAR A K, GUO Mu-fan, et al. Effect of bovine casein and its hydrolysates on hardening in protein dough model systems during storage[J]. Food Control, 2016, 60: 621-628.
[3] HOGAN S A, CHAURIN V, KELLY P M. Influence of dairy proteins on textural changes in high-protein bars[J]. Intern-ational Dairy Journal, 2012, 26(1): 58-65.
[4] LI Yun, SZLACHETKA K, CHEN Paul, et al. Ingredient characterization and hardening of high-protein food bars: an NMR state diagram approach[J].Cereal Chemistry, 2008, 85(6): 780-786
[5] LOVEDAY S M, HINDMARSH J P, CREAMER L K, et al. Physicochemical changes in intermediate-moisture protein bars made with whey protein or calcium caseinate[J]. Food Research International, 2010, 43(5): 1 321-1 328.
[6] ZHOU Peng, LIU Xiao-ming, LABUZA T P. Effects of moisture-induced whey protein aggregation on protein conformation, the state of water molecules, and the microstructure and texture of high-protein-containing matrix[J]. Journal of Agricultural and Food Chemistry, 2008, 56(12): 4 534-4 540.
[7] RAO Qin-chun, ROCCA-SMITH J R, LABUZA T P. Storage stability of hen egg white powders in three protein/water dough model systems[J]. Food Chemistry, 2013, 138: 1 087-1 094.
[8] ZHU Dan, LABUZA T P. Effect of cysteine on lowering protein aggregation and subsequent hardening of whey protein isolate (WPI) protein bars in WPI/buffer model systems[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 7 970-7 979.
[9] GARCIA-OCHOA F, SANTOS V E, CASAS J A, et al. Xanthan gum: production, recovery, and properties[J]. Biotechnology Advances, 2000, 18(7): 549-579.
[10] 周盛华, 黄龙, 张洪斌. 黄原胶结构、性能及其应用的研究[J]. 食品科技, 2008, 33(7): 156-160.
[11] GAMBUS H, SIKORA M, ZIOBRO R. The effect of composition of hydrocolloids on properties of gluten-free bread[J]. Acta Scientiarum Polonorum Technologia Alimentaria, 2007, 6(3): 61-74.
[12] TROMP R H, VAN de Velde F, VAN Riel J, et al. Confocal scanning light microscopy (CSLM) on mixtures of gelatine and polysaccharides[J]. Food Research International, 2001, 34(10): 931-938.
[13] LU Nai-yan, ZHANG Liang, ZHANG Xuan, et al. Molecular migration in high-protein intermediate-moisture foods during the early stage of storage: Variations between dairy and soy proteins and effects on texture[J]. Food Research International, 2016, 82: 34-43.
[14] LABUZA T P, HYMAN C R. Moisture migration and control in multi-domain food[J].Trends in Food Science and Technology, 1998, 9(2): 47-55.
[15] 林玉惠, 李鹏鹏, 何志勇, 等. 不同盐浓度下黄原胶对大豆分离蛋白—肌原纤维蛋白复合凝胶性质的影响[J]. 食品与机械, 2015, 31(5): 11-15.
[16] 刘锐, 武亮, 张影全, 等. 基于低场核磁和差示量热扫描的面条面团水分状态研究[J]. 农业工程学报, 2015, 31(9): 288-294.
Mechanism of texture influenced by xanthan gum on soy protein bar model system
WUYu-ting1
ZHOUPeng1
LIJuan1
LIUChang-shu2
WANGSai2
(1.StateKeyLaboratoryofFoodScienceandTechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China;2.StandardInvestment〔China〕Co.,Ltd,Shanghai201103,China)
Soy protein bar model system was normally multicompo-nent and thermodynamically unstable and its hardness was increased significantly in the early stage of storage. Xanthan gum is a kind of hydrocolloid with high viscosity and water holding capacity, and it is widely used in food industry as quality improver. This study aimed to evaluate the influence of xanthan gam on texture of soy protein bar model system. The changes in texture, microstructure and T2relaxation time of soy protein bar model systems with or without xanthan gum were observed through texture analyzer, confocal laser scanning microscopy (CLSM), scanning electronic microscopy (SEM) and low-field nuclear magnetic resonance (LF-NMR) respectively. Comparing to the samples without xanthan gum, samples with xanthan gum had apparently lower hardness. Moreover, the microstructure was significantly changed by adding xanthan gum, and a higher ratio of small molecules such as water and polyols remained relatively high mobility.
Xanthan gum; Nutrition bar; Soy protein; Texture; Microstructure
国家自然科学基金(编号:31471697);教育部科学技术研究项目(编号:113032A)
巫雨婷,女,江南大学在读硕士研究生。
周鹏(1975—),男,江南大学教授,博士。 E-mail:zhoupeng@jiangnan.edu.cn
2017—03—13
10.13652/j.issn.1003-5788.2017.05.007
