内生细菌对香茅草产柠檬醛的影响
2017-07-05柳倩
柳 倩
阎晋东1,2
徐 婷1,2
李 燕1,2
朱咏华1,2
(1. 湖南大学生物学院,湖南 长沙 410082;2. 植物基因组学与发育调控湖南省重点实验室,湖南 长沙 410082)
内生细菌对香茅草产柠檬醛的影响
柳 倩1,2
阎晋东1,2
徐 婷1,2
李 燕1,2
朱咏华1,2
(1. 湖南大学生物学院,湖南 长沙 410082;2. 植物基因组学与发育调控湖南省重点实验室,湖南 长沙 410082)
内生菌对于植物的健康和新陈代谢具有非常重要的作用,目前内生菌对芳香植物香茅草挥发性有机化合物(VOCs)代谢的影响尚不清楚。试验分离了不同生长季节的香茅草内生细菌,得到1株具有清新自然香味的优势内生菌CcLf-2,鉴定为芽孢杆菌属。通过顶空气相色谱质谱联用仪对香茅草VOCs进行检测,发现不同季节其主要挥发性物质柠檬醛含量的变化与CcLf-2的分离率分布规律一致。进一步将CcLf-2接种到香茅草无菌苗中,发现CcLf-2可以成功定殖到香茅草中,并明显增强其所产柠檬醛的比例。实时定量PCR(qRT-PCR)分析表明,CcLf-2的存在可诱导香茅草中柠檬醛生物合成途径相关基因的表达量显著上升(P<0.05)。说明内生菌可以作为诱导子来提高宿主植物中一些重要的VOCs的产量。
内生细菌;香茅草;代谢调节;柠檬醛含量;基因表达
内生菌是一类与植物紧密联系的特殊微生物,在其生命周期的某一阶段或者整个阶段定殖于植物组织或器官内,但不引起植物出现明显病害症状[1]。植物内生菌几乎存在于所有植物中[2],对植物的生长发育[3-4],适应性[5]以及多样性具有非常重要的作用[6]。由于特殊的生存环境,内生菌在长期的协同进化过程中,具有调节其宿主植物次级代谢产物合成的能力[7-8]。挥发性有机化合物(VOCs)是植物次级代谢产物中的重要成分,具有极重要的生物功能,如抗非生物胁迫或生物胁迫;在实际生产中的应用范围也很广,从香料的生产到新药的来源[9],因而受到越来越多关注。有报道[10]显示,芳香植物的内生菌对宿主萜类挥发性有机物的产量和质量具有重要的影响,如内生真菌PGP-HSF会影响薄荷中萜类化合物的化学合成。相对来说,关于内生细菌对宿主次级代谢,特别是VOCs影响的报道还非常少。
香茅草,又被称为柠檬草,是一种重要的香料植物,主要生长在热带地区[11]。其VOCs的主要成分是柠檬醛。天然状态下,柠檬醛主要以橙花醛和香叶醛两种几何异构体的形式存在[12]。柠檬醛具有拮抗细菌[13]、真菌[14]以及抗虫性能[15],并被广泛用于生产香料,合成紫罗兰酮、VA和VE等[16]。然而,芳香植物所产生的柠檬醛还远不能满足高速发展的香料行业的需求,所以,探究影响香茅草产柠檬醛的因素极其重要。目前,已有研究显示生长季节[17]和植物年龄[18]能影响香茅草精油成分,而内生菌对香茅草VOCs的影响未见诸于报道。
本研究拟对不同生长季节的香茅草内生细菌进行分离,并鉴定了具有产香能力的优势内生细菌。通过对不同季节内生细菌的分布规律以及香茅草挥发性成分进行分析比较,揭示内生细菌与宿主次级代谢产物合成之间的关系。进一步通过植物组织培养技术获得香茅草无菌苗,并用优势内生菌对无菌苗进行处理,通过顶空气相色谱质谱联用仪(HS-GC-MS)对用菌处理与未处理的香茅草无菌苗的VOCs进行检测分析。同时,通过实时定量PCR(qRT-PCR)对香茅草中柠檬醛合成途径中相关基因的mRNA水平的表达情况进行检测,以发掘内生菌影响香茅草生产柠檬醛的作用机制。
1 材料与方法
1.1 材料与仪器
香茅草[Cymbopogoncitrates(DC.) Stapf]:由福建农林大学提供,种植于湖南省长沙市岳麓区湖南大学(28.10' 47.9994"N, 112.57' 0′′E);
细菌DNA提取试剂盒:上海捷瑞生物工程有限公司;
Prime Script RT试剂盒:宝生物工程有限公司;
气相色谱-质谱联用仪: Thermo-Finnigan Trace GC + Polaris Q型, 美国赛默飞世尔科技公司;
qRT-PCR仪:Mx3000P QPCR System型,美国安捷伦科技有限公司。
1.2 试验方法
1.2.1 香茅草内生细菌的分离 清洗干净的香茅草样品,室温晾干后,参照文献[5]进行表面消毒和内生细菌的分离。待内生细菌析出后统计其分离率[分离率为4种分离培养基:大豆酪蛋白培养基(TSA)、甘露醇大豆培养基(MS)、酵母提取物培养基(TWYE)[19]和水琼脂培养基(WA)[20]分离到内生菌的平均值],并将其挑出到NA培养基上[21]进行划线培养得到纯培养物。
1.2.2 细菌菌种鉴定 用细菌DNA提取试剂盒提取细菌基因组DNA。以此为模板,以通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′) 和1492R (5′-GGTTACCTTGTTACGACTT-3′) 对其16S rRNA进行扩增,测序后的序列在NCBI酸数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi) 中进行比对分析,用GENEDOC软件和MEGA 5.1软件构建系统发育树。
1.2.3 HS-GC-MS分析 将新鲜的香茅草用SiO2研磨,所得汁液转移到20 mL色谱瓶。检测条件参照文献[22],所得总离子流图与NIST08标准质谱数据库进行对比,对香茅草挥发性成分进行分析鉴定[23]。
内生细菌在NA培养基上培养24 h后,刮取菌体混合于装有无菌水的20 mL色谱瓶中,用于HS-GC-MS分析,检测条件同香茅草检测条件。
1.2.4 香茅草组织培养 新鲜的香茅草样品剥去1~2层叶鞘,选取幼嫩根状茎作为外植体进行表面消毒:70%乙醇浸泡2 min,无菌水冲洗,2% NaClO浸泡10~15 min,无菌水冲洗3~10次,于超净工作台晾干。将香茅草样品切成1 cm左右转移到NB培养基[24][2.0 g/L 2,4-二氯苯氧基乙酸(2,4-D)]诱导愈伤组织。2周后,将愈伤组织转移到MS培养基[25][3.0 g/L激动素(KT),0.05 mg/Lα-萘乙酸(NAA)]进行分化。培养温度为28 ℃,14 h光照/10 h黑暗,光强为80 μmol/(m2·s)。
2.3 转染pSIREN-hTERT对A2780细胞增殖的影响 MTT比色法描绘细胞生长曲线提示,空白对照及转染pSIREN-Con对照质粒的A2780细胞生长速率相近,而pSIREN-hTERT转染的A2780细胞生长速率明显降低,后者分别与前两对照组比较差异有统计学意义(均P<0.05),表明靶向hTERT的shRNA导入抑制了A2780细胞的增殖能力。见表1。
1.2.5 优势内生菌处理香茅草无菌苗 将内生细菌的发酵液稀释至1×105CFU/mL,待组培瓶中生根培养基[1/2 MS[25],0.05 mg/L NAA]冷却至35 ℃左右时,加入发酵液2 mL,在培养基中加入2 mL无菌水作为对照。待培养基冷却至室温后,将90 d苗龄的香茅草幼苗转移到培养基上进行培养。
1.2.6 植物总RNA提取和qRT-PCR 使用植物总RNA 快速抽提试剂盒对香茅草总RNA进行提取,使用Prime Script RT试剂盒合成cDNA。qRT-PCR引物参照文献[26]。qRT-PCR反应体系及扩增程序参照文献[27]。每个反应重复3次,使用2-ΔΔCt方法计算基因表达相对值[28]。无菌水处理的香茅草基因表达水平设为1。
2 结果与讨论
2.1 香茅草产香内生细菌的分离
通过对2015年7月~2016年6月的香茅草内生细菌进行分离,从14 376个香茅草组织样品中分离出3 594株内生细菌。在所分离的内生细菌中,发现一株细菌不管是在不同的生长季节还是在不同的香茅草组织中,析出频率都比较高,将其命名为CcLf-2。通过形态学观察结合16S rRNA序列分析,鉴定该菌为芽孢杆菌属(Bacillus)(图1 )。据报道[29],一些内生真菌可以产生与其宿主植物相似的次级代谢物,如紫杉醇。然而,关于内生细菌的类似研究却很少见[7]。通过感官评定,发现分离自香茅草的一些内生细菌可以产生清新自然的香味,尤其是CcLf-2,香味很明显。芽孢杆菌属的菌种具有抗菌、除臭等多种生理功能[30],但是其具有产香能力却是首次发现。通过HS-GC-MS检测CcLf-2的挥发性物质,表明CcLf-2的挥发性成分中含有桃醛、紫罗兰酮等重要的香料物质(表1)。

表1 Bacillus sp. CcLf-2的挥发性成分分析Table 1 The volatile organic compounds ofBacillus sp. CcLf-2

分支点上的数字表示构建系统发育树时1 000次计算时形成该节点的百分比
图1 CcLf-2的16S rRNA基因系统发育树
Figure 1 Phylogenetic tree of CcLf-2 16S rRNA gene sequences
值得注意的是,不同季节CcLf-2的分离率(图2)与香茅草内生细菌的总分离率(图3)的变化趋势相反,即具有产香能力的优势菌CcLf-2析出频率高的时候,并不对应着内生细菌在宿主植物香茅草中分布最丰富的季节。而香茅草挥发性物质的组成及比例随季节发生变化,因此怀疑这一变化是否与产香内生细菌的特殊分布存在关联。为了验证这一猜测,通过HS-GC-MS对不同季节香茅草VOCs进行检测。
2.2 不同季节香茅草VOCs分析
利用HS-GC-MS,鉴定出香茅草中9个挥发性成分(表2)。主要包含柠檬醛(以橙花醛和香叶醛两种几何异构体的形式存在)和α-蒎烯,这两种物质均广泛应用于香料生产中。有研究报道香茅草精油中含有30多种挥发性物质[31],本研究只分离鉴定到9种,其原因可能有以下两点:① 不同于传统提炼精油的方法,本研究直接用石英砂来研磨新鲜的香茅草样品,可能会导致一些含量很少的成分损失;② 本研究通过顶空自动进样器来收集样品,在此过程中,一些高沸点的化合物难以自然扩散到进样器中。但本方法快速便捷,能满足获得主要VOCs的需要。由表2可知,不同季节香茅草VOCs的比例发生了明显的变化,其中橙花醛和香叶醛的比例在春季和夏季明显高于秋冬季节,与之前提到的优势内生细菌CcLf-2在不同季节的分布规律的变化趋势一致(图2)。因此,寄生于香茅草内的产香内生细菌可能会对其VOCs,尤其是主要成分柠檬醛的含量有一定的影响。

图2 不同季节优势内生细菌Bacillus sp. CcLf-2的分离率Figure 2 The isolation rate of dominant endophytic bacteriaBacillus sp. CcLf-2 in different seasons

图3 香茅草内生细菌的总分离率Figure 3 General endophytic bacteria from C. citratusin different seasons表2 不同季节香茅草挥发性成分分析Table 2 Volatile organic compounds obtained fromC. citratus in different seasons
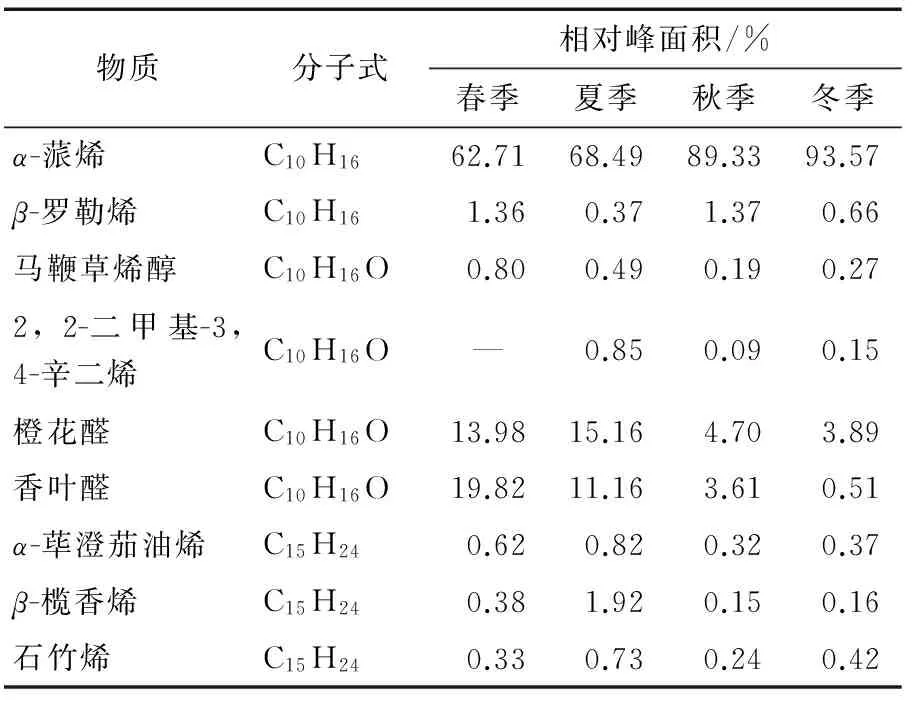
物质分子式相对峰面积/%春季夏季秋季冬季α-蒎烯C10H1662.7168.4989.3393.57β-罗勒烯C10H161.360.371.370.66马鞭草烯醇C10H16O0.800.490.190.272,2-二甲基-3,4-辛二烯C10H16O—0.850.090.15橙花醛C10H16O13.9815.164.703.89香叶醛C10H16O19.8211.163.610.51α-荜澄茄油烯C15H240.620.820.320.37β-榄香烯C15H240.381.920.150.16石竹烯C15H240.330.730.240.42
2.3 内生菌CcLf-2对香茅草VOCs的影响
为了进一步验证内生细菌对香茅草VOCs的影响,首先通过植物组织培养技术获得了香茅草无菌苗(图4),以排除其他微生物的干扰。将内生细菌CcLf-2接种到香茅草无菌苗培养基中,CcLf-2可以通过香茅草的根部渗入香茅草。通过重分离试验,从香茅草组培苗的叶片和鞘中分离出了CcLf-2(图5),证明其的确可以成功定殖在香茅草中。通过HS-GC-MS检测接种了CcLf-2(E +)和未接种CcLf-2(E-)的香茅草无菌苗以及野生香茅草幼苗(W)的VOCs,发现接种CcLf-2后,香茅草VOCs中橙花醛和香叶醛的比例明显增加(表3),说明内生细菌CcLf-2可以诱导香茅草主要挥发性物质柠檬醛的产生。值得注意的是,生长同期,大小一致的野生香茅草幼苗,其柠檬醛的含量明显高于CcLf-2处理后的香茅草组培苗,表明内生菌诱导香茅草VOCs中柠檬醛比例的增加可能不只依赖单个菌种,而是依赖整个微生物菌群。
2.4 CcLf-2对香茅草中萜类化合物生物合成基因表达的调控
为了进一步探讨内生细菌诱导宿主香茅草中柠檬醛合成的分子机制,通过qRT-PCR分析香茅草中柠檬醛代谢途径相关基因的转录表达水平。异戊烯二磷酸酯(IPP)和二甲基烯丙基二磷酸酯(DMAPP)是萜类化合物生物合成的两种前体物质[32]。植物体主要通过甲羟戊酸(MVA)途径和2-C-甲基-D-赤藻糖醇-4-磷酸(MEP)途径来合成IPP和DMAPP[33-34]。本研究对MVA途径中的3个基因[甲基戊二酰辅酶A还原酶(HMGR)、甲羟戊酸激酶(MK)、甲羟戊酸二磷酸脱羧酶(MDC)]和MEP途径中的5个基因[1-脱氧-D-木酮糖5-磷酸合成酶(DXS)、1-脱氧-D-木酮糖5-磷酸还原异构酶(DXR)、5-二磷酸-2-C-甲基-D-赤藓糖醇激酶(CMK)、2,4-环磷酸合酶(MCS)、(E)-4-羟基-3-甲基丁-2-烯基-二磷酸合酶(HDS)]进行了检测。这些基因都是萜类物质合成途径中的关键基因[26]。由图6可知,与未处理的香茅草无菌苗相比,用CcLf-2处理过的香茅草组培苗中除MCS以外,所有检测基因的表达量均显著性上调(P<0.01),特别是MVA途径中的基因。植物挥发性萜类化合物的合成涉及到一系列复杂的生化反应过程,是多种基因相互作用的结果。由于香茅草基因组信息有限,虽然只检测了部分基因的mRNA水平,但已有结果仍表明内生细菌CcLf-2在香茅草中的定殖可以通过调控与萜类物质合成相关的基因的表达水平来提高柠檬醛的合成。

A. 香茅草外植体在NB培养基上培养2周后形成的愈伤组织 B. 香茅草愈伤组织在MS分化培养基上培养7 d形成的芽 C. MS培养基上培养2个月的香茅草无菌苗
图4 香茅草组织培养
Figure 4 The tissue culture ofC.citratus

图5 从未接种CcLf-2(E-)和接种CcLf-2(E +)的 香茅草组培苗中重分离CcLf-2
Figure 5 The bacteria CcLf-2 reisolation result from CcLf-2-free (E-) and CcLf-2-inoculated (E+)C.citratusaseptic seedlings
表3 内生细菌CcLf-2处理(E+)和未处理的香茅草组培苗(E-)以及香茅草野生幼苗(W)的挥发性成分分析
Table 3 Volatile organic compounds obtained from endop-hyte CcLf-2-inoculated (E+), CcLf-2-free (E-)C.citratusaseptic seedlings and wildC.citratusseedlings (W)

物质分子式相对峰面积/%E-E+Wα-蒎烯C10H1689.9785.1680.75β-罗勒烯C10H16——2.10马鞭草烯醇C10H16O1.372.630.06橙花醛C10H16O0.831.963.98香叶醛C10H16O3.406.1011.04α-荜澄茄油烯C15H242.232.181.49β-榄香烯C15H240.850.740.46石竹烯C15H241.341.230.18

E-:香茅草无菌苗;E +:CcLf-2处理10 d的香茅草组培苗;星号表示与香茅草无菌苗的显著差异, * P <0.05,** P <0.01,*** P <0.001图6 香茅草中与MVA和MEP合成途径相关的基因表达水平分析Figure 6 The expression levels of genes responsible for MVA pathway and MEP pathway (n=3)
3 结论
本研究探究了内生细菌对香茅草VOCs的影响。结果表明,分离出的香茅草优势内生细菌CcLf-2可以成功定殖在香茅草无菌苗中,通过调控其与萜类化合物合成途径相关基因的表达水平可提高柠檬醛的合成;初步揭示了内生菌诱导香茅草柠檬醛合成的分子机制,证明内生菌作为提高一些高商业价值天然产物产量的诱导子,具有很大的开发潜力。然而,内生菌诱导宿主香茅草产柠檬醛的详细分子机制还需要进一步研究;如何通过控制内生菌的接种方法和接种量,使香茅草柠檬醛的产量达到最大,从而应用于实践生产当中仍需要进一步摸索。
[1] HARDOIM P R, VAN Overbeek L S, BERG G, et al. The Hidden World within Plants: Ecological and Evolutionary Considerations for Defining Functioning of Microbial Endophytes[J]. Microbiolo Mol Biol R, 2015, 79(3): 293-320.
[2] WANG Yu, DAI Chuan-chao. Endophytes: a potential resource for biosynthesis, biotransformation, and biodegradation[J]. Annals of Microbiollogy, 2011, 61(2): 207-215.
[3] CHEBOTAR V K, MALFANOVA N V, SHCHERBAKOV A V, et al. Endophytic bacteria in microbial preparations that improve plant development (review)[J]. Appl Biochem Micro, 2015, 51(3): 271-277.
[4] SHCHERBAKOV A V, BRAGINA A V, KUZMINA E Y, et al. Endophytic bacteria of Sphagnum mosses as promising objects of agricultural microbiology[J]. Microbiology, 2013, 82(3): 306-315.
[5] XU Ting, LI Yan, ZENG Xia-dong, et al. Isolation and evaluation of endophyticStreptomycesendusOsiSh-2 with potential application for biocontrol of rice blast disease[J]. J. Science Food Agric., 2017, 97(4): 1 149-1 157.
[6] BULGARELLI D, GARRIDO-OTER R, MUNCH P C, et al. Str-ucture and function of the bacterial root microbiota in wild and domesticated barley[J]. Cell Host & Microbe, 2015, 17(3): 392-403.
[7] LUDWIG-MULLER J. Plants and endophytes: equal partners in secondary metabolite production?[J]. Biotechnol Lett, 2015, 37(7): 1 325-1 334.
[8] MULLER C A, OBERMEIER M M, BERG G. Bioprospecting plant-associated microbiomes[J]. J Biotechnol, 2016, 235(10): 171-180.
[9] MAFFEI M E, GERTSCH J, APPENDINO G. Plant volatiles: production, function and pharmacology[J]. Nat Prod Rep, 2011, 28: 1 359-1 380.
[10] MUCCIARELLI M, CAMUSSO W, MAFFEI M. Volatile terpenoids of endophyte-free and infected peppermint (MenthapiperitaL.): chemical partitioning of a symbiosis[J]. Microbiol Ecol, 2007, 54: 685-696.
[11] TAVARES F, COSTA G, FRANCISCO V, et al.Cymbopo-goncitratusindustrial waste as a potential source of bioactive compounds[J]. J Sci. Food Agric, 2015, 95(13): 2 652-2 659.
[12] NEGRELLE R R B, GOMES E C.Cymbopogoncitratus(DC.) Stapf: chemical composition and biological activities[J]. Rev Bras Pl Med, 2007, 9(1): 80-92.
[13] KIM J K, MARSHALL M R, CORNELL J A, et al. Antibacterial activity of carvacrol, citral and geraniol againstSalmonellatyphimuriumin culture medium and on fish cubes[J]. J Food Sci. 1995, 60(6): 1 364-1 374.
[14] TAO Neng-guo, OU YANG Qiu-li, JIA Lei. Citral inhibits mycelial growth ofPenicilliumitalicumby a membrane damage mechanism[J]. Food Control, 2014, 41: 116-121.
[15] RICE P J, COATS J R. Insecticidal Properties of Several Mon-oterpenoids to the House Fly (Diptera: Muscidae), Red Flour Beetle (Coleoptera: Tenebrionidae), and Southern Corn Rootworm (Coleoptera: Chrysomelidae)[J]. J Econ Entomol, 1994, 87(5): 1 172-1 179.
[16] LERMEN C, MORELLI F, GAZIM Z C, et al. Essential oil content and chemical composition ofCymbopogoncitratusinoculated with arbuscular mycorrhizal fungi under different levels of lead[J]. Ind Crop Prod, 2015, 76(15): 734-738.
[17] VIRLENE D A J, ALINE J E M, WILLIAN F D C, et al. Effect of seasons on chemical composition and fungitoxicity ofCymbopogoncitratus(DC). Staf essential oil[J]. Afr J Agr Res, 2016, 11(12): 1 048-1 055.
[18] ROCHA R P, MELO E D C, BARBOSA L C A, et al. Influence of plant age on the content and composition of essential oil ofCymbopogoncitratus(DC.) Stapf[J]. J Med Plants Res, 2014, 8(37): 1 121-1 126.
[19] LE Xu-yen, FRANCO C M M, BALLARD R A. Isolation and characterisation of endophytic actinobacteria and their effect on the early growth and nodulation of lucerne (MedicagosativaL.) [J]. Plant Soil, 2015, 405(1): 13-24.
[20] GARBEVA P, HORDIJK C, GERARDS S. Volatiles produced by the mycophagous soil bacteriumCollimonas[J]. FEMS Microbiol Ecol, 2014, 87(3): 639-649.
[21] PANG Fa-hu, WANG Tan, ZHAO Chen-chen, et al. Novel bacterial endophytes isolated from winter wheat plants as biocontrol agent against stripe rust of wheat[J]. Bio Control, 2016, 61(2): 207-219.
[22] BARBOSA L C A, PEREIRA U A, MARTINAZZO A P, et al. Evaluation of the chemical composition of brazilian commercialCymbopogoncitratus(DC.) Stapf samples[J]. Molecules, 2008, 13(8): 1 864-1 874.
[23] YANG Chun-xiang, WANG Yi-ju, LIANG Zhen-chang, et al. Volatiles of grape berries evaluated at the germplasm level by headspace-SPME with GC-MS[J]. Food Chem, 2009, 114(3): 1 106-1 114.
[24] YE Xu-dong, AL-BABILI S, KLÖTI A, et al. Engineering the provitamin A (beta-carotene) biosynthetic pathway into (carotenoid-free) rice endosperm[J]. Science, 2000, 287(5 451): 303-305.
[25] LIN Yong-jun, ZHANG Qi-fa. Optimising the tissue culture conditions for high efficiency transformation of indica rice[J]. Plant Cell Rep, 2005, 23(8): 540-547.
[26] DEVI K, MISHRA S K, SAHU J, et al. Genome wide transcriptome profiling reveals differential gene expression in secondary metabolite pathway ofCymbopogonwinterianus[J]. Sci Rep, 2016, DOI:10.1038/srep21026.
[27] MA Jiang-shan, ZHANG Ke-ke, HUANG Mei, et al. Involvement of Fenton chemistry in rice straw degradation by the lignocellulolytic bacterium Pantoea ananatis Sd-1[J]. Biotechnology for Biofuels, 2016, 9: 211.
[28] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2[ -Delta Delta C(T)] Method[J]. Methods, 2001, 25(4): 402-408.
[29] STROBEL G A. Endophytes as sources of bioactive products[J]. Microbes Infect, 2003, 5(6): 535-44.
[30] LOGAN N A, DE Vos P.Bacillus[M]// Bergey’s Manual of Systematics Bacteriology. New Youk: Springer, 2015: 3-124.
[31] AJAYI E O, SADIMENKO A P, AFOLAYAN A J. GC-MS evaluation ofCymbopogoncitratus(DC.) Stapf oil obtained using modified hydrodistillation and microwave extraction methods[J]. Food Chem, 2016, 209(15): 262-266.
[32] LANGE B M, RUJAN T, MARTIN W, et al. Isoprenoid biosynthesis: the evolution of two ancient and distinct pathways across genomes[J]. PNAS, 2000, 97(24): 13 172-13 177.
[33] LICHTENTHALER H K. The 1-deoxy-d-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants[J]. Annu Rev Plant Phys, 1999, 50: 47-65.
[34] KASAHARA H, HANADA A, KUZUYAMA T, et al. Contribution of the mevalonate and methylerythritol phosphate pathways to the biosynthesis of gibberellins inArabidopsis[J]. J Biol Chem, 2002, 277(47): 45 188-45 194.
Effects of endophytic bacteria on citral production inCymbopogoncitratus(DC.) Stapf
LIUQian1,2
YANJin-dong1,2
XUTing1,2
LIYan1,2
ZHUYong-hua1,2
(1.CollegeofBiology,HunanUniversity,Changsha,Hunan410082,China; 2.HunanProvinceKeyLaboratoryofPlantFunctionalGenomicsandDevelopmentalRegulation,Changsha,Hunan410082,China)
The existence of endophytes significantly contributes to plant health and metabolism, however, the effects of endophytes on the volatile organic compounds (VOCs) metabolism of aromatic plantCymbopogoncitratusare still unclear. In this study, the endophytic bacteria fromC.citratusgrown at different seasons were isolated, and a dominant endophytic bacteriumBacillussp. CcLf-2 was identified, with a fragrance-producing property. After seasonal analysis of the VOCs ofC.citratusby headspace gas chromatography-mass spectrometry, found that the abundance pattern of CcLf-2 had a similar trend with the emission profile of citral, the primary and valuable composition of VOCs, inC.citratus. By inoculating CcLf-2 intoC.citratusaseptic seedlings obtained by tissue culture, endophyte reisolation test verified the colonization of CcLf-2 in plants and the presence of CcLf-2, which can increased the citral proportion, obviously. Moreover, quantitative real-time PCR analysis of relevant genes in the citral biosynthesis pathway revealed that they were significantly up-regulated (at least P <0.05) with the existence of CcLf-2. The endophytic bacteria may enhance the citral production by modulating the expression of genes related to biosynthesis. And implies the possibility of using endophytic bacteria as a regulator to improving yields of some important VOCs in its host.
Endophytic bacteria;Cymbopogoncitratus; metabolism regulation; citral production; gene expression
国家自然科学基金(编号:31672093)
柳倩,女,湖南大学在读硕士研究生。
朱咏华(1968—),女,湖南大学教授,博士。 E-mail:yonghuaz@outlook.com
2017—04—03
10.13652/j.issn.1003-5788.2017.05.002
