玉屏风散对低温环境下小鼠肺脏固有淋巴样细胞比例及功能的影响
2017-07-05安磊郭钰琪王丽孙晓艳吕衍民兰红云姚成芳
安磊,郭钰琪,王丽,孙晓艳,吕衍民,兰红云,姚成芳
(1济南大学 山东省医学科学院医学与生命科学学院,济南 250062;2山东省医学科学院基础医学研究所)
玉屏风散对低温环境下小鼠肺脏固有淋巴样细胞比例及功能的影响
安磊1,2,郭钰琪2,王丽2,孙晓艳2,吕衍民2,兰红云1,2,姚成芳2
(1济南大学 山东省医学科学院医学与生命科学学院,济南 250062;2山东省医学科学院基础医学研究所)
目的 观察玉屏风散对低温环境下小鼠肺脏固有淋巴样细胞(ILCs)比例及功能的影响。方法 将24只小鼠随机分为对照组、低温模型组和玉屏风散组,对照组不做处理,低温模型组和玉屏风散组给予低温处理(3 h/d,连续3 d),且玉屏风散组低温处理前第7天开始给予玉屏风散直至实验结束。采用流式细胞术检测各组小鼠肺脏组织淋巴细胞中ILCs及其亚群(ILC1、ILC2和ILC3)比例,采用RT-PCR法检测小鼠肺脏组织中ILCs功能因子IFNγ、IL-13、IL-17A mRNA表达。结果 与对照组相比,低温模型组小鼠肺脏组织淋巴细胞中ILCs、ILC1、ILC2、ILC3比例低(P均<0.05),IFNγ、IL-13、IL-17A mRNA表达低(P均<0.01)。与低温模型组相比,玉屏风散组小鼠肺脏组织淋巴细胞中ILCs、ILC1、ILC2、ILC3比例高(P均<0.05),IFNγ、IL-13、IL-17A mRNA表达高(P均<0.05)。结论 玉屏风散可逆转低温环境对肺脏ILCs及其功能因子的抑制作用。
低温;固有淋巴样细胞;肺;玉屏风散;中药
低温环境常常诱发或加重支气管炎、哮喘等呼吸系统疾病[1,2]。肺脏是黏膜免疫的重要组成部分,其固有免疫系统在抵抗环境温度刺激时发挥首要保护作用。近年来新发现的天然免疫细胞——固有淋巴样细胞(ILCs)被认为是黏膜组织固有免疫的重要组成部分,在抵抗病原入侵、维持黏膜稳态、淋巴组织形成及组织修复中发挥重要作用[3]。ILCs由共同淋巴样祖细胞(CLP)分化而来,根据细胞因子分泌模式不同,被分为ILC1、ILC2和ILC3亚群。ILC1以产生大量IFNγ等为特征,是机体抗病毒、抗肿瘤的关键细胞亚群;ILC2可产生IL-5及IL-13等细胞因子,主导黏膜体液免疫和过敏反应;ILC3分泌IL-17A等细胞因子,主导并放大炎症反应[4,5]。ILCs对保持肺脏微环境的平衡与稳定、维持肺脏固有免疫、抵御外界环境变化有着重要意义[6],但其对外界低温环境的敏感性及其细胞因子分泌变化模式尚无报道。中药玉屏风散由黄芪、白术、防风组成,发挥扶正、固表、祛邪之功效,用于表虚不固、外感风邪等证[7],可增强机体防邪入侵的功能。但玉屏风散靶向肺脏ILCs的作用尚不清楚。2016年10~12月,本研究观察了玉屏风散对低温环境下小鼠肺脏ILCs比例及功能的影响,现将结果报告如下。
1 材料与方法
1.1 实验动物、试剂及仪器 SPF级雌性C57BL/6小鼠24只,6~7周龄,体质量(18.29±1.41)g,购自济南朋悦实验动物繁育有限公司。玉屏风散由本实验室采用水提醇沉法制得。流式抗体Rat anti mouse PerCP-CD45、PE-Cy7-CD3、FITC-CD335、APC-IFNγ、PE-IL-5、APC-Cy7-IL-17A,固定穿膜试剂盒,佛波酯,离子霉素,蛋白转运抑制剂,胶原酶Ⅳ,BD FACSVerse流式细胞仪,TRIzol、Oligo dT、dNTP、RNasin、2×Taq Master Mix(北京康为世纪生物科技有限公司),IFNγ、IL-13及IL-17A引物(济南博尚生物技术有限公司)。
1.2 方法
1.2.1 实验分组与处理 将24只C57BL/6小鼠随机分为对照组、低温模型组、玉屏风散组,各8只。对照组与低温模型组小鼠自由饮水;玉屏风散组饮用玉屏风散制剂2.34 g/(kg·d)直至实验结束。各组小鼠均在室温(25 ℃)饲养7 d。自玉屏风散组给药第8天开始,每日将玉屏风散组和低温模型组小鼠置于(10±1)℃低温装置内,低温处理3 h,连续处理3 d。低温处理后,测得低温模型组小鼠体质量、肛温较对照组低(P<0.05或<0.01),表明成功建立小鼠低温模型。于末次低温处理后,处死各组动物,使用冷PBS在体冲洗肺脏。
1.2.2 小鼠肺脏组织淋巴细胞中ILCs及其亚群比例检测 采用流式细胞术。分离小鼠肺脏组织,剪碎,置于胶原酶Ⅳ消化液中,振荡消化40 min,研磨过滤,PBS洗1遍。LSK淋巴细胞分离液分离单个核细胞,PBS洗2遍,RPMI1640和10% FBS RPMI1640培养液各洗1遍,计数细胞,用于流式细胞检测。按照细胞数5×106/孔接种于24孔板,根据试剂盒说明书加入适当浓度的佛波酯、离子霉素和蛋白转运抑制剂,刺激培养5 h后收集细胞。PBS洗2遍,每管加20 μL新鲜大鼠血清室温避光孵育20 min,PBS洗1遍后加入流式抗体CD45、CD3、CD335,4 ℃避光孵育30 min。PBS洗2遍,按照固定穿膜试剂盒说明书进行固定穿膜,加入胞内流式抗体IFNγ、IL-5、IL-17A,4 ℃避光1 h。PBS洗2遍后,使用流式细胞仪检测肺脏CD45+CD3-CD335+ILC及其亚群-ILC1(IFNγ+)、ILC2(IL-5+)和ILC3(IL-17A+)在淋巴细胞中所占比例。
1.2.3 小鼠肺脏组织IFNγ、IL-13、IL-17A mRNA表达检测 分离肺脏小叶,剪碎后用1 mL TRIzol对其充分裂解5 min。加入200 μL氯仿剧烈震荡,离心后取上清,加入等体积异丙醇混匀静置后,离心弃上清,依次用75%乙醇和无水乙醇洗涤沉淀。最后用若干体积RNase-free水溶解RNA,经ND-1000分光光度仪检测RNA纯度与含量后,调整各样本RNA浓度至2 μg/11 μL。RT反应:采用20 μL体系,以1 μL Oligo dT为RT反应引物,与2 μg(11 μL)总RNA先进行70 ℃、5 min预热,冰浴降温后加入4 μL 5×RT buffer、2 μL dNTP(10 mmol/L)、1 μL RNasin及1 μL M-MLV,进行反应。PCR反应:采用25 μL体系,包括RT产物4 μL、上下游引物(10 μmol/L)各2 μL、2×Taq Master Mix 12.5 μL、RNase-free水6.5 μL。PCR产物用1.5%凝胶电泳后,使用Alpha凝胶成像系统显影。以GAPDH为内参,计算IFNγ、IL-13、IL-17A mRNA相对表达量。

2 结果
2.1 各组小鼠肺脏组织淋巴细胞中ILCs及其亚群比例比较 见表1。
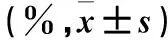
表1 各组小鼠肺脏组织淋巴细胞中ILCs及其亚群比例比较
注:与对照组相比,△P<0.05,*P<0.01;与低温模型组相比,▲P<0.05,#P<0.01。
2.2 各组小鼠肺脏组织IFNγ、IL-13、IL-17A mRNA表达比较 见表2。
3 讨论
ILCs多分布于肺脏,是肺组织防御感染、维持组织稳定的重要细胞[8]。ILC1在胞内病原体感染的免疫过程中发挥关键作用,如在弓形虫感染的小鼠体内是IFNγ和TNF的主要来源,并有招募炎性髓细胞控制感染的作用[9]。ILC2具有拮抗蠕虫感染和促进呼吸道炎症反应等作用[10]。ILC3可在小鼠胞外细菌或真菌感染过程中快速响应,通过产生IL-17A、IL-22等细胞因子促进趋化因子CXCL1、CXCL9等的表达,增强宿主的固有免疫能力[11,12]。因此,维持ILC亚群的组织含量与功能稳定,对保持肺组织局部固有免疫功能具有重要意义。寒冷季节急、慢性呼吸系统疾病的入院率明显升高[13],说明低温环境显著影响肺脏免疫功能。本研究发现,低温环境下小鼠肺组织ILCs及其ILC1、ILC2和ILC3亚群的比例显著下降,ILC亚群特征性细胞因子IFNγ、IL-13及IL-17A的表达水平下降,与肺组织ILCs含量整体水平下降密切相关,说明低温可降低肺脏固有免疫功能。低温导致肺脏黏膜免疫稳态被破坏,抗菌、抗病毒和抗炎等功能受到抑制,不仅直接影响肺组织的ILCs免疫稳态,还可进一步影响T细胞主导的适应性免疫应答能力,造成机体整体免疫力下降,是低温状态下肺脏感染性疾病和哮喘等疾病发生发展的重要原因。

表2 各组小鼠肺脏组织IFNγ、IL-13、IL-17A mRNA表达比较
注:与对照组相比,*P<0.01;与低温模型组相比,▲P<0.05,#P<0.01。
玉屏风散出自《丹溪心法》,为中医扶正固表之明方[14]。玉屏风散可以通过调控Th1/Th2平衡有效防治流行性感冒和治疗慢性支气管炎等呼吸系统疾病。另有动物实验和临床研究证明,玉屏风散可上调免疫球蛋白含量和血清IgA值,对呼吸道感染有防治作用[15]。以往研究多集中于玉屏风散对机体整体免疫的作用机理,对肺脏局部免疫微环境的药理研究较少。玉屏风散对肺脏的保护效应与组方中药的功效密不可分。黄芪能够提高胸腺和脾脏内T细胞数目,提升干扰素分泌能力和免疫球蛋白水平[16]。白术可上调Th细胞数、纠正T细胞亚群紊乱,可改善机体代谢状态、增强免疫功能、抵抗应激反应等[17]。防风具有抗炎、解痉的作用,常用于治疗发热、风湿、头痛和惊厥等病症。本研究结果发现,低温模型组较对照组小鼠肺脏组织淋巴细胞中ILCs、ILC1、ILC2、ILC3比例低,IFNγ、IL-13、IL-17A mRNA表达低;玉屏风散组较低温模型组小鼠肺脏组织淋巴细胞中ILCs、ILC1、ILC2、ILC3比例高,IFNγ、IL-13、IL-17A mRNA表达高。可见,玉屏风散可逆转低温环境对肺脏ILCs及其功能因子的抑制作用,这为低温状态下呼吸系统疾病的防治提供了新的理论依据。
[1] 蔡磊,朱莹,孔永,等.温度对小鼠哮喘模型免疫细胞活化及肺组织损伤的影响[J].现代免疫学,2013,33(5):377-382.
[2] Luo B, Shi H, Wang L, et al. Rat lung response to PM2.5 exposure under different cold stresses[J]. Int J Environ Res Public Health, 2014,11(12):12915-12926.
[3] Diefenbach A, Colonna M, Koyasu S. Development, differentiation, and diversity of innate lymphoid cells[J]. Immunity, 2014,41(3):354-365.
[4] Constantinides MG, McDonald BD, Verhoef PA, et al. A committed precursor to innate lymphoid cells[J]. Nature, 2014,508(7496): 397-401.
[5] Wong SH, Walker JA, Jolin HE, et al. Transcription factor RORα is critical for nuocyte development[J]. Nat Immunol, 2011,13(3):229-236.
[6] Sonnenberg GF, Artis D. Innate lymphoid cells in the initiation, regulation and resolution of inflammation[J]. Nat Med, 2015,21(7):159-162.
[7] 李雪嫣,张李峰,桂曼曼,等.复方玉屏风散对小鼠细胞免疫力的增强作用研究[J].西部中医药,2013,(8):11-14.
[8] Gasteiger G, Rudensky AY. Interactions between innate and adaptive lymphocytes[J]. Nat Rev Immunol, 2014,14(9):631-639.
[9] Klose CS, Flach M, Mohle L, et al. Differentiation of type 1 ILCs from a common progenitor to all helper-like innate lymphoid cell lineages[J]. Cell, 2014,157(2):340-356.
[10] 黄超,田志刚.呼吸道Ⅱ型固有淋巴细胞与肺脏疾病研究进展[J].中国免疫学杂志,2015,31(4):433-439.
[11] 彭慧,田志刚.固有淋巴细胞研究进展[J].中国免疫学杂志,2015,31(2):145-150.
[12] Sonnenberg GF, Nair MG, Kirn TJ, et al. Pathological versus protective functions of IL-22 in airway inflammation are regulated by IL-17A[J]. J Exp Med, 2010,207(6):1293-1305.
[13] Donna G, Hilary B, Peter T, et al. Differential effects of temperature extremes on hospital admission rates for respiratory disease between indigenous and non-indigenous Australians in the northern territory[J]. Int J Environ Res Public Health, 2015,12(12):15352-15365.
[14] 郑康,郑光,罗丹,等.利用文本挖掘技术探索玉屏风散的用药规律[J].中华中医药学刊,2015,33(5):1131-1133.
[15] SONG Jue, LI Jun, ZHENG Shi-rui, et al. Anti-Inflammatory and Immunoregulatory Effects of Yupingfeng (玉屏风) Powder on Chronic Bronchitis Rats[J]. Chin J Integr Med, 2013,19(5):353-359.
[16] Oh HA, Choi HJ, Kim NJ, et al. Anti-stress effect of astragaloside IV in immobilized mice[J]. J Ethnopharmacol, 2014,153(3):928-932.
[17] Xu D, Li W, Huang Y, et al. The effect of selenium and polysaccharide of Atractylodes macrocephala Koidz (PAMK) on immune response in chicken spleen under heat stress[J]. Biol Trace Elem Res, 2014,160(2):232-237.
Influence of Yupingfeng powder on proportion and function of lung-resident innate lymphoid cells in mice under hypothermia
ANLei1,GUOYuqi,WANGLi,SUNXiaoyan,LYVYanmin,LANHongyun,YAOChengfang
(1JinanUniversity,ShandongAcademyofMedicalSciences,Jinan250062,China)
Objective To observe the influence of Yupingfeng powder on the proportion and function of lung-resident innate lymphoid cell subsets (ILCs) in mice under hypothermia.Methods Twenty-four C57BL/6 mice were randomly divided into three groups: the control group, the hypothermia model group, and the group of Yupingfeng powder (YPF group). The mice in the control group were not given any treatment. The mice from hypothermia model group and YPF group were both exposed to a cold condition (10℃±1℃ ) in a cryogenic vessel, 3 h/d, for 3 days. The mice of the YPF group were given YPF on day 7 before cold exposure until the end of the experiment. ILCs, and its three subsets (ILC1, ILC2, and ILC3) in lung lymphocytes were detected by flow cytometry. The expression of IFNγ, IL-13, and IL-17A was detected by RT-PCR. Results Compared with the control group, the proportions of ILCs, ILC1, ILC2, and ILC3 were lower in the hypothermia model group (allP<0.05) as well as the mRNA expression of IFNγ, IL-13, and IL-17A (allP<0.01). Compared with the hypothermia model group, the proportions of ILCs, ILC1, ILC2, and ILC3 were higher in the YPF group (allP<0.05), as well as the mRNA expression of IFNγ, IL-13, and IL-17A (allP<0.05). Conclusions Yupingfeng powder may reverse the inhibitory effect of hypothermia on ILCs and the functional factors in lung tissues.
hypothermia; innate lymphoid cells; lung; Yupingfeng powder; traditional Chinese drugs
国家自然科学基金资助项目(81573728);山东省自然科学基金资助项目(ZR2015HM007)。
安磊(1990-),男,在读硕士研究生,主要从事中医药免疫的研究。E-mail: fufu126@sina.com
姚成芳(1966-),女,博士后,研究员,硕士生导师,主要从事中医药免疫的研究。E-mail: yaocf9941@163.com
10.3969/j.issn.1002-266X.2017.22.004
R392
A
1002-266X(2017)22-0012-03
2017-02-03)
