干扰素联合恩替卡韦治疗HBeAg阳性慢性乙型肝炎的疗效及安全性分析
2017-07-05杨旭邹园涛曾妮
杨旭,邹园涛,曾妮
(1 南昌大学第四临床医学院,南昌 330031;2 南昌大学公共卫生学院)
干扰素联合恩替卡韦治疗HBeAg阳性慢性乙型肝炎的疗效及安全性分析
杨旭1,邹园涛1,曾妮2
(1 南昌大学第四临床医学院,南昌 330031;2 南昌大学公共卫生学院)
目的 比较干扰素(IFN)联合恩替卡韦(ETV)与IFN、ETV单用对HBeAg阳性慢性乙型肝炎患者的疗效和安全性。方法 计算机检索PubMed、EMbase、Cochrane Library、知网、万方、维普等数据库,收集以IFN联合ETV、IFN或ETV单独使用为主要干预措施,对HBeAg阳性的慢性乙型肝炎患者进行治疗的随机对照试验,数据资料用Review Manager5.0进行分析。结果 ①共纳入12篇随机对照试验研究,1 313例HBeAg阳性慢性乙型肝炎患者。②与单用ETV相比,IFN联合ETV治疗患者HBV DNA低于下限率在治疗后48周(RR=1.21,95%CI:1.03~1.41)增加,HBeAg转阴率在治疗后12周(RR=1.72,95%CI:1.06~2.81)、24周(RR=1.84,95%CI:1.34~2.68)和48周(RR=1.76,95%CI:1.42~2.17)增加,HBeAg转换率在治疗后24周(RR=1.62,95%CI:1.16~2.28)和48周(RR=1.82,95%CI:1.46~2.27)增加。③与单用IFN相比,IFN联合ETV治疗患者ALT复常率在治疗后12周(RR=1.47,95%CI:1.14~1.89)、24周(RR=1.74,95%CI:1.47~2.06)和48周(RR=1.37,95%CI:1.22~1.54)增加,HBV DNA低于下限率在治疗后12周(RR=2.02,95%CI:1.52~2.68)、24周(RR=1.90,95%CI:1.57~2.30)和48周(RR=1.42,95%CI:1.26~1.61)增加,HBeAg转阴率在治疗后24周(RR=1.80,95%CI:1.34~2.43)和48周(RR=1.38,95%CI:1.16~1.65)增加,HBeAg转换率在治疗后24周(RR=1.75,95%CI:1.17~2.60)和48周(RR=1.38,95%CI:1.09~1.73)增加。④IFN联合ETV治疗与单用ETV或IFN相比不良反应无统计学差异。结论 HBeAg阳性的慢性乙型肝炎患者联合使用IFN与ETV的疗效优于单用ETV或IFN,并且安全。
慢性乙型肝炎;联合治疗;干扰素;恩替卡韦;HBeAg阳性;Meta分析
慢性乙型肝炎是由乙型肝炎病毒(HBV)持续感染引起的肝脏慢性炎症性疾病,是全球性的重大公共卫生问题[1,2],且肝炎病毒引起的死亡在全球死因排名上升到第7位[3]。全球HBsAg阳性的慢性乙型肝炎携带者约有2.48亿,其中20%~30%患者会出现肝硬化、肝癌等严重的并发症,且每年超过68.6万人死于此类并发症[4,5]。目前治疗慢性乙型肝炎的主要药物有干扰素(IFN)和核苷(酸)类似物(NAs),但两类药物在临床实践中对HBeAg阳性的慢性乙型肝炎患者治疗效果仍不理想[6]。我国2015年慢性乙型肝炎防治指南显示,同步聚乙二醇干扰素(PEG-IFN)α与NAs的联合治疗方案能否提高疗效仍不明确[7]。恩替卡韦(ETV)作为一种高耐药屏障的NAs类药物,联用IFN对HBeAg阳性的慢性乙型肝炎患者疗效尚存在争议。因此本研究采用Meta分析方法综合评价IFN联合ETV对HBeAg阳性慢性乙型肝炎的疗效和安全性,以期为临床决策提供依据。
1 资料与方法
1.1 检索策略 计算机检索PubMed、EMbase、Cochrane Library、中国知网(CNKI)、万方数据知识服务平台(WanFang Data)、维普中文科技期刊数据库(VIP),检索时限均为建库起至2016年7月26日。中文检索词包括干扰素、恩替卡韦、慢性乙型肝炎、乙型肝炎、HBeAg、随机对照实验、随机;英文检索词包括interferon、entecavir、chronic hepatitis B、HBeAg positive、randomized controlled trial;并通过引文追踪法查找可能遗漏的相关文献。
1.2 纳入与排除标准 纳入标准:①随机对照试验,无论是否采用盲法;②HBeAg阳性需要治疗的慢性乙型肝炎患者;③联合组的干预措施为IFN-α注射联合ETV口服治疗,对照组为单用IFN-α或ETV治疗,联合治疗时间至少6个月;④联合组和对照组在年龄、性别、生化等方面具有均衡的可比性,治疗各组具有单一变量;⑤中英文文献。排除标准:①合并感染丙型肝炎、人类免疫缺陷病毒;②合并有失代偿期肝硬化、其他非病毒性慢性肝脏疾病、肝功能失代偿、肝移植者等;③有IFN治疗禁忌证(如总胆红素≥10×正常值上限,中性粒细胞计数<1.0×109/L,血小板计数<50×109/L,精神病史等);④伴有严重的肝肾功能障碍者、妊娠及哺乳期女性、未控制的甲状腺疾病患者、恶性肿瘤患者等;⑤6个月内接受过抗病毒、免疫调节剂治疗。
1.3 有效性、安全性评价方法 比较联合组与对照组的HBeAg转阴率和转换率、HBV DNA低于下限率、ALT复常率等进行有效性评价:比较联合组与对照组的不良反应发生率进行安全性评价。
1.4 文献筛选、资料提取及纳入研究的偏倚风险评价 两位评价员独立筛选文献、提取资料并交叉核对。文献筛选时首先阅读文题和摘要进行初筛,在排除明显不相关的文献后,进一步阅读全文进行复筛,以确定最终是否纳入。资料提取内容主要包括:①纳入研究的基本信息,包括第一作者、发表时间等;②研究对象的基线特征(各组的样本数、患者的年龄、性别等);③干预措施的治疗类型、治疗时间、随访时间等;④结局指标。本文对纳入文献的质量评价依照Cochrane Handbook for Systematic Reviews 5.1.0中推荐的随机对照试验偏倚风险方法进行[8]。
1.5 统计学方法 采用RevMan 5.0统计软件。计数资料采用相对危险度(RR)为效应指标,各效应量均给出其点估计值和95%CI,纳入研究结果间的异质性运用χ2检验(检验水准为α=0.100),同时结合I2定量判断异质性的大小。当P≥0.1时,各研究结果间无统计学异质性,则采用固定效应模型进行Meta分析;当P<0.1、I2>50%时,各研究结果间存在统计学异质性,则进一步分析异质性来源,对可能导致异质性的因素进行亚组分析,若未找到明显的临床异质性来源,则采用随机效应模型。Meta分析的检验水准为α=0.05。纳入研究数量较多时采用“倒漏斗图”评价发表偏倚。
2 结果
2.1 文献检索结果 初检共获得相关文献953篇,排除了220篇重复性文章,根据论文题目及摘要筛选得到82篇文献,通过引文追踪法新纳入1篇文献,再排除与纳入及排除标准本研究不符的文献71篇,共纳入12篇文献[9~20],其中中文9篇、英文3篇。
2.2 纳入文献的基本特征 纳入12篇文献中共有1 313例HBeAg阳性慢性乙型肝炎患者,其中接受IFN联合ETV治疗587例、ETV单药治疗475例、IFN单药治疗251例;治疗方案中采用从头联合治疗方案8篇[9,10,12~16,19]、序贯联合治疗2篇[11,17]、追加联合治疗2篇[18,20]。所有的文献显示基线特征具有可比性。
2.3 纳入研究的偏倚风险评价结果 纳入研究随机序列产生的偏倚多为不清楚,分配隐藏多为高风险,研究者和受试者施盲均不清楚,研究结局盲法评定为低风险,结局数据的完整性、报告偏倚及其他偏倚多为低风险。纳入文献的各类偏倚风险结果提示偏倚风险较低。
2.4 各组治疗有效性比较
2.4.1 ALT复常率 与单用ETV相比,ALT复常率在IFN联合ETV治疗患者治疗后12、24、48周比较差异无统计学意义,见表1。与单用IFN相比,ALT复常率在IFN联合ETV治疗患者治疗后12周(RR=1.47,95%CI:1.14~1.89)、24周(RR=1.74,95%CI:1.47~2.06)和48周(RR=1.37,95%CI:1.22~1.54)均增加,见表2。
2.4.2 HBV DNA低于下限率 与单用ETV相比,HBV DNA低于下限率在IFN联合ETV治疗患者治疗后12、24周比较差异无统计学意义,在48周(RR=1.21,95%CI:1.03~1.41)增加,见表1。与单用IFN相比,HBV DNA低于下限率在IFN联合ETV治疗患者治疗后12周(RR=2.02,95%CI:1.52~2.68)、24周(RR=1.90,95%CI:1.57~2.30)和48周(RR=1.42,95%CI:1.26~1.61)均增加,见表2。
2.4.3 HBeAg转阴率 与单用ETV相比,HBeAg转换率在IFN联合ETV治疗患者治疗后12周(RR=1.72,95%CI:1.06~2.81)、24周(RR=1.84,95%CI:1.34~2.68)和48周(RR=1.76,95%CI:1.42~2.17)增加,见表1。与单用IFN相比,HBeAg转换率在IFN联合ETV治疗患者治疗后12周比较差异无统计学意义,在24周(RR=1.80,95%CI:1.34~2.43)和48周(RR=1.38,95%CI:1.16~1.65)增加,见表2。
2.4.4 HBeAg转换率 与单用ETV相比,HBeAg转换率在IFN联合ETV治疗患者治疗后12周比较差异无统计学意义,在24周(RR=1.62,95%CI:1.16~2.28)和48周(RR=1.82,95%CI:1.46~2.27)增加,见表1。与单用IFN相比,HBeAg转换率在IFN联合ETV治疗患者治疗后12周比较差异无统计学意义,在24周(RR=1.75,95%CI:1.17~2.60)和48周(RR=1.38,95%CI:1.09~1.73)增加,见表2。
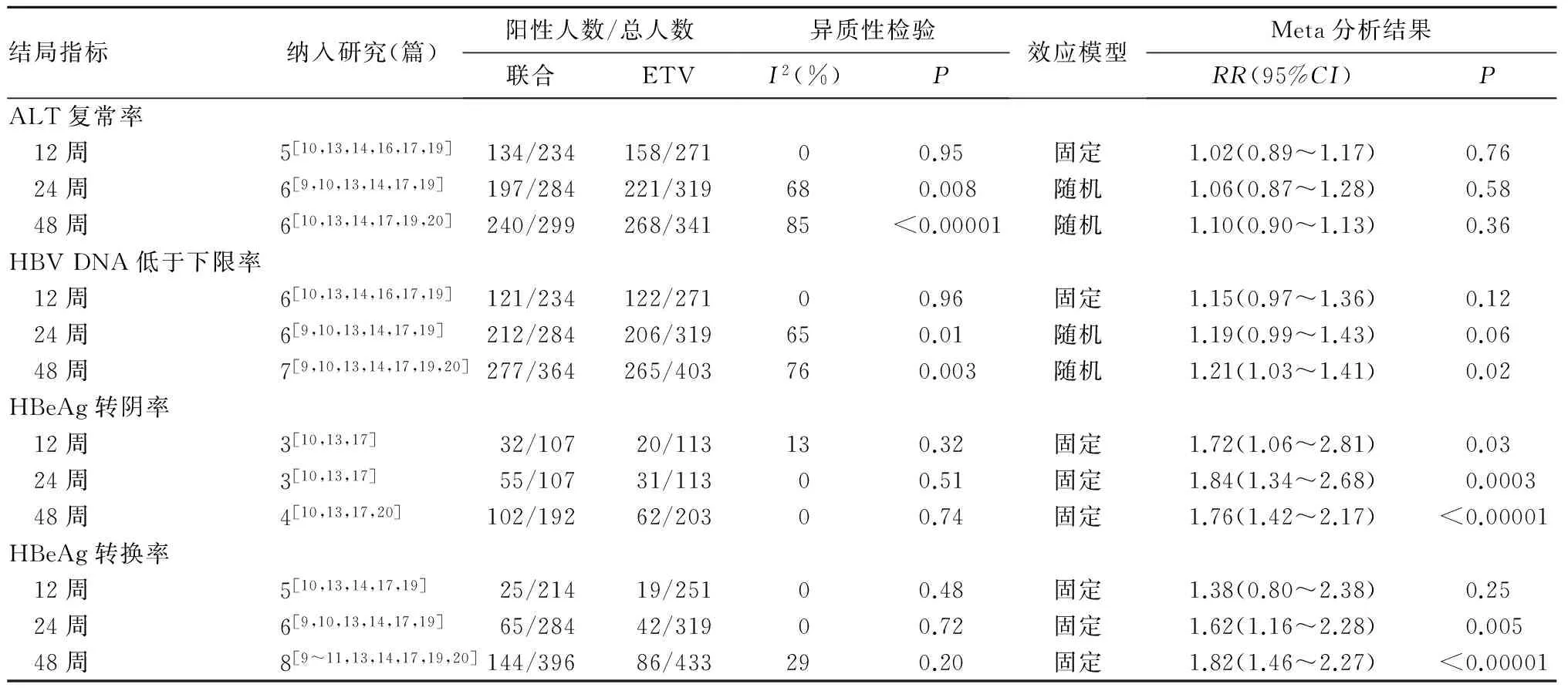
表1 ETV联合IFN与单用ETV治疗HBeAg阳性慢性乙型肝炎的疗效比较
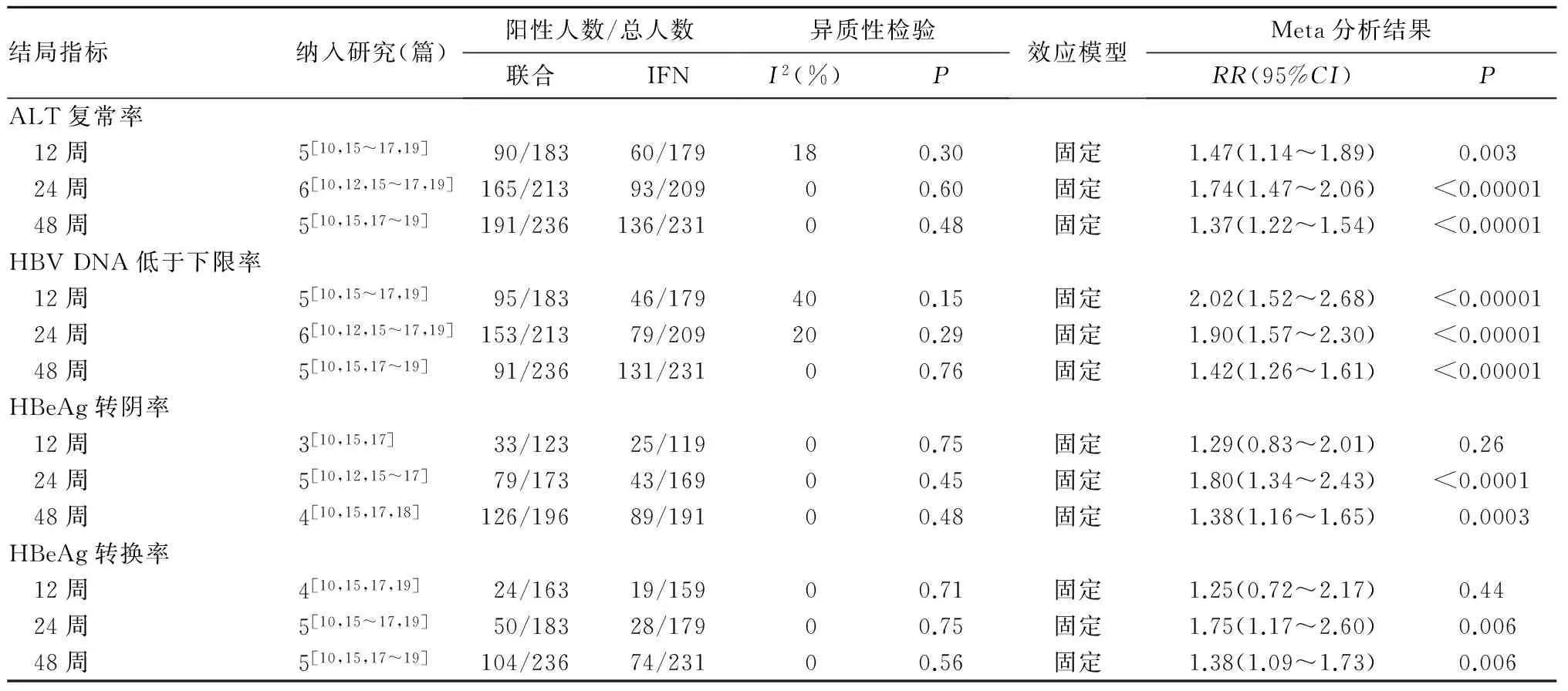
表2 ETV联合IFN与单用IFN治疗HBeAg阳性慢性乙型肝炎的疗效比较
2.5 各组不良反应比较 共9篇文献[9,10,13~16,18~20]报告了不良反应,包括发热、全身疼痛、皮肤瘙痒、白细胞减少、血小板降低等,此类症状经对症治疗后大多消失,未对慢性乙型肝炎的治疗产生影响。其中,7篇文献[9,13~16,18,19]表明组间不良反应比较无统计学差异,有2篇文献[10,20]表明组间不良反应比较差异有统计学意义,但严重不良反应比较无统计学差异或都经对症治疗后好转。
2.6 发表偏倚 用以ETV为对照组的8篇文献[9~11,13,14,17,19,20]联合治疗48周的HBeAg转换率来评价联合治疗的文献的发表偏倚,图示研究位点呈左右对称排列,多分布在虚线两侧,且多向上方和中部集中,仅有1篇文献[11]落在中下部,提示文献发表性偏倚风险较小。用以IFN为对照组的5篇文献[10,15,17~19]联合治疗48周的HBeAg转换率来评价发表偏倚,结果显示发表性偏倚风险亦较小。
3 讨论
HBeAg阳性的慢性乙型肝炎患者有着高的HBV DNA载量和HBeAg阳性状态,这两种状态均能增加肝癌的发生的风险[21,22]。一般认为乙肝“病毒治愈”的概率较小,而“临床治愈”成为治疗的最终目标。HBsAg转换就被认为乙肝被“临床治愈”,HBsAg清除被认为是接近乙肝“临床治愈”的标志,而HBeAg转换是HBsAg清除的重要必备条件,故降低HBV DNA载量、HBeAg状态的转换对HBeAg阳性的慢性乙型肝炎患者具有重要的意义[23]。
在HBeAg阳性慢性乙型肝炎患者治疗中,单用PEG-IFNα-2a治疗48周后实现31%的HBeAg转换率[24];而单用ETV 48周后,67%的患者实现了HBV DNA低于下限率,21%实现HBeAg转换[25]。在本次Meta分析中,联合治疗48周HBeAg转换率和HBV DNA低于下限率39.2%和61.3%,较单用ETV组和IFN组均有提高。
近期的随机对照试验研究发现,PEG-IFNα-2a联合NAs在HBeAg阴性且持续HBV DNA低于下限的慢性乙型肝炎患者与单用NAs对比并不能显著提高HBsAg清除率[26];而PEG-IFNα-2a联合替诺福韦(TDF)治疗慢性乙型肝炎患者,与PEG-IFN或TDF单药治疗相比均有更好的HBsAg转阴率,尤其是在基因型是A型或HBeAg阳性的患者中[27]。一项回顾性研究发现ETV序贯联合PEG-IFN治疗在满足HBeAg<200 S/CO、HBsAg<1 000 IU/mL和12周HBsAg水平下降>0.5 log10IU/mL的这类HBeAg阳性慢性乙型肝炎患者能取得良好的应答[28]。提示联合IFN和NAs类药物在某些经过选择的HBeAg阳性的慢性乙型肝炎患者效果可能最佳。
针对本次Meta分析结果,与单用ETV相比,联合IFN用药能显著增加HBeAg应答、HBV DNA应答,但对ALT应答无显著差异,随着时间的延长,效益值(即RR值)有递增的趋势。这提示在以ETV为基础的联合IFN治疗的疗程越长,获益可能越多。IFN通过免疫调节和抗病毒作用等机制来治疗慢性乙型肝炎[2]。慢性乙型肝炎患者通常显示低效或无效的病毒特异性T细胞应答活性[29],而基于PEG-IFN的联合治疗能诱导HBV特异性T细胞的恢复[30],还能影响记忆T细胞的数量和质量[31]。本研究分析得出,联合治疗效益值随时间变化趋势,可能与IFN随着联合治疗的时间增加效益亦随之增加有关[32],也有可能与联合治疗的方式不同有关。
与单用IFN相比,联合ETV用药能显著提高HBeAg应答、HBV DNA应答、ALT应答,随着时间的延长,联合治疗的RR值有先增加后降低的趋势,在24周时效益值普遍最大。这提示以IFN为基础的联合ETV的治疗在疗程前期获益明显,后期获益有下降的趋势。ETV能通过显著抑制逆转录中前基因组RNA(pgRNA)逆转录到HBV DNA从而降低HBV DNA载量,抑制病毒的复制[2],故能显著提高HBeAg应答、HBV DNA应答、ALT应答。除了直接抑制逆转录,深入研究还发现ETV亦能通过调节Tregs细胞和细胞因子等来调节自身免疫系统,改善机体对HBV的免疫应答[33]。本研究分析得出联合治疗在疗程前期获益明显,后期获益有下降的趋势,这可能与ETV等NAs药物HBeAg的应答率较低相关[34],也可能与联合治疗后期和治疗后疗效维持不佳有关[18],也有可能与联合治疗的方式不同有关。
本研究也存在一些不足之处:①纳入研究的结局指标不一,如对HBsAg结果的观察多未出现,HBV DNA低于下限的指标标准不同;②治疗时间不一,且多数研究未进行随访;③联合用药方案、时间和剂量也存在差别,如IFN的剂量和类型不完全统一;④HBV基因型、cccDNA、肝组织学多未测;⑤纳入文献亦存在一定的偏倚风险,尤其是在分配隐藏和盲法上;⑥因纳入的研究仍较少,亦无法按照IFN种类、联合治疗方案、高病毒载量与否等进行亚组分析。
综上所述,HBeAg阳性的慢性乙型肝炎患者联合使用IFN与ETV的疗效优于单用ETV或IFN,并且是安全的。受纳入研究的质量和数量所限,本研究结论(尤其是长期疗效)尚需开展更多高质量、大规模、长时间、多中心随机对照试验研究予以验证。
[1] WHO Guidelines Approved by the Guidelines Review Committee. Guidelines for the prevention, care and treatment of persons with chronic hepatitis B infection[M]. Geneva: World Health Organization, 2015:45-61.
[2] Trépo C, Chan HL, Lok A. Hepatitis B virus infection[J]. Lancet, 2014,384(9959):2053-2063.
[3] Stanaway JD, Shepard DS, Undurraga EA, et al. The global burden of dengue: an analysis from the Global Burden of Disease Study 2013[J]. Lancet Infect Dis, 2016,16(6):712-723.
[4] Schweitzer A, Horn J, Mikolajczyk RT, et al. Estimations of worldwide prevalence of chronic hepatitis B virus infection: a systematic review of data published between 1965 and 2013[J]. Lancet, 2015,386(10003):1546-1555.
[5] Van Damme P. Long-term Protection After Hepatitis B Vaccine[J]. J Infect Dis, 2016,214(1):1-3.
[6] Lampertico P, Maini M, Papatheodoridis G. Optimal management of hepatitis B virus infection-EASL Special Conference[J]. J Hepatol, 2015,63(5):1238-1253.
[7] 中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2015更新版)[J].中华肝脏病杂志,2015,23(12):888-905.
[8] Higgins JP, Altman DG, Gotzsche PC, et al. The Cochrane Collaboration′s tool for assessing risk of bias in randomised trials[J]. BMJ, 2011,343:d5928.
[9] Liu CJ, Wang CC, Yang SS, et al. 758 entecavir plus peginterferon alfa-2a vs. entecavir alone in thetreatment of hepatttis B e antigen-positive chronic hepatttis B: an interim report[J]. J Hepatol, 2013,58:S308.
[10] 李晶.α-干扰素联合恩替卡韦治疗慢性乙型肝炎早期疗效[J].肝脏,2012,17(10):714-716.
[11] 徐敏.临床观察恩替卡韦序贯聚乙二醇干扰素α-2a治疗HBeAg阳性慢性乙型肝炎的疗效[J].山西职工医学院学报,2016,26(1):36-38.
[12] 赵春红,程开.恩替卡韦联合干扰素治疗乙型肝炎患者的临床疗效观察[J].齐齐哈尔医学院学报,2015,32(15):2214-2215.
[13] 陈炎生,费新应,刘文涛,等.干扰素α-1b联合恩替卡韦治疗HBeAg阳性慢性乙型肝炎33例48周疗效观察[J].临床内科杂志,2013,30(1):42-43.
[14] 任成俭,熊燕飞.聚乙二醇干扰素α-2a联合恩替卡韦治疗HBeAg阳性慢性乙型肝炎的临床研究[J].医学理论与实践,2016,29(2):154-155.
[15] 丁艾昆,郭利伟,欧阳瑞春,等.聚乙二醇干扰素α-2a联合核苷(酸)类似物治疗HBeAg阳性慢性乙型肝炎的疗效观察[J].中国病原生物学杂志,2015,10(3):272-276.
[16] 曾文,袁静,刘映霞,等.聚乙二醇干扰素alpha-2a联合恩替卡韦治疗高病毒载量HBeAg阳性慢性乙型肝炎的临床研究[J].中华实验和临床病毒学杂志,2013,27(2):115-118.
[17] 张志敏,季宝玉,李琳.恩替卡韦联合α-2b干扰素治疗慢性乙型肝炎的疗效观察[J].蚌埠医学院学报,2014,39(5):621-623.
[18] Xie Q, Zhou H, Bai X, et al. A randomized, open-label clinical study of combined pegylated Interferon Alfa-2a (40KD) and Entecavir treatment for Hepatitis B "e" Antigen-Positive Chronic Hepatitis B[J]. Clin Infect Dis, 2014,59(12):1714-1723.
[19] 李健.聚乙二醇干扰素联合恩替卡韦治疗HBeAg阳性慢性乙型肝炎患者的临床观察[D].石家庄:河北医科大学,2015.
[20] Brouwer WP, Xie Q, Sonneveld MJ, et al. Adding peginterferon to entecavir for HBeAg-positive chronic hepatitis B: A multicentre randomized trial (ARES study)[J]. Hepatology, 2014,61(5):1512-1522.
[21] Yang HI, Lu SN, Liaw YF, et al. Hepatitis B e antigen and the risk of hepatocellular carcinoma[J]. N Engl J Med, 2002,347(3):168-174.
[22] Chen CJ, Yang HI, Su J, et al. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level[J]. JAMA, 2006,295(1):65-73.
[23] Liaw YF, Lau GK, Kao JH, et al. Hepatitis B e antigen seroconversion: a critical event in chronic hepatitis B virus infection[J]. Dig Dis Sci, 2010,55(10):2727-2734.
[24] Piratvisuth T, Lau G, Chao YC, et al. Sustained response to peginterferon alfa-2a (40 kD) with or without lamivudine in Asian patients with HBeAg-positive and HBeAg-negative chronic hepatitis B[J]. Hepatol Int, 2008,2(1):102-110.
[25] Chang TT, Gish RG, de Man R, et al. A comparison of entecavir and lamivudine for HBeAg-positive chronic hepatitis B[J]. N Engl J Med, 2006,354(10):1001-1010.
[26] Bourlière M, Rabiega P, Ganne-Carrie N, et al. Effect on HBs antigen clearance of addition of pegylated interferon alfa-2a to nucleos(t)ide analogue therapy versus nucleos(t)ide analogue therapy alone in patients with HBe antigen-negative chronic hepatitis B and sustained undetectable plasma hepatitis B virus DNA: a randomised, controlled, open-label trial[J]. Lancet Gastroenterol Hepatol, 2017,2(3):177-188.
[27] Marcellin P, Ahn SH, Ma X, et al. Combination of tenofovir disoproxil fumarate and peginterferon α-2a increases loss of hepatitis B surface antigen in patients with chronic hepatitis B[J]. Gastroenterology, 2016,150(1):134-144. e10.
[28] Li GJ, Yu YQ, Chen SL, et al. Sequential combination therapy with pegylated interferon leads to loss of hepatitis B surface antigen and hepatitis B e antigen (HBeAg) seroconversion in HBeAg-positive chronic hepatitis B patients receiving long-term entecavir treatment[J]. Antimicrob Agents Chemother, 2015,59(7):4121-4128.
[29] Ye B, Liu X, Li X, et al. T-cell exhaustion in chronic hepatitis B infection: current knowledge and clinical significance[J]. Cell Death Dis, 2015,6:e1694.
[30] de Niet A, Stelma F, Jansen L, et al. Restoration of T cell function in chronic hepatitis B patients upon treatment with interferon based combination therapy[J]. J Hepatol, 2016,64(3):539-546.
[31] Sun B, Wang Y, Meng Q, et al. Dynamics of memory T cells during treatment with interferon-alpha in patients with chronic hepatitis B[J]. Hepatol Res, 2010,40(8):806-812.
[32] Liaw YF, Jia JD, Chan HL, et al. Shorter durations and lower doses of peginterferon alfa-2a are associated with inferior hepatitis B e antigen seroconversion rates in hepatitis B virus genotypes B or C[J]. Hepatology, 2011,54(5):1591-1599.
[33] Jiang Y, Li W, Yu L, et al. Enhancing the antihepatitis B virus immune response by adefovir dipivoxil and entecavir therapies[J]. Cell Mol Immunol, 2011,8(1):75-82.
[34] Buti M. HBeAg-positive chronic hepatitis B: Why do I treat my patients with Nucleos (t) ide Analogs[J]. Liver Int, 2014,34(Suppl 1):108-111.
本刊2017年57卷18期第109页发表的“哈蟆油抗衰老机制的研究进展”,作者单位为“1广州军区广州总医院,广州510010;2广东药科大学中药学院;3广东省第二人民医院”。
本刊编辑部
曾妮(E-mail: miracle_625@163.com)
10.3969/j.issn.1002-266X.2017.22.026
R512.6
B
1002-266X(2017)22-0068-05
2016-12-29)
