响应面法优化苋红素提取工艺及其抗氧化性
2017-07-05,,,,,,
,, ,,, ,
(宁波大学食品科学与工程系,浙江宁波 315211)
响应面法优化苋红素提取工艺及其抗氧化性
熊茜,王春幸,孙朦,王凯凯,宋佳敏,许凤*,王鸿飞
(宁波大学食品科学与工程系,浙江宁波 315211)

彩苋,苋红素,响应面优化法,抗氧化性
苋菜又名米苋、赤苋、彩苋、青香苋、雁来红等,系苋科苋属一年生植物苋的茎叶。苋菜按其颜色分为红苋、绿苋和彩苋三种,在我国南北各地均有栽培,是夏季的主要蔬菜之一[1]。随着人们消费观念的变化,在满足蔬菜产品数量的同时,开始追求产品的内在营养、保健食疗价值,要求无污染、食用安全、方便等[2]。苋菜营养丰富,是一种十分优良的菜、粮、药兼用作物。现代医学和营养学研究表明,苋菜含有矿物质元素锌、钙、钾、钠等;维生素C、维生素E和维生素K以及18种氨基酸等,其中包括人体必需的8种氨基酸[3-4]。
苋菜中所含的苋红素是一种易溶于水的含氮有机物[5],它不同于花青素,属于甜菜素类中甜菜红素亚型的生物色素[6]。苋红素色泽鲜艳,安全无毒,是天然的食用色素,具有预防心血管疾病和某些癌症、保护视力、抗氧化、抗衰老、抗溃疡、抗炎等生理和药理作用[7-8]。目前,合成色素苋菜红广泛用于食品、饮料、药品、化妆品、烟草、饲料、食品包装材料等的着色[9],以天然苋红素取代合成色素,因其更符合现代消费者的消费需求,并具有广阔的市场前景。刘德良[10]以2%盐酸作为提取溶剂提取红苋草中的苋红素,廖芙蓉[11]等以籽粒苋花穗为原料,采用超声波辅助提取法,以10%乙醇作为溶剂提取其色素。
生物体内自由基种类繁多,以活性氧为主。活性氧自由基(Reactive Oxygen Species,ROS)会导致蛋白质损伤、酶失活、膜脂过氧化等,从而引起机体衰老,诱发肿瘤等恶性疾病。寻找适当的外源性抗氧化剂,清除体内的自由基,对保持自由基稳衡性动态,治疗疾病和保护人体健康很有益处。有研究表明,野苋菜具有潜在的抗氧化活性[12-15]。本文以市售蔬菜彩苋为原料,采用响应面法优化苋红素的提取工艺,并在前人研究的基础上,对其抗氧化性开展进一步的研究,为天然苋红素的充分利用提供理论依据。
1 材料与方法
1.1材料与仪器
彩苋 购于宁波庄市菜市场,选取新鲜、无病虫害的叶片进行实验;乙醇、盐酸等 均为分析纯;甜菜苷红色素标准品(纯度 ≥ 99%)、2,4,6-三吡啶基三嗪(TPTZ)、硫酸亚铁、1,1-二硝基苦基苯肼(DPPH)、邻菲罗啉、邻苯三酚 国药集团化学试剂有限公司。
754型紫外分光光度计 上海美谱达科技有限公司;GL-16G-Ⅱ型离心机 湖南长沙湘仪离心机仪器有限公司;水浴锅、烘箱 上海精宏实验设备有限公司;PHS-3C型pH计 上海仪电科学仪器股份有限公司。
1.2实验方法
1.2.1 原料制备 将买来的彩苋去根,保留地上的部分,洗净,沥干表面水分后,50 ℃烘干,粉碎后过60目筛,保存于干燥避光处备用[16]。精确称取1.0 g干燥的苋菜粉于烧杯中,加入蒸馏水40 mL,置于30 ℃的水浴锅中浸提1 h后对其进行抽滤,得到的滤液即为苋红素提取液。
1.2.2 确定最大吸收波长 将提取出的苋红素滤液用蒸馏水定容至100 mL,倒入光径1 cm的比色皿中,用可见分光光度计在400~700 nm的波长下进行波长扫描,确定其最大吸收光谱[17]。
1.2.3 苋红素标准曲线的测定及得率的计算方法 称取甜菜苷红色素标准样品0.2000 g,用水溶解定容至1000 mL,摇匀得浓度为0.20 mg/mL的苋红素标准储备液,加水配制成浓度分别为0、4、8、12、16、20 μg/mL的溶液,于最大吸收波长处测定其吸光度值。以溶液浓度为横坐标,吸光度值为纵坐标,绘制甜菜苷红色素的标准曲线图[18]。苋红素标准曲线为Y=0.0103X-0.0011,R2=0.9996。
苋红素得率(%)=苋红素含量/苋菜粉的质量×100
式(1)
其中,苋红素含量根据苋红素标准曲线计算得到。
1.2.4 提取溶剂种类对苋红素提取效果的影响 在提取温度为40 ℃,提取时间为30 min,料液比为1∶30的条件下,分别采用水、无水乙醇、50%乙醇、pH 6.0磷酸氢二钠-柠檬酸缓冲液、2%盐酸作为提取剂进行提取。考察不同溶剂对苋红素提取效果的影响,从而确定最合适的提取剂。
1.2.5 苋红素提取的单因素实验条件优化 实验选择料液比、提取时间、提取温度作为苋红素提取效果的主要影响因素,以苋红素得率为考察指标,进行单因素实验。
准确称取6份1 g干燥的苋菜粉,分别加入10、20、30、40、50、60 mL提取剂进行提取,在40 ℃水浴锅中放置30 min后抽滤,取一定量滤液高速(10000 r/min)冷冻离心10 min,得到的上清液用水稀释后于538 nm处测定吸光度值。
准确称取6份1 g苋菜粉,加入40 mL提取剂进行提取,在温度为40 ℃的水浴锅中分别放置10、30、50、70、90、110 min后,进行以上相同的处理,于538 nm处测定吸光度值。
准确称取6份1 g苋菜粉,加入40 mL提取剂进行提取,分别在温度为20、30、40、50、60、70 ℃的水浴锅中浸提50 min后,进行以上相同的处理,于538 nm处测定吸光度值。
1.2.6 响应面法优化苋红素提取工艺 根据单因素实验结果,以提取时间(A)、提取温度(B)、料液比(C)为实验因素,以苋红素得率作为响应值,进行Box-Benhnken实验设计,实验因素水平及编码见表1。

表1 Box-Benhnken响应面优化实验因素水平表Table 1 The factors and levels table of Box-Benhnken experiment
1.2.7 苋红素抗氧化性的研究
1.2.7.1 苋红素总抗氧化能力的测定 本实验参照[19-20]的方法,采用FRAP法对苋红素的总抗氧化能力进行测定。
还原力标准曲线的绘制:分别取 0.01、0.02、0.04、0.06、0.08、0.1 mmol/L的FeSO4溶液3 mL,加入3 mL FRAP工作液,混匀后于37 ℃反应10 min,于593 nm处测定吸光度值。以FeSO4溶液的浓度为横坐标,吸光度值为纵坐标绘制标准曲线。
样品总抗氧化能力的测定:在最优条件下提取出苋红素溶液,并将其稀释成浓度分别为0.07、0.08、0.09、0.10、0.12、0.15、0.20 mg/g的待测液,同时配制相同浓度VC溶液作为对照,按照绘制标准曲线的方法测定吸光度值,抗氧化化活性以相同吸光度值的FeSO4溶液来表示。
1.2.7.2 苋红素清除DPPH自由基能力的测定 苋红素清除DPPH自由基能力的测定方法参照董迪迪等[21]的方法有所改动。将提取出的苋红素稀释成浓度分别为0.10、0.14、0.18、0.27、0.34、0.45、0.55、0.68 mg/g的溶液(同时配制相同浓度的VC溶液)。向试管中加入样品液1 mL及0.02 mmol/L DPPH溶液2 mL,混合均匀后于暗处静置30 min,乙醇做参比,在517 nm处测定吸光度值A2;同样的操作,用等体积的蒸馏水代替样品液,测定吸光度值A0;不加DPPH,用等体积乙醇代替,分别加入1 mL不同浓度的样品液,同法操作测定吸光度值A1,按以下公式计算清除率:
式(2)
1.2.7.3 苋红素清除羟基自由基能力的测定 本实验采用Feton法中的分光光度法测定苋红素清除羟基自由基的能力[17]。将提取出的苋红素稀释成浓度分别为0.01、0.03、0.05、0.07、0.09、0.10 mg/g的溶液(同时配制相同浓度的VC溶液)。试管中依次加入2 mL pH7.4 PBS缓冲液、1 mL 0.75 mmol/L邻菲罗啉溶液、1 mL 0.75 mmol/L FeSO4溶液、1.5 mL样品液、0.5 mL 0.01%双氧水,混合均匀后于536 nm测定吸光度值A2;用等体积的蒸馏水代替样品液和双氧水,相同的方法测定吸光度值A0;不加样品液,用等体积的蒸馏水代替,测定吸光度值A1,按以下公式计算清除率:
式(3)
1.2.7.4 苋红素清除超氧阴离子自由基能力的测定 本实验采用邻苯三酚的自氧化作用建立超氧阴离子体系。
邻苯三酚自氧化速率的测定[22]:在试管中加入4.5 mL 50 mmol/L Tris-HCl缓冲液(pH8.2,在37 ℃水浴锅中预热20 min)和4 mL蒸馏水,混匀后于37 ℃水浴锅中保温20 min后取出,立即加入0.5 mL已在37 ℃条件下预热的3 mmol/L邻苯三酚溶液,反应1 min后,迅速倒入比色皿中,以10 mmol/L HCl溶液配制空白管作为对照,325 nm处每隔30 s测其吸光度。以时间为横坐标,吸光度值为纵坐标线性回归,其斜率为邻苯三酚自氧化的反应速率(V0)。
样品清除超氧阴离子自由基能力的测定[23]:将提取出的苋红素稀释成不同浓度分别为0.14、0.17、0.20、0.35、0.5、0.7 mg/g的溶液(同时配制相同浓度的VC溶液),按上述步骤,在加入邻苯三酚之前加入4 mL不同浓度的待测液代替蒸馏水。于325 nm处每隔30 s测定吸光度值,按相同的方法线性回归,曲线斜率记为V1。按以下公式计算抑制率:
式(4)
1.3数据处理
样品取样3次,进行实验。数据均取3次重复的平均值,采用IBM SPSS V 19.0软件分析实验数据,平均值的差异性用单因素方差分析(one-way ANOVA)中的Duncan’s检验,p<0.05为有统计学差异。使用Origin 8.0软件作图。
2 结果与分析
2.1提取溶剂种类对苋红素提取效果的影响
图1反映了不同提取溶剂对苋红素得率的影响,从图中可以看出,5种提取剂对苋红素得率依次为:50%乙醇>水>pH 6.0缓冲液>无水乙醇>2%盐酸。但由于苋菜叶片中的叶绿素能够溶于50%的乙醇中,而且叶绿素a的最大吸收光的波长在420~663 nm,叶绿素b的最大吸收波长范围在460~645 nm[24],会对苋红素的测定产生一定影响,综合考虑,选择水作为苋红素的提取剂。

图1 不同提取剂对苋红素提取效果的影响Fig.1 Effect of different solvent on extraction of amaranthin注:不同字母表示差异性显著。
2.2单因素实验条件优化
2.2.1 料液比对苋红素提取效果的影响 由图2可知,增加料液比可以显著提高苋红素得率,提高提取效果,当料液比达到1∶40时,苋红素已基本溶出,继续增大料液比,不但会增加溶剂的用量,而且会增大去除溶剂所需负荷,因此,从苋红素得率和节约成本两方面考虑,确定料液比为1∶40。

图2 不同料液比对苋红素提取效果的影响Fig.2 Effect of different solid-liquid ratio on extraction of amaranthin
2.2.2 提取时间对苋红素提取效果的影响 由图3可以看出,随着提取时间的延长,苋红素得率逐渐增多,在50 min时达到峰值,超过50 min后,苋红素得率开始下降,可能是因为部分色素在提取的过程中被分解,因此,苋红素得率的提取时间应控制在50 min左右为宜。

图3 不同提取时间对苋红素提取效果的影响Fig.3 Effect of different time on extraction of amaranthin
2.2.3 提取温度对苋红素提取效果的影响 图4反映出提取温度对苋红素得率的影响,当温度低于30 ℃时,苋红素得率随提取温度的升高而平缓增大,但当温度超过30 ℃时,随温度的升高苋红素得率呈下降的趋势,温度超过50 ℃时,由于色素热稳定性较差,在高温下产生分解而导致苋红素得率急剧下降。因此,苋红素的提取温度宜控制在30 ℃以下。
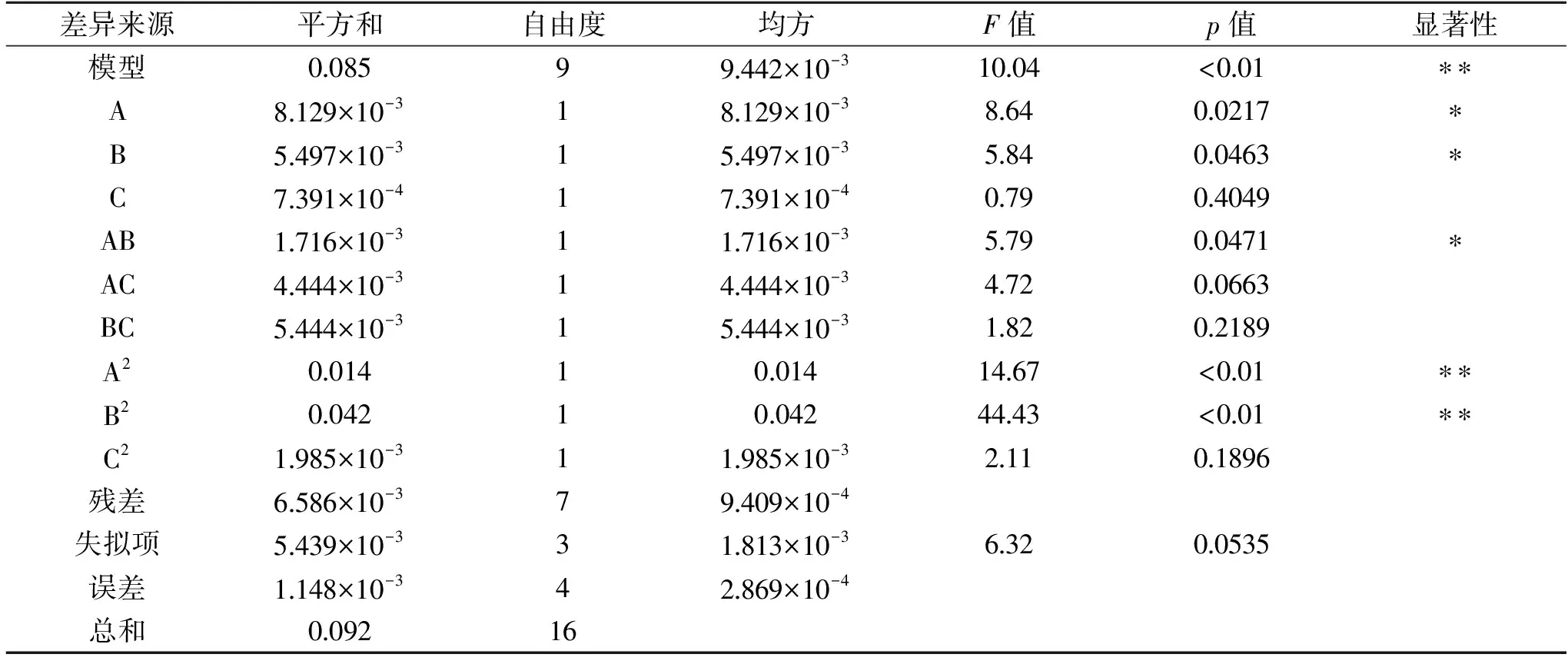
表3 回归模型的方差及显著性分析Table 3 Regression model of variance and significant analysis

图4 不同提取温度对苋红素提取效果的影响Fig.4 Effect of different temperature on extraction of amaranthin
注:*:差异显著,p<0.05;**:差异极显著,p<0.01。2.3响应面法优化苋红素得率提取工艺
2.3.1 响应面分析优化实验 表2中实验共17组,其中12组为析因实验,其余5组为中心实验,用于实验误差的估计,采用Design Expert软件对实验数据进行回归分析,得到苋红素得率关于提取时间(A),提取温度(B)和料液比(C)等因素的二次多项回归方程:
苋红素得率Y=-0.32871+0.073608A+0.087521B+0.011324C-2.0712×10-4AB-3.3333×10-4AC-3.68933×10-4BC-5.72493×10-4A2-9.96441×10-4B2+2.17149×10-4C2
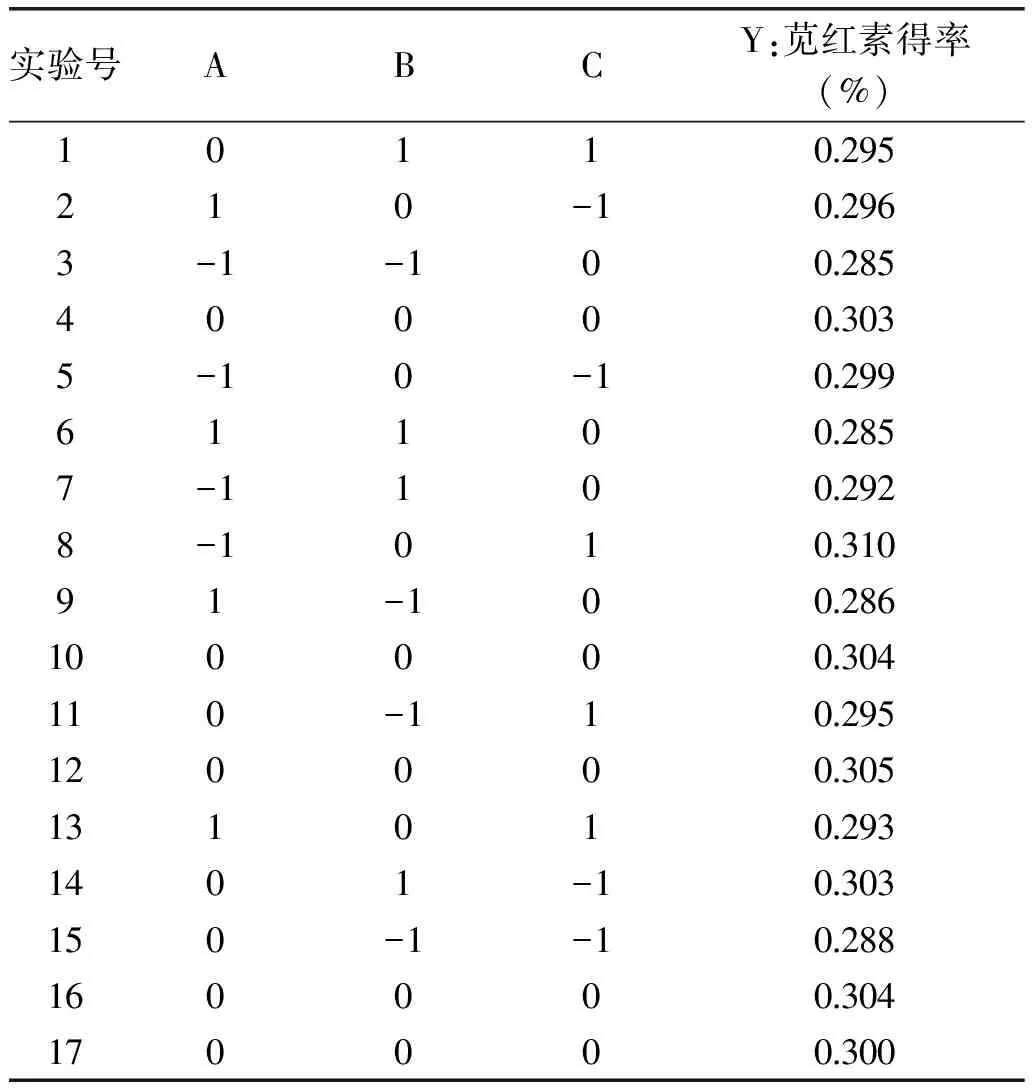
表2 响应面优化实验设计及实验结果Table 2 Experimental design and results of optimizing test with response surface method

2.3.3 响应面的曲面分析 将提取时间,提取温度、料液比3个参数分别固定,苋红素得率随其余两个参数变化趋势如图5~图7所示。响应面中等高图直观地反映出各因素交互作用对响应值的影响,圆形表示二因素交互作用不显著,椭圆表示二因素交互作用显著[25]。

图5 提取时间和提取温度的响应曲面图Fig.5 Response surface plot of extraction time and extraction temperature

图6 提取时间和料液比的响应曲面图 Fig.6 Response surface plot of extraction time and solid-liquid ratio
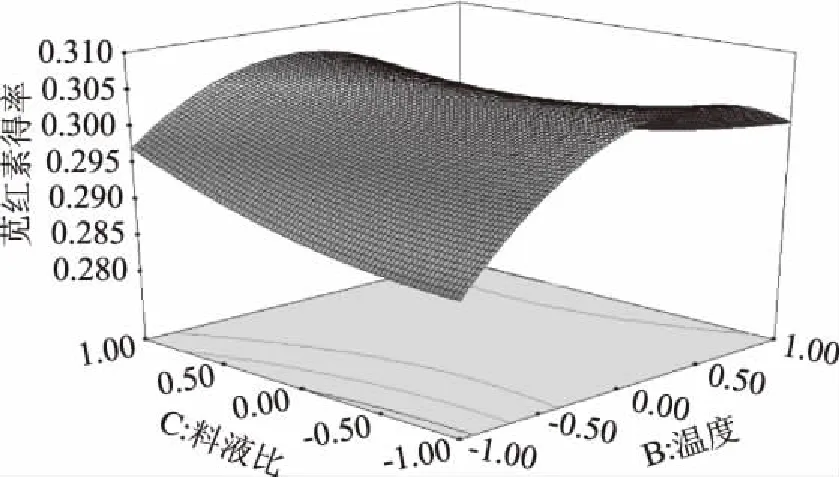
图7 提取温度和料液比的响应曲面图Fig.7 Response surface plot of extraction temperature and solid-liquid ratio
提取温度和提取时间对提取出的苋红素得率呈近似椭圆形(图5),说明两者之间有交互作用,当提取时间一定时,苋红素得率随提取温度的升高呈现先增加后减小的趋势,在温度为30~35 ℃的范围内苋红素得率较好。当提取温度一定时,提取出的苋红素的量随提取时间的变化较小。而从图6、图7中的等高线可以看出,提取时间和料液比之间或者提取温度和料液比之间交互作用较小,可能是料液比在该实验范围内对苋红素得率影响较小。
通过回归模型的分析,可以确定苋红素得率的最佳工艺条件为提取温度为30.06 ℃、提取时间为44.34 min、料液比为1∶50。在此条件下,模型预测提取出的苋红素得率为3.08 mg/g。为方便实际操作,将工艺条件修正为温度为30 ℃、时间为44 min、料液比为1∶50。为检验该响应面优化方法的可靠性,采用上述最佳条件测定苋红素得率,实际得到的苋红素得率为3.05 mg/g,与理论预测值相比误差为0.98%。因此,采用响应面优化苋红素得率的工艺条件阐述准确可靠,具有实用价值。
2.4苋红素抗氧化性研究
苋菜中苋红素的抗氧化性研究结果如图8所示。由图8(A)可知,苋红素和VC都具有较好的抗氧化能力,并且随着浓度的增加,抗氧化能力越来越强,当浓度高于0.15 mg/g时,两者的抗氧化能力都趋于平衡,随浓度变化不大。在实验浓度范围内苋红素的抗氧化能力均高于VC。结合总抗氧化能力标准曲线可以得出0.15 mg/g苋红素溶液的抗氧化能力相当于0.09 mmol/L FeSO4,而相同浓度的VC溶液则相当于0.07 mmol/L FeSO4溶液。
图8(B)反映出苋红素对DPPH自由基的清除能力。在0.1~0.55 mg/g的范围内,苋红素对DPPH自由基的清除能力随其浓度的增加而增强,超过0.55 mg/g后,清除能力随浓度变化不大。而VC作为对照,在其浓度介于0.1~0.45 mg/g时,其清除能力显著低于(p<0.05)苋红素,继续提高其浓度,两者清除效果相当且变化不大。DPPH自由基清除力的大小通常用半清除率(IC50)表示,IC50是当清除率达到50%时所需要的抗氧剂浓度[22]。因此,根据清除率拟合曲线得到苋红素和VC的IC50分别为0.18 mg/g和0.40 mg/g。
苋红素对羟基自由基的清除作用如图8(C)所示。苋红素和VC都具有良好的清除羟基自由基的能力,在低浓度时,VC对羟基自由基的清除效果要优于苋红素,随着浓度的增加,当浓度大于0.06 mg/g时,苋红素的清除能力反而高于VC,但二者的清除率都趋于平衡,随浓度的增加变化不大,与郝秀梅[26]等研究结果一致。根据清除率拟合曲线得到苋红素和VC的IC50分别为0.06 mg/g和0.11 mg/g。
与王宁[27]等研究结果相似,在浓度低于0.6 mg/g时,苋红素对超氧阴离子自由基的清除作用强于VC,且随着浓度的增加,清除率也随之增大。当浓度高于0.6 mg/g时,VC的清除能力超过苋红素(图8D)。根据清除率拟合曲线得到苋红素和VC的IC50分别为0.35 mg/g和0.48 mg/g。

图8 苋红素抗氧化性研究结果Fig.8 Results of study of amaranthin antioxidant注:A:总抗氧化能力;B:DPPH自由基清除率;C:羟基自由基清除率;D:超氧阴离子自由基清除率; “**”和“*”分别表示相同浓度的VC与苋红素溶液的抗氧化性在 0.01水平(双侧)和0.05水平(双侧)上显著相关。
3 结论
利用响应面优化法得到提取苋菜中苋红素的最佳工艺条件为H2O作为提取剂、提取时间为44 min、提取温度为30 ℃、料液比为1∶50。影响提取最显著的因素是提取温度,其次是提取时间,最后是料液比。在此最优条件下,苋红素得率为0.305%。苋红素具有较好的抗氧化能力,其对DPPH自由基的清除率及总抗氧化能力均优于相同浓度的VC溶液,对羟基自由基以及超氧阴离子自由基的清除率也与VC相差不大。研究得出,0.15 mg/g苋红素提取液的总抗氧化能力相当于0.09 mmol/L FeSO4,对DPPH自由基、羟基自由基、超氧阴离子自由基的IC50分别为0.18、0.06和0. 35 mg/g。
[1]赵秀玲. 苋菜的营养成分与保健功能[J]. 食品工业科技,2010(8):391-393.
[2]玄永浩,金银哲,刘旭,等. 苋菜药理作用研究进展[J]. 长江蔬菜,2010,22:1-4.
[3]吴时敏. 苋菜的开发利用[J]. 农村实用工程技术,1999(3):29-30.
[4]张普庆,邓淑娥,张新闽,等. 野苋菜氨基酸含量与营养评价[J]. 氨基酸和生物资源,1998,20(1):38-39.
[5]Chauhan S P,Sheth N R,Rathod I S,et al. Analysis of betalains from fruits of Opuntia species[J]. Phytochemistry Reviews,2013,12(1):35-45.
[6]Stintzing F C,Schieber A,Carle R. Betacyanins in fruits from red-purple pitaya. Hylocereus polyrhizus,(Weber)Britton & Rose[J]. Food Chemistry,2002,77(1):101-106.
[7]金同铭. 苋菜的营养特色与保健作用[J]. 蔬菜,1998,25(4):25-26.
[8]赵海军,汪朝阳,侯晓娜,等. 天然红色素的提取研究进展[J]. 广州化学,2008,33(3):32-39.
[9]唐业昌. 野苋菜营养丰富[J]. 中国蔬菜,1989,21(1):38-40.
[10]刘德良. 红苋草色素提取工艺及稳定性研究[J]. 湖北农业科学,2012,51(1):143-145.
[11]廖芙蓉,阚建全,熊丽娜. 响应面法优化超声波辅助提取籽粒苋花穗色素工艺[J]. 食品科学,2013,34(2):93-98.
[12]Ozsoy N,Yi Lmaz T,Kurt O,et al.Invitroantioxidant activity of Amaranthus lividus L[J]. Food Chemistry,2009,116(4):867-872.
[13]Tikekar R V,Ludescher R D,Karwe M V. Processing stability of squalene in amaranth and antioxidant potential of amaranth extract[J]. Journal of Agricultural & Food Chemistry,2008,56(22):10675-10678.
[15]Chon S U,Heo B G,Park Y S,et al. Total Phenolics Level,Antioxidant Activities and Cytotoxicity of Young Sprouts of Some Traditional Korean Salad Plants[J]. Plant Foods for Human Nutrition,2009,64(1):25-31.
[16]姜雪. 碱蓬色素提取及应用研究[D].辽宁:大连工业大学,2013.
[17]陈冠林,胡坤,邓晓婷,等. 红肉火龙果果皮色素的纯化及稳定性的研究[J]. 中国农学通报,2012,28(27):277-282.
[18]岳鹍,潘志恒,刘鹏,等. 超声波辅助提取火龙果果皮红色素工艺研究[J]. 食品研究与开发,2015(19):68-70.
[19]Zhang Z,Lv G,He W,et al. Effects of extraction methods on the antioxidant activities of polysaccharides obtained from Flammulina velutipes[J]. Carbohydrate Polymers,2013,98(2):1524-1531.
[20]马淑凤,王利强,胡志超,等. 酶法提取白灵菇深层发酵菌丝体多糖的研究[J]. 农业工程学报,2006,22(9):198-201.
[21]董迪迪,王鸿飞,周增群,等. 杨梅籽油抗氧化活性及其调节血脂作用的研究[J]. 中国粮油学报,2014,29(5):53-57.
[22]Zhang H,Ma H,Liu W,et al. Ultrasound enhanced production and antioxidant activity of polysaccharides from mycelial fermentation of Phellinus igniarius[J]. Carbohydrate Polymers,2014,113:380-387.
[23]杨娜,王鸿飞,郝艳佳,等. 裂褶菌多糖提取工艺及抗氧化活性研究[J]. 中国食品学报,2014,14(8):92-98.
[24]何若韫. 叶绿素含量测定[J]. 新农业,1980(3):33-34.
[25]石恩慧,李红,贾昌喜,等. 板栗总苞多酚提取工艺优化及其抗氧化性研究[C]. 中国畜牧兽医学会动物营养学分会第十一次全国动物营养学术研讨会论文集[R]. 2012:406-414.
[26]郝秀梅. 甜菜红色素的分离纯化及抗氧化与抗疲劳活性的研究[D]. 哈尔滨:东北林业大学,2011.
[27]王宁,薛源,孙体健. 苋菜红色素对羟自由基和超氧阴离子自由基的清除作用[J]. 山西医科大学学报,2009,40(5):458-460.
Responsesurfacemethodologyforoptimizingextractionofamaranthinanditsantioxidantactivity
XIONGQian,WANGChun-xing,SUNMeng,WANGKai-kai,SONGJia-min,XUFeng*,WANGHong-fei
(College of Food Science and Engineering,Ningbo University,Ningbo 315211,China)

AmaranthustricolorL.;amaranthin;response surface methodology;antioxidant activity
2016-12-30
熊茜(1991-),女,硕士研究生,研究方向:农产品贮藏加工,E-mail:13646621631@163.com。
*通讯作者:许凤(1983-),女,博士,副教授,研究方向:农产品贮藏加工,E-mail:xufeng1@nbu.edu.cn。
国家自然科学基金青年科学基金项目(31301574);浙江省自然科学基金项目(Y16C200011);浙江省科技厅项目(2014C02023);宁波市自然科学基金项目(2015A610273);宁波大学人才引进项目(ZX2012000031);宁波大学学科项目(xkl1344);宁波大学校科研基金项目(XYL14025);宁波大学学科项目(xkzsc1526)。
TS255.1
:B
:1002-0306(2017)12-0221-07
10.13386/j.issn1002-0306.2017.12.040
