白芸豆α淀粉酶抑制剂对α淀粉酶抑制特性的研究
2017-07-05,,,
,, ,
(1.食品科学与技术国家重点实验室,江苏无锡 214122; 2.江南大学食品学院,江苏无锡 214122)

马艳丽1,让一峰1,赵伟2,*,杨瑞金2
(1.食品科学与技术国家重点实验室,江苏无锡 214122; 2.江南大学食品学院,江苏无锡 214122)
本文研究了白芸豆α-淀粉酶抑制剂(α-AI)对α-淀粉酶的抑制特性。通过探究淀粉浓度、孵育时间、α-淀粉酶活力、淀粉类型对白芸豆α-AI抑制作用的影响来反映α-AI对α-淀粉酶的抑制特性。结果表明:白芸豆α-AI对α-淀粉酶的抑制作用属于非竞争性抑制,该抑制作用基本不受淀粉类型的影响,会随孵育时间的延长而显著增强(p<0.05),当α-淀粉酶活力过高(>1.125 U)时,抑制作用显著降低(p<0.05)。
白芸豆,α-淀粉酶抑制剂,抑制率,抑制特性
α-淀粉酶抑制剂(α-AI)能够有效地抑制人及其他动物体内唾液和肠道α-淀粉酶活力,阻碍淀粉等碳水化合物的分解消化,具有减少食物摄入量、控制体重增长、减缓脂肪蓄积和降低血糖水平等生理作用[1],因而在防控肥胖症和糖尿病方面具有广阔的前景[2-4]。自然界中存在的α-AI安全性较高[5],在众多谷物和豆类α-AI中,白芸豆α-AI抑制活性更强,生物安全性更高[6]。因而白芸豆α-AI的提取与利用具有重要的社会价值和经济价值。国外对白芸豆α-AI的研究较多[7-9],且其产品较多地集中在美、日、欧等发达国家或地区[10],而我国鲜有白芸豆α-AI的相关产品。本文研究了一款国产白芸豆α-AI对α-淀粉酶的抑制特性,旨在指导其实际应用的方法和范围,为其综合利用提供理论依据。
1 材料与方法
1.1材料与仪器
白芸豆淀粉酶抑制剂(α-AI) 活力>3000 U/g,深圳新产业健康管理有限公司公司;猪胰α-淀粉酶 美国Sigma-Aldrich公司;马铃薯淀粉、大米淀粉、小麦淀粉、玉米淀粉 标示总糖含量分别为88.3%、85.9%、90.2%和81.7%,市售;3,5-二硝基水杨酸(DNS)、可溶性淀粉等 均为分析纯。
还原糖自动分析仪 日本日立公司;WK-1000A型高速药物粉碎机 青州市精诚机械有限公司;PK-820电热恒温水浴锅 上海精宏实验设备有限公司;UV-1100型紫外可见分光光度计 上海美谱达仪器有限公司。
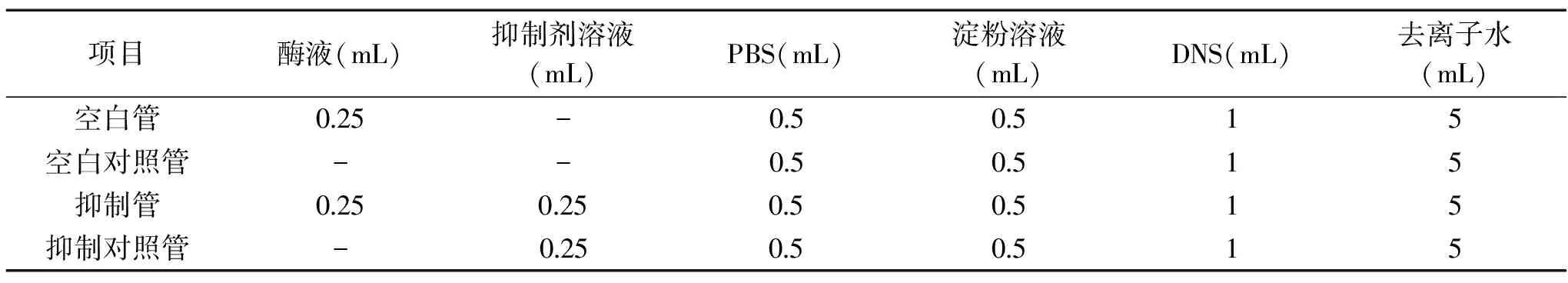
表1 α-淀粉酶抑制率测定体系Table 1 Determination system for inhibition rate on α-amylase
注:-表示未添加。1.2实验方法
1.2.1 白芸豆α-AI抑制类型的测定 将白芸豆α-AI用PBS(pH6.9)配制成浓度为10 mg/mL的抑制剂溶液。将不同浓度(0.0125、0.025和0.05 mg/mL)的α-淀粉酶液与抑制剂溶液或PBS于37 ℃下孵育10 min后,测定添加抑制剂的α-淀粉酶与未添加抑制剂的α-淀粉酶催化浓度为10 mg/mL可溶性淀粉的反应速率(mg/min),反应速率以每分钟生成的葡萄糖量(mg)计算。以α-淀粉酶浓度为横坐标,以反应速率为纵坐标绘制酶促反应动力学图像。
将浓度为0.025 mg/mL的α-淀粉酶液分别与10 mg/mL抑制剂溶液和PBS于37 ℃下孵育10 min后,测定添加抑制剂的α-淀粉酶与未添加抑制剂的α-淀粉酶催化不同浓度(5、10、15 mg/mL)可溶性淀粉溶液的反应速率。以1/S为横坐标,以1/V为纵坐标绘制Lineweaver-Burk曲线。
1.2.2α-AI对α-淀粉酶的抑制率的测定 参照Yang[11]的方法,将α-淀粉酶抑制剂溶液适当稀释使其对α-淀粉酶的抑制率(AR,%)低于50%。将0.25 mLα-淀粉酶液(1.5 U/mL)和0.25 mL适当稀释的抑制剂溶液加入到0.5 mL、0.2 mol/L PBS中(pH6.9),于37 ℃水浴10 min,加入0.5 mL 1%(w/w)可溶性淀粉溶液,精确反应5 min后加入1 mL DNS试剂以终止反应。将反应液于沸水浴中加热10 min后迅速置于冰水浴中冷却至室温,然后加入5 mL去离子水,混合均匀后于540 nm波长下测定吸光值。在测定过程中,设置空白管、空白对照管和抑制对照管。空白管中不添加样品,空白对照管中不加α-淀粉酶液和样品,抑制对照管中不加α-淀粉酶液,体积不足处均以PBS补足,反应体系如表1所示。α-AI对α-淀粉酶的抑制率(AR)按式(1)计算:
式(1)
式中,A1、A2、A3和A4分别为540 nm下空白管、空白对照管、抑制管和抑制对照管的吸光值。
α-AI活力(U)定义:在37 ℃、pH6.9下,在α-淀粉酶催化淀粉水解的反应中,1 min内抑制1 μmol葡萄糖生成所需α-AI的量。α-AI活力按式(2)计算:
α-AI活力=AR×1.5×n×V
式(2)
式中:1.5:α-淀粉酶液的活力(U/mL);n:样品稀释倍数;V:样品总体积(mL)。
1.2.3 淀粉浓度对白芸豆α-AI抑制作用的影响 将白芸豆α-AI用PBS(pH6.9)配制成浓度为2 mg/mL的抑制剂溶液,然后将抑制剂溶液适当稀释,使其抑制率低于50%,在抑制活力测定过程中,添加不同浓度(0.25%、0.5%、1%、1.5%、2%,w/v)的可溶性淀粉溶液,测定在不同淀粉浓度下白芸豆α-AI对α-淀粉酶的抑制率。
1.2.4 孵育时间对白芸豆α-AI抑制作用的影响 在抑制活力测定过程中,使抑制剂溶液与α-淀粉酶的孵育时间分别为10、30、60、90、120 min,测定在不同孵育时间下白芸豆α-AI对α-淀粉酶的抑制率。
1.2.5α-淀粉酶活力对白芸豆α-AI抑制作用的影响 在抑制活力测定过程中,添加不同活力(0.1875、0.375、0.75、1.125、1.5、1.875 U)的α-淀粉酶溶液,测定在不同α-淀粉酶活力下白芸豆α-AI对α-淀粉酶的抑制率。
1.2.6 淀粉类型对白芸豆α-AI抑制作用的影响 根据马铃薯淀粉、大米淀粉、小麦淀粉和玉米淀粉的标示总糖含量将其分别配制成1%(w/v)的淀粉溶液。在抑制活力测定过程中,分别用马铃薯淀粉溶液、大米淀粉溶液、小麦淀粉溶液和玉米淀粉溶液代替可溶性淀粉溶液,测定在不同类型淀粉溶液下白芸豆α-AI对α-淀粉酶的抑制率。
1.2.7 数据处理方法 数据结果表示为三次平行实验结果平均值±标准差,采用SPSS 17.0软件进行ANOVA单因素方差分析及Ducan’s多重检验(p<0.05)。
2 结果与讨论
2.1白芸豆α-AI的抑制类型
酶的抑制剂的抑制类型与其应用范围有着紧密联系[12]。根据抑制动力学曲线可以判断抑制剂的抑制类型。图1所示为白芸豆α-AI对α-淀粉酶的抑制动力学图。未被抑制和被抑制的α-淀粉酶的酶解速率曲线几乎相交在原点,这与可逆抑制特征曲线[13]相符,因此可以判定白芸豆α-AI对α-淀粉酶的抑制作用是可逆的。结合Lineweaver-Burk图(图2)可以看出,未被抑制和被抑制α-淀粉酶的Lineweaver-Burk线在横轴上的截距几乎是一致的,而且被抑制α-淀粉酶的Lineweaver-Burk线在纵轴上的截距大于未被抑制α-淀粉酶,由此可见,白芸豆α-AI与α-淀粉酶发生抑制作用后,α-淀粉酶酶解反应中的米氏常数(Km)不变,而最大反应速率(Vmax)变小,因此白芸豆α-AI对α-淀粉酶的抑制作用属于非竞争性抑制。
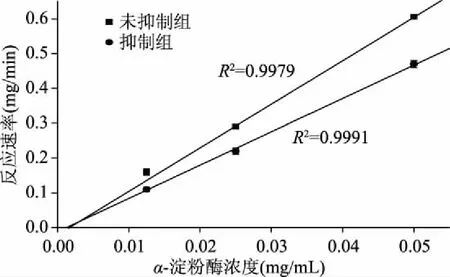
图1 白芸豆α-AI的抑制动力学图Fig.1 Inhibition kinetic diagram of α-AI
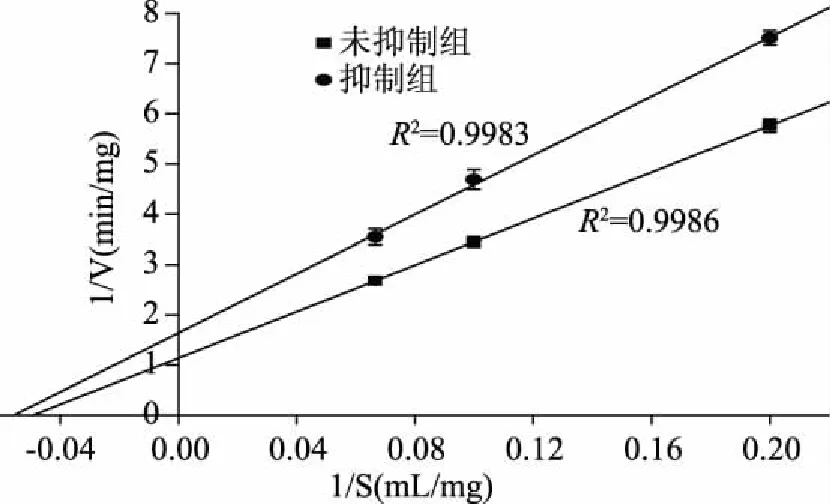
图2 白芸豆α-AI的Lineweaver-Burk图Fig.2 Lineweaver-Burk diagram of α-AI
2.2淀粉浓度对白芸豆α-AI抑制作用的影响
非竞争性抑制剂对酶的抑制作用不受底物浓度的影响,因此淀粉浓度的增加不会削弱白芸豆α-AI对α-淀粉酶的抑制作用。图3所示为不同淀粉浓度下白芸豆α-AI对α-淀粉酶的抑制作用曲线。淀粉浓度的增加(0.25%~2%)不会显著影响白芸豆α-AI对α-淀粉酶的抑制率(p>0.05)。由于在抑制率低于50%时,抑制率能较真实地反应α-AI对α-淀粉酶的抑制作用[14],因此,测定前将抑制剂溶液适当稀释,使其抑制率低于50%。
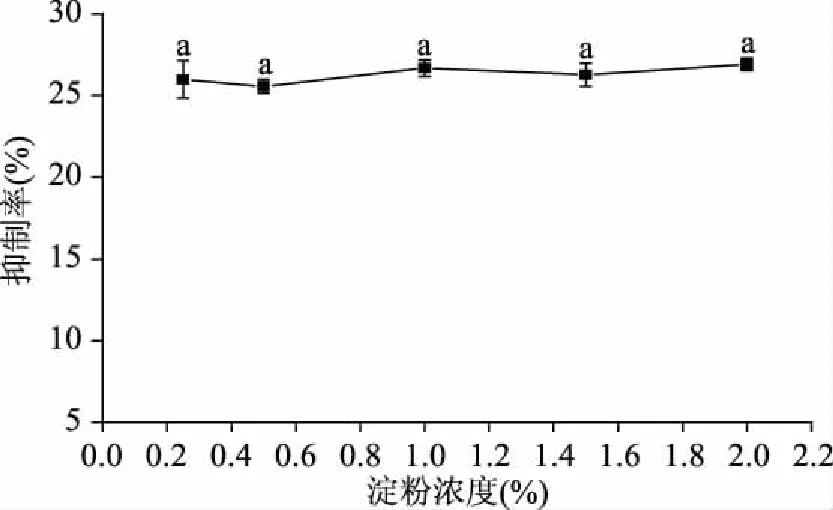
图3 淀粉浓度对白芸豆α-AI抑制作用的影响Fig.3 Effects of starch concentration on the inhibition of α-AI注:标有不同小写字母表示差异显著(p<0.05),图4~图6同。
2.3孵育时间对白芸豆α-AI抑制作用的影响
图4所示为不同孵育时间下白芸豆α-AI对α-淀粉酶的抑制作用曲线。随着孵育时间的延长,抑制率不断增大。当孵育时间从15 min延长到60 min时,抑制率提高了2.90倍。随着孵育时间的进一步延长,抑制率缓慢增大。当孵育时间为120 min时,抑制率达91.38%。在以往的研究中,白芸豆α-AI完全抑制α-淀粉酶活力所需的孵育时间不超过120 min[15],而本文中孵育时间达到120 min后,抑制率仍然未达到100%,这可能是抑制体系中所加入的抑制剂活力较低的缘故。尽管孵育时间超过30 min后抑制率高于50%,但抑制率的上升趋势则很好地说明了孵育时间影响着α-AI的抑制作用。因此,在实际应用中,餐前适当时刻摄入白芸豆α-AI可能会增强α-AI对肠道α-淀粉酶的抑制作用。
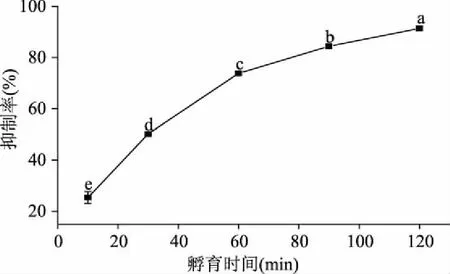
图4 孵育时间对白芸豆α-AI抑制作用的影响Fig.4 Effects of preincubation time on the inhibition of α-AI
2.4α-淀粉酶活力对白芸豆α-AI抑制作用的影响
图5所示是在不同α-淀粉酶活力下白芸豆α-AI对α-淀粉酶的抑制作用曲线。当α-淀粉酶活力为0.1875~1.125 U时,抑制率无显著变化(p>0.05)。当α-淀粉酶活力高于1.125 U时,抑制率显著下降(p<0.05)。当α-淀粉酶活力为1.875 U时,抑制率仅为7.33%。这一现象说明白芸豆α-AI对较高活力α-淀粉酶的抑制作用较小。胰蛋白酶抑制剂(TI)能够刺激胰脏分泌更多的α-淀粉酶,因而含过高TI活力的白芸豆α-AI产品在体内无法发挥预期的生理作用[16]。
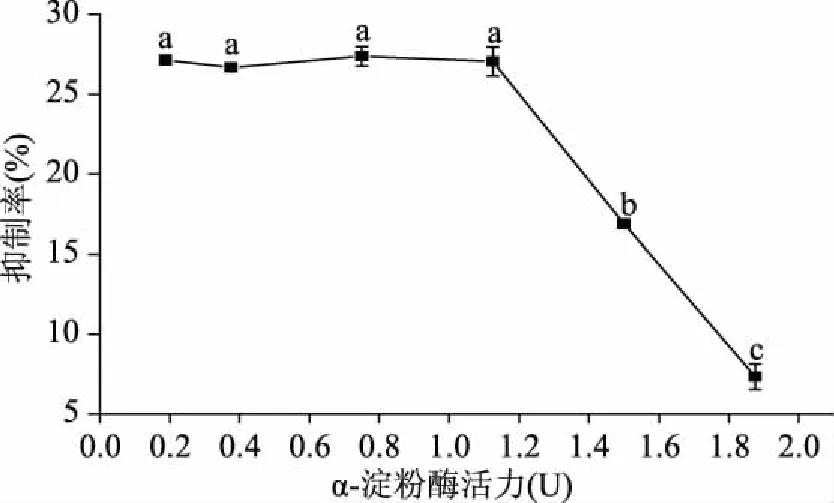
图5 α-淀粉酶活力对白芸豆α-AI抑制作用的影响Fig.5 Effects of α-amylase activity on the inhibition of α-AI
2.5淀粉类型对白芸豆α-AI抑制作用的影响
马铃薯淀粉、大米淀粉、小麦淀粉和玉米淀粉是广泛存在于人们日常饮食中的淀粉类型。图6所示为在不同淀粉类型下白芸豆α-AI对α-淀粉酶的抑制作用。尽管当淀粉类型不同时,白芸豆α-AI对α-淀粉酶的抑制作用会出现显著的变化(p<0.05),但这些变化并不是极显著(p>0.01),因此白芸豆α-AI能够广泛用于抑制α-淀粉酶对日常饮食中淀粉的水解。
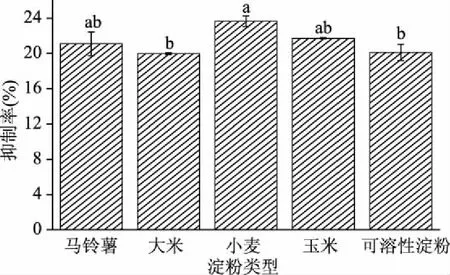
图6 淀粉类型对白芸豆α-AI抑制作用的影响Fig.6 Effects of starch breed on the inhibition of α-AI
3 结论
α-淀粉酶的抑制特性影响其应用范围,因此掌握白芸豆中α-AI的抑制特性可以更好地指导白芸豆α-AI的实际应用。本文通过研究得出白芸豆α-AI对α-淀粉酶的抑制作用属于非竞争性抑制,其抑制作用基本不受淀粉类型的影响,随孵育时间的延长其抑制作用显著增强(p<0.05),而当α-淀粉酶活力过高(>1.125 U)时,其抑制作用显著降低(p<0.05)。本研究为白芸豆α-AI的应用提供理论依据,有利于白芸豆资源的开发利用。
[1]Mauro A C N F,Barbara L,Giancarlo C,et al. Potential efficacy of preparations derived fromPhaseolusvulgarisin the control of appetite,energy intake,and carbohydrate metabolism[J]. Diabetes Metabolic Syndrome & Obesity Targets & Therapy,2009,2(default):145-153.
[2]Barrett M L,Udani J K. A proprietary alpha-amylase inhibitor from white bean(Phaseolusvulgaris):a review of clinical studies on weight loss and glycemic control[J]. Nutrition Journal,2011,10(1):1.
[3]Ademiluyi A O,Oboh G. Soybean phenolic-rich extracts inhibit key-enzymes linked to type 2 diabetes(α-amylase andα-glucosidase)and hypertension(angiotensin I converting enzyme)invitro[J]. Experimental and Toxicologic Pathology,2013,65(3):305-309.
[4]Oboh G,Ademiluyi A O,Akinyemi A J,et al. Inhibitory effect of polyphenol-rich extracts of jute leaf(Corchorusolitorius)on key enzyme linked to type 2 diabetes(α-amylase andα-glucosidase)and hypertension(angiotensin I converting)invitro[J]. Journal of Functional Foods,2012,4(2):450-458.
[5]Celleno L,Tolaini M V,D’amore A,et al. A Dietary
supplement containing standardizedPhaseolusvulgarisextract influences body composition of overweight men and women[J]. International Journal of Medical Sciences,2006,4(1):45-52.
[6]Mauro A C N F,Barbara L,Giancarlo C,et al. PotenTIl efficacy of preparations derived fromPhaseolusvulgarisin the control of appetite,energy intake,and carbohydrate metabolism[J]. Diabetes Metabolic Syndrome & Obesity Targets & Therapy,2009,2(default):145-153.
[7]Campbell P M,Reiner D,Moore A E,et al. Comparison of theα-Amylase Inhibitor-1 from Common Bean(Phaseolusvulgaris)Varieties and Transgenic Expression in Other Legumes Post-Translational Modifications and Immunogenicity[J]. Journal of Agricultural and Food Chemistry,2011,59(11):6047-6054.
[8]Sales P M,Souza P M,Simeoni L A,et al.α-Amylase inhibitors-a review of raw material and isolated compounds from plant source[J]. Journal of Pharmacy & Pharmaceutical Sciences,2012,15(1):141-183.
[9]Spadafranca A,Rinelli S,Riva A,et al.Phaseolusvulgarisextract affects glycometabolic and appetite control in healthy human subjects[J]. British Journal of Nutrition,2013,109(10):1789-1795.
[10]Chokshi D. Phaseolamin compositions and methods for using the same,US:20040997315[P].
[11]Powers J R,Whitaker J R. Effect of several experimental parameters on combination of red kidney bean(Phaseolusvulgaris)aP-amylase inhibitor with porcine pancreatic aP-amylase[J]. Journal of Food Biochemistry,2007,1(3):239-260.
[12]Le B A V,Bompard G C,Payan F,et al. Characterization and functional properties of the alpha-amylase inhibitor(alpha-AI)from kidney bean(Phaseolusvulgaris)seeds[J]. Biochimica Et Biophysica Acta,1997,1343(1):31-40.
[13]王镜岩. 生物化学.上册[M]. 北京:高等教育出版社,2002:370-373.
[14]Wang H H,Chen C L,Jeng T L,et al. Comparisons ofα-amylase inhibitors from seeds of common bean mutants extracted through three phase partitioning[J]. Food Chemistry,2011,128(4):1066-1071.
[15]Powers J R,Whitaker J R. Effect of several experimental parameters on combination of red kidney bean(Phaseolusvulgaris)aP-amylase inhibitor with porcine pancreatic aP-amylase[J]. Journal of Food Biochemistry,2007,1(3):239-260.
[16]Obiro W C,Zhang T,Jiang B. The nutraceutical role of thePhaseolusvulgarisalpha-amylase inhibitor[J]. British Journal of Nutrition,2008,100(1):1-12.
《食品工业科技》愿为企业铺路、搭桥!
Studyontheinhibitorypropertiesofα-amylaseinhibitorfromwhitekidneybeans
MAYan-li1,RANGYi-feng1,ZHAOWei2,*,YANGRui-jin2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China; 2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The inhibitory properties ofα-amylase inhibitor(α-AI)from white kidney beans were analyzed by the effect of starch concentration,preincubation time,α-amylase activity and starch breed on the inhibition ofα-AI. The results showed that the inhibition ofα-AI onα-amylase was non-competitive and the variation of starch did not affect the inhibition. With the extension of preincuation time,the inhibition significantly increased(p<0.05). While withα-amylase activity exceeded 1.125 U,the inhibition significantly decreased(p<0.05).
white kidney bean;α-amylase inhibitor;inhibition rate;inhibitory property
2016-10-14
马艳丽(1987-),女,博士研究生,研究方向:食品加工与配料,E-mail:yanli_ma@sina.cn。
*通讯作者:赵伟(1982-),男,博士,教授,研究方向:食品加工,E-mail:zhaow@jiangnan.edu.cn。
国家自然科学基金项目(31522044,31271977);中央高校基本科研业务费专项资金(JUSRP51406A)。
TS214.9
:A
:1002-0306(2017)12-0109-04
10.13386/j.issn1002-0306.2017.12.020
