ERK12信号通路在紫杉醇诱导直肠癌细胞凋亡中的作用分析
2017-07-05张潮团郑权
张潮团 郑权
【摘要】 目的:探讨ERK12信号通路在紫杉醇诱导直肠癌细胞凋亡中的作用。方法:培养直肠癌细胞系CX1作为研究标本,分别单独应用紫杉醇、紫杉醇+ERK12信号通路抑制剂PD98059作用于直肠癌细胞系CX1,应用MTT法检测两者对直肠癌细胞的杀伤力。结果:(1)不同药物浓度下,紫杉醇+ERK12信号通路抑制剂PD98059作用72 h的直肠癌细胞生长抑制率均较单独应用紫杉醇高(P<0.05)。(2)紫杉醇+ERK12信号通路抑制剂PD98059作用24、48 h的细胞凋亡率均较单独应用紫杉醇高(P<0.05)。结论:通过抑制ERK12信号通路,能够增强紫杉诱导直肠癌细胞凋亡的作用。
【关键词】 直肠癌; ERK12信号通路; 紫杉醇; 细胞凋亡; 作用
Analysis the Role of ERK12 Signaling Pathway in Taxol Induced of Colorectal Cancer Cell Apoptosis/ZHANG Chao-tuan,ZHENG Quan.//Medical Innovation of China,2017,14(16):032-034
【Abstract】 Objective:To study the ERK12 signaling pathways in taxol induce the role of apoptosis of colon cancer.Method:Cultivate CX1 colorectal cancer cell line as the research samples,used drug,Taxol +ERK12 separately signaling pathway inhibitor PD98059 CX1 role in colorectal cancer cell line,determined by MTT method was applied to detect both lethality of colorectal cancer cells.Result:(1)under different concentrations of drug,Taxol +ERK12 signaling pathway inhibitor PD98059 72 h of colorectal cancer cells growth inhibition rate were relatively high application paclitaxel alone(P<0.05).(2)Taxol+ERK12 signaling pathway inhibitor PD98059 role within 24 and 48 h,apoptosis rate were relatively high application paclitaxel alone(P<0.05).Conclusion:By inhibiting ERK12 signaling pathways,can enhance the effect of yew induced rectal cancer cell apoptosis.
【Key words】 Colorectal cancer; ERK12 signaling pathways; Taxol; Cell apoptosis; Role
First-authors address:The Peoples Liberation Army 421th General Surgery Center Hospital,Guangzhou 510000,China
doi:10.3969/j.issn.1674-4985.2017.16.009
直肠癌的发病范围为齿状线至直肠乙状结肠交界,由于病灶位置深入盆腔,解剖关系复杂,故手术治疗难以彻底,术后复发率较高,远期预后较差[1-3]。针对直肠癌手术治疗存在的弊端,近年来越来越多的直肠癌患者选择接受手术治疗联合术后化疗[4]。但伴随着临床对直肠癌化疗作用机制的深入研究,不断有研究学者发现ERK12信号传导通路被激活后会促进肿瘤细胞的分化和增殖,并推测ERK12信号传导通路的异常激活可能参与了直肠癌患者肿瘤浸润及转移的过程[5-7]。基于上述研究现状,本研究对ERK12信号通路在紫杉醇诱导直肠癌细胞凋亡中的作用进行分析,旨在明确ERK12信号通路对直肠癌患者临床疗效的影响,为临床制定直肠癌患者的治疗方案提供参考价值,以进一步改善直肠癌患者远期预后。
1 资料与方法
1.1 一般资料 研究标本为直肠癌细胞系CX1。
1.2 方法
1.2.1 直肠癌细胞培养 直肠癌细胞系CX1的培养液为10%胎牛血清(经30 min灭活)和庆大霉素12 U/mL,培养液温度56 ℃,放于培养箱内培养。培养箱温度37 ℃、饱和湿度、5% CO2,进行传代培养,选取对数生长期细胞开展研究。
1.2.2 两种药物方案的敏感性检测 应用MMT(噻唑蓝)检测紫杉醇+ERK12信号通路抑制剂PD98059和紫杉醇对直肠癌细胞的敏感性。具体方法为:在96孔板上接种直肠癌细胞,浓度为1×105个/mL。先放在培养液中培养4 h,观察细胞贴壁后,将96个孔板分为两组,其中一组加入浓度为10 μmol/L、100 nmol/L、1 nmol/L的紫杉醇,另一组加入ERK12信号通路抑制剂PD98059后在加入不同浓度的紫杉醇。两组均继续培养72 h,在培养至69 h时于每个孔板中加入20μL MMT,4 h后将上清液吸出,加入100 DMSO,充分混匀后,使用酶标仪在570 nm波长处检测细胞的OD值,计算两组的直肠癌细胞生长抑制率。计算公式为:抑制率=(1-存活率)×100%,存活率為两组OD值的比值与10%的乘积。
1.2.3 直腸癌细胞周期解析 在6孔板上接种直肠癌细胞,浓度为1×106个/mL。在每个孔板中加入3.5 mL培养液,之后分别加入浓度为10 μmol/L、100 nmol/L、1 nmol/L的紫杉醇和ERK12信号通路抑制剂PD98059。于加入PD98059后24、48 h收集细胞,在收集的细胞中加入冷PBS,以1000 r/min的速度离心5 min,洗涤2次,加入体积比为70%的4 ℃乙醇过夜,在1000 r/min的速度离心5 min,洗涤2次,加入100 μL碘化丙啶,放在4 ℃闭光的环境中染色30 min,应用流式细胞及配套软件对细胞周期进行解析。
1.3 观察指标 本研究选取的关注指标包括:(1)不同药物浓度下(10 μmol/L、100 nmol/L、1 nmol/L),紫杉醇、紫杉醇+ERK12信号通路抑制剂PD98059作用72 h的直肠癌细胞抑制率;(2)紫杉醇、紫杉醇+ERK12信号通路抑制剂PD98059作用24、48 h直肠癌细胞凋亡率。
1.4 统计学处理 使用SPSS 20.0版本统计学软件建立数据分析模型,计量资料采用(x±s)表示,比较采用t检验,计数资料采用例(%)描述,比较采用 字2检验,以P<0.05为差异有统计学意义。
2 结果
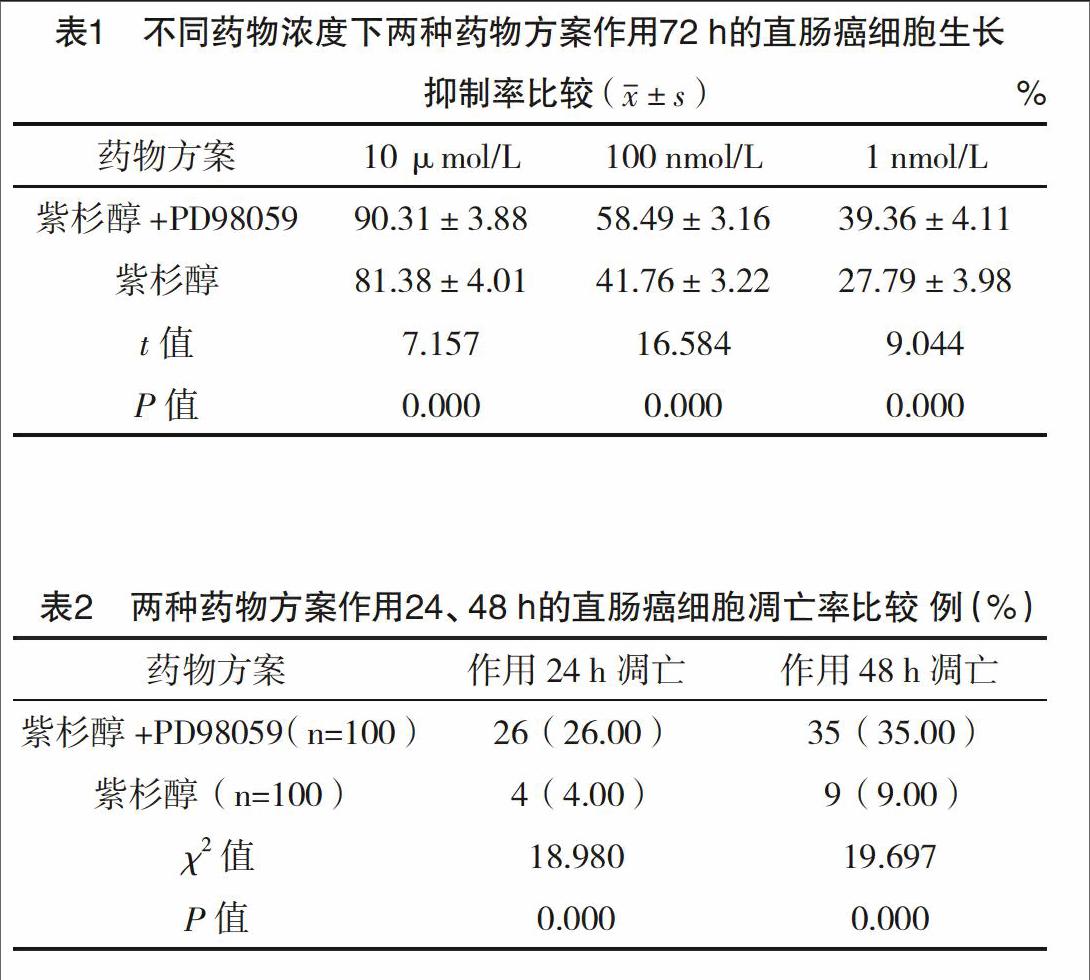
2.1 不同药物浓度下两种药物方案作用72 h的直肠癌细胞生长抑制率比较 10 μmol/L、100 nmol/L、1 nmol/L浓度下,紫杉醇+ERK12信号通路抑制剂PD98059作用72 h的直肠癌细胞生长抑制率均较单独应用紫杉醇高(P<0.05),见表1。
2.2 两种药物方案作用24、48 h的直肠癌细胞凋亡率比较 在高倍镜下观察紫杉醇+ERK12信号通路抑制剂PD98059作用24、48 h的直肠癌细胞凋亡情况,随机选取视野内100个细胞统计两种药物方案的细胞凋亡率,结果显示紫杉醇+ERK12信号通路抑制剂两个作用时间点的直肠癌细胞凋亡率均高于单独应用紫杉醇(P<0.05),见表2。
3 讨论
紫杉醇为我国临床治疗卵巢癌和乳腺癌的常用药物,其本质是红豆杉属植物中的一种结构复杂的次生代谢产物,也是目前我国医疗领域上使用的唯一可以促进微管聚合和稳定已聚合微管的药物[8-10]。药理研究证实该种药物的微蛋白结合十分稳定,能够抑制微管正常的力学重组,并能影响细胞的正常分裂,从而能够抑制细胞内某些调控因素对微管的作用,诱导细胞凋亡[11]。近年来的临床研究均报道该种药物在卵巢癌和乳腺癌患者临床治疗中的应用,能够获良好的临床疗效,但关于该药物在直肠癌患者临床治疗中的应用,却鲜有报道[12-13]。动物实验研究结果显示,紫杉醇对荷瘤裸鼠具有明显疗效,同时也发现ERK信号传导系统会对紫杉醇治疗荷瘤裸鼠的疗效产生影响[14-15]。
ERK是介导机体内细胞反应的重要信号传导系统,普遍存在于多种哺乳动物体内,该信号通路能够将细胞信号逐级扩大传入细胞内,将细胞外的刺激物和细胞内的细胞质、细胞核中的效应分子连接,对于细胞的生长和分化具有促进作用[16-18]。现阶段,我国临床研究最多的ERK信号通路为ERK12,主要研究内容为该信号通路对恶性肿瘤患者疾病治疗效果的影响[19]。直肠癌手术治疗术后复发率高,我国临床尚缺乏能够改善直肠癌患者术后远期预后的有效治疗方案[20]。本研究旨在通过明确ERK12信号通路在紫杉醇诱导直肠癌细胞凋亡中的作用,对现有的直肠癌治疗方案进行改建。研究结果显示紫杉醇+PD98059作用下的直肠癌细胞生长抑制率、凋亡率均明显高于单用紫杉醇。分析ERK12信号通路影响紫杉醇治疗直肠癌疗效的作用机制为:直肠癌细胞受到外南街刺激后能够机会ERK1,促使ERK12发生磷化,细胞浆转移至细胞核对,激活细胞核内的下游底物,介导一些原癌基因的活化,对细胞的生长产生调控作用,促使癌细胞的浸润和转移。
对上述研究结果进行分析,本研究认为ERK12信号通路会对紫杉醇治疗直肠癌的疗效产生影响,通过抑制ERK12信号通路,能够增强紫杉诱导直肠癌细胞凋亡的作用。但由于现阶段我国临床同类临床研究报道较少,本院本次研究过程中的操作有待进一步规范,因此本研究所得结果仍需更多研究学者进行大量实践研究验证。
参考文献
[1]张海峰,李金海,戴华卫,等.直肠癌凋亡相关蛋白与肿瘤细胞体外化疗药物敏感性的关系[J].温州医学院学报,2013,43(3):178-180.
[2]何耀明.光动力疗法联合紫杉醇对结直肠癌患者淋巴细胞转移增殖的影响[J].实用药物与临床,2016,19(5):561-564.
[3]马友龙,郑海燕,祁海艳,等.多西紫杉醇联合方案经动脉介入治疗结直肠癌肝转移的临床研究[J].中国现代医学杂志,2015,25(33):65-70.
[4]马友龙.多西紫杉醇联合方案经动脉介入对结直肠癌肝转移患者近远期生存率的影响[J].中国医药导报,2015,12(34):78-81,89.
[5]王宏,郭广洋.经导管动脉栓塞化疗为基础的多烯紫杉醇联合方案治疗结直肠癌肝转移效果分析[J].现代消化及介入诊疗,2016,21(1):35-37,42.
[6]章群,汪灏,沈洁,等.结直肠癌BRCA1 mRNA表达与多西紫杉醇、奥沙利铂体外敏感性的关系[J].江苏医药,2014,40(9):1027-1029.
[7]付蕾,李潜,温一阳,等.多烯紫杉醇与TACE方案联合化疗治疗结直肠癌肝转移疗效观察[J].中国继续医学教育,2016,8(30):141-142.
[8]陆卫萍.硬膜外麻醉复合全身麻醉和单纯全身麻醉在腹腔镜直肠癌手术中的疗效比较[J].中外医学研究,2016,14(34):152-153.
[9]杨冠宁,王泽麟.腹腔镜与开腹手术治疗直肠癌对患者术后CRP、TNF-α和IL-6水平的影响[J].中国医学创新,2016,13(28):128-131.
[10]田晓玲,李慧琼,徐焱成,等.尿路上皮癌相关基因1对磷脂酰肌醇3激酶-丝氨酸/苏氨酸激酶信号通路和葡萄糖摄取的影响[J].中华糖尿病杂志,2016,8(9):564-568.
[11]方艺聪,曾群章.腹膜外隧道式乙状结肠造口联合疝补片在腹腔镜老年直肠癌Miles术中的应用[J].中外医学研究,2016,14(16):38-39.
[12]李翀,郑旭,韩燕燕,等.肺泡样肺腺癌中端锚聚合酶的表达及其与WNT信号通路的关系[J].天津医药,2016,44(6):733-735,652.
[13]彭榆翀,彭宁福,谢志波,等.PI3K/AKT信号通路对肝癌细胞MHCC-97H中CD90+干样细胞的影响[J].中华肝脏病杂志,2016,24(4):285-290.
[14]王国方,唐敏.腹腔镜外科手术治疗直肠癌的临床效果评价[J].中国医学创新,2012,9(22):10-11.
[15]刘荣福,计成永,谭伟,等.Wnt信号通路调控因子Pygo2在人肾癌组织中的表达及意义[J].中华泌尿外科杂志,2013,34(3):212-214.
[16]徐珊珊,韩玉贞,曾令瑞,等.乳腺原发癌和淋巴结转移癌干细胞Hedgehog信号通路相关基因的比较[J].解剖学杂志,2015,38(2):179-181.
[17]曹珮,姜学军,席志军,等.舒尼替尼通过抑制Akt/mTOR信号通路诱导肾癌细胞自噬[J].北京大学学报(医学版),2016,48(4):584-589.
[18]徐珊珊,韩玉贞,马文浩,等.乳腺原发癌和淋巴结转移癌中Hedgehog信号蛋白的表达及意义[J].临床与实验病理学杂志,2012,28(11):1198-1201.
[19]聶琳,徐玉清.非小细胞肺癌中HGF/c-Met信号通路与EGFR-TKI获得性耐药的关系[J].国际肿瘤学杂志,2016,43(9):703-705.
[20]刘进辉,李明华,白晓龙,等.TGF-β1/Smad信号通路在皮肤病理性瘢痕及瘢痕癌组织中的变化[J].河北医学,2014,20(12):1983-1986.
(收稿日期:2017-03-08) (本文编辑:周亚杰)
