花椒内生细菌Y-6抗菌蛋白抑菌活性及稳定性研究
2017-07-05杜宾,李娜,李燕*
杜 宾,李 娜,李 燕*
(1.太原学院,山西 太原 030012; 2.山西省农业信息科技中心, 山西 太原 030006)
花椒内生细菌Y-6抗菌蛋白抑菌活性及稳定性研究
杜 宾1,李 娜2,李 燕1*
(1.太原学院,山西 太原 030012; 2.山西省农业信息科技中心, 山西 太原 030006)
为明确花椒内生细菌Y-6抗菌物质种类与特性,丰富生物农药开发源,采用生长速率法、硫酸铵沉淀及聚丙烯酰胺凝胶电泳等方法对其抗菌物质种类、抑菌活性、最佳硫酸铵沉淀饱和度及稳定性进行研究。结果表明,菌株Y-6代谢物对番茄早疫病菌、番茄灰霉病菌和梨黑斑病菌具有较好的抑菌效果,抑菌率分别为90.4%、95.2%和90.1%。抗菌物质为蛋白质,在70%硫酸铵饱和度下可完全沉淀,其对番茄早疫病菌和番茄灰霉病菌的抑菌圈直径分别为 24 mm和26 mm。抗菌物质在pH值4~11、温度低于80 ℃和紫外照射12 h后仍表现出较好的抑菌活性。综上说明,花椒内生细菌Y-6抗菌蛋白具有一定的生物农药开发应用潜力。
花椒; 内生细菌; 抗菌蛋白; 抑菌活性; 稳定性; 生物农药
粮食、蔬菜和水果等农产品是人类赖以生存的物质基础,其产量和品质关系到粮食安全和人类健康。病虫害是农产品产量和品质的主要限制因素,每年都会造成一定的经济损失[1]。化学防治作为当前植物病虫害防治的主要手段,在保障农产品产量、挽回经济损失中起到了关键作用[2]。然而,近年来由于农产品生产过程中化学农药的不合理使用,导致农产品农药残留超标[3-4]、病虫害抗药性产生[5-7]、农药使用年限缩短[7-8]、环境污染[2]和生态平衡破坏[9]等问题日益加重,农产品品质下降,对人类健康和我国农产品出口贸易及食品安全造成了严重影响,阻碍了我国农业可持续发展[10]。因此,在保障产量的同时,降低农产品农药残留,保障农产品出口质量和食品安全,促进农业可持续发展显得尤为重要。生物农药是一类利用生物活体(真菌、细菌、昆虫病毒、转基因生物、天敌等)或其代谢产物进行开发,对农业有害生物具有杀灭或抑制作用的制剂[11-12],同化学农药相比,具有选择性强、对人畜安全、无毒、低残留、高效、不易产生抗药性和对生态环境影响小等特点[13],已成为近年来农药和植保工作者的研究热点,同时应用生物农药也是促进国家实现“减药”目标和农业可续发展的一个重要途径。
近年来,虽然我国在生物农药研究方面取得了一定进展,但是注册登记的生物农药绝大多数是利用植物有效成分、真菌、病毒、放线菌以及土壤和根际细菌等开发的,如:苦皮藤素(成都新朝阳作物科学有限公司)、苦参碱(内蒙古帅旗生物科技股份有限公司)、球孢白僵菌(山西绿海农药科技有限公司)、甜菜夜蛾核型多角体病毒(河南省济源白云实业有限公司)、井冈霉素(浙江省桐庐汇丰生物科技有限公司)、申嗪霉素(江西珀尔农作物工程有限公司)、多抗霉素[中农立华(天津)农用化学品有限公司]、地衣芽孢杆菌(河南省安阳市国丰农药有限责任公司)和多黏类芽孢杆菌(浙江省桐庐汇丰生物科技有限公司)等[14]。植物内生细菌作为自然界中的一类丰富资源,几乎存在于所有植物体内[15-16]。同其他微生物相比,其除了能在宿主体内定殖、可与宿主和谐共生、不易受外界环境影响外,还具有抗病[17-18]、促生[19-20]、耐盐[21-22]、降解有机污染物[23]等生物学作用,是生物农药的又一重要开发源。虽然目前已从多种植物体内发现具有抗植物病原真菌作用的内生细菌,但与已记载的植物种类和其他开发源生物农药相比,植物内生细菌还具有很大的开发空间,特别是一些药用植物中的内生细菌。
花椒(ZanthoxylumbungeanumMaxim.)为芸香科花椒属落叶小乔木,在我国除台湾、海南及广东不产外,其他各地均有分布,在北方常被用作果园防护树种,具有良好的药用和食用价值,特别是叶片和果实深受人们喜爱[24-25]。近年来,虽然人们对其药用价值[25]、病虫害防治技术[26-28]、栽培技术[29]、内生真菌[30]、化学成分[31-34]以及根际生防细菌[35]等进行了研究,但有关其内生细菌的研究报道还较为匮乏,仅陈冲等[36]对花椒果实中产L-酪氨酸内生细菌进行了报道。利用其内生细菌进行抗病的研究还未见相关报道,因此,太原学院园林研究所植物保护研究室于2015年8月对花椒树不同组织部位的内生细菌进行了分离,发现来自叶片的菌株Y-6代谢物具有良好的抗植物病原真菌活性。本研究重点对其代谢物中抗菌物质的种类及抑菌活性进行研究,旨在为拓展生物农药开发源,促进花椒内生细菌生物农药开发,提高人们对花椒内生细菌的认知度,促进花椒树植物资源的高效利用提供理论依据。
1 材料和方法
1.1 供试菌株
植物内生细菌:菌株Y-6分离自花椒叶部,保存于太原学院园林研究所。
植物病原真菌:番茄早疫病菌(Alternariasolani)、番茄灰霉病菌(Botrytiscinerea)、小麦赤霉病菌(Fusariumgraminearum)、棉花立枯病菌(Rhizoctoniasolani)、辣椒枯萎病菌(Fusariumoxysporumf.sp.vasinfectum)、梨黑斑病菌(Alternariaalternate)由太原学院园艺系提供。
1.2 供试培养基
NA培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g、琼脂20 g,pH值7.0,定容到1 000 mL。
PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g,pH值自然,定容到1 000 mL。
BPY发酵液:蛋白胨10 g、牛肉浸膏5 g、酵母粉5 g、葡萄糖5 g、NaCl 5 g,pH值7.0,定容到1 000 mL。
1.3 内生细菌Y-6菌株发酵液制备
1.3.1 菌株活化 取-86 ℃甘油保藏法保藏的菌株Y-6悬浮液50 μL,涂布于新鲜NA培养基平板中,28 ℃恒温培养48 h后,挑取单菌落,采用划线法转接至新鲜NA培养基平板上,于28 ℃恒温培养12 h后用于后续试验。
1.3.2 菌株发酵培养 挑取活化后的菌株Y-6于300 mL BPY发酵液(500 mL容器)中,28 ℃、160 r/min振荡培养12 h,获得种子发酵液。随后将种子发酵液按照1%的接种量接种至新鲜BPY发酵液中,在同样条件下振荡培养72 h后,终止发酵,于4 ℃、12 000 r/min离心10 min去除菌体,收集上清液。上清液经0.22 μm微孔滤膜除菌,4 ℃保存备用。
1.4 内生细菌Y-6菌株抗菌物质种类初判
1.4.1 Y-6代谢物室温抑菌活性测定 采用生长速率法[37-38]对菌株Y-6代谢物的抑菌活性进行测定。将1.3.2中获得的无菌发酵液和融化后的PDA培养基按照1∶9(V∶V)混合后制备含药平板,以空白发酵液为对照,凝固后将直径为5 mm的植物病原真菌菌饼接种至平板中央,重复3次,于26 ℃恒温培养5 d后,计算抑菌率。抑菌率=(对照植物病原真菌菌落直径-处理组植物病原真菌菌落直径)/(对照植物病原真菌菌落直径-5)×100%。
1.4.2 Y-6代谢物高温处理后抑菌活性测定 取适量1.3.2中获得的发酵液,经121 ℃高温处理30 min后,采用1.4.1中所述方法测定其抑菌活性。
1.4.3 抗菌粗蛋白提取及十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)
1.4.3.1 粗蛋白硫酸铵沉淀 无菌发酵液经饱和度为80%的硫酸铵4 ℃沉淀12 h后,于4 ℃、10 000 r/min 离心10 min 收集沉淀,用10 mL 0.02 mol/L的无菌Tris-HCl缓冲液溶解后装入透析袋(截留分子质量为8 000~14 000 u)中,在0.02 mol/L Tris-HCl缓冲液中透析48 h后,使用聚乙二醇6000浓缩至10 mL,并用0.22 μm微孔过滤器过滤除菌,采用生长速率法(1.4.1中所述)测定抑菌活性,于4 ℃保存备用。
1.4.3.2 SDS-PAGE检测 参照翟茹环[39]所述的方法进行操作。抗菌粗蛋白和5 × 蛋白质上样缓冲液按照1∶4 (V∶V)混合后,于沸水中煮沸5 min,室温冷却,12 000 r/min离心5 min后进行SDS-PAGE检测,以0.02 mol/L Tris-HCl缓冲液和上样缓冲液混合为对照,电泳结束后使用考马斯亮蓝R-250染色 20 min,脱色后采用凝胶成像系统拍照观察,出现条带为正反应,无条带为负反应。
1.5 抗菌蛋白最佳硫酸铵沉淀饱和度筛选
1.5.1 粗蛋白分级沉淀 采用1.3.2中方法获得菌株Y-6无菌发酵液后,用不同饱和度硫酸铵(20%、40%、60%、70%、80%、100%)对抗菌蛋白进行分级沉淀。4 ℃沉淀12 h后,于4 ℃、12 000 r/min离心10 min收集沉淀,剩余上清液继续添加硫酸铵调至下一级饱和度。蛋白质沉淀使用0.02 mol/L pH值 7.0的Tris-HCl缓冲液溶解,装入透析袋,置于0.02 mol/L Tris-HCl缓冲液中4 ℃透析 48 h,0.22 μm微孔过滤器除菌后,冷冻干燥获得粗蛋白,于-20 ℃保存备用。
1.5.2 粗蛋白抑菌活性测定 将1.5.1中硫酸铵分级沉淀获得的各级蛋白质用pH值 7.0、0.02 mol/L的Tris-HCl缓冲液溶解,使各级蛋白质终质量浓度均为100 mg/mL,以番茄早疫病菌和番茄灰霉病菌为病原指示菌,采用琼脂扩散法[40]测定各级蛋白质的抑菌活性。操作流程如下:(1)PDA平板制备:向直径为90 mm的培养皿中每皿加入40 mL溶化后的PDA培养基,于超净工作台中凝固待用;(2)植物病原真菌菌悬液制备:用直径为5 mm的打孔器在新鲜的植物病原真菌平板中打取3个菌饼,挑入装有10 mL无菌水的样品瓶中,封口并于涡旋器中涡旋3 min,之后使用4层无菌纱布过滤到无菌三角瓶中,获得植物病原真菌菌悬液;(3)蛋白质抑菌活性测定:吸取100 μL植物病原真菌菌悬液涂布于制备好的PDA平板表面,待其干燥后,使用打孔器在每皿中打取3~4个直径为5 mm的小孔,随后在每孔中加入80 μL各级蛋白质溶液,以无菌Tris-HCl缓冲液为对照,重复3次,于26 ℃恒温培养3 d后,测定各级蛋白质的抑菌圈大小。
1.6 抗菌蛋白稳定性测定
1.6.1 热稳定性 将抗菌蛋白分别在室温、40 ℃、60 ℃、80 ℃、100 ℃、121 ℃下处理30 min,冷却至室温后,以番茄早疫病菌为病原指示菌,采用生长速率法(1.4.1中所述)测定抑菌活性,重复3次。
1.6.2 酸、碱稳定性 将抗菌粗蛋白液pH值用盐酸和氢氧化钠分别调至3、4、5、7、9、10、11、13,4 ℃静置12 h 后将各pH值调回中性,以番茄早疫病菌为病原指示菌,采用生长速率法(1.4.1中所述)测定抑菌活性,重复3次。
1.6.3 紫外稳定性 将抗菌粗蛋白液在20 W 紫外灯下照射2、4、6、8、10、12 h后,以番茄早疫病菌为病原指示菌,采用生长速率法(1.4.1中所述)测定抑菌活性,重复3次。
2 结果与分析
2.1 内生细菌Y-6代谢物的抑菌活性
抗菌蛋白作为植物内生细菌的抗菌物质之一,可以有效防治多种植物病害,已在多种植物内生细菌中被发现。大量研究表明,该类抗菌物质多数耐热性较差[41-43],因此,为明确内生细菌Y-6代谢产物中抗菌物质是否为蛋白质,通过比较室温和高温处理后的抑菌效果差异进行初步判断。结果表明,内生细菌Y-6代谢物在室温下对6种植物病原菌具有一定的抑菌效果,不同病菌之间抑菌效果差异显著,其中对番茄早疫病菌、番茄灰霉病菌和梨黑斑病菌抑菌效果较好,抑菌率分别为90.4%、95.2%和90.1%;对小麦赤霉病菌的抑菌效果最差,抑菌率仅为6.7%;虽然对辣椒枯萎病菌和棉花立枯病菌也表现出一定的抑菌效果,但均低于60%(表1、图1)。说明内生细菌Y-6代谢物在番茄早疫病、番茄灰霉病以及梨黑斑病防治中具有一定的应用价值。代谢物经高温处理后对6种植物病原真菌的抑菌活性均显著下降,抑菌率最高仅为16.6%,说明该抗菌物质耐热性差,推断其可能为对热敏感的蛋白质、肽以及氨基酸类等物质。

表1 内生细菌Y-6对6种植物病原真菌的抑菌效果
注:同行不同小写字母表示在0.05水平差异显著。
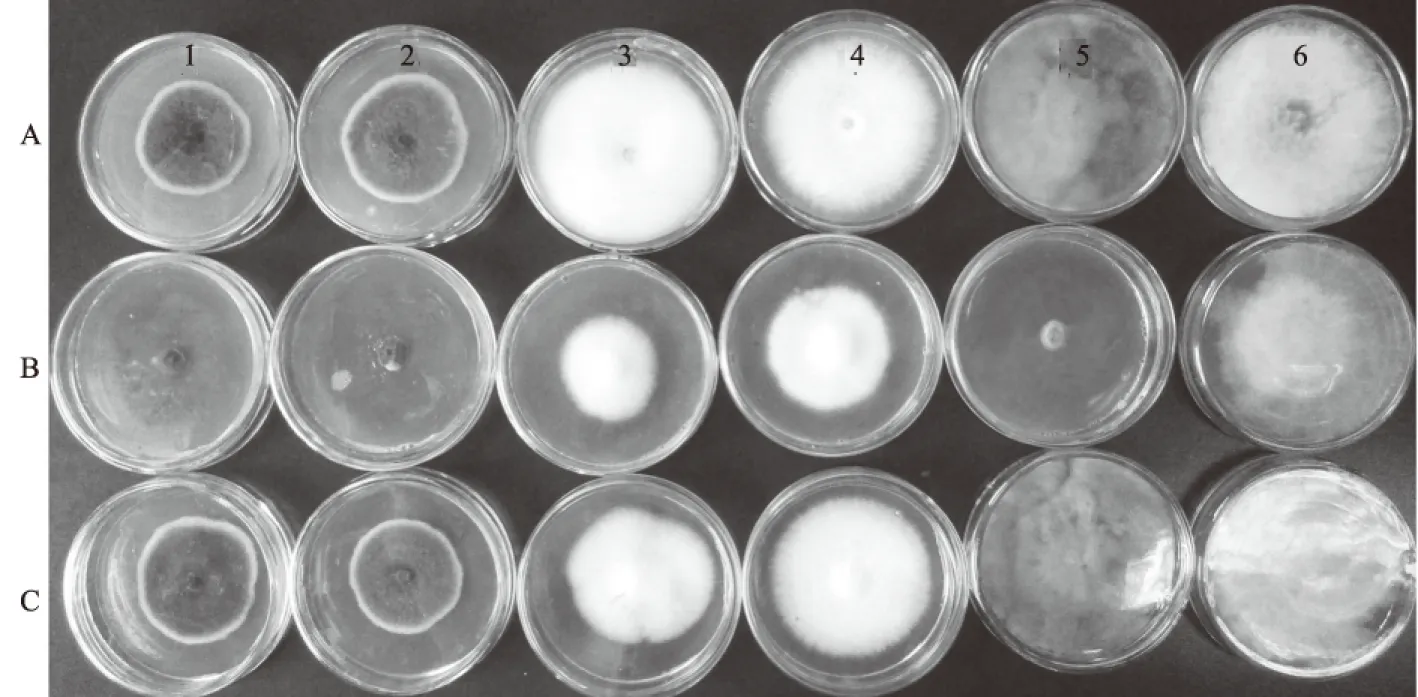
A~C依次为:对照、室温和高温处理;1~6依次为:梨黑斑病菌、番茄早疫病菌、辣椒枯萎病菌、棉花立枯病菌、番茄灰霉病菌和小麦赤霉病菌
2.2 内生细菌Y-6抗菌粗蛋白的抑菌活性及SDS-PAGE检测结果
为进一步确定内生细菌Y-6的抗菌物质是否为蛋白质,采用硫酸铵沉淀法对其粗蛋白进行提取,并以番茄早疫病菌为靶标进行抑菌活性测定,结果表明,硫酸铵沉淀物具有较好的抑菌效果(图2),抑菌率为89.16%。
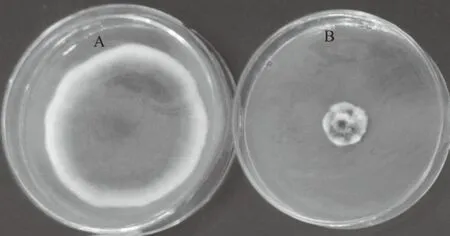
A.对照;B.Y-6粗蛋白处理
SDS-PAGE结果表明,该抗菌物质电泳结束经考马斯亮蓝染色后出现清晰条带(图3),进一步说明该抗菌物质种类为对热敏感的蛋白质。
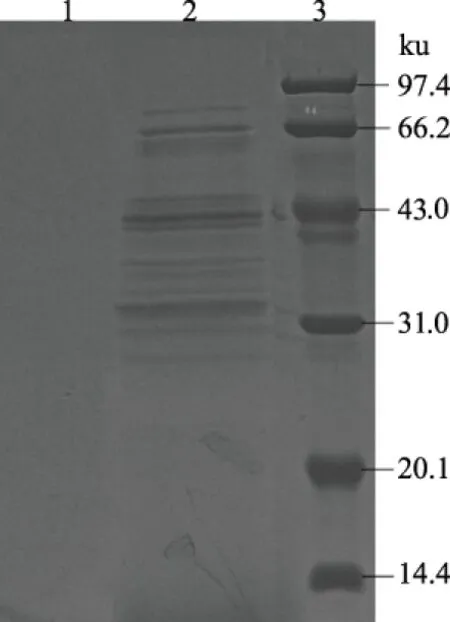
1.对照;2.粗蛋白;3.Marker
2.3 内生细菌Y-6抗菌蛋白硫酸铵沉淀最适饱和度及抑菌活性
不同的蛋白质由于其特性不同,在进行硫酸铵沉淀时所需的饱和度也不尽相同,因此,本研究在确定内生细菌Y-6抗菌物质为蛋白质后,对其最佳硫酸铵沉淀饱和度进行了研究。结果表明,硫酸铵饱和度为20%的沉淀物对番茄早疫病菌和番茄灰霉病菌均无抑菌效果;当硫酸铵饱和度达到40%时,抗菌蛋白开始沉淀并表现微弱的抑菌活性,对番茄早疫病菌和番茄灰霉病菌的抑菌圈直径分别为3 mm和9 mm;饱和度达到60%时,抗菌蛋白开始大量沉淀,抑菌活性明显增强;饱和度为70%的硫酸铵可将抗菌蛋白完全沉淀,其对2种植物病原真菌的抑菌活性最大,抑菌圈直径分别为24 mm和26 mm;饱和度大于80%后,虽然仍有少量沉淀出现但均无抑菌活性(图4)。以上结果说明,70%为内生细菌Y-6抗菌蛋白硫酸沉淀时的最佳饱和度。
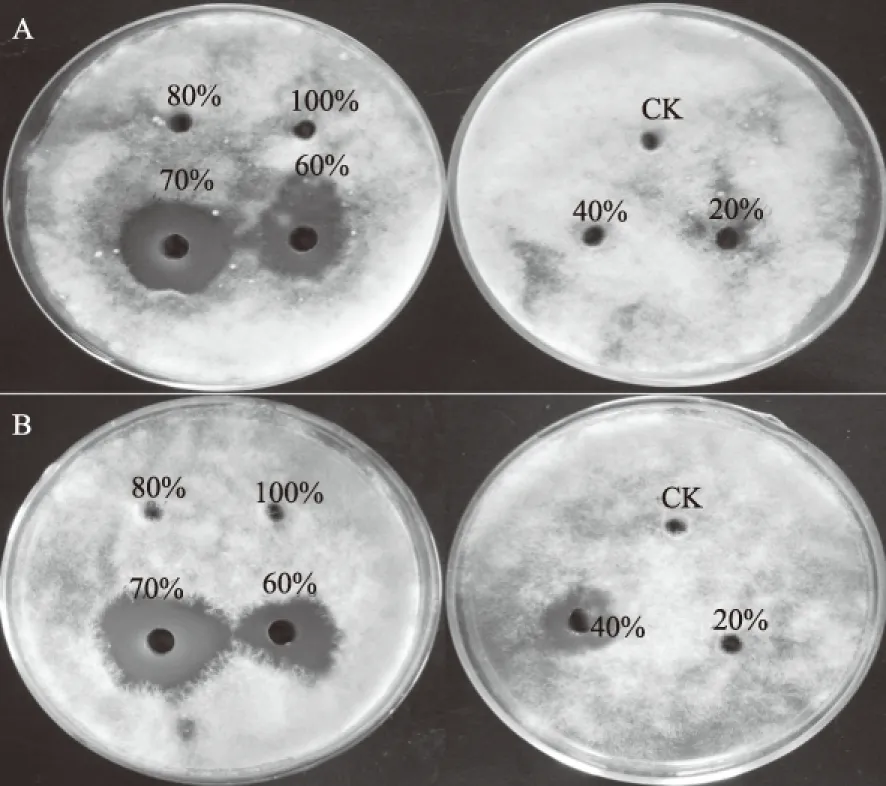
A.番茄早疫病菌;B.番茄灰霉病菌
2.4 内生细菌Y-6抗菌蛋白的稳定性
2.4.1 温度对抗菌粗蛋白抑菌活性的影响 内生细菌Y-6抗菌粗蛋白经不同温度处理后抑菌活性发生显著变化(图5)。随着温度升高,抑菌活性呈现下降趋势,当处理温度≤60 ℃时,抑菌率下降较小,可保持在80%以上;当处理温度提高到80 ℃后,抑菌活性出现明显下降,抑菌率下降至60%附近;当处理温度达到100 ℃后,抑菌活性几乎丧失。说明该抗菌蛋白具有一定的耐热性,在温度不超过80 ℃时可保持60%以上的抑菌活性,尤其在温度低于60 ℃时,几乎保持原有的抑菌效果,表明该抗菌蛋白具有一定的开发应用潜力。
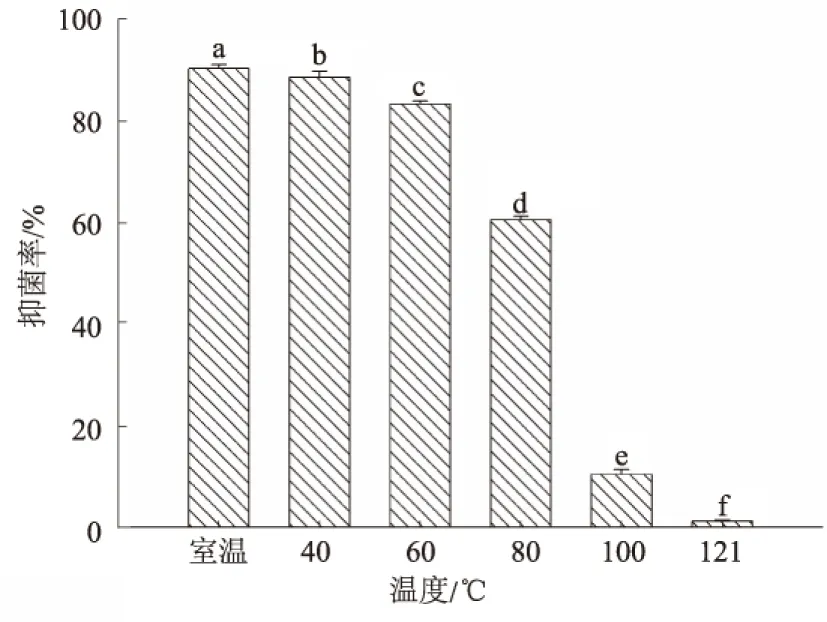
不同小写字母表示在0.05水平差异显著。下同
2.4.2 pH值对抗菌粗蛋白抑菌活性的影响 不同pH值处理对抗菌粗蛋白的抑菌率产生影响。该抗菌蛋白在pH值4~11时较为稳定,抑菌率可保持在60%以上,超过该范围后抑菌率下降速度较快;pH值为5~9时抑菌率较高,均可保持在80%以上;当pH值高于11时,抑菌率出现大幅度下降,pH值为13时,抑菌率几乎下降为0(图6)。以上结果表明,该抗菌蛋白具有一定的抗酸、碱能力。
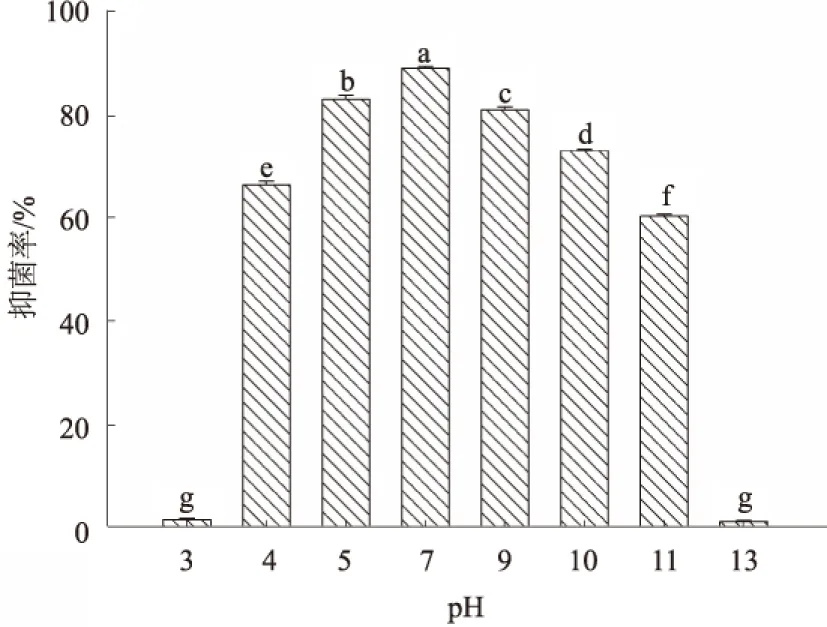
图6 抗菌粗蛋白的酸、碱稳定性
2.4.3 紫外照射对抗菌粗蛋白抑菌活性的影响 内生细菌Y-6抗菌粗蛋白紫外稳定性研究结果表明,该抗菌蛋白在20 W 紫外灯下照射2~12 h后,抑菌活性均无显著性变化(图7),说明该抗菌蛋白对紫外线照射不敏感,具有较好的抗紫外能力。
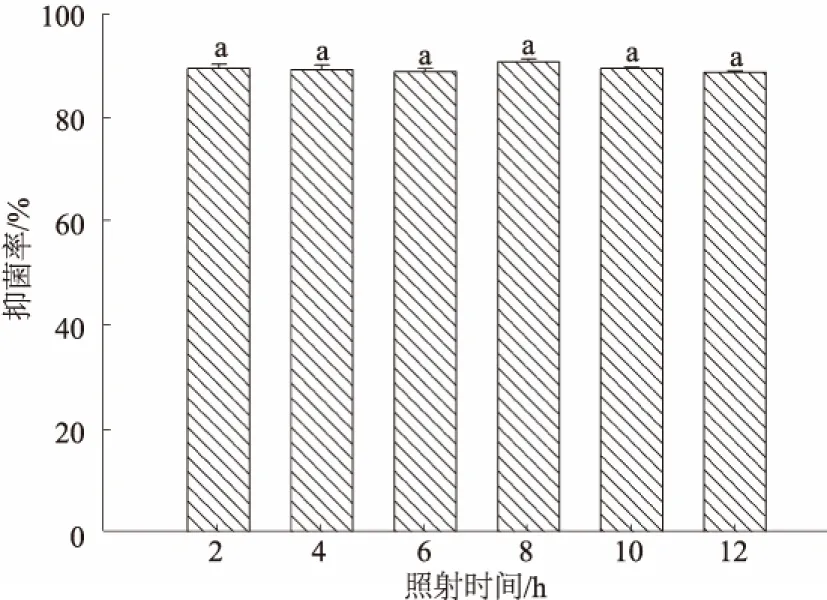
图7 抗菌粗蛋白的紫外稳定性
3 结论与讨论
植物内生细菌作为一类可与宿主和谐共生的微生物,广泛存在于植物体内,是自然界中的一类丰富资源,在医药和农业生产中具有重要作用。虽然目前已从多种植物体内发现了内生细菌,但同已发现的植物种类和植物源药物相比,植物内生细菌的开发还处于起步阶段,需进一步加大开发力度。
本研究以花椒内生拮抗细菌Y-6为研究对象,采用硫酸铵沉淀法对抗菌蛋白进行了提取,并对其抗菌谱和物理特性进行了研究。结果发现,菌株Y-6代谢产物对番茄早疫病菌、番茄灰霉病菌和梨黑斑病菌具有较好的抑菌效果,抑菌率分别为90.4%、95.2%和90.1%,说明菌株Y-6在3种病害防治中具有较好的应用价值;高温处理后,抑菌效果明显下降,说明该抗菌物质可能为对热敏感的蛋白质、氨基酸或肽类物质,这一结果同采俊香等[41]、张宝俊等[42]和蔡光华等[43]的研究结果相似,进一步说明内生细菌抗菌蛋白不具有耐高温特性;为进一步验证抗菌物质是否为蛋白质,采用硫酸铵沉淀法对其粗蛋白进行了提取,用生长速率法以番茄早疫病菌为靶标检测了抑菌活性,发现硫酸铵沉淀物对番茄早疫病菌具有较好的抑菌活性,抑菌率为89.16%,采用SDS-PAGE进行了检测,电泳染色后出现明亮条带,说明该抗菌物质为蛋白质。随后还对该抗菌蛋白的最佳硫酸铵沉淀饱和度进行了研究,结果发现,该抗菌蛋白在硫酸铵饱和度为70%时可沉淀完全,这一结果与陈夕军等[44]、秦楠等[45]和张铎等[46]的研究结果不同,可能是由菌株和来源差异引起的。活性物质的温度、酸、碱以及紫外稳定性是限制其在生物农药开发领域应用的几个重要因素,为明确内生细菌Y-6抗菌蛋白在生物农药开发中的应用潜力,本研究对其相关稳定性进行了测定。结果表明,该抗菌蛋白在pH值4~11、温度低于80 ℃以及紫外照射12 h后均具有较好的稳定性,同水稻内生枯草芽孢杆菌G87[44]相比,具有较好的热、酸和碱稳定性,其与内生解淀粉芽孢杆菌LP-5具有类似的稳定性[42],同生防细菌甲基营养型芽孢杆菌(Bacillusmethylotrophicus)[47]相比稳定性较差,进一步说明不同菌株以及不同来源的菌株可能产生不同性质的抗菌蛋白。
在本研究中将花椒树内生细菌Y-6的抗菌物质确定为蛋白质,并对其粗蛋白的抑菌活性、最佳硫酸铵沉淀饱和度和稳定性进行了研究,关于该抗菌蛋白的种类、抑菌机制、田间应用效果和制剂开发等内容还需进一步完善和研究,其结果可为微生物源生物农药的开发和植物病害生物防治提供一定的参考依据。
[1] 沈颖,王华弟,李仲惺,等.水稻白叶枯病再流行原因分析与防控对策研究[J].中国农学通报,2016,32(24):180-185.
[2] 卜元卿,孔源,智勇,等.化学农药对环境的污染及其防控对策建议[J].中国农业科技导报,2014,16(2):19-25.
[3] 刘永明,葛娜,崔宗岩,等.2012—2014年青岛、深圳、大连三口岸282份进口水果和蔬菜中农药残留监测[J].中国食品卫生杂志,2016,28(4):511-515.
[4] 麻耀君.山西省芹菜农药残留情况检测与分析[J].山西农业科学,2016,44(8):1181-1183.
[5] 梁延坡,谢圣华,符尚娇,等.海南地区小菜蛾对氯虫苯甲酰胺和乙基多杀菌素的抗药性变化趋势[J].应用昆虫学报,2016,53(2):273-278.
[6] 王学贵,罗维,冯晓菲,等.不同地区灰霉病菌株对腐霉利的抗性测定及生理生化研究[J].西南农业学报,2016,29(6):1353-1357.
[7] 吴永官,陆少峰,黄思良,等.华南地区瓜类疫霉对甲霜灵的田间抗药性[J].微生物学报,2011,51(8):1078-1086.
[8] 史晓晶,任璐,陈浩,等.番茄早疫病菌抗啶酰菌胺菌株的适合度及生物学特性[J].植物保护学报,2016,43(3):475-482.
[9] 李晓强,孙跃先,叶光祎,等.使用化学农药对农业生物多样性的影响[J].云南大学学报(自然科学版),2008,30(S2):365-369.
[10] 郭晨.高危农药:健康和环境的杀手[J].生态经济,2016,32(7):6-9.
[11] 陈姗姗,宋述尧.生物农药在无公害蔬菜生产上的应用[J].北方园艺,2006(3):136-137.
[12] 何树文,达世彩.生物农药的国内外发展动态[J].湖北植保,2013(5):60-62.
[13] 纪明山,谷祖敏,张杨.生物农药研究与应用现状及发展前景[J].沈阳农业大学学报,2006,37(4):545-550.
[14] 邱德文.生物农药与生物防治发展战略浅谈[J].中国农业科技导报,2011,13(5):88-92.
[15] 杨成德,王玉琴,陈秀蓉,等.2种嵩草属牧草休眠期内生细菌多样性研究[J].草业学报,2016,25(8):136-144.
[16] 林吉恒,王睿之,马风兰,等.植物益生菌对植物的益生效应及其应用[J].中国生物防治,2010,26(S1):100-105.
[17] Yang P,Sun Z,Liu S,etal.Combining antagonistic endophytic bacteria in different growth stages of cotton for control ofVerticilliumwilt[J].Crop Protection,2013,47:17-23.
[18] Duan J,Li X,Gao J,etal.Isolation and identification of endophytic bacteria from root tissues ofSalviamiltiorrhizaBge.and determination of their bioactivities[J].Annals of Microbiology,2013,63(4):1501-1512.
[19] Amaresan N,Jayakumar V,Kumar K,etal.Isolation and characterization of plant growth promoting endophytic bacteria and their effect on tomato(Lycopersiconesculentum) and chilli(Capsicumannuum) seedling growth[J].Annals of Microbiology,2012,62(2):805-810.
[21] 钮旭光,韩梅,宋立超,等.翅碱蓬内生细菌鉴定及耐盐促生作用研究[J].沈阳农业大学学报,2011,42(6):698-702.
[22] 卞光凯,张越己,秦盛,等.南通沿海滩涂耐盐植物重金属抗性内生细菌的筛选及生物多样性[J].微生物学报,2011,51(11):1538-1547.
[23] Zhang X,Liu X,Wang Q,etal.Diesel degradation potential of endophytic bacteria isolated fromScirpustriqueter[J].International Biodeterioration & Biodegradation,2014,87:99-105.
[24] 董云岚,魏玉群,赵一鹏.太行山区花椒的种质资源及分布[J].林业科技通讯,1997(9):20-22.
[25] 肖正春,张卫明.花椒的主要品种及其开发利用[J].中国野生植物资源,2016,35(1):60-63.
[26] 吕增芳.花椒树蚜虫危害严重的原因及防治建议[J].山西果树,2010(1):39-40.
[27] 杨晓凤,程全民,李强,等.花椒树主要病虫害及其防治[J].北方园艺,2007(3):200.
[28] 李彦东.花椒树主要害虫的发生规律及综合防治[J].河北林业科技,2004(6):39-40.
[29] 张家权.花椒树整形修剪及肥水管理[J].现代园艺,2016(12):24.
[30] 刘苏萌,王丽娟,宋会银.花椒产香内生真菌的分离鉴定及其挥发性成分分析[J].中国调味品,2013,38(6):99-102.
[31] 王锐清,郭盛,段金廒,等.花椒果实不同部位及其种子油资源性化学成分分析与评价[J].中国中药杂志,2016,41(15):2781-2789.
[32] 张敬文,赵镭,史波林,等.花椒果皮中化学成分的研究[J].华西药学杂志,2016,31(2):109-112.
[33] 祝瑞雪,曾维才,赵志峰,等.汉源花椒精油的化学成分分析及其抑菌作用[J].食品科学,2011,32(17):85-88.
[34] 周江菊,任永权,雷启义.樗叶花椒叶精油化学成分分析及其抗氧化活性测定[J].食品科学,2014,35(6):137-141.
[35] 李姝江,朱天辉,谯天敏,等.花椒根腐病生防芽孢杆菌的筛选鉴定及定殖和防治效果[J].西北农林科技大学学报(自然科学版),2016,44(4):114-122.
[36] 陈冲,李霄洁,赵志峰,等.产L-酪氨酸花椒内生菌的分离鉴定[J].现代食品科技,2016,32(2):66-72.
[37] 高振峰,张宝俊,刘慧芹,等.酸枣内生真菌的分离及抑菌活性测定[J].山西农业大学学报(自然科学版),2014,34(2):121-123.
[38] 方中达.植病研究方法[M].3版.北京:中国农业出版社,1998:122-125.
[39] 翟茹环.枯草芽孢杆菌G8抗菌物质的理化性质分析及分离纯化[D].泰安:山东农业大学,2008.
[40] 赵胜民,郑来久,杜冰.琼脂扩散法测定罗布麻韧皮中酮类物质的抑菌活性[J].科技导报,2009,27(7):37-40.
[41] 采俊香,王强.抱茎苦荬内生细菌的分离及其抑菌活性研究[J].中国植保导刊,2014,34(11):19-23.
[42] 张宝俊,张家榕,韩巨才,等.内生解淀粉芽孢杆菌LP-5抗菌蛋白的分离纯化及特性[J].植物保护学报,2010,37(2):143-147.
[43] 蔡光华,战峰,王晓玲.苹果树腐烂病拮抗内生细菌PG-10-8-11v菌株抗菌物质的初步研究[J].西南民族大学学报(自然科学版),2011,37(6):946-949.
[44] 陈夕军,李娟,孙启利,等.水稻内生枯草芽孢杆菌G87抗菌蛋白的分离纯化及理化特性[J].微生物学报,2010,50(10):1353-1357.
[45] 秦楠,郝林,李鑫.解淀粉芽孢杆菌HRH317抗菌蛋白的分离纯化及其抗菌作用[J].植物保护学报,2015,42(5):813-819.
[46] 张铎,谢莉,张蕾,等.棉花黄萎病拮抗内生菌的筛选鉴定及抗菌物质研究[J].河北师范大学学报(自然科学版),2008,32(5):673-678.
[47] 姜云,许鹏,陈长卿,等.Bacillusmethylotrophicus菌株产抗菌蛋白性质及对人参锈腐病菌抑菌作用[J].农药,2013,52(11):835-838.
Antagonistic Activity and Stability of Antifungal Protein of Endophytic Bacterium Y-6 fromZanthoxylumbungeanumagainst Plant Pathogenic Fungi
DU Bin1,LI Na2,LI Yan1*
(1.Taiyuan University,Taiyuan 030012,China; 2.Shanxi Agricultural Information Technology Center,Taiyuan 030006,China)
In order to determine the type and characteristic of antifungal substance synthesized by the endophytic bacterium Y-6 fromZanthoxylumbungeanumand rich the source of bio-pesticide,growth rate method,ammonium sulfate precipitation and SDS-polyacrylamide gel electrophoresis(SDS-PAGE) were used to study the antifungal activity,types,optimal ammonium sulfate saturation and stability.Results showed that secondary metabolites had significant antifungal activity againstAlternariasolani,BotrytiscinereaandAlternariaalternate.The inhibitory rates were 90.4%,95.2% and 90.1%,respectively.The antifungal substance was identified as protein and could be completely precipitated at 70% ammonium sulfate saturation.The inhibition zone diameters of the antifungal protein againstA.solaniandB.cinereawere 24 mm and 26 mm,respectively.Besides,the antifungal protein still had good antifungal activity at pH value of 4—11,below 80 ℃ and after 12 h of UV irradiation.Therefore,it has good potential in the development of bio-pesticide.
Zanthoxylumbungeanum; endophytic bacteria; antifungal protein; antifungal activity; stability; bio-pesticide
2016-11-10
山西省教育厅科研基金项目(GH-13181)
杜 宾(1980-),男,山西交城人,讲师,硕士,主要从事植物保护研究。E-mail:Dubin0351@163.com
*通讯作者:李 燕(1971-),女,山西太原人,副教授,硕士,主要从事园林有害生物防治研究。 E-mail:Liyan0351@126.com
S476
A
1004-3268(2017)06-0067-07
