叶绿素降解工程菌株的构建
2017-07-05杨宗灿彭玉富马宇平
杨宗灿,张 展,彭玉富,侯 佩,聂 聪,马宇平*
(1.河南中烟工业有限责任公司 技术中心,河南 郑州 450000;2.郑州轻工业学院 食品与生物工程学院,河南 郑州450001)
叶绿素降解工程菌株的构建
杨宗灿1,张 展1,彭玉富1,侯 佩2,聂 聪1,马宇平1*
(1.河南中烟工业有限责任公司 技术中心,河南 郑州 450000;2.郑州轻工业学院 食品与生物工程学院,河南 郑州450001)
为特异、高效地降解烟叶中的叶绿素,从模式植物拟南芥中克隆获得了叶绿素酶基因AtCLH1片段,大小为975 bp。通过构建表达载体pET28a-AtCLH1,并转化大肠杆菌BL21,获得了重组工程菌株。该菌株在30 ℃下,经0.5 mmol/L IPTG诱导培养22 h,可较好地表达重组蛋白AtCLH1,蛋白质电泳图谱显示其大小约为35 ku。该菌株的叶绿素酶活力可达24.9 U/mL,能够明显降解烟叶提取物中的叶绿素,在提升低次烟叶品质方面具有很好的应用前景。
烟叶; 工程菌株; 叶绿素酶基因; 重组蛋白; 叶绿素降解
叶绿素是高等绿色植物进行光合作用、吸收光能和光能转化的主要色素类物质,包括叶绿素a、叶绿素b、脱镁叶绿素等[1-2]。叶绿素是烟草生长过程中烟叶进行碳氮代谢的基础[3-6]。一般在烟叶成熟和调制过程中,叶绿素大量降解,其降解率可达99%,常以痕量存在[7-8]。但若降解不完全,烟叶烤后易形成不同程度的“青黄烟”[9],这部分烟叶在燃吸时,会产生明显的青杂气,严重影响烟叶的外观品质与内在品质[10-11]。因此,探索有效方法,充分降解烟叶中的叶绿素,是提升低次烟叶(尤其是青黄烟叶、微带青烟叶)品质的重要途径。
叶绿素酶普遍存在于高等植物中[12],是介导叶绿素降解反应的关键酶之一,主要位于植物叶绿体内膜上[13],质体外也有分布[14]。该酶由叶绿素酶基因编码,目前已经克隆出的叶绿素酶基因共有4个,分别是藜叶绿素酶基因CaCLH、柑橘叶绿素酶基因CHLASE1以及拟南芥叶绿素酶基因AtCLH1、AtCLH2[15]。本研究采用分子生物学方法,根据NCBI数据库中模式植物拟南芥叶绿素酶基因AtCLH1的完整ORF设计引物,从拟南芥中克隆获得AtCLH1基因片段,构建重组表达质粒载体pET28a-AtCLH1,将其导入大肠杆菌,从而获得重组工程菌株,并对其进行诱导表达与叶绿素酶活力检测,旨在为工程菌株在烟叶加工中的进一步应用奠定基础。
1 材料和方法
1.1 仪器
温度梯度PCR扩增仪购自德国Eppendorf公司,凝胶设备成像仪购自上海思伯明仪器设备有限公司,5417R高速冷冻离心机购自德国Eppendorf公司,桌面式超净工作台购自苏州净化有限公司,HZQ-F100全温振荡培养箱购自太仓市华美生化仪器厂,D-1型全自动高压蒸汽灭菌锅购自上海乔跃电子有限公司,电热恒温水槽购自上海精宏实验设备有限公司,SPX-150B-Z型生化培养箱购自上海博迅实业有限公司,UV-2550紫外分光光度计购自Shimadzu公司,超声破碎仪购自日本Taitec公司。
1.2 酶与试剂
限制性内切酶、TaqDNA聚合酶、Pfu DNA聚合酶均购自TaKaRa公司,质粒小提试剂盒、胶回收试剂盒、PCR产物纯化试剂盒、加A反应液均购自TIANGEN公司,Ligation high连接试剂盒购自TOYOBO公司,氨苄青霉素、卡那霉素等抗生素均购自Sigma公司,DNA琼脂糖凝胶电泳染色剂购自北京博大泰克公司,其他试剂和缓冲液均购自上海生工公司,PCR引物合成和测序在上海博尚生物技术有限公司进行。
1.3 拟南芥总RNA的提取与反转录
取生长10~15 d的新鲜拟南芥叶片约100 mg,放入液氮预冷过的研钵中,迅速将叶片研磨成粉末,将粉末转移至1.5 mL离心管中,采用Trizol法进行RNA的提取。
将RNA样品进行DNase消化,ACTIN-PCR检测样品中是否残留DNA。待检测无DNA残留、污染后,对提取的拟南芥总mRNA进行反转录获得cDNA,具体步骤为:取2 μg RNA样品于1.5 mL离心管中,加入2 μL 10 mmol/L dNTP mixture、1 μL Primer oligo(dT);70 ℃加热5 min,冰上静置2 min;加入4 μL 5×Reaction Buffer、1 μL RNase inhibitor、1 μL Reverse transcriptase;轻轻混匀后,42 ℃下放置60 min,再于80 ℃下放置5 min;最后保存于4 ℃。
1.4 拟南芥叶绿素酶基因AtCLH1的克隆
从基因数据库中(http://www.ncbi.nlm.nih.gov)获取拟南芥叶绿素酶基因(AtCLH1)全长CDS序列,以此为基础设计以下引物:5′-GCGGAATTCATGGCGGCGATAGAGGACAG-3′(引物1,加EcoR Ⅰ 酶切位点),5′-CCGCTCGAGCTAGACGAAGATACCAGAAG-3′(引物2,加XhoⅠ 酶切位点)。
以上述拟南芥全cDNA为模板进行PCR扩增,50 μL扩增体系中加入10 ×高保真PCR Buffer 5 μL,10 mmol/L dNTP mixture 1 μL,50 mmol/L MgSO42 μL,10 μmol/L的引物1、2各1.5 μL,cDNA 2.0 μL,Pfu DNA聚合酶0.2 μL,ddH2O 36.8 μL。PCR程序为:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火40 s,68 ℃延伸75 s,35个循环;68 ℃延伸10 min;4 ℃保存。PCR产物经电泳检测后,用凝胶回收试剂盒进行回收,利用TIANGEN公司的加A反应液进行AtCLH1片段加A反应,用PCR产物纯化试剂盒纯化加A的AtCLH1片段。将纯化后加A的AtCLH1片段连接到pMD18-T载体上,然后转化大肠杆菌DH5α感受态细胞,经菌落PCR鉴定与EcoRⅠ、XhoⅠ双酶切验证后,选择阳性克隆进行质粒提取,送至上海博尚生物技术有限公司进行测序。
1.5 表达载体的构建
用质粒提取试剂盒提取pMD18T-AtCLH1和pET28a质粒DNA,然后用EcoRⅠ和XhoⅠ对二者进行双酶切,用胶回收试剂盒回收AtCLH1基因片段和pET28a载体片段。用Ligation high连接试剂盒将AtCLH1片段与pET28a载体进行连接,将连接产物转化大肠杆菌DH5α感受态细胞,挑取单菌落进行菌落PCR鉴定与双酶切验证,筛选阳性克隆进行质粒提取。
1.6 工程菌株的构建与目的基因的诱导表达
将pET28a-AtCLH1转化大肠杆菌BL21感受态细胞,完成重组工程菌株的构建。挑取新鲜活化的单菌落进行摇菌培养,至菌液OD600为0.6时,加入不同浓度的IPTG,在30 ℃诱导培养22 h,离心收获菌体。
将菌体重悬,调整菌液浓度至OD600为2.0,取20 μL菌液与等体积的2×Loading Buffer混合均匀,100 ℃水浴10 min,再于冰上静置3~5 min,重复以上操作5次后,用SDS-PAGE电泳检测。电泳完毕后,用考马斯亮蓝染色液进行染色,脱色后观察电泳条带,看是否有特异蛋白质的表达。
1.7 重组工程菌的叶绿素酶活力测定
1.7.1 粗酶液的制备 挑取含有pET28a-AtCLH1的重组工程菌株单菌落进行过夜摇菌培养,4 ℃、12 000 r/min离心10 min收获菌体,用Tris-HCl缓冲液重悬,调整OD600为2.0,然后进行超声波破碎细胞,超声条件为有效功率200 W、有效时间10 min(作用3 s、间隙7 s)。破碎结束后,8 000 r/min、4 ℃离心15 min,取上清液进行酶活力测定。
1.7.2 叶绿素底物的制备 用刀片将新鲜烟叶切成直径小于1 mm的细丝,取3.0 g切好的叶丝加入30 mL无水乙醇中,用铝箔纸将其包裹,以防叶绿素见光分解。黑暗条件下浸泡提取过夜,离心后取上清液与蒸馏水混合(比例为1∶1),作为叶绿素底物液。1.7.3 重组蛋白的叶绿素酶活力测定 取1 mL粗酶液,加入到2 mL叶绿素底物液中,混匀后立即用分光光度计检测720 nm处吸光值,读取起始数据(A),准确计时20 min后,读取OD720值(B)。对照样品为相同处理条件下含有空载体pET28a质粒的大肠杆菌 BL21感受态转化菌株。工程菌粗酶液与对照样品粗酶液均测量6次,取平均值。叶绿素酶活力定义为单位时间(1 min)内反应体系变化0.001 OD720值为1个酶活力单位(1 U);样品酶活力=N×(A-B)×103/20,其中N为样品稀释倍数。
2 结果与分析
2.1AtCLH1的克隆与测序
以反转录获得的拟南芥cDNA为模板,用设计的特异性引物进行PCR扩增,结果如图1所示,目的基因AtCLH1片段大小约为975 bp。将AtCLH1片段进行回收,对其进行尾部加A反应并纯化,之后与pMD18-T载体连接,转化大肠杆菌DH5α感受态细胞,并进行菌落PCR鉴定(图2A)与EcoRⅠ、XhoⅠ双酶切验证(图2B)。2号克隆能在975 bp位置扩增出清晰明显的目的条带,且双酶切后在975 bp位置也可获得目的条带,故选择2号阳性克隆进行质粒提取,送至上海博尚生物技术有限公司进行测序,测序结果正确,可用于后续试验。
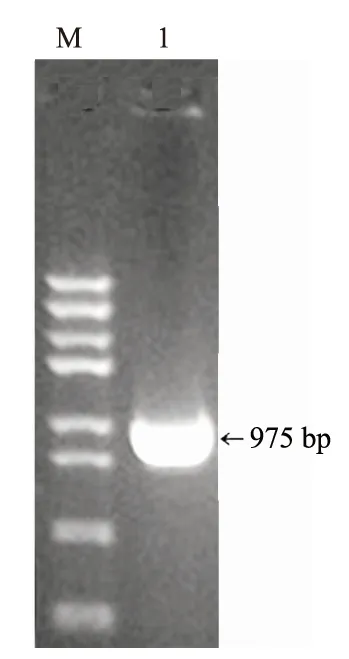
M.Trans DNA Marker Ⅲ; 1.AtCLH1片段扩增产物
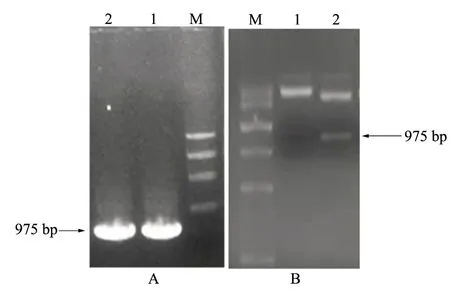
A为菌落PCR扩增结果; B为双酶切结果; M.Trans DNA Marker Ⅲ; 1、2均为从平板上挑选的阳性克隆,其中1号克隆酶切结果无目标条带,2号克隆有明显的目标条带
2.2 表达载体的构建
用限制性内切酶EcoRⅠ和XhoⅠ将AtCLH1片段从pMD18T-AtCLH1载体上双酶切下来,与同样经过EcoRⅠ和XhoⅠ双酶切后的表达载体pET28a连接,转化大肠杆菌DH5α感受态细胞,得到重组质粒pET28a-AtCLH1。经菌落PCR鉴定与双酶切验证,证明AtCLH1已成功插入到表达载体pET28a中(图3)。
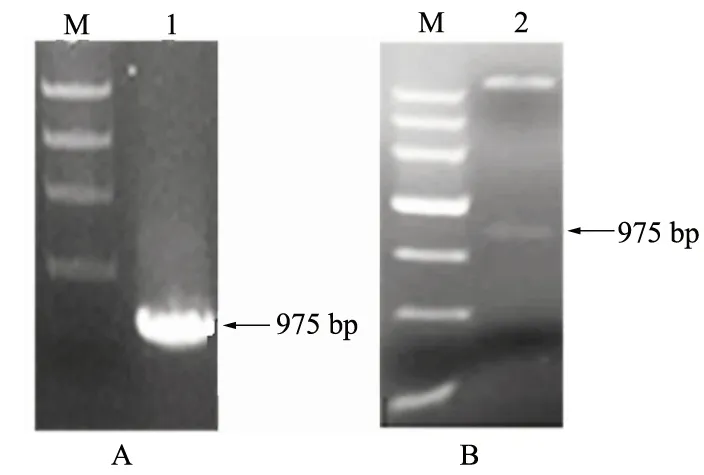
A.菌落PCR扩增结果; B.双酶切结果; M.Trans DNA Marker Ⅲ;1.菌落PCR扩增出的目的条带; 2.表达载体pET28a-AtCLH1双酶切出的目的条带
2.3 目的基因的诱导表达
将pET28a-AtCLH1转化大肠杆菌BL21感受态细胞,构建重组工程菌株,并对其进行目的基因诱导表达。在30 ℃下,加入不同浓度的IPTG进行诱导,收集菌体后进行细胞破碎,对全细胞液进行SDS-PAGE检测,结果如图4所示,在各浓度梯度下,目的蛋白AtCLH1均有所表达,且大小均在35 ku左右。当IPTG浓度为0.5 mmol/L时,重组蛋白AtCLH1的表达量最高。说明重组工程菌株能很好地表达目的蛋白AtCLH1。
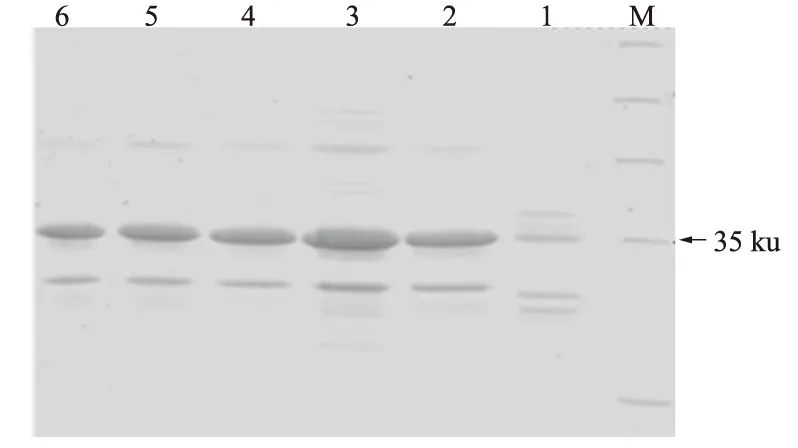
M.蛋白质标准分子质量Marker; 1.含有空载体pET28a的E.coli全细胞液(对照组); 2—6.含有表达载体pET28a-AtCLH1的E.coli全细胞液,IPTG浓度依次为0.2、0.5、1.0、2.0、2.2 mmol/L
2.4 重组工程菌的叶绿素酶活力
对含有pET28a-AtCLH1的重组工程菌的叶绿素酶活力进行测定,根据酶活力定义及酶活力公式,计算得出对照组酶活力为0.3 U/mL,试验组酶活力为24.9 U/mL,说明工程菌具有良好的叶绿素酶活力,可明显降解叶绿素底物。
3 结论与讨论
本研究以拟南芥全cDNA为模板,根据NCBI数据库中拟南芥AtCLH1编码序列设计特异性引物,克隆获得了叶绿素酶基因AtCLH1片段,该片段大小为975 bp。将AtCLH1片段与pET28a载体连接,转化大肠杆菌DH5α感受态细胞,构建了表达载体pET28a-AtCLH1。进一步将pET28a-AtCLH1转化大肠杆菌BL21感受态细胞,构建了重组工程菌株。该菌株在30 ℃下,经0.5 mmol/L IPTG诱导培养22 h后,可高效表达重组蛋白AtCLH1,大小约为35 ku。叶绿素酶活力测定结果表明,工程菌株具有良好的叶绿素酶活力,其酶活力达24.9 U/mL,可明显降解叶绿素底物。
有研究表明,烟叶中的叶绿素在降解过程中可形成新植二烯和呋喃等致香前体物质[9],因此,近年来,国内外学者围绕如何有效降解烟叶中的叶绿素开展了一系列研究,但由于缺乏市售的叶绿素酶成品,传统方法仍是通过提取新鲜烟叶中的叶绿素酶制成酶溶液,并结合其他物质施加在烟叶表面进行处理,该方法虽然有一定的效果,但需要消耗大量的原材料,成本高,且容易混入其他杂质,从而加重对烟叶吸食品质的不利影响。本研究通过构建重组工程菌株,将真核生物拟南芥中的叶绿素酶基因AtCLH1在原核生物大肠杆菌表达系统中进行表达,为降低烟叶中叶绿素含量提供了很好的手段。由于大肠杆菌表达系统具有基因操作简便、培养条件简单、培养周期短、成本低、产量高、易于规模化等优点[16],避免了从新鲜烟叶中提取叶绿素酶的繁琐与高成本,克服了市场上无叶绿素酶成品出售的不足,为工程菌株进一步在烟叶中的应用奠定了良好的基础。
[1] 左天觉.烟草的生产、生理和生物化学[M].上海:上海远东出版社,1993.
[2] 王慧琴,冯美臣,李广信,等.基于高光谱和HJ-1 CCD的水旱地冬小麦叶绿素含量反演[J].山西农业科学,2014,42(8):821-826.
[3] 过伟民,尹启生,宋纪真.烟草质体色素及其降解产物影响因素研究进展[J].华北农学报,2008,23(增刊):358-362.
[4] 张向前,杜世州,曹承富,等.烟农19叶绿素荧光、光合特性及产量对播期和密度的响应[J].华北农学报,2014,29(2):133-140.
[5] 李旭华,扈强,潘义宏,等.不同成熟度烟叶叶绿素含量及其与SPAD值的相关分析[J].河南农业科学,2014,43(3):47-52,58.
[6] 毛家伟,翟文汇,孙大为,等.覆盖方式和钾施用量对烤烟生长、叶绿素含量及产质量的影响[J].河南农业科学,2015,44(3):36-39.
[7] Amin A M.Dynamic transformation of chemical corrstituents during flue-curing ofNicotianatabacumL.[D].Raleigh:North Carolina State University,1979.
[8] 裴晓东,路晓崇,唐付林,等.湖南烟区烤烟散叶烟箱烘烤过程中的生理生化研究[J].河南农业科学,2016,45(8):144-148.
[9] 赵铭钦,刘金霞,黄永成,等.烟草质体色素与烟叶品质的关系综述[J].中国农学通报,2007,23(7):135-138.
[10] 宫长荣.烟草调制学[M].北京:中国农业出版社,2003:91-119.
[11] 郭瑞,曾榕,张金鑫,等.低温后不同光强对烤烟幼苗叶片活性氧代谢和叶绿素荧光参数的影响[J].华北农学报,2015,30(增刊):225-230.
[12] 杨晓棠,张昭其,徐兰英,等.植物叶绿素的降解[J].植物生理学通讯,2008,44(1):7-14.
[13] Matile P,Schellenberg M,Vicentini F.Localization of chlorophyllase in the chloroplast envelope[J].Planta,1997,201(1):96-99.
[14] Satoh H,Nakayama K,Okada M.Molecular cloning and functional expression of a water-soluble chlorophyll protein,a putative carrier of chlorophyll molecules in cauliflower[J].J Biol Chem,1998,273(46):30568-30575.
[15] 唐蕾.叶绿素酶研究的新进展[J].生命的化学,2002,22(4):373-374.
[16] Panavas T,Sanders C,Butt T R.SUMO fusion technology for enhanced protein production in prokaryotic and eukaryotic expression systems[J].Methods Mol Biol,2009,497(6):303-317.
Construction of Chlorophyll Degradation Engineering Bacteria
YANG Zongcan1,ZHANG Zhan1,PENG Yufu1,HOU Pei2,NIE Cong1,MA Yuping1*
(1.Technology Center,China Tobacco Henan Industrial Co.,Ltd.,Zhengzhou 450000,China;2.College of Food and Biological Engineering,Zhengzhou University of Light Industry,Zhengzhou 450001,China)
For the specific and efficient degradation of chlorophyll in tobacco leaves,the chlorophyllase geneAtCLH1 containing a full coding region of 975 bp was cloned fromArabidopsisthaliana.AtCLH1 gene was cloned into vector pET28a,and the vector was then transformed intoE.coliBL21 cells,finally the recombinant engineering bacterium was obtained.After culturing under 30 ℃ for 22 h,the protein AtCLH1 could express well with 0.5 mmol/L IPTG(isopropy-β-D-thiogaIactopyranoside) as inducer.Sodium dodecyl sulfate(SDS) fingerprint results showed that the molecular mass of AtCLH1 was 35 ku.The activity of AtCLH1 was 24.9 U/mL,which could degrade the chlorophyll in tobacco extract and had a good application prospect in improving the quality of low quality tobacco.
tobacco leaf; engineering bacteria; chlorophyllase gene; recombinant protein;chlorophyll degradation
2016-12-03
河南中烟工业有限责任公司科学研究和技术开发计划项目(2009002)
杨宗灿(1985-),男,河南郑州人,工程师,硕士,主要从事植物生理学与生物化学研究。E-mail:974866606@qq.com
*通讯作者:马宇平(1965-),男,河南许昌人,研究员,硕士,主要从事烟草香味化学研究。E-mail:mayp159659@126.com
Q812;TS41+4
A
1004-3268(2017)06-0039-04
