茭白茎部CTK及ABA含量动态变化分析
2017-07-05邢阿宝崔海峰俞晓平张雅芬叶子弘
邢阿宝,崔海峰,俞晓平,张雅芬,叶子弘
(中国计量大学 生命科学学院 浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018)
茭白茎部CTK及ABA含量动态变化分析
邢阿宝,崔海峰,俞晓平,张雅芬,叶子弘
(中国计量大学 生命科学学院 浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018)
通过比较分析正常茭白与灰茭两种膨大表型茎部发育期间的CTK和ABA含量的动态变化,探索茭白茎部菰黑粉菌生长分布与CTK和ABA含量变化的调节关系.本实验以灰茭和正常茭不同发育时期茎部为实验材料,并采用酶联免疫吸附分析法(简称ELISA)测定实验材料内CTK和ABA的含量,结果表明,灰茭茎部CTK含量峰值出现在孢子形成期,可能与灰孢子的增殖有关,而正常茭出现在分蘖期,可能与茭白组织不断分裂有关;ABA激素在灰茭茎部含量一直较高,在孢子形成期后期达到峰值,正常茭在8叶期和膨大期较高,内源激素ABA的高水平表达可能是由菰黑粉菌侵染茭白以及大量繁殖引起的.总体上CTK和ABA在灰茭和正常茭白内的关系不是单一的,而是相辅相成的.
茭白;肉质茎;菰黑粉菌;脱落酸;细胞分裂素
茭白,古称菰,是一种禾本科菰属(ZizanialatifoliaTurcz)多年生草本植物,多生长在水田或沼泽等湿地,属无性繁殖,原产于中国和东南亚地区,现主要在我国江南一带大面积种植[1],是我国第二大水生蔬菜[2].茭白口感微甜,营养丰富[3],深受广大消费者的喜爱.除了正常茭白,田间也会经常看到一些看似正常膨大的茭白,但其肉质茎部充满了灰褐色的冬孢子堆,无法食用[4].这主要是由于不同类型菰黑粉菌小种侵染茭白后产生的,研究发现菰黑粉菌活体营养专性寄生在茭白植株[5],能够使茭白茎部发生膨大,不论正常茭还是灰茭,但正常茭是由菌丝型(M-T型)的菰黑粉菌侵染后形成的,而灰茭是由孢子型(T型)的菰黑粉菌侵染后产生的[6-7];正常茭可以食用,并具有经济价值,而灰茭在实际生产上没有价值,且会影响周围正常茭白正常生长,因此一旦形成灰茭即应人工去除[8].
植物内源激素是植物自身产生的一类有机物质,极易穿透细胞壁,可在植物体内自由移动,极微量的条件下即可产生显著的生理生化作用[9],对植物的生长十分关键.目前,公认的植物激素主要包括生长素(auxin)、细胞分裂素(cytokinin,CTK)、赤霉素(gibberellin)、乙烯(ethylene)、脱落酸(abscisicacid, ABA)等[10].
CTK是一类促进细胞分裂、诱导芽的形成并促进其生长的植物激素,主要分布于一些细胞分裂活跃的组织如根尖、茎尖[11]和萌发的种子中[12].细胞分裂素在植物内运输是非极性的,随植物的蒸腾作用向地上部分运输[13],外源喷施的细胞分裂素如果喷施于叶片主脉部分,则可进入输导系统进行双向运输,但如直接喷施于叶肉或侧芽上则不能移动[14].细胞分裂素最显著的生理作用就是能促进细胞分裂和诱导细胞扩大[15].Chan等人[16]检测菰黑粉菌厚坦孢子分泌的激素,发现CTK含量最高,推测CTK是刺激茭白肉质茎膨大的主要激素.另外,江解增[17]等人研究发现在茭白生长发育过程中地上各部位(茎尖、叶片和叶鞘)的激素以CTK含量最高,且CTK含量在茭白肉质茎膨大前期明显上升,在膨大后期开始下降,与张强[18]研究结果基本一致.CTK除了在诱导植物器官分化[19]、解除植物顶端优势[20-21]、延缓叶片衰老[22-23],还对植物开花和性别分化[24-25]具有一定的作用.
ABA同样是植物内重要的内源激素.因为植物在逆境条件下内源ABA含量会显著增加,ABA也常被称为胁迫激素.ABA广泛参与植物的生长发育和多种生物及非生物胁迫反应的调控.其主要的生理作用是促进成熟或衰老植物器官脱落.此外,ABA还具有诱导气孔关闭[26]、提高植物抗逆性[27]、调控植物侧根生长[28]和植物芽休眠[29]等作用.近年研究表明,脱落酸在植物与病原菌互作中同样扮演着重要的角色[30].由于外界环境条件、植物生理状况、病原菌种类差异以及脱落酸信号系统的复杂性,脱落酸在植物与病原菌的互作反应中表现出多重效应,既可协助植物抵御病原菌[31],也可协助病原菌侵染植物[32],并且越来越多的学者开始这方面的研究,其作用机制与规律也正在逐渐被揭示.如张强等人[18]研究推测ABA含量在茭白肉质茎膨大初期的下降可能与菰黑粉菌的侵染有关.另外,也有研究发现ABA能够显著促进愈伤组织内非还原糖的合成[33],同时在ABA的作用下引起淀粉磷酸酶活性增加,促进了淀粉的积累,还有研究证明蔗糖的合成对ABA敏感[34],而在茭白膨大初期,肉质茎中总糖及还原糖含量迅速增加[35],可能与ABA含量的增加有关.
虽然已有少量研究对茭白CTK和ABA含量进行了分析,但尚未见二者在正常茭和灰茭之间的差异比较.本文比较了CTK和ABA激素在灰茭和正常茭不同发育时期内的含量动态变化,以期在前人研究成果的基础上,探寻CTK和ABA含量的动态变化与正常茭、灰茭形成的可能机制之间的关系,为茭白的优质、高产研究提供理论基础.
1 材料与方法
1.1 材料及试验处理
以龙茭2号不同发育时期灰茭和正常茭膨大肉质茎为试验材料.材料取自于浙江省桐乡市董家村茭白种植基地,选择灰茭5叶期、8叶期、膨大初期、孢子形成期1、孢子形成期2、孢子形成期3,和正常茭5叶期、8叶期、膨大初期、膨大5 cm(膨大肉质茎长度5 cm,以此类推)、膨大10 cm、膨大15 cm、膨大20 cm(图1).田间采集的样本用消毒纱布包好后液氮保存带回实验室,-80 ℃超低温冰箱保存供试.
1.2 方法
内源激素的提取:将待测样品从-80℃超低温冰箱中取出,分类标记,称取待测样本1.000±0.050 g(千分之一天平称取),液氮速冻下研磨,加2 mL提取液(1 mmol/L二叔丁基对甲苯酚(BTH)的80%甲醇溶液)继续冰上研磨,充分研磨后将匀浆转入10 mL离心管中,再用提取液分次将研钵洗净,一并转入试管中,最后加提取液至总体系为8 mL.4 ℃下4 h,3 500 r/min离心20 min,取上清液,沉淀中再加入2 mL提取液,于4 ℃下1 h,离心,合并上清液,上清液过C-18固相萃取柱.
内源激素的测定:采用酶联免疫吸附分析法(简称ELISA)测定.试剂盒由北京诚林生物科技有限公司提供.测定CTK(细胞分裂素)和ABA(脱落酸).

注:从左往右编号1-6样本为灰茭不同发育时期的茎部,依次为5叶期、8叶期、膨大初期、孢子形成期1、孢子形成期2和孢子形成期3;编号7-13样本为正常茭白不同发育时期的茎部,依次为5叶期、8叶期、膨大初期、膨大5 cm、膨大10 cm、膨大15 cm和膨大20 cm图1 茭白茎部样品取样Figure 1 Stem samples of Zizania latifolia
1.3 数据处理
采用Excel软件及R软件,对数据进行统计分析和作图;统计数据均以平均值±标准误(mean±SE)标注.用字母标注法对数据进显著性标注,p<0.05,用小写字母标记.
2 试验结果与分析
2.1 CTK激素含量的动态变化
灰茭在不同发育时期其茎部CTK含量是不同的,如图2,灰茭中CTK含量在5叶期(348.3 ng·g-1FW)至8叶期(314.2 ng·g-1FW)略微下降,但没有显著差异.8叶期后,CTK含量呈现上升趋势,膨大初期CTK含量(365.0 ng·g-1FW)至孢子形成期1(508.2 ng·g-1FW)增长最明显,孢子形成期1时CTK含量显著高于膨大初期.在孢子形成期之后CTK含量趋于稳定.至孢子形成期3时,CTK的含量略有下降(489.1 ng·g-1FW),但与孢子形成期1和2没有显著差异.
正常茭中,CTK的含量同样随着茭白茎部生长发育而发生变化,如图2,在正常茭的5叶期(411.3 ng·g-1FW)和8叶期(396.5 ng·g-1FW)时,CTK的含量基本保持在一个稳定的水平上.8叶期后,CTK含量显著上升,膨大初期达到最大值(469.0 ng·g-1FW)之后开始呈现下降趋势.
综合比较灰茭和正常茭对应时期CTK含量,发现灰茭和正常茭茎部CTK含量的峰值出现在不同时期,灰茭出现在孢子形成期,而正常茭出现在膨大初期.具体比较发现灰茭和正常茭在5叶期—8叶期—膨大初期过程中,一开始CTK含量均处于一个较高的水平,且正常茭CTK含量水平高于灰茭,可能与此阶段茭白幼苗快速生长有关,且正常茭一般比灰茭长势较好.在8叶期时均有下降趋势,且8叶期时正处于茭白孕茭期,可能与茭白开始孕茭有关.另外,在膨大初期,灰茭和正常茭CTK含量又开始增加,推测与茭白膨大起始有关,同时正常茭在膨大初期CTK含量达到峰值,这可能与该时期植株处于分蘖期,较高含量CTK可能与茭白植株顶端生长优势消除和器官不断分化有关.在膨大后期,灰茭和正常茭内CTK含量变化差异明显,正常茭CTK含量开始下降,说明茭白同样存在库器官对源器官的影响,这与江解增[17]研究结果一致,但灰茭在膨大初期之后,CTK的含量则继续增加,峰值出现在孢子形成期1,直至达到一个稳定水平,可能与灰茭中冬孢子的大量增殖有关.
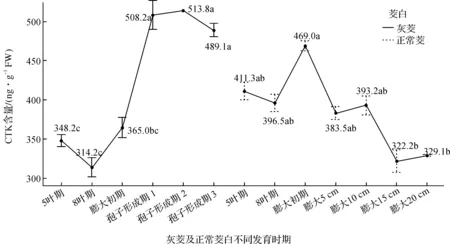
图2 灰茭及正常茭不同发育时期CTK含量的变化Figure 2 The changes of CTK content in different developmental stages of ash Jiao and Zizania latifolia
2.2 ABA激素含量的动态变化
灰茭在不同发育时期其茎部ABA含量的变化如图3所示,灰茭中ABA含量在5叶期(1 875.7 ng·g-1FW)至孢子形成期2(2 589.5 ng·g-1FW)一直呈增加趋势,但增加趋势不是很明显,且5叶期、8叶期(2 006.8 ng·g-1FW)、膨大初期(2 051.2 ng·g-1FW)、孢子形成期1(2 464.2 ng·g-1FW)和孢子形成期2时ABA含量水平之间均没有显著差异,但在孢子形成期2至孢子形成期3(1 435.8 ng·g-1FW),此时灰茭茎部ABA含量显著下降.
正常茭的茭白茎部ABA含量的变化同样随着茭白的生长发育具有一定的变化趋势,如图3所示,在5叶期(1 546.8 ng·g-1FW)至8叶期(1 665.1 ng·g-1FW)时,茭白茎部ABA含量开始增加,但是差异不显著,在8叶期后,ABA含量又开始有一定程度下降,在膨大初期(1 485.3 ng·g-1FW)时达到最低值.当茭白开始膨大后,ABA含量明显上升,在膨大5 cm(1 600.3 ng·g-1FW)时增幅不显著;当茭白茎部继续膨大至10 cm(1 878.8 ng·g-1FW)时,茭白茎部ABA含量又继续增加,与相比膨大初期间差异显著,此时茎部ABA含量达到峰值,随后在膨大15 cm(1 605.5 ng·g-1FW)至膨大20 cm(1 681.2 ng·g-1FW)时,茎部ABA含量有所降低.
综合比较发现:灰茭和正常茭相同发育时期ABA激素含量的动态变化明显不同.灰茭茎部ABA含量在5叶期至孢子形成期2一直处于缓慢上升的趋势,但在孢子形成期2至孢子形成期3阶段,ABA含量显著降低.正常茭茎部ABA含量变化在8叶期有一个小峰值,随后在膨大初期有一个明显下降,推测在5叶期至8叶期阶段,菰黑粉菌开始侵染茭白,处于孕茭阶段(在茭白生产上,将菰黑粉菌大量繁殖、肉质茎准备膨大的阶段称为孕茭),此时ABA含量的有所上升,而在8叶期至膨大初期,茎部ABA含量开始下降,CTK含量在膨大初期达到了峰值,说明茭白开始正常孕茭,此时菰黑粉菌侵染基本结束,茭茎部开始正常膨大.膨大初期之后,ABA含量又开始上升,此时是茭白各种营养物质开始快速积累的阶段,肉质茎中总糖及还原糖含量迅速增加[35],可能与ABA促进蔗糖[34]、淀粉[33]等糖类的合成有关.在膨大10 cm至15 cm时期,茭白应用物质积累速度逐渐减慢,CTK和ABA的含量均开始降低,而在膨大15 cm至20 cm时,茭白开始结束膨大,此时ABA含量的上升可能与茭白的衰老有关[36].另外发现,灰茭茎部ABA的含量总体要比正常茭的要高,可能与灰茭中大量菰黑粉菌的侵染及增殖有关.
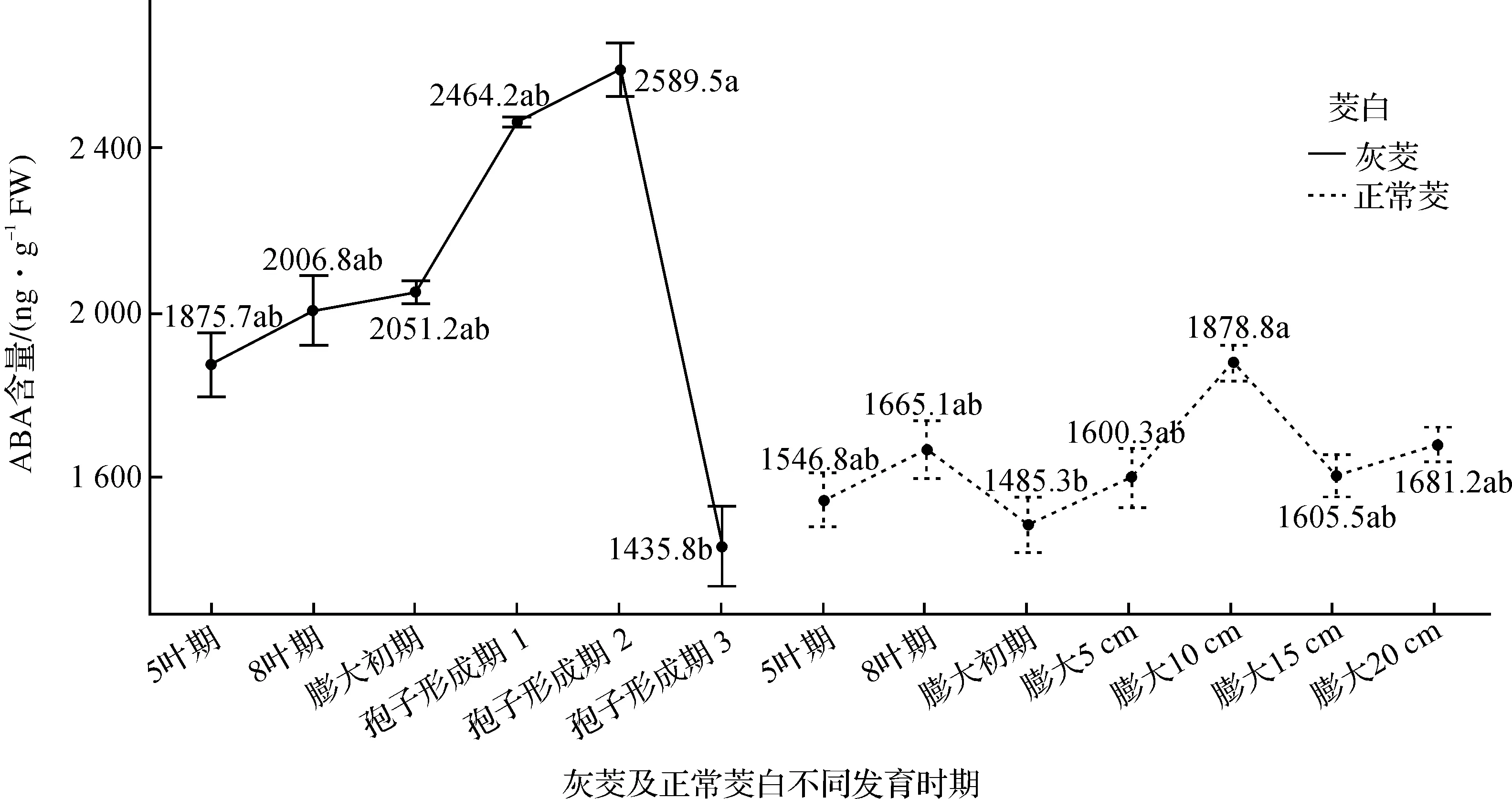
图3 灰茭及正常茭不同发育时期ABA含量的变化Figure 3 The changes of ABA content in different developmental stages of ash Jiao and Zizania latifolia
3 讨 论
茭白孕茭是由菰黑粉菌侵染茭白植株诱导形成的膨大肉质茎,其形成与茎部菰黑粉菌的侵染及生长增殖诱导密切相关,已有研究表明病原菌侵染植物后会导致植物体内激素IAA、GA、CTK、ABA等含量发生变化[37],并可能引发感病组织形态发生变化,如畸形、膨大等.江解增等人研究发现正常茭白植株生育过程中各部位的内源激素含量存在明显差异[17,38].另外,外源施加生长激素对茭白茎部膨大具有显著促进作用,茭白分蘖期喷施生长激素及杀菌剂敌磺钠,茎部内源生长激素IAA水平变化明显,茭白结茭数量均显著高于对照组合[39].茭白茎部膨大期间伴随着明显的激素含量变化,Chan等人[16]认为茭白茎部膨大可能是由茭白茎部生长素和细胞分裂素含量的增加引起的.本文通过比较分析正常茭白与灰茭两种膨大表型茎部发育期间的CTK和ABA含量变化,发现CTK和ABA的动态变化与茭白茎部膨大发育及膨大表型关系密切,还探讨了茎部菰黑粉菌生长分布与CTK和ABA含量变化的调节关系.已有研究报道表明,正常茭白膨大肉质茎中CTK主要有玉米素(zeatin,Z)、玉米素核苷(trans-zeatin-riboside,ZR)以及一种由菰黑粉菌和茭白植株互作产生的未知细胞分裂素[40],其中Z是由菰黑粉菌产生,而ZR是由茭白植株产生的[16].韩秀芹等人[40]比较了菰黑粉菌离体培养与膨大茭白肉质茎中的CTK激素激素含量变化,认为肉质茎膨大初期时CTK含量的增加可能来源于植物与菰黑粉菌互作诱导.本研究发现:膨大初期的灰茭和正常茭茎部CTK激素含量均明显增加,较高CTK含量有助于茭白茎部细胞分裂及增殖,促进茭白肉质茎起始膨大;膨大初期后正常茭肉质茎内CTK激素含量降低,与前期报道结果一致[18],表明茭白肉质茎膨大初期其内部生理活动有一个逐渐加强的过程,茎部膨大可能是由CTK含量变化起主导作用的,同时也暗示着茭白肉质茎膨大初期先是以细胞分裂增殖为主,后与细胞自身膨大生长有关[17].此外,本研究发现灰茭和正常茭肉质茎中的CTK激素含量动态变化差异显著,可能与两种表型茭白茎部菰黑粉菌侵染及生长增殖的方式不同相关.灰茭茎部发育后期CTK激素水平开始增加,且含量高于正常茭,可能与灰茭茎部菰黑粉菌大量侵染及增殖诱导相关,在茎部膨大末期,菰黑粉菌形成大量孢子,侵染能力下降,CTK含量下降,进一步表明茭白茎部CTK含量变化与茎部菰黑粉菌侵染及生长增殖密切相关.
ABA激素在植物生长发育过程中具有复杂的调节作用[26-35],ABA参与植物蔗糖合成,有利于植物内总糖及还原糖含量迅速增加[33-34],并在物质运输过程中起着重要的作用[41].此外,研究表明ABA参与植物与病原菌的互作反应,可以迅速介导气孔关闭,阻止病原菌的侵入植物细胞[30],但也可降低宿主对病原菌的抵抗力,协助病原菌侵染植物宿主[32].灰茭茎部发育期间茎部ABA含量逐渐增加,但在孢子形成后期降低,而正常茭茎部内ABA含量变化较为复杂,可能与两种表型茭白茎部膨大发育及菰黑粉菌生长分布不同相关.灰茭及正常茭茎部发育早期,茎部的ABA含量已经处于一个较高的水平,可能与茎部菰黑粉菌侵染诱导植物相关.菰黑粉菌离体培养的发酵液中能够检测到较高水平的ABA激素,表明菰黑粉菌自身可以分泌产生ABA激素[36,40].本研究发现灰茭茎部ABA含量高于正常茭白,可能与灰茭茎部更多的菰黑粉菌侵染诱导及大量菌丝生长增殖分泌相关.
4 结 语
灰茭与正常茭白茎部膨大发育不同,并伴随着茎部菰黑粉菌生长分布的差异,其膨大茎部发育中CTK和ABA激素的影响不是单一的,除了CTK和ABA,茭白中还存在着IAA、GA3等其它常见的植物内源激素,且不同激素之间可能存在相互作用,既是拮抗的也是相辅相成的,通过多种内源激素的协调作用,共同促进了茭白植株与菰黑粉菌诱导的肉质茎的膨大发育.
[1] 赵有为.中国水生蔬菜[M].北京:中国农业出版社,1999:155-170.
[2] 李艳.“苽”之疏解[J].西安文理学院学报(社会科学版),2012,15(4):10-13. LI Y. Textual research on “Gu”[J]. Journal of Xi’an University of Arts and Science:(Social Science Edition),2012,15(4):10-13.
[3] 郭宏波.菰属食物营养研究与发展前景[J].中国食物与营养,2008(6):13-15. GUO H B. Research and development prospect ofZizanianutrition food[J]. Food and Nutrition in China,2008(6):13-15.
[4] 闫宁,薛惠民,石林豫,等.茭白“雄茭”和“灰茭”的形成及遗传特性[J].中国蔬菜,2013(16):35-42. YAN N, XUE H M, SHI L Y, et al. The growth and heritability ofZizinialatifoliaplants infected with sporidial strain ofUstilagoesculenta[J]. China Vegetables,2013(16):35-42.
[5] CHUNG K G, TZENG D D. Nutritional requirements of the edible gall-producing fungusUstilagoesculenta[J]. Journal of Biological Sciences,2004,4(2):246-252.
[6] YOU W Y, LIU Q, ZOU K Q, et al. Morphological and molecular differences in two strains ofUstilagoesculenta[J]. Current Microbiology,2011,62(1):44-54.
[7] 李志兰,尤文雨,邹克琴,等.菰黑粉菌孢子萌发过程中形态学观察及系统发育研究[J].中国计量学院学报,2010,21(2):58-63. LI Z L, YOU W Y, ZOU K Q, et al. Morphological observation and phylogenetic analysis ofUstilagoesculenta[J]. Journal of China University of Metrology,2010,21(2):58-63.
[8] 柯卫东.怎样防除雄茭和灰茭[J].长江蔬菜,2000(3):43-43. KE W D. How to control the male and gray Jiaobai[J].Journal of Changjiang Vegetables,2000(3):43-43.
[9] MOORE T C. Biochemistry and Physiology of Plant Hormones[M]. Berlin: Springer,1979:274-276.
[10] LENTON J. Plant hormones on the move![J]. Trends in Plant Science,1998,3(12):457-458.
[11] ALONI R, ULLRICH C I. Role of cytokinin in the regulation of root gravitropism.[J]. Planta,2004,220(1):177-182.
[12] OVERBEEK J V, BLAKESLEE A F. Chemical stimulationof ovule development and its possible relation to parthenogenesis[J]. American Journal of Botany,1941,28(8):647-656.
[13] GILLISSEN B, FFRMMER W B. A new family of high-affinity transporters for adenine, cytosine, and purine Derivatives inArabidopsis[J]. Plant Cell,2000,12(2):291-300.
[14] 汪俏梅,郭得平.植物激素与蔬菜的生长发育[M].北京:中国农业出版社,2002:18-26.
[15] WERNER T, MOTYKA V, STRNAD M, et al. Regulation of plant growth by cytokinin[J]. Proceeding of the National Academy of Sciences of the United States of America,2001,98(18):10487-10492.
[16] THROWER L B, CHAN Y S. Gau sun: A cultivated host-parasite combination from china[J]. Economic Botany,1980,34(1):20-26.
[17] 江解增,邱届娟,韩秀芹,等.茭白生育过程中地上各部位内源激素的含量变化[J].武汉植物学研究,2004,22(3):245-250. JIANG J Z, QIU J J, HAN X Q, et al. Changes of endogenous hormone contents of different parts during development of water bamboo (Zizanialatifolia)[J]. Journal of Wuhan Botanical Research,2004,22(3):245-250.
[18] 张强.茭白肉质茎膨大期间生理生化特性研究[D].扬州:扬州大学,2004. ZHANG Q. Study on Physiological and Biochemical Characteristics inZizaniagall Expanding Peogress[D]. Yangzhou: Yangzhou University,2004.
[19] PORTER H K. The Biological Action of Growth Substances[M]. Cambridge: Cambridge University Press,1957:329-330.
[20] JACKSON D, VEIT B, HAKE S. Expression of maize KNOTTED1 related homeobox genes in the shoot apical meristem predicts patterns of morphogenesis in the vegetative shoot[J]. Development,1993,120(2):405-413.
[21] LEIBFRIED A, TO J P, BUSCH W, et al. WUSCHEL controls meristem function by direct regulation of cytokinin-inducible response regulators[J]. Nature,2005,438(22):1172-1175.
[22] GAN S, AMASINO R M. Inhibition of leaf senescence by autoregulated production of cytokinin[J]. Science,1995,270(4):1986-1988.
[23] LARA M E B, GARCIA M C G, FATIMA T, et al. Extracellular invertase is an essential component of cytokinin-mediated delay of senescence[J]. Plant Cell,2004,16(5):1276-1278.
[24] FAKHRAI F, EVANS P K. Morphogenic potential of cultured floral explants ofCrocussativusL. for the in vitro production of saffron[J]. Journal of Experimental Botany,1990,41(1):47-52.
[25] KURZ B, MELZER S, BERNIER G, et al. Cytokinin and gibberellin activate SaMADS A, a gene apparently involved in regulation of the floral transition in Sinapis alba[J]. Plant Journal,2000,24(1):103-111.
[26] CUMMINS W R, KENDE H, RASCHKE K. Specificity and reversibility of the rapid stomatal response to abscisic acid[J]. Planta,1971,99(4):347-351.
[27] ZHAO K F, HARRIS P J C. The effects of roots on the growth and development of shoots ofAtriplexlentiformis,SesbaniaaculeataandSuaedasalsaunder salt stress[J]. Monograph-British Plant Growth Regulation Group,1990,46(6):3-6.
[28] GUO D L, LIANG J H, LI L. Abscisic acid (ABA) inhibition of lateral root formation involves endogenous ABA biosynthesis inArachishypogaea, L[J]. Plant Growth Regulation,2009,58(2):173-179.
[29] WAREING P F. The control of bud dormancy in seed plants[J]. Symposia of the Society for Experimental Biology,1969,23:241-262.
[30] CAO F Y, YOSHIOKA K, DESVEAUX D. The roles of ABA in plant-pathogen interactions[J]. Journal of Plant Research,2011,124(4):489-499.
[31] FAN J, HILL L, CROOKS C, et al. Abscisic acid has a keyrole in modulating diverse plant-pathogen interactions[J]. Plant Physiology,2009,150(4):1750-1761.
[32] MIALOUNDAMA A S, HEINTZ D, DEBAYLE D, et al. Abscisic acid negatively regulates elicitor-induced synthesis of capsidiol in wild tobacco[J]. Plant Physiology,2009,150(3):1556-1567.
[33] 姜华,高晓玲,万佳,等.脱落酸对水稻愈伤组织糖类代谢及相关酶活性的影响[J].中国水稻科学,2006,20(4):406-410. JIANG H, GAO X L, WAN J, et al. Effect of abscisic acid on saccharide metabolism and related enzyme activities in rice callus[J]. Chinese Journal of Rice Science,2006,20(4):406-410.
[34] TROUVERIE J, THEVENOT C, ROCHER J P, et al. The role of abscisic acid in the response of a specific vacuolar invertase to water stress in the adult maize leaf[J]. Journal of Experimental Botany,2003,54(390):2177-2186.
[35] 程龙军,郭得平.茭白肉质茎膨大期间主要成分的变化[J].园艺学报,2003,30(6):741-741. CHENG L J, GUO D P. The biochemical changes during stem swelling inZizanialatifolia[J]. Acta Horticulturae Sinica,2003,30(6):741-741.
[36] 林源吉.茭白孕茭及共生黑粉菌体外培养和快速检测技术的研究[D].杭州:杭州师范大学,2007. LIN Y. Study on Pregnant ofZizanialatifoliaand Cultivation ofUstilagoesculentain Vitro and It’s Rapid Detection Technology[D]. Huangzhou: Hangzhou Normal University,2007.
[37] ZHANG J Z, CHU F Q, GUO D P, et al. The vacuoles containing multivesicular bodies: a new observation in interaction betweenUstilagoesculentaandZizanialatifolia[J]. European Journal Plant Pathology,2014,138:79-91.
[38] 江解增,曹碚生,黄凯丰,等.茭白肉质茎膨大过程中的糖代谢与激素含量变化[J].园艺学报,2005,32(1):134-137. JIANG J Z, CAO P S, HUANG K F, et al. Changes of NSC, enzymes and endogenous hormones duringZizaniagall’s swelling[J]. Acta Horticulturae Sinica,2005,32(1):134-137.
[39] 应荣,崔海峰,倪方群,等.杀菌剂敌磺钠及植物生长调节剂对茭白孕茭的影响.植物生理学报,2014,50(7):946-952. YING R, CUI H F, NI F Q. Effects of fungicide fenaminosulf and plant growth regulator on gall formation ofZizanialatifolia[J]. Plant Physiology Journal,2014,50(7):946-952.
[40] 韩秀芹.茭白黑粉菌生物学特性的研究[D].扬州:扬州大学,2004. HAN X Q. Studies on Biological Characteristics ofUstilagoesculenta[D]. Yangzhou: Yangzhou University,2004.
[41] TERRELL E E, BATRA L R.ZizanialatifoliaandUstilagoesculenta, a grass-fungus association[J]. Economic Botany,1982,36(3):274-285.
Dynamic analysis of the contents of CTK and ABA in the stem ofZizanialatifolia
XING Abao, CUI Haifeng, YU Xiaoping, ZHANG Yafen, YE Zihong
(Zhejiang Provincial Key Laboratory of Biometrology, Inspection and Quarantine, College of Life Sciences,China Jiliang University, Hangzhou 310018, China)
The content variation of CTK and ABA of twoZizanialatifoliaamong different stem swollen stages was detected by ELISA. It was found that the dynamic variation of CTK was significantly different between the two swollen types inZ.latifolia. During the stem development, the content of CTK increased most sharply in gray type at the stage of spore formation, while it reduced in white type the highest at the stage of swollen initiation. However, the content of ABA was all high at the stem of gray type with the highest at the later swollen stage, while the changes of ABA were different in white type. The dynamic variation of CTK and ABA was related to the development and the type of swollen stems inZ.latifolia, which might be induced and regulated by the infections and reproductions ofUstilagoesculentaP. Henn at the stem ofZ.latifolia.
Z.latifolia; swollen stem;U.esculenta; ABA; CTK
2096-2835(2017)02-0261-08
10.3969/j.issn.2096-2835.2017.02.020
2017-03-15 《中国计量大学学报》网址:zgjl.cbpt.cnki.net
国家自然科学基金资助项目(No.3147085),浙江省公益资助项目(No.2014C32022).
邢阿宝(1992-),男,安徽省芜湖人,硕士研究生,主要研究方向为植物与微生物互作.E-mail:xab033298@163.com 通信联系人:叶子弘,女,教授.E-mail:zhye@cjlu.edu.cn
Q946
A
