基于ISSR的日本落叶松2代优树遗传多样性研究
2017-07-03汪成成王月婵
汪成成 ,冯 健,姜 韬 ,王月婵 ,黄 夏
(1.辽宁省林业科学研究院,辽宁 沈阳 110032;2.辽宁省林业调查规划院)
日本落叶松[Larix kaempferi(Lamb.)Carr.]系松科落叶松属乔木,因其适应性强、生长迅速、成林快、木材用途广,已成为我国北方地区及南方亚高山地区引种最为成功的造林树种之一。日本落叶松苗木主要靠播种繁殖,种子主要是从种子园或母树林获得。我国早在1963年就开始了日本落叶松优树选择和初级种子园营建工作,当时的初级种子园是利用根据表型选择的优株营建成。由于选优林地生态环境条件较复杂,所选优树又未经过子代测定就全部纳入种子园的营建中,造成了较高的误选率,并不可避免地影响了种子园的遗传多样性。由于组成种子园优树的不同,仅以依靠子代测验来评估种子园的遗传增益就不能真实地体现种子园的总体遗传多样性,这不利于种质资源的保护和遗传改良[1-2]。本研究旨在通过ISSR分子标记技术来分析日本落叶松2代优树亲本的遗传多样性。
ISSR分子标记技术是由ZIETKIEWICZ等[3]于1994年创建的一种以PCR扩增为基础的新型分子标记技术,其采用 SSR(simple sequence repeats)对简单重复序列间的遗传信息进行多态性扩增。因其简便迅速、多态性高、重复性好的优点被广泛应用于动植物的品种鉴定[4-5]、DNA指纹图谱构建[6-7]、物种分类以及种质资源多样性研究[8-11]等领域,目前未见应用在日本落叶松上的报道。针对以上情况,本研究欲利用ISSR分子标记的方法对80株日本落叶松2代优树亲本的遗传多样性进行分析,以求在日本落叶松2代种子园的建成中,有较高的遗传增益和遗传多样性。
1 材料与方法
1.1 试验样品
本次试验的80个不同的日本落叶松2代优树亲本无性系样品均采自辽宁省抚顺市清原县大孤家国营林场,样品采集时间为2015年7月20日,每个无性系均选择树体健壮的植株,取树冠中部针叶,每个样品约5g,采集后立即用锡纸包裹,在锡纸上写好编号,编号采用随机的方式编写,最后投入液氮罐带回实验室,于-80℃超低温冰箱中保存备用。80个供试材料的基本情况见表1。
1.2 DNA的提取与检测
DNA的提取采用改良CTAB法[12-15],DNA质量的检测是用0.8%琼脂糖凝胶电泳和紫外分光光度计,取部分基因组DNA稀释到50ng·μL-1,保存于-20℃的冰箱内备用。
1.3 ISSR反应体系的优化建立及引物筛选
试验所用的引物是从加拿大英属哥伦比亚大学(UBC)网站公布的96个ISSR引物中筛选出的,将筛选的引物在日本落叶松样本的ISSR反应体系和反应程序中扩增,建立了一套适合日本落叶松的ISSR反应体系和反应程序,即ISSR-PCR反应体系为 25 μL,其中模板 DNA 2 μL,引物 0.5 μL,dNTPs 0.5 μL,10×PCR buffer 2.5 μL,Taq 酶 0.5 μL,ddH2O 19 μL。ISSR的 PCR程序为 95℃预变性 5 min;95℃变性 30s,50 ℃退火 45s,72 ℃延伸 2 min,循环45次;最后72℃延伸10 min,4℃保存。

表1 日本落叶松的供试材料Table1 The test materials of Larix kaempferi(Lamb.)Carr.
续表1
1.4 ISSR扩增及电泳检测
ISSR-PCR扩增在DG-III双稳数显电泳仪上进行,PCR扩增产物采用8%非变性聚丙烯酰胺凝胶电泳,电泳结果用凝胶成像仪检测并照相、分析。
1.5 数据处理
统计每一引物对供试材料所扩增的清晰可辨的总带数,按扩增条带在相对迁移位置的有或无赋值,“有”记为“1”,“无”记为“0”,构建二维数据矩阵。根据ISSR扩增的结果,利用NTSYS-pc version2.1软件对统计的“0/1”数据矩阵进行分析,得到Dice相似性系数,并利用UPGMA法进行聚类分析,构建树状图[16]。
2 结果与分析
2.1 ISSR标记的遗传多态性分析
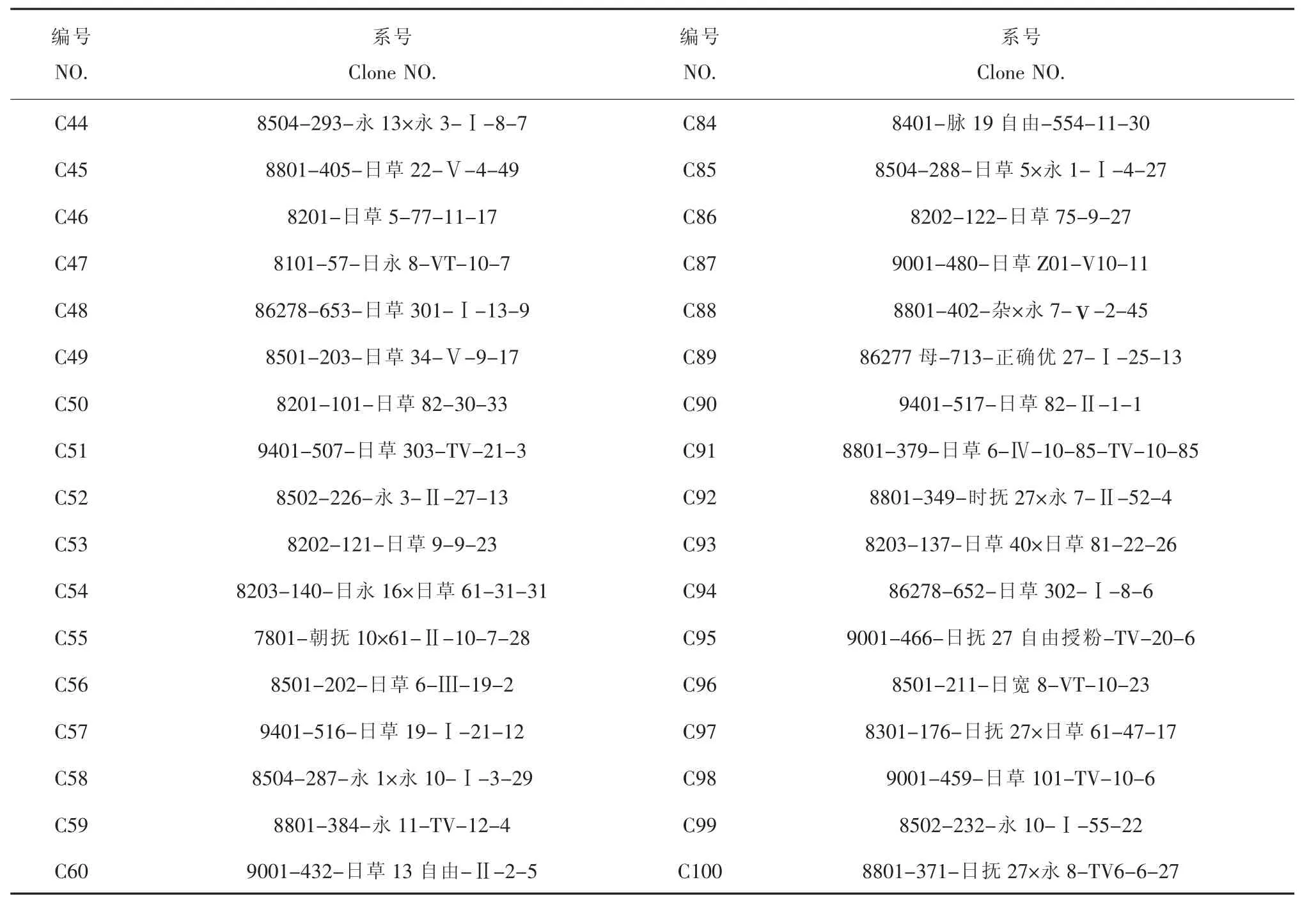
从96个ISSR引物中筛选出重复性好、特异性高、扩增效果好的引物8个(表2),对80份日本落叶松进行PCR扩增,所扩增的片段大部分集中在200~1000bp,其中引物807的扩增图谱见图1~图3。8个ISSR引物扩增统计结果见表3。8个ISSR引物共扩增出281条DNA条带,全部为多态性条带,多态性百分率为100%,平均每条引物扩增的多态性条带数为35.1。
2.2 基于ISSR标记的遗传相似系数分析
利用NTSYS-pc version2.1软件对扩增结果进行相似系数计算,得到相似性系数矩阵。ISSR扩增结果的遗传相似性在0.8479~0.9142之间,变幅为0.0663,。其中编号为C46和C94的遗传相似系数最低为0.8479(图4),表明二者亲缘关系最远;编号为C96和C97的遗传相似系数最高为0.9142(图5),表明二者亲缘关系最近。从相似性系数可以看出,变幅较小,说明所选的材料差异不明显。

表2 ISSR引物代号及序列Table2 List of ISSR forward primers and their sequence
2.3 基于ISSR标记的聚类分析
基于日本落叶松ISSR遗传相似性系数,利用UPGMA法进行聚类,获得聚类树状图(图6)。当相似性系数在0.856时,将80个日本落叶松亲本样本划分为5个类群。类群Ⅰ包括65个样本,在相似性系数为0.8635时该类群可以分为5个亚类群。其中亚类群Ⅰ-1包括8个样本材料;亚类群Ⅰ-2只有编号为C30这1个样本材料;亚类群Ⅰ-3包括29个样本材料;亚类群Ⅰ-4包括6个样本材料;亚类群Ⅰ-5包括21个样本材料。类群Ⅱ包括11个样本材料,类群Ⅲ只有编号为C61和C64这2个样本材料;类群Ⅳ和类群Ⅴ分别只有1个样本材料。类群Ⅰ中样本材料占总样本的81.25%,说明这一类群中的日本落叶松无性系亲本遗传基础较为狭窄,大部分亲本间亲缘关系较近。.
3 结论与讨论
近年来,随着分子生物学的发展,ISSR分子标记技术已经广泛应用于分类学、品种鉴定、种群遗传学研究和构建遗传连锁图谱等生物学领域。因其具有快速、可靠、可以提供有关基因组丰富信息的DNA等特点,许多学者将其应用到植物的遗传多样性研究上。刘桂丰等[17]分析了分布在国内外的12种五针松的的亲缘关系,共检测出117个位点,其中多态位点百分率在9.40%~33.33%之间,利用ISSR分子标记构建的12种五针松的遗传关系聚类图,在阈值0.358时将12种五针松分为2个类群。那冬晨等[18]利用ISSR标记对17个兴安落叶松种源的170个样本进行了遗传多样性分析,并根据地理距离和遗传距离对兴安落叶松进行了种源间的划分。李岩[19]应用ISSR分子标记技术分析了凉水国家自然保护区的天然红松种群在时间尺度上的遗传多样性变化和遗传分化。随机选取的15个ISSR引物共检测出104个位点,其中多态位点85个,多态位点比率为81.73%,Shannon指数得出龄级间遗传变异为11.96%,Nei指数得出龄级间遗传分化为11.03%。赵秀香等[20]以烟草靶斑病菌基因组DNA为模板,对采自东北三省烟区的20个烟草靶斑病菌菌株进行ISSR分析,共扩增出132条带,多态条带比率为73.48%,在相似系数0.74处将其划分为3个类群,结果表明遗传聚类组群与菌株的地理来源具有一定的相关性,而与菌株的致病性无明显的相关性。前人的研究结果均表明,ISSR分子标记技术能有效揭示品种遗传多样性,本研究首次将ISSR分子标记技术应用到日本落叶松2代优树遗传多样性的研究中,分析结果较理想,达到了区分2代优树之间的亲源关系,为日本落叶松2代种子园的营建工作提供了帮助,为日本落叶松种质资源的开发和利用、新品种的选育和生产提供了理论依据。

图1 引物807对C21~C40号日本落叶松DNA的扩增结果Figure 1 Results of amplification using 807 primer for DNAC21-C40

图2 引物807对C41~C70号日本落叶松DNA的扩增结果Figure 2 Results of amplification using 807 primer for DNAC 41-C70
图3 引物807对C71~C100号日本落叶松DNA的扩增结果Figure 3 Results of amplification using 807 primer for DNA C71-C100

表3 ISSR引物扩增带数及多态性带数Table3 The numbers of primer amplification and polymorphism
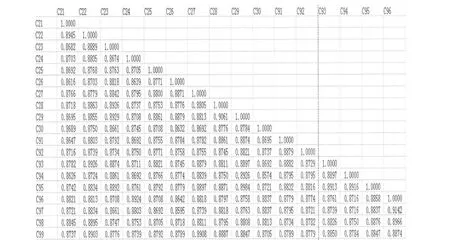
图4 ISSR标记的包含编号C46和C94的部分供试材料之间的相似性系数Figure 4 Genetic similarity of part of materials include C46 and C94 based on ISSR

图5 ISSR标记的包含编号C96和C97的部分供试材料之间的相似性系数Figure 5 Genetic similarity of part of materials include C96 and C97 based on ISSR
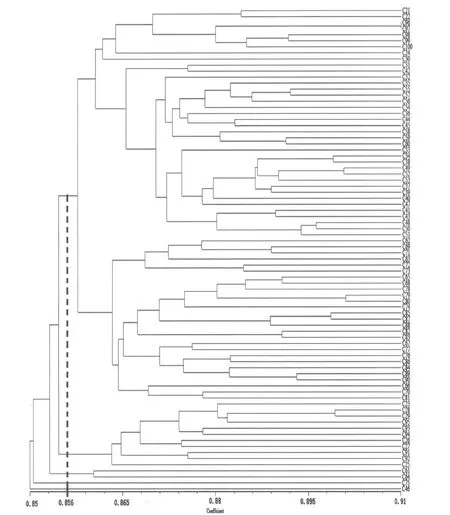
图6 80份日本落叶松ISSR聚类图Figure 6 The map of cIuster analysis for 80 Larix kaempferi(Lamb.)Carr.by ISSR
通过利用ISSR分子标记技术分析日本落叶松2代优树间的遗传多样性,结果表明,筛选出的8个引物对80个样品共扩增出281条DNA条带,全部为多态性条带,品种间的遗传相似性系数在0.8479~0.9142之间,遗传多样性不够丰富。利用UPGMA法进行聚类,在相似系数为0.856时,可将80个日本落叶松种质材料划分为5个类群。聚类基本符合与子一代的亲缘关系,类群间遗传基础较狭窄,亲缘关系较近。
[1]朴楚炳,张万雄,刘 君.兴安落叶松天然优良林分改造为母树林的研究初报[J].林业科技,1991,16(3):17-23.
[2]张源润,周全良,梅曙光,等.华北落叶松无性系种子园子代测定研究[J].宁夏农学院学报,2004,25(4):8-11.
[3]ZIETKIEWICZ E,RAFALSKI A,LABUDA D.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymer action amplification[J].Genomics,1994,20:176-183.
[4]郑宵蓓,陈科力,尹文仲,等.鄂西高产半夏脂溶性成分的 GC-MS 分析[J].中药材,2007,30(6):665-667.
[5]孙淑霞,李 靖,陈 栋,等.ISSR分子标记技术在桃品种鉴定中的应用[J].中国农学通报,2011,27(04):173-177.
[6]魏臻武.利用SSR,ISSR和RAPD技术构建苜蓿基因组 DNA 指纹图谱[J].草业学报,2004,13(3):62-67.
[7]葛亚英,张 飞,沈晓岚,等.丽穗凤梨 ISSR 遗传多样性分析与指纹图谱构建[J].中国农业科学,2012,45(4):726-733.
[8]冯亮亮,唐 红,李 毅,等.甘肃红砂不同种群遗传多样性的 ISSR 分析[J].草业学报,2011,20(1):125-130.
[9]MATLAGA D,KAROLY K.Long-term grazing effects on genetic variation in Idaho fescue[J].Range Management,2004,57:275-278.
[10]雒新艳,王 晨,戴思兰,等.基于ISSR标记的大菊品种资源遗传多样性分析 [J].中国农业科学,2013,46(11):2394-2402.
[11]曾 亮,袁庆华,王 方,等.冰草属植物种质资源遗传多样性的 ISSR 分析[J].草业学报,2013,2:260-267.
[12]WANG X D,WANG Z P,ZOU Y P.An improved procedure for the isolation of nuclear DNA isolation from leaves of wild grapevine dried with silica-gel[J].Plant Mol.Biol.Rep.,1996,14(4):369-373.
[13]王关林,方宏筠.植物基因工程原理与技术[M].北京:高等教育出版社,1998.
[14]胡凤荣,任 翠,鲍仁蕾,等.风信子DNA不同提取方法的效果比较 [J].沈阳农业大学学报,2011,42(5):570-573.
[15]POREBSKI S,BAILEY L G,BAUM B R.Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components[J].Plant Molecular Biology Reporter,1997,15(1):8-15.
[16]NEI M,KUMAR S.MoIecular Evolution and Phylogenctics [M].New York:Oxford University Press,2000:87-96.
[17]LIU GF,DONG JX,JIANG Y ET AL.Analysis of genetic relationship in12 species of Section Strobus with ISSR markers [J].Journal of Forestry Research,2005,16(3):213-215.
[18]那冬晨,杨传平,姜 静,等.利用ISSR标记分析兴安落叶松种源的遗传多样性[J].林业科技,2006,31(1):1-4.
[19]李 岩.天然红松遗传多样性在时间尺度上变化的RAPD和ISSR分析[D].大连:辽宁师范大学,2005.
[20]赵秀香,苏燕妮,伏 颖,等.烟草靶斑病菌(Rhizoctonia solani)ISSR反应体系的优化及遗传多样性分析[J].沈阳农业大学学报,2016,47(1):97-102.
