PP2CE在人原发性肝癌中的表达及其临床意义
2017-07-03徐卫华黄焕军
徐卫华, 黄焕军
1 湖北省孝感市孝昌县第一人民医院消化内科,孝感 4329002华中科技大学同济医学院附属同济医院消化内科,武汉 430030
PP2CE在人原发性肝癌中的表达及其临床意义
徐卫华1, 黄焕军2△
1湖北省孝感市孝昌县第一人民医院消化内科,孝感 4329002华中科技大学同济医学院附属同济医院消化内科,武汉 430030
目的 探讨PP2CE在人原发性肝癌组织中的表达、亚细胞定位及其与临床病理特征的关系。方法 收集武汉同济医院2010~2015年手术切除的原发性肝癌(HCC)及其对照的癌旁组织标本50例。采用荧光定量PCR法和免疫组织化学法分别检测PP2CE在肝癌及癌旁组织中mRNA和蛋白表达水平,分析其与临床病理资料之间的关系。免疫荧光法检测PP2CE在肝癌及癌旁组织中的亚细胞定位。结果 肝癌中PP2CE mRNA和蛋白表达水平较其对应的癌旁组织明显减少(均P<0.05),通过分析PP2CE免疫组化结果与临床病理特征的关系发现,PP2CE减少与肝癌大小、分化程度、门静脉侵犯和临床分期相关(均P<0.05)。免疫荧光检测表明PP2CE主要表达于细胞质和核周。结论 PP2CE在HCC中表达减少,其可能参与抑制肝癌的发生和发展。
PP2CE; 肝细胞癌; 亚细胞定位; 转移
我国是肝癌大国,肝癌是我国60岁以下男性最主要罹患的肿瘤,其发病率和死亡率居所有肿瘤的前列[1]。尽管临床上开展了多项针对肝癌的治疗手段,如手术切除、肝移植、物理治疗和放化疗等,但近十年来肝癌治疗的疗效并未明显提高,肝癌早期转移是其疗效差的主要原因[2]。因此,深入研究肝癌转移早期的生物学行为和相关的分子靶点,可能为肝癌的诊断和治疗提供帮助。
PP2C蛋白磷酸酶是一个具有独特结构和功能的酶家族,随着对这个家族蛋白的不断研究,揭示了其可参与调节多个细胞生物学过程,如神经突生长调节[3],细胞生长和应激反应等[4]。最近的研究发现,多个PP2C蛋白磷酸酶可参与肿瘤发生发展:PP2Cα[5]、ILKAP[6]和PHLPP[7]可通过调控细胞增殖抑制肿瘤进展,而PP2Cδ(Wip1)[8]却被发现可能是一个促肿瘤因子。PP2CE是PP2C家族新发现的重要成员,最早是在鼠中克隆出来,虽然只是一个仅有20 kD大小的分子,但其可能在细胞生理过程中起重要作用[4]。研究发现,PP2CE可通过去磷酸化TAK1和ASK1,调控JNK信号通路,进而可能影响细胞应激反应[9]。然而,目前对于PP2CE的研究太少,它是否也与其他的PP2C成员一样参与肿瘤发生发展呢?目前并未见研究报道。
本研究采用荧光定量PCR法和免疫组织化学法检测PP2CE在肝癌及癌旁组织中的表达水平,分析其表达与肝癌临床病理特征之间的关系,研究其在组织细胞中的表达和定位,探讨其在肝癌发生、发展过程中的可能作用。
1 材料与方法
1.1 材料
1.1.1 临床标本 本研究中的6例肝血管瘤瘤旁组织和50对肝癌及其对应的癌旁组织均来自于武汉同济医院2010年1月至2015年12月的手术切除标本。肝癌组织经手术和病理学诊断证实为人原发性肝细胞癌。标本切除后立即切成0.3 cm×0.5 cm小块,一部分保存于液氮,另一部分做成石蜡包埋组织。所有患者术前均未接受肿瘤相关治疗。
1.1.2 主要试剂 PP2CE抗体购自美国Novus Biologicals公司,羊抗兔荧光二抗购自武汉启动子生物科技公司。免疫组化试剂盒购自北京中杉金桥生物技术有限公司。逆转录试剂盒和PCR试剂盒购自宝生物工程(大连)有限公司。
1.2 研究方法
1.2.1 荧光定量PCR法检测PP2CE在肝癌组织中的表达 采用Trizol试剂提取50对肝癌组织及配对癌旁组织的总mRNA,取2 μg进行逆转录,逆转录后的cDNA通过PCR试剂盒进行检测。操作步骤均按照说明书进行。PCR总反应体系为10 μL:2×Subgreen Mix 5 μL,上下游引物各0.5 μL,cDNA 1 μL,无酶水3 μL。反应参数为:94℃预变性2 min;94℃变性5 s,60℃退火15 s,72℃延伸25 s,共40个循环;72℃终止延伸5 min。每个样本设3个复孔。PP2CE相对表达量通过2-ΔΔCt法进行计算。引物序列见表1。
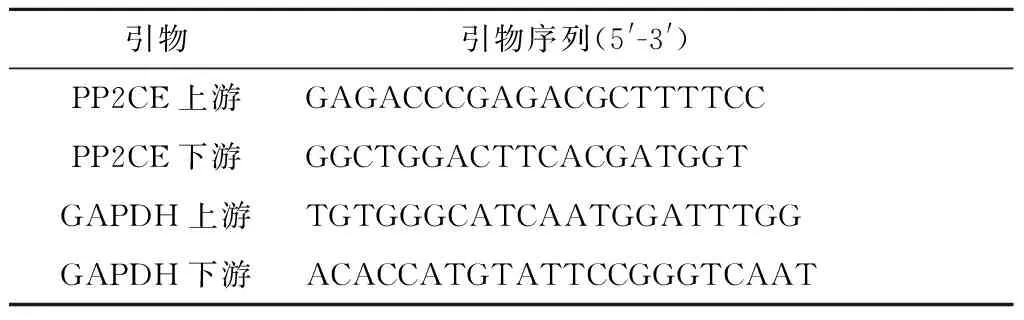
表1 PCR引物序列
1.2.2 免疫组织化学SP法检测PP2CE蛋白表达 石蜡包埋切片常规脱蜡,梯度乙醇充分水化;柠檬酸缓冲液微波法修复抗原;3%过氧化氢孵育10 min以消除内源性过氧化物酶活性;正常羊血清室温孵育30 min以减少非特异性背景;滴加PP2CE一抗4℃孵育过夜,滴加链霉素抗生物素蛋白-过氧化物复合物湿盒孵育30 min;滴加新鲜配置的DAB显色液于显微镜下控制显色;苏木精复染;梯度乙醇脱水,二甲苯透明,中性树胶封片。实验设置PBS代替一抗作为阴性对照。
免疫组化结果以分值作为阳性的评判标准。高倍显微镜下随机取4个不同的视野,计数细胞总数及阳性细胞数,依阳性细胞百分数<5%、5%~、25%~、50%~分别计为1、2、3、4分;按阳性细胞着色强度计分:不着色0分,浅黄色1分,浅棕色2分,深棕色3分。阳性细胞百分数得分×阳性细胞着色强度得分为综合评分,综合评分≥3分即为阳性表达[10]。
1.2.3 免疫荧光法检测PP2CE组织细胞亚定位 前期过程同免疫组化,但不需要孵育3%过氧化氢。一抗孵育过夜后,滴加荧光二抗避光孵育1 h,DAPI染核10 min,抗荧光淬灭剂封片,于荧光显微镜下观察。
1.3 统计学分析
采用SPSS 18.0软件进行统计分析,制图采用GraphPad Prism 5.0软件。各组间均数比较采用独立样本t检验及单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 肝癌组织中PP2CE mRNA表达水平
PP2CE在肝癌组织中的mRNA表达少于对应的癌旁组织的1/2时,被认为是低表达。我们发现,在50对肝癌组织中,35对出现癌组织中表达减少(图1),进一步分析发现,PP2CE mRNA在肿瘤组织中的平均表达量显著低于癌旁组织,癌旁组织与肿瘤组织的相对mRNA表达为(14.4±1.5)vs.(7.7±0.9),P<0.01。
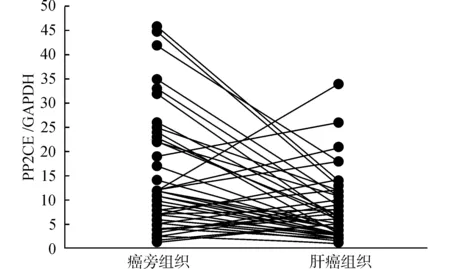
图1 肝癌和癌旁组织中PP2CE mRNA表达Fig.1 PP2CE mRNA levels in HCC tissues and their para-carcinoma tissues
2.2 肝癌组织中PP2CE蛋白表达水平
我们将6例肝血管瘤的瘤旁组织作为正常肝脏组织,免疫组化结果发现(图2),PP2CE在正常肝组织和癌旁组织中表达水平较高,而在肝癌组织中表达多为阴性(32/50),与mRNA表达水平一致。进一步将这50例肝癌组织中PP2CE蛋白表达与临床病理资料进行分析发现(表2),PP2CE低表达与肝癌肿瘤大小(P=0.048)、分化程度(P=0.008)、门静脉侵犯(P=0.016)以及临床分期(P=0.032)相关。
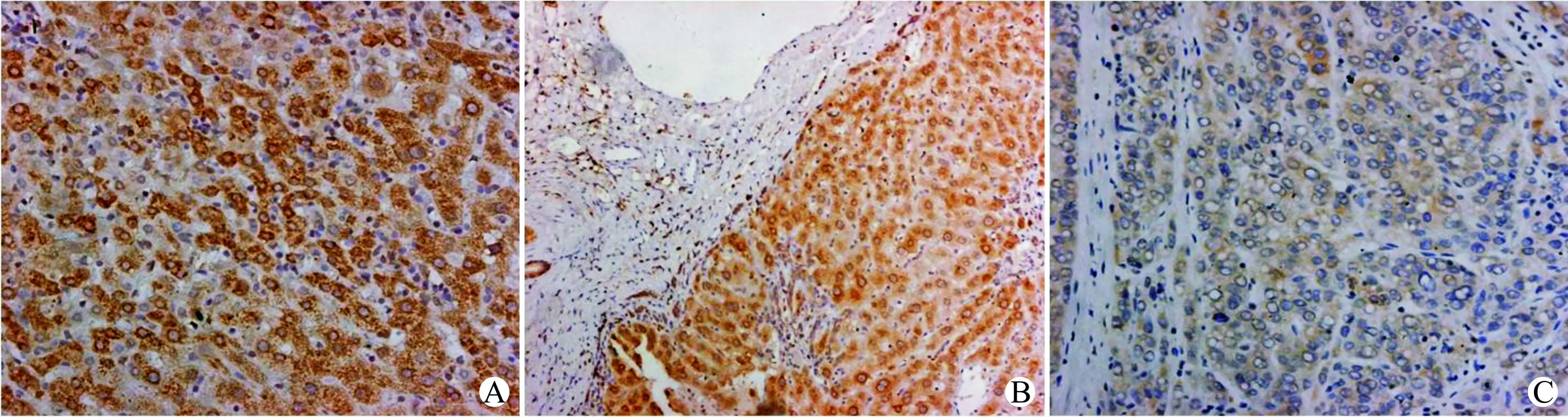
A:正常组织;B:癌旁组织;C:肝癌组织图2 PP2CE蛋白在肝癌、癌旁组织和正常肝组织中表达(×200)Fig.2 PP2CE protein levels in HCC tissues,para-carcinoma tissues and normal liver tissues(×200)
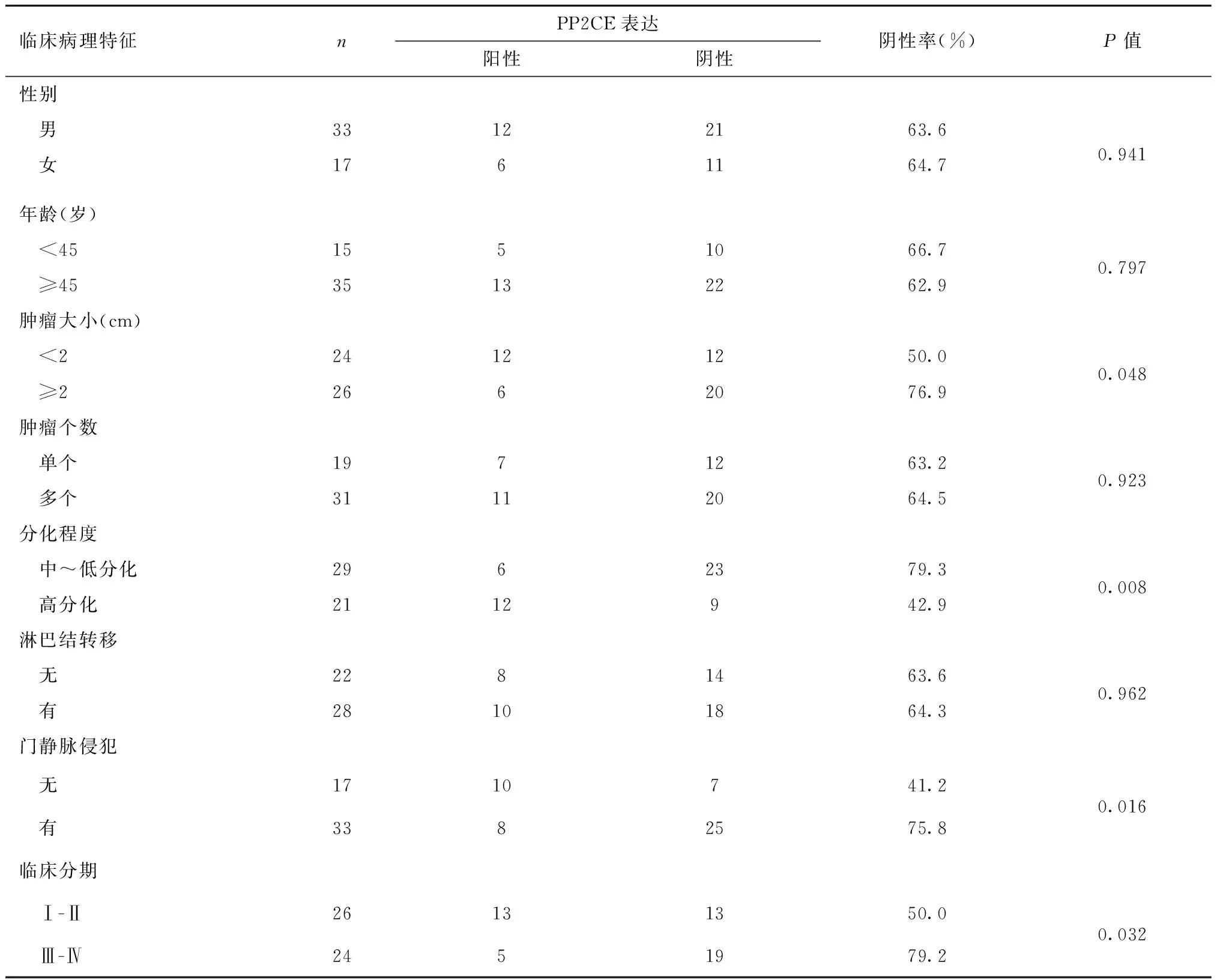
临床病理特征nPP2CE表达阳性阴性阴性率(%)P值性别 男33122163.6 女1761164.70.941年龄(岁) <451551066.7 ≥4535132262.90.797肿瘤大小(cm) <224121250.0 ≥22662076.90.048肿瘤个数 单个1971263.2 多个31112064.50.923分化程度 中~低分化2962379.3 高分化2112942.90.008淋巴结转移 无2281463.6 有28101864.30.962门静脉侵犯 无1710741.2 有3382575.80.016临床分期 Ⅰ-Ⅱ26131350.0 Ⅲ-Ⅳ2451979.20.032
2.3 PP2CE在组织细胞中亚定位
通过免疫荧光方法观察PP2CE在组织样本中的亚细胞定位,我们发现(图3),肝癌组织中PP2CE表达较癌旁组织明显减少;PP2CE主要表达于细胞质和核周围,与The Human Protein Atlas数据库中的结果一致。而PP2CE亚细胞定位可能是其作用的主要调节因素。
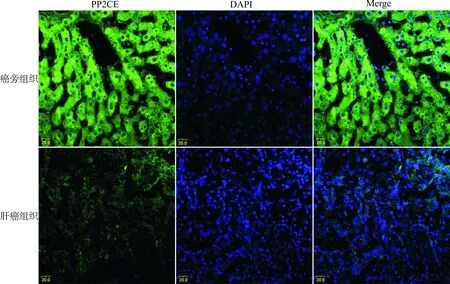
图3 PP2CE蛋白在肝癌及癌旁组织亚细胞定位表达(标尺=20 μm)Fig.3 Sub-cellular localization of PP2CE in HCC and their para-carcinoma tissue cells(Scale bar=20 μm)
3 讨论
肝癌转移是阻碍肝癌治疗的主要因素,它是一个复杂而多步骤的过程,包括增殖,脱离原发病灶,迁移,血管生成,远处定植等[11]。找到调控癌细胞增殖和早期转移的分子及机制是抑制肝癌转移的重要思路。
蛋白磷酸酶PP2C家族是8大蛋白丝氨酸/苏氨酸磷酸酶家族之一,它们具有独特的结构和功能。目前在人类基因组中共发现有18个PP2C家族成员,这些基因编码了至少22个不同的同工酶。而在酵母细胞中,PP2C家族有7个成员,即PTC1~7[12]。PP2C家族中被研究最多的有PPM1A和PPM1B,研究发现,这2个基因可通过去磷酸化CDK2和抑制细胞应激信号,负向调节细胞生长[4]。PP2CE是新发现的PP2C家族成员,目前对其的研究很少,关于其在肿瘤中的作用大多也是通过对PP2C家族其他成员的研究推测而得。然而,不同的或同一个PP2C家族成员对于肿瘤是促进或是抑制作用还具有争议。最早在肿瘤中研究PPM1H的Sugiura等[13]发现PPM1H在结肠腺癌中较正常结肠组织表达增加,PPM1H可能通过去磷酸化CSE1L调控细胞周期和增殖,提出PPM1H可能促进肿瘤增殖。而近年来,Lee-Hoeflich等[14]在乳腺癌中研究却发现PPM1H可能是一个抑癌基因,PPM1H表达减少增加p27磷酸化降解,促进癌细胞增殖。我们推测,PP2C家族成员在肿瘤中的不同作用可能跟其在细胞内的亚定位相关。
在本研究中,我们收集同济医院的肝癌手术切除标本,通过荧光定量PCR法和免疫组织化学法分别检测PP2CE mRNA和蛋白在肝癌及癌旁组织中的表达水平,发现无论是在基因水平还是蛋白水平,PP2CE在肝癌组织中均减少。提示PP2CE可能参与了肝癌的生物学行为,如肝癌发生、增殖、迁移、侵袭,以及远处转移等。进一步通过分析肝癌组织中PP2CE低表达与临床病理资料之间的关系,我们发现,PP2CE表达减少与肝癌肿瘤大小、分化程度、门静脉侵犯和临床分期相关,提示PP2CE可能参与肝癌的增殖和侵袭转移。然而我们发现,PP2CE表达与肝癌淋巴转移却无明显相关性,这可能由于大部分的肝癌细胞以血行转移作为主要的转移途径,另一方面,PP2CE可能主要参与调节肝癌细胞增殖及血行转移。另外,运用免疫荧光法,我们检测到PP2CE主要表达于细胞质和核周围,且在肝癌组织中,其荧光染色明显减少。这些结果为进一步研究PP2CE对肝癌增殖和侵袭转移的作用提供了依据。
尽管目前已经有部分研究在探索PP2CE与肿瘤之间的关系[15],但PP2CE与肿瘤的转移的机制仍不清楚。PP2CE在细胞中主要起磷酸酶活性作用,其主要定位于细胞质中[16]。目前已有多个研究报道,一些具有酶活性的蛋白参与肿瘤发生发展过程,如aldolase[17]、PKM2[18]、CLK-1[19],然而,其对肿瘤的作用可能不仅仅依赖于酶活性作用,可能还跟它们的非酶活性相关。这些蛋白可能通过改变细胞亚定位,参与其它的信号通路或分子调节。因此,我们推测,可能存在一些调控PP2CE亚细胞定位的分子和机制,通过PP2CE的非酶作用而调控肿瘤的生物学行为。另外,由于目前对PP2CE的研究太少,其对肿瘤发生发展的影响机制还不是很清楚,借鉴PP2C家族中其他基因的下游信号调节机制可能对于深入研究PP2CE在肿瘤中的作用机制具有指导作用。总之,研究PP2CE在不同组织和不同类型肿瘤中的表达和亚细胞定位,对于研究PP2CE分子和肿瘤发生发展具有重要意义。
[1] Chen W,Zheng R,Baade P D,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2] Ingle P V,Samsudin S Z,Chan P Q,et al.Development and novel therapeutics in hepatocellular carcinoma:a review[J].Ther Clin Risk Manag,2016,12:445-455.
[3] Labes M,Roder J,Roach A.A novel phosphatase regulating neurite extension on CNS inhibitors[J].Mol Cell Neurosci,1998,12(1/2):29-47.
[4] Lammers T,Lavi S.Role of type 2C protein phosphatases in growth regulation and in cellular stress signaling[J].Crit Rev Biochem Mol Biol,2007,42(6):437-461.
[5] Lammers T,Peschke P,Ehemann V,et al.Role of PP2Calpha in cell growth,in radio-and chemosensitivity,and in tumorigenicity[J].Mol Cancer,2007,6:65.
[6] Hausmann C,Temme A,Cordes N,et al.ILKAP,ILK and PINCH1 control cell survival of p53-wildtype glioblastoma cells after irradiation[J].Oncotarget,2015,6(33):34592-34605.
[7] Qiu Y,Li X,Yi B,et al.Protein phosphatase PHLPP induces cell apoptosis and exerts anticancer activity by inhibiting Survivin phosphorylation and nuclear export in gallbladder cancer[J].Oncotarget,2015,6(22):19148-19162.
[8] Tang Y,Liu L,Sheng M,et al.Wip1 knockout inhibits the proliferation and enhances the migration of bone marrow mesenchymal stem cells[J].Exp Cell Res,2015,334(2):310-322.
[9] Li M G,Katsura K,Nomiyama H,et al.Regulation of the interleukin-1-induced signaling pathways by a novel member of the protein phosphatase 2C family(PP2Cepsilon)[J].J Biol Chem,2003,278(14):12013-12021.
[10] Kihara C,Seki T,Furukawa Y,et al.Mutations in zinc-binding domains of p53 as a prognostic marker of esophageal-cancer patients[J].Jpn J Cancer Res,2000,91(2):190-198.
[11] Kim J U,Shariff M I,Crossey M M,et al.Hepatocellular carcinoma:Review of disease and tumor biomarkers[J].World J Hepatol,2016,8(10):471-484.
[12] Arino J,Casamayor A,Gonzalez A.Type 2C protein phosphatases in fungi[J].Eukaryot Cell,2011,10(1):21-33.
[13] Sugiura T,Noguchi Y,Sakurai K,et al.Protein phosphatase 1H,overexpressed in colon adenocarcinoma,is associated with CSE1L[J].Cancer Biol Ther,2008,7(2):285-292.
[14] Lee-Hoeflich S T,Pham T Q,Dowbenko D,et al.PPM1H is a p27phosphatase implicated in trastuzumab resistance[J].Cancer Discov,2011,1(4):326-337.
[15] Thean L F,Loi C,Ho K S,et al.Genome-wide scan identifies a copy number variable region at 3q26 that regulates PPM1L in APC mutation-negative familial colorectal cancer patients[J].Genes Chromosomes Cancer,2010,49(2):99-106.
[16] Sugiura T,Noguchi Y.Substrate-dependent metal preference of PPM1H,a cancer-associated protein phosphatase 2C:comparison with other family members[J].Biometals,2009,22(3):469-477.
[17] Mamczur P,Gamian A,Kolodziej J,et al.Nuclear localization of aldolase A correlates with cell proliferation[J].Biochim Biophys Acta,2013,1833(12):2812-2822.
[18] Hsu M C,Hung W C,Yamaguchi H,et al.Extracellular PKM2 induces cancer proliferation by activating the EGFR signaling pathway[J].Am J Cancer Res,2016,6(3):628-638.
[19] Monaghan R M,Barnes R G,Fisher K,et al.A nuclear role for the respiratory enzyme CLK-1 in regulating mitochondrial stress responses and longevity[J].Nat Cell Biol,2015,17(6):782-792.
(2016-06-29 收稿)
Expression of PP2CE in Human Hepatocellular Carcinoma Tissues and the Clinical Significance
Xu Weihua1,Huang Huanjun2△
1DepartmentofGastroenterology,XiaochangFirstPeople’sHospital,Xiaogan432900,China2DepartmentofGastroenterology,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
Objective To investigate expression of PP2CE in human hepatocellular carcinoma(HCC)tissues and the clinical pathological significance,and test its sub-cellular localization in liver cells and HCC cells.Methods A total of 50 samples of HCC tissues and their para-carcinoma tissues were collected in Tongji Hospital(Wuhan).PP2CE mRNA and protein levels were detected in HCC tissues and their para-carcinoma tissues by qRT-PCR and immunohistochemistry method.Immunofluorescent assay was performed to test the sub-cellular localization of PP2CE in the cells.Results PP2CE mRNA and protein expression levels were significantly decreased in HCC tissues as compared with those in para-carcinoma tissues(bothP<0.05).Immunohistochemistry analysis found that PP2CE expression was associated with tumor size,differentiated degree,portal vein invasion and clinical stage(bothP<0.05).Immunofluorescent assay suggested that PP2CE was mainly located in the cytoplasm and perinuclear area.Conclusion PP2CE is reduced in HCC and may be implicated in the development and progression of HCC.
PP2CE; hepatocellular carcinoma; sub-cellular localization; metastasis
R735.7
10.3870/j.issn.1672-0741.2017.03.018
徐卫华,男,1966年生,副主任医师,E-mail:1951462303@qq.com
△通讯作者,Corresponding author,E-mail:hjhuang12345@126.com
