苯甲酰矢车菊素-3-葡萄糖苷的酶法合成及结构表征
2017-07-03李春阳黄午阳张丽霞
闫 征,李春阳,黄午阳,张丽霞
(江苏省农业科学院 农产品加工研究所,江苏 南京 210014)
苯甲酰矢车菊素-3-葡萄糖苷的酶法合成及结构表征
闫 征,李春阳,黄午阳,张丽霞*
(江苏省农业科学院 农产品加工研究所,江苏 南京 210014)
采用响应面分析确定脂肪酶催化合成酰基化矢车菊素-3-葡萄糖苷的最佳工艺,并通过液质联用和核磁共振对产物进行鉴定。结果显示,以酰基化反应转化率为指标的最佳工艺条件为:反应温度41 ℃,真空度-90 kPa,酶浓度43 mg·mL-1,矢车菊素-3-葡萄糖苷浓度10 mg·mL-1,苯甲酸甲酯浓度0.4 g·mL-1,反应时间24 h,最终转化率为90.92%。矢车菊素-3-葡萄糖苷的酰基化产物经液质联用和核磁共振鉴定为矢车菊素-3-(6-苯甲酰)葡萄糖苷。
矢车菊素-3-葡萄糖苷;苯甲酰化;脂肪酶
矢车菊素-3-葡萄糖苷(cyanidin-3-glucoside,C3G)是黑米色素的主要成分[1-3],是最常见、分布最广的一种天然花色苷色素。天然花色苷色素具有安全、无毒、无异味、色彩鲜艳等特点,同时还具有多种营养保健和药理作用[4-7]。在当今化学合成色素越来越受到消费者抵制的情况下,天然花色苷作为合成色素的替代品具有很大的发展空间。但是花色苷的不稳定性一直是制约其作为食用色素广泛应用的主要因素[8-9]。研究发现,天然芳香族酰基花色苷比非酰基花色苷稳定性高[10-11],如对非酰基花色苷进行人工酰基化,提高其稳定性,将极大地扩展天然花色苷色素的应用范围。
Lv等[12]使用化学方法,利用辛烯基琥珀酸酰化了黑米花色苷;Stevenson等[13]酶法合成了酰基化蓝莓花色苷;de Castro等[14]用Novozym 435脂肪酶催化,合成了酰基化拟爱神木花色苷;Enaud等[15]利用芳香酸甲酯,基于脂肪酶催化下的转酯作用合成了芳香酰根皮苷酯。与化学法酰基化相比,生物酶法酰基化具有区域选择性高、反应步骤少、反应条件温和、简单可控等优点,尤其是对于像花色苷这类易分解、稳定性差的天然化合物,酶催化法比化学法更加适用。Adamczak等[16]对脂肪酶固定化方法进行了研究,结果表明,固定化可提高酶的稳定性,促进产物分离和酶的重复利用,更加适用于有机溶剂中对花色苷等黄酮类物质的酰基化。笔者所在研究团队在前期研究中利用脂肪酶催化合成了多种酰基化C3G,其中苯甲酰C3G合成效果最好,转化率最高,且产物的热稳定性、光稳定性比C3G有大幅度提高[17]。
目前,与同属黄酮类物质的其他天然化合物的酶法酰基化相比,采用酶法酰基化花色苷的研究较少。本研究拟以固定化脂肪酶Novozym435为生物催化剂,通过减压条件下苯甲酸甲酯和黑米C3G在吡啶溶剂中发生的酯交换反应工艺,分析产物结构,考查真空度、酶浓度、底物浓度、反应温度等对转化率的影响,基于响应面分析对合成工艺进行优化,并利用液质联用色谱和核磁共振对产物结构进行表征,为酶法酰基化花色苷技术的开发提供参考与理论依据。
1 材料与方法
1.1 试验材料
矢车菊素-3-葡萄糖苷(由黑米提取纯化获得,含量≥80%)参照闫征等[18]的方法自行制备。脂肪酶Novozym435由诺维信(中国)生物技术有限公司提供。吡啶、苯甲酸甲酯等均为国产分析纯,购自南京化学试剂有限公司。试验仪器和设备包括:RE-5250型旋转蒸发仪,上海亚荣生化仪器厂;Agilent 1100高效液相色谱仪,美国Agilent公司。
1.2 试验方法
1.2.1 C3G的酶法酰基化
将C3G、脂肪酶Novozym435及反应容器在30 ℃下真空干燥24 h以上,有机试剂吡啶、苯甲酸甲酯用4A分子筛干燥48 h备用。在250 mL烧瓶中加入一定量的黑米C3G,加入少量吡啶使C3G完全溶解,再加入一定量苯甲酸甲酯和脂肪酶Novozym435,最后加入吡啶使反应液总体积为5 mL。将反应体系在旋转蒸发仪上以一定的温度和真空度,转速20 r·min-1反应24 h。
1.2.2 HPLC条件
色谱柱,Zorbax SB-C18反相色谱柱(4.6 mm×250 mm,5 μm);流动相A为6%乙酸水溶液,B为6%乙酸乙腈溶液。梯度设计:0—25 min,5%~30%流动相B;25—35 min,30%~80%流动相B;35—45 min,80%~5%流动相B;45—50 min,5%流动相B。进样量10 μL,检测波长分别为520、280 nm,流速0.6 mL·min-1。
1.2.3 转化率和收率测定
采用高效液相色谱法测定,色谱条件见1.2.2节。按下列公式计算转化率和收率:

(1)

(2)
式(1)、(2)中:A1为未反应的C3G峰面积;A2为酰基化C3G的峰面积;n为实际得到的苯甲酰化矢车菊素-3-葡萄糖苷的物质的量,mmol;N为理论上应得的苯甲酰化矢车菊素-3-葡萄糖苷的物质的量(以矢车菊素-3-葡萄糖苷加入量计),mmol。
1.2.4 反应产物的结构表征
质谱分析:质量扫描范围,m/z 200~2 000;离子方式,毛细管电压正离子模式,3.0kV;毛细管温度350 ℃;干燥气与雾化气均为N2。
核磁共振分析:将分离纯化后的酰基化C3G产物溶解于氘代甲醇中,采用500MHz扫描,测定各化合物的氢谱(1H-NMR)和碳谱(13C-NMR)。
1.3 试验设计
1.3.1 单因素试验
通过前期试验,确定反应在苯甲酸甲酯过量情况下效果较好,因此选择苯甲酸甲酯添加浓度0.4g·mL-1;反应在24h后可达到平衡,因此取反应时间为24h。按1.2.1节方法,真空度-90kPa,反应温度40 ℃,C3G浓度10g·mL-1,脂肪酶Novozym435 40mg·mL-1。固定其他反应条件,分别考查真空度(-60、-70、-80、-90、-100kPa)、反应温度(20、30、40、50 ℃)、脂肪酶用量(10、20、30、40、50、60mg·mL-1)、C3G浓度(4、6、8、10、12、14mg·mL-1)对转化率的影响。
1.3.2 响应面试验设计
在单因素试验基础上,确定对转化率影响较大的4个因素分别为真空度(X1,kPa)、反应温度(X2,℃)、脂肪酶用量(X3,mg·mL-1)以及C3G浓度(X4,mg·mL-1),对其进行4因素3水平的Box-Behnken试验设计,如表1所示。采用软件Desigeexpert进行方差分析及反应参数优化。
2 结果与分析
表1 因子水平表
Table1Independentvariablesandtheirlevels

编码Code水平Level-10+1X1-95-90-85X2304050X3304050X481012
2.1 单因素试验
2.1.1 真空度对转化率的影响
减压条件可使酯交换产生的反应副产物甲醇在设定的反应温度下蒸发,脱离反应体系,从而使反应向生成酰基化C3G的方向进行。如果真空度过低,会使溶剂和底物也发生蒸发,从而影响反应的进度;因此,必须选择适当的真空度以维持反应体系的稳定。考查真空度-60~-100 kPa下脂肪酶催化反应中转化率的变化,结果如图1所示。当真空度为-60 kPa时,反应转化率极低,几乎无产物生成。随着真空度增加,转化率不断提高。当真空度达到-90 kPa时,反应24 h后转化率最高。可见,在一定的范围内提高真空度可以大幅度提高转化率和反应速度,但是更高的真空度会造成溶剂的过快蒸发,使反应无法进行,而且更高的真空度从技术和成本角度考虑也不适于实际生产;因此,本试验采用-90 kPa作为反应条件。
2.1.2 反应温度对转化率的影响
温度是酶促反应的重要影响因素之一。对于一般的酶促反应,温度影响酶的稳定性及酶活,同时也影响底物及产物溶解度。随着温度升高,酶催化反应速度提高,但当温度高过一定值时,酶的稳定性会下降,甚至造成失活。由于本试验系在减压条件下进行,过高的温度还会造成溶剂的蒸发,因此,必须选择适当的温度以维持反应体系的稳定及酶的催化活性。如图1所示,随着温度的升高,反应的转化率增加,当温度为40 ℃时达到最高转化率,当温度为50 ℃时,由于溶剂蒸发,反应中途终止,造成转化率下降。这说明:低温时反应物之间的传质不佳,且酶活性较低,另外副产物甲醇的蒸发速度慢;当温度升高,反应转化率提升;当温度超过50 ℃时,溶剂体系中的吡啶等有机溶剂蒸发损失,使反应未完成时就由于溶剂缺乏而终止,造成转化率下降。

图1 单因素试验结果Fig.1 Results of single factor experiment
2.1.3 脂肪酶用量对转化率的影响
酶用量是催化反应中的关键因素,酶用量主要影响酶促反应的速度。一般情况下,产物的转化率会随着酶用量的增加而提高。如图1所示,当酶用量开始逐渐增加时,转化率呈增长趋势,但当酶用量超过40 mg·mL-1,转化率几乎不再提高。这可能是由于在此条件下,酶的量相对于底物的浓度已经饱和,转化率无法进一步提高。
2.1.4 C3G浓度对转化率的影响
如图1所示,随着C3G浓度的增加,转化率有所提高,但当C3G的添加量超过10 mg·mL-1时,转化率反而有所下降。C3G浓度的适当提高,可以提高酶与底物的结合机会,从而提高转化率,但浓度过大会导致发生不溶于溶剂的现象,也会相对降低苯甲酸甲酯的有效浓度,从而在一定程度上阻碍反应的进行。
2.2 响应面法优化酶法苯甲酰化C3G工艺
2.2.1 多元回归分析

对所构建的二次回归方程进行方差分析(表3),模型F值为49.50,P<0.000 1,失拟项F值为2.71,P>0.05,说明所构建的模型可靠。模型的拟合度R2为0.980 2,校正拟合度R2为0.960 4,信噪比26.332,说明所构建的二次模型模拟合理,可信度较高。对各因素回归进行显著性检验:一次项中真空度(X1)、反应温度(X2)、脂肪酶用量(X3)对转化率均有极显著的影响(P<0.01);交互项中X1X2交互作用对转化率有极显著的影响(P<0.01)。各因素对转化率的影响大小依次为真空度(X1)>脂肪酶用量(X3)>反应温度(X2)>C3G浓度(X4)。
2.2.2 响应面曲面分析
与多元回归分析的结果一致,沿C3G浓度(X4)轴向的响应曲面较平滑,等高线变化较稀疏(图2),表明其对转化率的影响较小,而真空度和反应温度对转化率的影响显著,其他交互项对转化率的影响不显著。固定C3G浓度和脂肪酶用量的情况下,真空度对转化率的影响比反应温度大。对于转化率的影响,真空度>脂肪酶用量,真空度>C3G浓度,脂肪酶用量>反应温度,反应温度>C3G浓度,脂肪酶用量>C3G浓度。
表2 试验设计及检测值
Table 2 Complete experimental conditions tested and corresponding observed values

试验号No.编码水平CodelevelX1X2X3X4转化率Conversion/%1-1-10064.2021-10076.903-110075.404110070.50500-1-183.306001-181.20700-1177.408001185.909-100-171.5010100-175.1011-100172.4012100178.30130-1-1081.901401-1081.40150-11081.4016011086.3017-10-1072.301810-1076.4019-101075.5020101079.40210-10-173.5022010-180.30230-10180.6024010180.4025000091.8026000090.3027000091.0028000089.3029000090.70
表3 方差分析
Table 3 ANOVA analysis

来源Source总平方和Sumofsquares自由度Degreeoffreedom均方MeansquareFP模型Model1304.361493.1749.50<0.0001**X153.34153.3428.34<0.0001**X220.80120.8011.050.0050**X324.08124.0812.790.0030**X48.5018.504.520.0519X1X277.44177.4441.14<0.0001**X1X30.0110.010.0050.9429X1X41.3211.320.700.4160X2X37.2917.293.870.0692X2X412.25112.256.510.0231*X3X428.09128.0914.920.0017**X21916.241916.24486.77<0.0001**X22255.211255.21135.58<0.0001**X2342.93142.9322.810.0003**X24188.101188.1099.93<0.0001**残差Residualerror26.35141.88失拟项Lackoffit22.96102.302.710.1744绝对偏差Pureerror3.3940.85总和Sum1330.7128
*与**分别表示差异显著(P<0.05)与极显著(P<0.01)。
* and**indicated significant difference atP<0.05 orP<0.01, respectively.
2.2.3 最优参数的确定及模型验证
根据等值线图确定最优条件:真空度-90 kPa,反应温度41 ℃,脂肪酶用量43 mg·mL-1,C3G浓度10 mg·mL-1。在最优条件下,模型预测的转化率为91.10%。对预测模型重复验证3次,结果表明,反应的平均转化率为90.92%,与预测模型一致。通过对反应前后底物及产物含量的测定可知,在最佳反应条件下苯甲酰C3G收率为85.42%。
2.3 酰基化反应产物的确证
采用HPLC-MS分析反应前后反应体系的花色苷组成及主要成分分子量,检测波长为520 nm。图3为反应前后体系的HPLC谱图及主要物质的MS谱图:反应前其主要花色苷成分峰保留时间为14.85 min,相对分子量为449.2,由前人的研究可知该物质为矢车菊素-3-葡萄糖苷[19-21];反应后矢车菊素-3-葡萄糖苷的峰大幅度降低,新生成了保留时间为28.72 min的花色苷物质,相对分子量553.4,恰好为一个苯甲酸酰与一个矢车菊素-3-葡萄糖苷分子量之和,可见该反应为定向反应,主要产物为单酰基化产物(图4)。二级质谱显示产生了一个相对分子量287.1的离子碎片,可见苯甲酰应连接于葡萄糖苷上。核磁共振(NMR)分析的结果(图5)也支持上述结论。
3 讨论
C3G等花色苷类物质稳定性差,化学法酰基化易造成其降解褪色。以脂肪酶为代表的有机相中酶法酰基化可实现花色苷等黄酮糖苷类物质的酰基化。Stevenson等[13]用此法对蓝莓提取物进行酰基化研究,结果发现,有酰基化花色苷生成,但反应时间较长,转化率较低,且未对产物进行纯化和鉴定。de Castro等[14]以棕榈酸为酰基供体,Novozym435脂肪酶为催化剂,进行了拟爱神木花色苷的酰基化研究,结果成功合成了单棕榈酸酰飞燕草素-3-葡萄糖苷和矢车菊素-3-葡萄糖苷。与前人对酶法酰基化花色苷的研究结果相比,本研究通过减压条件下有机相中脂肪酶催化酯交换反应实现C3G的酰基化,酰基化率较高,而且反应时间较短,这主要是由于在设定反应条件下反应副产物甲醇能够立即蒸发脱离反应体系,使反应能够向生成产物的方向进行。使用苯甲酸甲酯为酰基供体成本较低,且未反应底物和溶剂回收利用容易。在实际生产中如采用该反应条件有助于获得较高的C3G酰基化转化率,缩短生产周期,提高生产效益。

X1, 真空度; X2, 反应温度; X3, 脂肪酶用量; X4, C3G浓度X1, Vacuum; X2, Temperature; X3, Amount of enzyme; X4, Concentration of C3G图2 响应面图和等值线图Fig.2 Response surface and contours
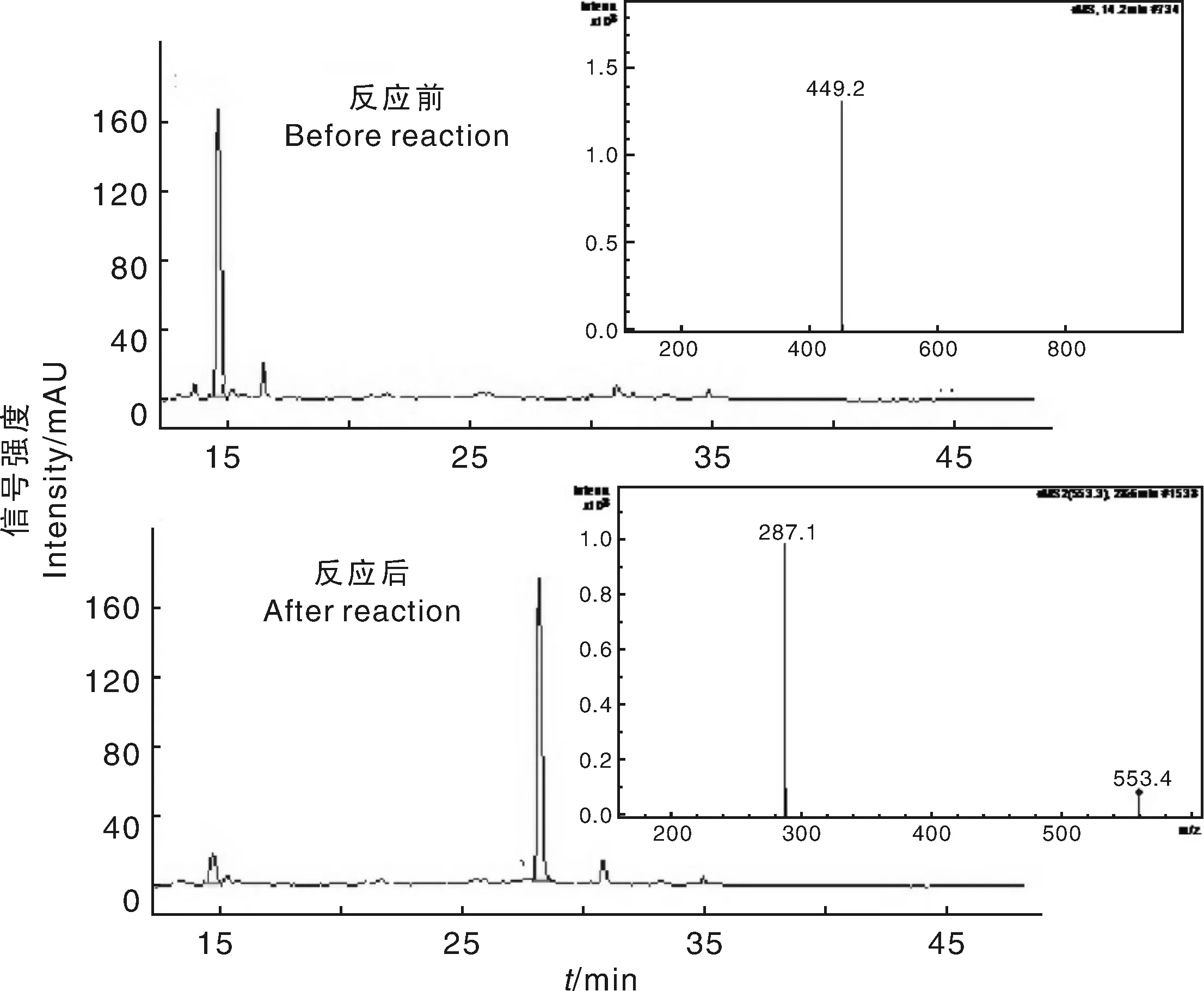
图3 酰基化反应前后的HPLC-MS谱图Fig.3 HPCL-MS spectra before and after reactionpurification

图4 酰基化反应示意图Fig.4 Diagrammatic sketch of acylation reaction

图5 酰基化反应前后的NMR谱图Fig.5 NMR spectra before and after reactionpurification
本研究通过单因素和响应面分析确定了脂肪酶催化的苯甲酸甲酯为酰基供体的C3G酰基化最佳反应条件:真空度-90 kPa,反应温度41 ℃,酶用量43 mg·mL-1,C3G浓度10 mg·mL-1,苯甲酸甲酯浓度0.4 g·mL-1,反应时间24 h。在此条件下,平均转化率为90.92%。酰基化产物经过质谱与核磁共振鉴定,推测产物为矢车菊素-3-(6-苯甲酰)葡萄糖苷,脂肪酶催化C3G酰基化的作用位点是葡萄糖苷的C-6位羟基。说明以脂肪酶为催化剂,苯甲酸甲酯为酰基供体,可以实现酰基化矢车菊素-3-葡萄糖苷的定向合成,且转化率较高。
目前,对酶法酰基化花色苷的研究尚处于初级阶段,今后将对反应体系进行扩大,争取实现工业化生产。另外,要加强对不同酰基供体反应条件的优化,为天然花色苷的酶法修饰研究提供技术支持。
[1] EL-SM A A, YOUNG J C, RABALSKI I. Anthocyanin composition in black, blue, pink, purple, and red cereal grains[J].JournalofAgricultural&FoodChemistry, 2006, 54(13):4696-4704.
[2] GALVANO F, LA F L, VITAGLIONE P, et al. Bioavailability, antioxidant and biological properties of the natural free-radical scavengers cyanidin and related glycosides[J].AnnaliDellistitutoSuperioreDiSanita, 2007, 43(4): 382-393.
[3] SHAO Y, XU F, SUN X, et al. Identification and quantification of phenolic acids and anthocyanins as antioxidants in bran, embryo and endosperm of white, red and black rice kernels (OryzasativaL.)[J].JournalofCerealScience, 2014, 59(2): 211-218.
[4] BUENO J M, RAMOS-ESCUDERO F, SEZ-PLAZA P, et al. Analysis and antioxidant capacity of anthocyanin pigments. Part I: General considerations concerning polyphenols and flavonoids[J].CriticalReviewsinAnalyticalChemistry, 2012, 42(2):102-125.
[5] BUENO J M, SEZ-PLAZA P, RAMOS-ESCUDERO F, et al. Analysis and antioxidant capacity of anthocyanin pigments. Part II: Chemical structure, color, and intake of anthocyanins[J].CriticalReviewsinAnalyticalChemistry, 2012, 42(2): 126-151.
[6] POJER E, MATTIVI F, JOHNSON D, et al. The case for anthocyanin consumption to promote human health: A review[J].ComprehensiveReviewsinFoodScience&FoodSafety, 2013, 12(5): 483-508.
[7] FERNANDES I, FARIA A, CALHAU C, et al. Bioavailability of anthocyanins and derivatives[J].JournalofFunctionalFoods, 2014, 7(1):54-66.
[8] PATRAS A, BRUNTON N P, O’DONNELL C, et al. Effect of thermal processing on anthocyanin stability in foods; mechanisms and kinetics of degradation[J].TrendsinFoodScience&Technology, 2010, 21(1): 3-11.
[9] CAVALCANTI R N, SANTOS D T, MAA M. Non-thermal stabilization mechanisms of anthocyanins in model and food systems——An overview[J].FoodResearchInternational, 2011, 44(2):499-509.
[10] GIUSTI M M, RODRGUEZSAONA L E, WROLSTAD R E. Molar absorptivity and color characteristics of acylated and non-acylated pelargonidin-based anthocyanins[J].JournalofAgricultural&FoodChemistry, 1999, 47(11):4631-4637.
[11] STINTZING F C, STINTZING A S, CARLE R, et al. Color and antioxidant properties of cyanidin-based anthocyanin pigments[J].JournalofAgricultural&FoodChemistry, 2002, 50(21): 6172-6181.
[12] LV X L, SUN H L, JI Z Y. Acylation of anthocyanins from black rice and their stability properties[J].AdvancedMaterialsResearch, 2011, 204-210: 750-754.
[13] STEVENSON D E, WIBISONO R, JENSEN D J, et al. Direct acylation of flavonoid glycosides with phenolic acids catalysed byCandidaantarctica, lipase B (Novozym 435®)[J].Enzyme&MicrobialTechnology, 2006, 39(6):1236-1241.
[14] DE CASTRO V C, DA SILVA P H A, DE OLIVEIRA E B, et al. Extraction, identification and enzymatic synthesis of acylated derivatives of anthocyanins from jaboticaba (Myrciariacauliflora) fruits[J].InternationalJournalofFoodScience&Technology, 2014, 49(1): 196-204.
[15] ENAUD E, HUMEAU C, PIFFAUT B, et al. Enzymatic synthesis of new aromatic esters of phloridzin[J].JournalofMolecularCatalysisBEnzymatic, 2004, 27(1): 1-6.
[16] ADAMCZAK M, KRISHNA S H. Strategies for improving enzymes for efficient biocatalysis[J].FoodTechnology&Biotechnology, 2004, 128(4): 251-264.
[17] ZHENG Y, LI C, ZHANG L, et al. Enzymatic acylation of anthocyanin isolated from black rice with methyl aromatic acid ester as donor: Stability of the acylated derivatives[J].JournalofAgricultural&FoodChemistry, 2016, 64(5): 1137-1143.
[18] 闫征, 王四维, 李春阳. 聚酰胺树脂分离纯化黑米中矢车菊素-3-葡萄糖苷工艺研究[J]. 粮食与饲料工业, 2016, 12(4): 31-36. YAN Z, WANG S W, LI C Y. Purification of cyanidin-3-glucoside from black rice by polyamide resin[J].Cereal&FeedIndustry, 2016, 12(4): 31-36. (in Chinese with English abstract)
[19] CHEN L, XIN X, LAN R, et al. Isolation of cyanidin 3-glucoside from blue honeysuckle fruits by high-speed counter-current chromatography[J].FoodChemistry, 2014, 152(2): 386-390.
[20] 刘琴, 李敏, 胡秋辉. 黑米麸皮与紫包菜花青素提取物的组成、抗氧化性与稳定性比较研究[J]. 食品科学, 2012, 33(19):113-118. LIU Q, LI M, HU Q H. Comparative studies on the composition, antioxidant activity and stability of anthocyanins from black rice bran and purple cabbage[J].FoodScience, 2012, 33(19): 113-118. (in Chinese with English abstract)
[21] CHEN X Q, NAGAO N, ITANI T, et al. Anti-oxidative analysis, and identification and quantification of anthocyanin pigments in different coloured rice[J].FoodChemistry, 2012, 135(4): 2783-2788.
(责任编辑 高 峻)
Synthesis technology and benzoylation cyanidin-3-glucoside catalyzed by lipase and structural characterization
YAN Zheng, LI Chunyang, HUANG Wuyang, ZHANG Lixia*
(InstituteofFarmProductProcessing,JiangsuAcademyofAgriculturalSciences,Nanjing210014,China)
The synthetic process of acylated cyanidin-3-glucoside catalyzed by enzyme was optimized through single factor experiment and response surface analysis according to the degree of conversion, and the product was identified by HPLC-MS and NMR. The optimum conditions were as follows: 41 ℃,-90 kPa, 43 mg·mL-1enzyme applied, concentration of cyanidin-3-glucoside 10 mg·mL-1, concentration of methyl benzoate 0.4 g·mL-1, reaction time 24 h. The structures of acylated cyanidin-3-glucoside products were identified as 3-(6″-benzoyl)-glucoside.
cyanidin-3-glucoside; benzoylation; lipase
10.3969/j.issn.1004-1524.2017.06.21
2016-12-26
国家自然科学基金(31401489)
闫征(1978—),男,黑龙江齐齐哈尔人,博士,助理研究员,研究方向为食品生物技术。E-mail: yz3737@sina.com
*通信作者,张丽霞,E-mail: zlx5885@163.com
TQ464.3
A
1004-1524(2017)06-1001-08
