抗草甘膦转基因大豆对雄性生殖损伤小鼠体外受精作用的影响
2017-07-03芦春斌陈博慧林泽斌仇平乐
芦春斌,张 雁,陈博慧,林泽斌,仇平乐,刘 标
(1.暨南大学 发育与再生生物学系,广东 广州510632; 2.环境保护部 南京环境科学研究所,江苏 南京 210042)
抗草甘膦转基因大豆对雄性生殖损伤小鼠体外受精作用的影响
芦春斌1,2,张 雁1,陈博慧1,林泽斌1,仇平乐1,刘 标2,*
(1.暨南大学 发育与再生生物学系,广东 广州510632; 2.环境保护部 南京环境科学研究所,江苏 南京 210042)
用化疗药物环磷酰胺(CP)处理小鼠建立雄性生殖损伤模型,以抗草甘膦转基因大豆饲料喂食30 d,进行体外受精实验,检测其受精率及2-细胞、4-细胞、8-细胞和囊胚的形成率和优胚率,评估转基因大豆饲料对雄鼠生殖功能的潜在影响。实验结果显示,在CP处理导致的生殖损伤条件下,与非转基因大豆喂食组相比,以抗草甘膦转基因饲料喂食30 d对小鼠受精率,及其分裂形成的2-细胞、4-细胞、8-细胞和囊胚形成率和优胚率无显著(P>0.05)影响,表明CP诱导的生殖损伤状态下,抗草甘膦转基因大豆饲料喂食30 d不会对雄性小鼠的生殖功能造成损伤。
转基因大豆;小鼠;环磷酰胺(CP);体外受精
抗草甘膦转基因大豆(农达)是目前种植最多的转基因作物,其携带编码莽草酸羟基乙烯转移酶(EPSPS)基因,能避免因草甘膦破坏植物中芳香族氨基酸合成而引起的死亡,从而赋予转基因大豆抗除草剂的优良性状,降低农业生产的成本,提高生产率[1-2]。从20世纪90年代开始,转基因技术和转基因农作物的推广和应用已有二十年的历史,目前国内外对转基因作物的安全性评估包括短期(14~28 d)、长期(90 d至24个月)动物饲养实验及多代(2~5代)实验,所用的转基因材料包括玉米、大豆、番茄、油菜籽、黑小麦等[3-4],转基因食品的安全性虽已得到充分验证,但国内外大众对其安全性还有很多质疑,而且随着更多的转基因植物被研究和推广,对其安全评估还需要继续进行。同时应该将更多生物科学新技术,如蛋白组学方法、转录组方法和技术,应用于转基因安全性的评估。
现阶段对转基因作物的食用安全评估主要集中于各种模式动物的生长状况、体重及器官的脏器系数、组织病理学、血液学、血液化学、神经功能性损伤等传统领域[3-5],采用的评估和检测技术也较为传统。Wang等[6]进行了90 d喂食转Bt大米TT51安全研究,除了对雄性大鼠体重、食物摄取、血液化学的传统性研究检测之外,还对其精子参数、血清性激素含量、睾丸组织病理变化等生殖功能进行了初步的研究,没有发现转Bt大米TT51对雄性大鼠的生殖功能有不良影响。2014年Séralini等[7]和Malatesta等[8]研究发现,转基因玉米和转基因大豆90 d喂食能影响模式动物生长,有一定的肝肾毒性,且呈剂量依赖性,然而该结果很快被科学界和欧洲食品安全权威机构所否决,因为大量的研究已经表明转基因作物不会对模式动物产生不良影响。Domingo[9]在2016年指出,转基因大豆、玉米、大米和小麦等没有潜在的毒性或不良影响,并更新了转基因作物作为消费食品、饲料无潜在不利影响的信息。
精子在雄性睾丸、附睾中发育成熟,睾丸、附睾等对外界刺激包括化疗等极为敏感,并且化疗潜在的生殖毒理将会是长期的、不可逆转的,因此精子的功能常用作生殖毒理评估的一项重要指标,无疑评估转基因农产品或饲料对动物和人类生殖功能损伤作用是全面评估其安全性并推广应用的先决条件。
环磷酰胺(cyclophosphamide,CP)是临床上普遍使用的抗癌化疗药物,其用于肿瘤化疗时会带来一定的毒副作用,包括对运动系统、生殖系统等较为明显的毒性作用[10]。虽然各种安全评估也已证明商品化的转基因农作物及其产品不存在食用安全问题,但是迄今为止涉及的转基因作物产品对化疗已造成的生殖损伤人群的潜在作用,及后代的生殖功能可能的潜在影响还鲜有研究。故本实验拟采用CP处理实验动物以构建雄鼠生殖损伤模型,进一步探讨喂食抗草甘膦转基因大豆30 d是否对已构建生殖损伤模型小鼠的体外受精率,及其分裂形成的2-细胞、4-细胞、8-细胞和囊胚形成率和优胚率有不良影响或毒副作用,以评估转基因食品的安全性。
1 材料与方法
1.1 实验材料与试剂
雄性昆明小鼠(6~8周,SPF级)购自暨南大学医学院动物中心,环磷酰胺(CP)购自江苏恒瑞医药股份有限公司。
转基因豆粕原料为本实验室保存的孟山都公司的抗草甘膦转基因大豆(GTS40-3-2),选用的非转基因豆粕为其亲本品种(A5403)的豆粕。其中豆粕占动物饲料的含量为16%。动物饲料由广东省实验动物中心参照实验动物合成饲料营养成分标准GB 14924.3—2001加工制成。转基因饲料和非转基因饲料中除大豆豆粕为转基因豆粕和非转基因豆粕外,其他成分均相同。
HTF溶液:参照《小鼠胚胎操作实验手册》进行配制[11],配制好的HTF培养液放置于4 ℃保存,保存期为2 周。实验开始前需放入37 ℃、5%CO2培养箱中过夜孵育。
PMSG(孕马血清促性腺激素):将10 mL 0.9%无菌生理盐水加入至1 000单位(1 000 IU)PMSG粉末中,使其充分溶解,制备成100 IU·mL-1的PMSG储备液,1 mL·只-1分装至1.5 mL EP管中,-20 ℃储存备用。
hCG(人绒毛膜促性腺激素):将10 mL 0.9%无菌生理盐水加入至1 000单位(1 000 IU)hCG粉末中,使其充分溶解,制备成100 IU·mL-1的hCG储备液,1 mL·只-1分装至1.5 mL EP管中,-20 ℃储存备用。
1.2 实验动物分组及处理
将40只5周雄性昆明小鼠用非转基因饲料适应性喂养7 d后,随机分为4组,每组10只小鼠。第一组在第一天一次性腹腔注射0.4 mL 0.9%生理盐水,同时喂食非转基因大豆饲料,即为CK组;第二组在第一天一次性腹腔注射0.4 mL 0.9%生理盐水,同时喂食转基因大豆饲料,即为GM组;第三组在第一天一次性腹腔注射0.4 mL环磷酰胺(200 mg·kg-1),同时喂食非转基因大豆饲料,即为CP-CK组;第四组在第一天一次性腹腔注射0.4 mL环磷酰胺(200 mg·kg-1),同时喂食转基因大豆饲料,即为CP-GM组。四组小鼠喂食至第30天,分别检测雄性小鼠精子的体外受精能力。
动物饲养和喂食条件按国家实验动物饲养标准进行,室内温度(22±2)℃,室内湿度40%~70%,光照时间为12 h·d-1,动物自由取食饮水。
1.3 实验方法
1.3.1 雄性小鼠生殖损伤模型建立
CP-CK组和CP-GM组小鼠在第一天一次性腹腔注射CP后,从第0天(CP注射当天)开始,每隔10 d对CP-CK组和CP-GM组小鼠的精子数量和精子存活率进行检测,直至第40天。通过检测小鼠的精子数量和精子存活率鉴定雄性小鼠生殖损伤模型的建立。精子数量和精子存活率检测的方法参考《世界卫生组织人类精液检查与处理实验室手册》[12]。
1.3.2 雌性昆明小鼠超排卵处理
已分组的雄性小鼠喂食至第30 d时,当天下午21:00对正常雌性小鼠注射10 IU PMSG促使雌鼠卵泡发育,48 h后注射10 IU hCG促使雌鼠超排卵。
1.3.3 雄性昆明小鼠精子收集及获能
已处理的实验雄鼠喂食至第30 d时颈椎脱臼处死,迅速摘取两侧附睾尾,放置至含有2 mL HTF培养液的60 mm培养皿中,在解剖显微镜下用细针扎破附睾尾中曲细精管,待精子流出后弃除附睾尾,于37 ℃ 5%CO2培养箱内孵育1 h使精子获能。
1.3.4 体外受精实验
将注射hCG后11~13 h的雌鼠经颈椎脱臼处死,取出卵子至HTF培养液滴中,于37 ℃ 5% CO2培养箱内孵育。同时将获能的已计数浓度为(1~2)×106个·mL-1精子加入至含有卵子的HTF培养液中,此时小鼠的受精时间记为0 dpc(days postcoitum)。分别在0.5、1.5、2.5、3.5和4.5 dpc时观察受精卵、2-细胞、4-细胞、8-细胞和囊胚的形成率和优胚率。
1.3.5 优胚率评估
优胚评估:根据早期胚胎形态学特征,如卵裂球均匀,周围有无碎片,进行判断。胚胎质量可分为4个等级:A级为优质胚胎,其细胞团均匀对称,单个卵裂球(或细胞)的大小、颜色、密度一致,且透明带光滑;B级为良好胚胎,其细胞团大小和形状以及单个细胞的颜色和密度存在一定不规则性;C级为质量差的胚胎;D级为死亡或退化胚胎,没有活力[11]。正常发育不同时期的优质胚胎如图1中箭头所示。
1.4 数据统计分析
2 结果与分析
2.1 雄性小鼠生殖损伤模型的建立
雄性小鼠经腹腔一次性注射单剂量的环磷酰胺(200 mg·kg-1)后,30 d内导致精子数量由0 d的 (540±22.91) 万个·mL-1下降至 (283.33±53.46) 万个·mL-1(下降约2倍),精子存活率由0 d的(74.83±3.33)%下降至(43.17±4.04)%(下降了42.3%)(图2),说明腹腔一次性注射单剂量的环磷酰胺(200 mg·kg-1)能够导致雄性小鼠精子质量包括精子数量和精子存活率下降,也进一步说明雄性小鼠生殖损伤模型构建成功。
2.2 抗草甘膦转基因大豆对雄性小鼠体外受精作用形成率的影响
在正常生理条件下(腹腔注射生理盐水对照组),喂食非转基因饲料30 d后,CK组小鼠的受精率为(87.86±1.16)%,2-细胞形成率为(81.80±2.27)%,4-细胞、8-细胞和囊胚的形成率分别为(66.43±2.34)%、(67.40±1.01)%和(50.23±0.75)%;喂食抗草甘膦转基因饲料30 d后,GM组小鼠的受精率为(87.33±2.13)%、2-细胞形成率为(80.96±3.35)%,4-细胞、8-细胞和囊胚的形成率分别为(66.70±0.26)%、(66.40±0.80)%和(49.86±0.55)%。GM组的受精率、2-细胞、4-细胞、8-细胞和囊胚的形成率与CK组相比均无显著性差异(P>0.05)(图3)。

箭头表示正常发育不同时期的胚胎。400×The arrow represents the normal development of different stage embryo. 400×a, 受精卵; b, 2-细胞; c, 4-细胞; d, 8-细胞; e, 囊胚a, Zygotes; b, 2-cell; c, 4-cell; d, 8-cell; e, Blastocysts图1 小鼠体外受精中受精卵-囊胚图Fig.1 The images of zygotes to blastocysts in vitro fertilization of mice

→表示环磷酰胺注射时间点→Represents the injection time of CP图2 雄性小鼠生物损伤模型构建Fig.2 The model of reproductive-damaged male mice
当小鼠经腹腔注射200 mg·kg-1的CP 后,CP-GM组小鼠的受精率为(64.16±1.42)%,2-细胞形成率为(50.50±4.07)%,4-细胞、8-细胞和囊胚的形成率分别为(39.43±2.70)%、(32.16±3.20)%和(24.93±2.17)%。CP-CK组小鼠的受精率为(62.00±3.41)%,2-细胞形成率为(50.93±2.13)%,4-细胞、8-细胞和囊胚的形成率分别为(38.23±0.75)%、(33.53±1.00)%、(24.60±0.85)%(图2),与正常条件下GM组和CK组相比均具有极显著性差异(P<0.01),说明CP处理后能导致雄性小鼠生殖损伤,从而影响其体外受精作用。
然而在CP处理的精子功能损伤条件下,CP-CK和CP-GM组小鼠的受精卵、2-细胞、4-细胞、8-细胞和囊胚的形成率无显著性差异(P>0.05),进一步说明在精子功能损伤条件下,喂食抗草甘膦转基因大豆不会对雄性小鼠的体外受精作用形成产生不良的影响(图2)。
2.3 抗草甘膦转基因大豆对雄性小鼠体外受精作用优胚率的影响
在正常生理条件下(腹腔注射生理盐水对照组),喂食非转基因饲料30 d后,CK组小鼠的优质受精率为(85.63±1.91)%,2-细胞优质率为(94.90±1.95)%,4-细胞、8-细胞和囊胚的优质率分别为(95.60±1.11)%、(92.30±0.98)%和(90.86±0.41)%;喂食转基因饲料30 d后,GM组小鼠的优质受精率为(88.26±0.90)%,2-细胞优质率为(93.83±3.02)%,4-细胞、8-细胞和囊胚的优质率分别为(95.60±1.15)%、(92.83±3.35)%和(89.20±1.00)%,GM组的优质受精率、2-细胞、4-细胞、8-细胞和囊胚的优质率与CK组相比均无显著性差异(P>0.05)(图4)。
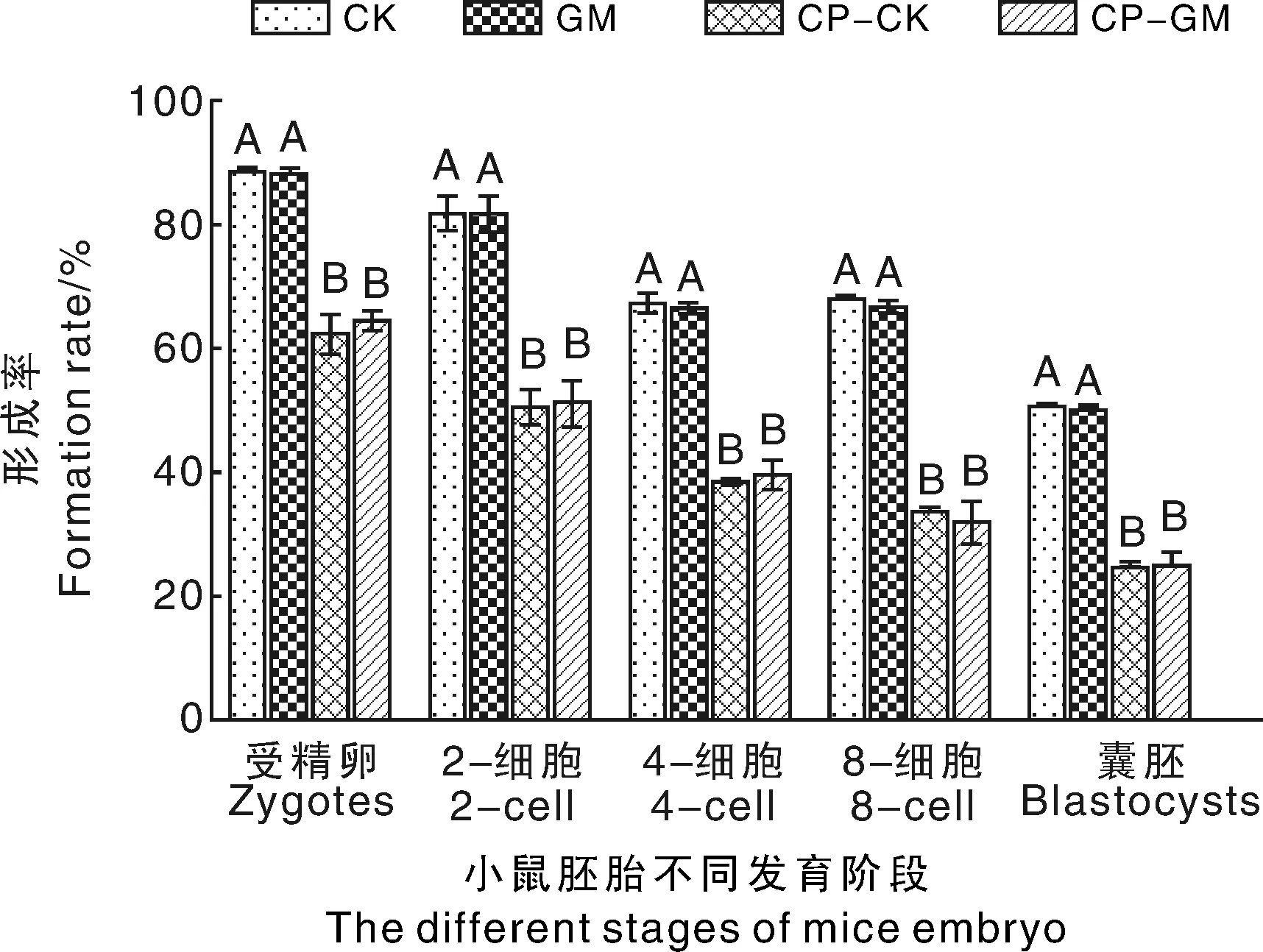
在胚胎的同一发育阶段,无相同大写字母的组间差异极显著(P<0.01),有相同大写字母的组间差异不显著(P>0.05)。下同During the same development stage of embryo, bars with the different capital letters indicated statistically significant difference at P<0.01, and the bars with the same letters indicated no significant difference at P> 0.05, respectively. The same as below图3 抗草甘膦转基因大豆对雄性小鼠体外受精作用形成率的影响Fig.3 Effect of glyphosate-resistant transgenic soybean on formation rate of in vitro fertilization of male mice
当小鼠经腹腔注射200 mg·kg-1的 CP 后,CP-GM组小鼠受精卵优质率为(67.13±1.67)%,2-细胞优质率为(74.86±0.70)%,4-细胞、8-细胞和囊胚的优质率分别为(84.90±1.41)%、(76.73±1.66)%和(78.66±0.96)%。而CP-CK组小鼠受精卵优质率为(68.00±2.83)%,2-细胞优质率为(73.33±2.80)%,4-细胞、8-细胞和囊胚的优质率分别为(85.03±1.45)%、(75.36±1.15)%、(76.36±1.85)%(图 4),与正常条件下GM组和CK组相比均具有极显著性差异(P<0.01),说明CP处理后能导致雄性小鼠生殖损伤,从而影响其体外受精作用后优质胚胎的形成。
然而在CP处理的精子功能损伤条件下,CP-CK和CP-GM组小鼠的优质受精卵、2-细胞、4-细胞、8-细胞和囊胚的优质率均无显著性差异(P>0.05),进一步说明在精子功能损伤条件下,喂食抗草甘膦转基因大豆不会对雄性小鼠的体外受精作用后的优胚率产生不良影响(图4)。

在胚胎的同一发育阶段,无相同大写字母的组间差异极显著(P<0.01),有相同大写字母的组间差异不显著(P>0.05)During the same development stage of embryo, bars with the different capital letters indicate statistically significant difference at P<0.01, and the bars with the same letters indicate no significant difference at P> 0.05, respectively图4 抗草甘膦转基因大豆对雄性小鼠体外受精作用优胚率的影响Fig.4 Effects of glyphosate-resistant transgenic soybean on excellent embryo rate of in vitro fertilization of male mice
3 结论与讨论
转基因植物是将传统植物经遗传改造以赋予其抗除草剂、抗虫等农学特征而研发出的[13]。现如今公众更多的是关注转基因食品是否存在潜在风险,例如过敏性,食物毒性,以及是否会导致抗生素抗性和环境污染[14]。Domingo[9]对过去6年转基因安全的研究进行了系统性的总结,并得出:转基因大豆、大米、玉米和小麦与其亲本物种一样具有安全可靠性。此外,Wang等[15]也对豆蔻黄素大豆(MON87708)进行了90 d亚慢性毒理学研究,结果表明转基因大豆是安全的。
哺乳动物受精作用是一个极其复杂的过程,精卵受精结合以及受精卵在体内或体外的正常发育大部分取决于生殖细胞精子和卵子是否受到自身体内因素和外界环境因素的影响[16]。受精作用包括精子和卵子的发生和成熟、精子迁移以及精卵识别和融合。这一过程中任何一个阶段受到影响,均能导致受精卵质量下降、受精卵与早期胚胎发育低下,甚至导致受精卵死亡或早期胚胎发育障碍[17]。近年来,关于转基因大豆饲料对动物生殖影响的研究发现,在正常生理条件下喂食转基因大豆30、60、90和120 d,对雄鼠生殖系统,如精子参数、精子染色体微核率等,均无不良影响。同时还评估了转基因大豆对雄鼠运动能力、耐疲劳能力和耐缺氧能力的影响,结果表明喂食抗草甘膦转基因大豆30 d对雄鼠运动能力无毒性效应[18]。
CP是一种能治疗恶性肿瘤的细胞毒性烷化剂,广泛用作抗肿瘤药物和肿瘤化疗,但其能靶向迅速分裂的细胞,通过形成共价DNA加合物而导致生殖系统损伤,尤其是睾丸组织[10,19-20]。实验小鼠经腹腔注射CP 后,CK组和GM组小鼠的受精卵、2-细胞、4-细胞、8-细胞和囊胚的形成率分别下降,表明CP处理后能导致雄性小鼠生殖损伤,从而影响其体外受精作用。在CP处理的精子功能损伤条件下,CP-CK和CP-GM组小鼠的受精卵、2-细胞、4-细胞、8-细胞和囊胚的形成率无显著性差异(P>0.05),说明在病理条件下,喂食抗草甘膦转基因大豆不会对雄性小鼠的体外受精作用形成产生不良的影响。进一步说明,抗草甘膦转基因大豆对雄性小鼠的受精能力未产生不良影响。
胚胎质量是受精成功与否的主要预测因素之一。许多的研究表明,胚胎的形态学、植入与临床妊娠率有很大的关系,质量差的胚胎虽具有成功怀孕的可能性,但其可能导致更高的自然流产、整体临床妊娠率和存活率的下降[21-22]。实验小鼠经腹腔注射CP 后,CK组和GM组小鼠的受精卵、2-细胞、4-细胞、8-细胞和囊胚的优质率分别下降,表明CP处理后能导致雄性小鼠生殖损伤,从而影响其体外受精作用后优质胚胎的形成。在CP处理的病理条件下,CP-CK和CP-GM组小鼠的受精卵、2-细胞、4-细胞、8-细胞和囊胚的优质率无显著性差异(P>0.05),说明在病理条件下,喂食抗草甘膦转基因大豆不会对雄性小鼠体外受精作用后优质胚胎的形成产生不良影响。进一步说明,抗草甘膦转基因大豆对雄性小鼠的受精能力未产生不良影响。
总之,本实验通过模拟体内受精的环境来研究抗草甘膦转基因大豆对CP诱导生殖损伤条件下雄性小鼠受精作用的影响,以评估抗草甘膦转基因大豆的食用安全性,实验结果证实,无论是正常生理条件或是CP诱导病理条件下,喂食30 d转基因大豆与非转基因大豆对雄鼠受精作用均无显著性影响,表明抗草甘膦转基因大豆和非转基因大豆一样安全,对受精作用没有潜在的毒性作用。
[1] QIU J, HALES B F, ROBAIRE B. Effects of chronic low-dose cyclophosphamide exposure on the nuclei of rat spermatozoa [J].BiologyofReproduction, 1995, 52(1):33-40.
[2] DANIELL H, DATTA R, VARMA S, et al. Containment of herbicide resistance through genetic engineering of the chloroplast genome [J].NatureBiotechnology, 1998, 16(4):345-348.
[3] SNELL C, BERNHEIM A, BERGÉ J B, et al. Assessment of the health impact of GM plant diets in long-term and multigenerational animal feeding trials: a literature review [J].FoodandChemicalToxicology, 2012, 50(3):1134-1148.
[4] RICROCH A E. Assessment of GE food safety using ‘-omics’ techniques and long-term animal feeding studies [J].NewBiotechnology, 2013, 30(4):349-354.
[5] APPENZELLER L M, MALLEY L, MACKENZIE S A, et al. Subchronic feeding study with genetically modified stacked trait lepidopteran and coleopteran resistant (DAS-Ø15Ø7-1xDAS-59122-7) maize grain in Sprague-Dawley rats [J].FoodandChemicalToxicology, 2009, 47(7):1512-1520.
[6] WANG E H, YU Z, HU J, et al. Effects of 90-day feeding of transgenic Bt rice TT51 on the reproductive system in male rats [J].FoodandChemicalToxicology, 2013, 62(12):390-396.
[7] SÉRALINI G E, CELLIER D, DE VENDOMOIS J S. New analysis of a rat feeding study with genetically modified maize reveals signs of hepatorenal toxicity [J].ArchivesofEnvironmentalContaminationandToxicology, 2007, 52(4):596-602.
[8] MALATESTA M, CAPORALONI C, GAVAUDAN S, et al. Ultrastructural morphometrical and immunocytochemical analyses of hepatocyte nuclei from mice fed on genetically modified soybean [J].CellStructureandFunction. 2002, 27(4):173-180.
[9] DOMINGO J L. Safety assessment of GM plants: An updated review of the scientific literature [J].FoodandChemicalToxicology, 2016, 95: 12-18.
[10] NAYAK G, HONGUNTIKAR S D, KALTHUR S G, et al. Ethanolic extract of Moringa oleifera Lam. leaves protect the pre-pubertal spermatogonial cells from cyclophosphamide-induced damage [J].JournalofEthnopharmacology, 2016, 182:101-109.
[11] NAGY A, GERTSENSTEIN M. 小鼠胚胎操作实验手册 [M]. 孙青原,陈大元,文端成,等,译. 北京:化学工业出版社,2006.
[12] COOPER D T G, BJOMDAHL D L. 世界卫生组织人类精液检查与处理实验室手册 [M]. 国家人口和计划生育委员会科学技术研究所,中华医学会男科学分会,中华医学会生殖医学分会精子库管理学组,译. 北京:世界卫生组织,人民卫生出版社,2010.
[13] DILL G M. Glyphosate-resistant crops: history, status and future [J].PestManagementScience, 2005, 61(3):219-224.
[14] DOMINGO J L, BORDONABA J G. A literature review on the safety assessment of genetically modified plants [J].EnvironmentInternational, 2011, 37(4):734-742.
[15] WANG X, HE X, ZOU S, et al. A subchronic feeding study of dicamba-tolerant soybean with thedmogene in Sprague-Dawley rats [J].RegulatoryToxicologyandPharmacology, 2016, 77: 134-142.
[16] LUCAS E. Epigenetic effects on the embryo as a result of periconceptional environment and assisted reproduction technology [J].ReproductiveBiomedicineOnline, 2013, 27(5):477-485.
[17] OKABE M. The cell biology of mammalian fertilization [J].Development, 2013, 140(22):4471-4479.
[18] 芦春斌,林泽斌,张雁,等. 抗草甘膦转基因大豆粕对雄鼠运动机能的影响 [J]. 浙江农业学报,2016, 28(7):1115-1120. LU C B, LIN Z B, ZHANG Y, et al. Effects of glyphosate-resistant transgenic soybeans on physical enginery of male mice[J].ActaAgricultureZhejiangensis, 2016, 28(7):1115-1120. (in Chinese with English abstract)
[19] CODRINGTON A M, HALES B F, ROBAIRE B. Spermiogenic germ cell phase-specific DNA damage following cyclophosphamide exposure [J].JournalofAndrology, 2004, 25(3):354-362.
[20] ELANGOVAN N, CHIOU T J, TZENG W F, et al. Cyclophosphamide treatment causes impairment of sperm and its fertilizing ability in mice [J].Toxicology, 2006, 222(1):60-70.
[21] MACKLON N S, BROSENS J J. The human endometrium as a sensor of embryo quality [J].BiologyofReproduction, 2014, 91(4): 1-8.
[22] WINTNER E M, HERSHKO-KLEMENT A, TZADIKEVITCH K, et al. Does the transfer of a poor quality embryo together with a good quality embryo affect theinvitrofertilization (IVF) outcome? [J].JournalofOvarianResearch, 2017, 10(1):Article 2, 1-5. DOI 10.1186/S13048-016-0297-9.
(责任编辑 卢福庄)
Effects of glyphosate-resistant transgenic soybean oninvitrofertilization of male mice with reproductive damage
LU Chunbin1,2, ZHANG Yan1, CHEN Bohui1, LIN Zebin1, QIU Pingle1, LIU Biao2,*
(1.DepartmentofDevelopmental&RegenerativeBiology,Ji’nanUniversity,Guangzhou510632,China; 2.NanjingInstituteofEnvironmentalSciences,MinistryofEnvironmentalProtection,Nanjing210042,China)
To assess the effects of glyphosate-resistant transgenic soybean on reproductive function in mice with reproductive damage male mice were injected chemotherapeutical agent, cyclophosphamide (CP), to induced reproductive damage as model mice. The formation rate of zygotes, 2-cells, 4-cells, 8-cells as well as blastocysts and excellent embryo rate were evaluated in vitro fertilization after feeding with glyphosate-resistant soybean for 30 days. The results showed that no significant difference (P> 0.05) in the formation rate of zygotes, 2-cells, 4-cells, 8-cells, as well as blastocysts and excellent embryo rate were observed in cyclophosphamide (CP) treated reproductive-damaged mice fed with glyphosate-resistant soybean for 30 days, compared with the mice fed with traditional soybean. In conclusion, there was no adverse effect on the reproductive function in male mice after feeding with transgenic soybean for 30 days under CP induced pathologic conditions.
transgenic soybean; mice; cyclophosphamide (CP);invitrofertilization
10.3969/j.issn.1004-1524.2017.06.08
2017-03-12
转基因生物新品种培育重大专项(2016ZX08012005);环保公益性行业科研专项(201509044)
芦春斌(1964—),男,陕西西安人,博士,副研究员,主要从事转基因植物疫苗和安全性研究。E-mail:tcblu@jnu.edu.cn
*通信作者,刘标,E-mail:liubiao@nies.org
S816.42;S561.1
A
1004-1524(2017)06-0910-07
