桑树Na+/H+逆向转运蛋白基因的克隆及功能分析
2017-07-03计东风沈国新林天宝吕志强
刘 岩,计东风,沈国新,魏 佳,林天宝,朱 燕,吕志强
(浙江省农业科学院 蚕桑研究所,浙江 杭州 310021)
桑树Na+/H+逆向转运蛋白基因的克隆及功能分析
刘 岩,计东风,沈国新,魏 佳,林天宝,朱 燕,吕志强*
(浙江省农业科学院 蚕桑研究所,浙江 杭州 310021)
盐害是威胁作物生长的重要因素之一,培育和种植耐盐作物品系是进行盐地开发利用的有效途径。该研究通过RACE方法,从特优1#桑品种克隆获得了Na+/H+逆向转运蛋白基因(MaNHX)的全长cDNA(2 016 bp),编码蛋白预测分子量59.28 ku,等电点6.67,含保守位点(82LFFIYLLPPI91)。用根癌农杆菌介导法,将MaNHX基因导入拟南芥中,结果表明,在拟南芥中异源表达MaNHX能明显提高拟南芥对盐胁迫的耐受性。转基因植株NaCl胁迫下叶绿素含量更高、抗氧化活性增强,MDA含量下降。结果证实,异源表达MaNHX转基因拟南芥可以通过维持细胞膜稳定性、减少膜损伤和透性伤害等机制应对盐胁迫。该研究可为桑树的抗盐品种培育提供候选参考基因。
Na+/H+逆向转运蛋白基因;盐胁迫;桑树;转基因
土壤盐渍化(主要是Na+)是影响全球生态环境和农林业生产的重要问题。据统计,全球每年因盐害造成的经济损失超过120亿美元[1]。传统育种方法虽然在改进非生胁迫方面取得了一定成绩,但碍于复杂基因座等因素的困扰,选育耐盐品种的进展较为缓慢。近年来,随着分子遗传学和植物转基因技术的快速发展,采用生物技术快速提高作物的耐盐性方面的研究受到越来越多的关注。
土壤中高浓度的盐会扰乱植物正常代谢活动,造成离子毒害、水分亏缺和离子失衡等损伤,进而导致植物生长受到抑制,甚至死亡[2-3]。为应对盐胁迫,植物通过增加外排、限制吸收、液泡区隔化以及渗透调节等策略来降低胞质中的Na+,维持细胞稳定性。其中,植物Na+/H+逆向转运蛋白基因(NHX)主要负责Na+的液泡区隔化作用。过表达AtNHX能增加拟南芥的耐盐性[4]。目前,NHX基因已在番茄(Solanumlycopersicum)[5]、油菜(BrassicacampestrisL.)[6]、小麦(BrassicacampestrisL)[7]、水稻(OryzasativaL)[8]、杨树(Pterocaryastenoptera)[9]等多种植物中陆续被报道,它们在植物耐盐调控中发挥重要作用。
桑树(Morusalba)一直以来都是家蚕的饲料,是蚕丝产业的重要物质基础。近年来的调查发现,桑树对盐碱、干旱和贫瘠等逆境的适应性较强,可以作为盐碱地绿化及防沙、治沙等生态治理的经济树种[10-11]。盐害对桑树种子萌发[12]、光合和理化[13]影响已有报道。在分子基础研究方面,虽然边晨凯等[14]克隆了川桑NHX1(MnNHX1)基因,并将其转入拟南芥,发现MnNHX能提高拟南芥的耐盐能力;但目前对桑树生产品种中的NHX基因及其功能特性仍未见报道。为此,我们从生产品种特优1#桑树中克隆了NHX全长基因,借助农杆菌转入拟南芥中过表达,并进行了耐盐性能的检测,以期增加对桑树防御盐害方面的认识,进一步探明桑树耐盐调控机制,为耐盐新品种的选育提供参考。
1 材料与方法
1.1 供试材料
特优1#桑树为蚕业生产上广泛应用的优良杂交品种,特优1#桑种子由广西壮族自治区蚕业技术推广总站提供。拟南芥(Col-0)为实验室保存株系。
1.2 RNA抽提及cDNA合成
取桑特优1#新鲜叶片,参照Tranzol Plant Kit操作说明,抽提样品总RNA,电泳检测RNA质量,通过紫外分光光度计测定RNA浓度后,取RNA样品500 ng,参照SuperScript II RT kit (Invitrogen,USA)配制反转录体系,经42 ℃逆转录反应60 min,获得cDNA,保存在-20 ℃备用。
1.3 全长MaNHX的扩增
根据NCBI登录的NHX1基因序列,经比对后设计兼并引物F1(5′-TAYAGTCTDGTDTTYGGDGARGG-3′) 和R1(5′-CKCATVAGNCCDGCCCACCA-3′),以上述cDNA样品为模板,扩增获得MaNHX片段。经测序分析后,再设计合成引物GSP-F1-NHX(5′-GCATTCGTGTTCCCTCTGTCCGCTC-3′)和GSP-R1-NHX(5′-GAGAATCCCGCAGAAGAAGACGGTGAG-3′),按Clontech公司试剂盒操作说明,分别进行3′RACE和5′RACE扩增,回收PCR产物,与pEASY-T1载体链接,转化DH5α感受态细胞,挑选克隆进行测序验证。
1.4 基因生物信息学分析
将MaNHX基因cDNA序列提交NCBI数据库,与桑树基因组序列进行Blast比对,分析MaNHX基因结构信息。利用ORF finder(http://www.ncbi.nlm.nih.govgorforfig.cgi)预测基因编码框,利用在线软件(http://isoelectric.ovh.org/)分析蛋白分子量和等电点,并通过TMHMM server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测分析MaNHX蛋白的二级结构。
1.5 定量PCR检测
特优1#桑种子经10%次氯酸钠消毒处理后,置MS培养基,于光周期14 h/10 h(L/D)、温度22 ℃、相对湿度75%、光强度≥3 000 lx的培养箱中萌发。
在无菌培养皿中放置2层滤纸,加入含0、50、100 、200 mmol·L-1NaCl溶液至滤纸饱和并稍有余液渗出。每个平皿内放5株萌发2周的桑幼苗,每个浓度NaCl处理组设3个重复。处理后1、4、8、12、24、48 h分别取样,检测NHX基因的转录表达。转基因拟南芥株系的MaNHX表达水平用定量PCR检测,定量PCR反应体系参照试剂盒配制。引物F-MaNHX(5′-CCTGTTCAGTACGGTGGT-3′)和R-MaNHX(5′-GAGAATGTTGGTTGTGGC-3′)扩增MaNHX基因172 bp片段,引物F-AtNHX(5′-CTTGGGTGATTATCTTGCTATTGG-3′)和R-AtNHX(5′-GCTTCGTGGTTTAGGTGAGTGA-3′)扩增AtNHX基因195 bp片段。引物F-Maactin(5′-TTCCTATCTACGAGGGTTATGC-3′),R-Maactin(5′-GTCAAGAGCAATGTAAGCCAAT-3′)和F-Atactin(5′-CCCTGCTATGTATGTGGCTAT),R-Atactin(5′-GCTGTGGTGGTGAAAGAGTAA-3′)分别扩增Maactin基因179 bp和Atactin基因225 bp片段作为内参。扩增结果按照2-ΔΔCt方法进行统计分析[15]。
1.6 重组载体的构建及拟南芥转基因
设计引物F2(5′-TGCTCGAGATGGAGATGTTGCAAGGAGTAATG-3′)、R2(5′-GGTCTAGATCACACTCCAAAAAGTGGTTGTTG-3′)扩增MaNHX全长ORF序列,产物经XhoI/XbaI双酶切后,连入pFGC-5941载体中,经测序验证后,转化并筛选重组农杆菌,利用浸花方法转化野生型拟南芥。再利用Basta抗性进行转基因拟南芥的筛选。以阳性转基因株系为供试分析材料,同时以野生型拟南芥Col-0和pNHX1转基因拟南芥[4]株系为对照分析材料。
1.7 NaCl胁迫对NHX转基因拟南芥的萌发观察
MaNHX转基因拟南芥(MaNHX)、pNHX1转基因拟南芥(AtNHX1)和野生型(WT)种子经10%次氯酸钠消毒处理后,分别置于含0、50、100、200、250 mmol·L-1的1/2 MS培养基中,于光周期14 h/10 h(L/D)、温度22 ℃、相对湿度75%,光强度≥3 000 lx的培养箱中萌发。参照文献[12]的方法统计萌发指标。
1.8 理化检测方法
MaNHX转基因和野生型拟南芥,同上条件在正常1/2 MS培养基上萌发培养2周后,将各株系幼苗分别移栽在营养土中继续培养3周。其中,野生型和转基因株系各36株苗,每组均随机分成2组,每组设置3个重复,每个重复含6株植物:一组每日以水浸透土壤,另一组每日以200 mmol·L-1的NaCl溶液浸透土壤,连续处理2周后,记录2组植物的生长状况,并取各组叶片用于检测分析。
叶绿素含量测定:参照文献[16]的方法,分别取野生型植株(对照组)、转MaNHX植株同叶位的叶片,剪成适宜大小后,分别置于95%乙醇溶液,黑暗浸泡48 h,用Tecan Infinite 200 PRO多功能酶标仪,以95%乙醇为对照,测定波长649、665 nm下的吸光值,计算叶片样品的叶绿素a(Chla)、叶绿素b(Chlb)含量,以及单位新鲜叶片的叶绿素含量。
叶片相对含水率测定:参考文献[17]的方法,利用称量法测定叶片的相对含水率(relative water content,RWC),采集的叶片测定鲜质量(fresh weight,FW)后,将叶片浸于无菌水过夜,拭干叶片表面水分后称湿质量(wet weight,WW),之后再将叶片70 ℃烘干,称取干质量(dry weight,DW)。按公式RWC=(FW -DW) / (WW- DW) ×100%,计算叶片相对含水率。
丙二醛含量测定:丙二醛(MDA)含量采用试剂盒法(试剂盒购自上海纪宁实业有限公司),按照文试剂盒说明书操作、比色、计算MDA含量。
CAT和SOD活性测定:参照文献[16]的方法抽提蛋白液,过氧化氢存在条件下,过氧化物酶(catalase,CAT)能使愈创木酚氧化生成茶褐色物质,可利用分光光度计检测CAT活性;超氧化物歧化酶SOD活性采用氮蓝四唑光化还原法测定。
离体叶盘的NaCl胁迫检测:参照文献[17]的方法,将新鲜叶片打孔取样,采集直径0.5 cm的叶盘,分别漂浮于0、100、200、300、500 mmol·L-1NaCl溶液中3 d,检测试验组转基因植株叶片在NaCl胁迫下的形态变化。
1.9 统计分析
利用Excel和SPS version 19进行数据统计分析,计算3次重复的平均值±标准误,采用单因素方差分析方法比较差异显著性。
2 结果与分析
2.1MaNHX基因的获得及分析
利用兼并引物扩增获得659 bp的MaNHX片段序列,经3′和5′RACE扩增后,得到特异性扩增产物833和947 bp条带(图1-A),测序并拼接得到MaNHX的全长cDNA序列(图1-B)。序列全长2 016 bp,含一个完整的开放阅读框,编码530个氨基酸;编码蛋白分子量59.28 ku,等电点6.67。生物信息学比对发现MaNHX具有Nha P-type Na+/H+(或K+/H+)保守结构域和amiloride结合结构域(82LFFIYLLPPI91),二级结构显示它具有11个跨膜结构域(图1-C)。

A,RACE扩增MaNHX的电泳检测结果。M,DL 2 000 marker;1为兼并引物的扩增结果;2、3分别为5’RACE和3’RACE的扩增结果。B,MaNHX全长序列。方框为起始密码子或终止密码子,阴影部分为保守序列。C,根据TMHMM软件预测的MaNHX跨膜结构域A, PCR amplification products of MaNHX in RACE reaction. M, DL 2 000 marker; 1, Conserved NHX fragment amplified using the degenerate primers; 2, 5’ RACE products; 3, 3’RACE products. B, Full length of MaNHX, in which the start and stop codons were indicated with a square, respectively, while the conserved motif of82LFFIYLLPPI91 was displayed in shadow. C, Transmembrane domains of MaNHX predicted by TMHMM Server v.2.0.图1 桑树特优1# MaNHX的全长核苷酸及其预测的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequence of the MaNHX gene from mulberry You 1#
2.2MaNHX对NaCl胁迫的响应
定量PCR结果显示:NaCl胁迫后24 h内,MaNHX的表达呈逐步上升趋势,24 h之后下降(图2)。随着NaCl浓度的增加,MaNHX的表达水平也逐渐升高,表明桑树MaNHX的表达受盐胁迫的诱导。
对动物检疫监督员开展定期与不定期业务培训,提高服务能力。要教育动物检疫员严格按照国家有关技术规程实施现场检疫,使用地区统一的表格做好现场检疫记录,严格出证条件,规范出具检疫证明,禁止只收费不检疫、检疫合格后不出证或不规范出证等行为。

图2 NaCl胁迫下桑树幼苗MaNHX的表达水平Fig.2 Relative expression of MaNHX in mulberry seedlings under salt stress
2.3 NaCl胁迫下MaNHX对转基因拟南芥萌发性能的影响
用根癌农杆菌介导的浸花法转化拟南芥,经过Basta抗性和定量PCR检测筛选后,在NaCl胁迫下对MaNHX株系(MaNHX1-2、MaNHX1-4、MaNHX1-6)和AtNHX1株系(AtNHX1-2、AtNHX1-3、AtNHX1-4)进行萌发性能调查。结果显示:正常培养条件下,转基因拟南芥(MaNHX或AtNHX1)与野生型WT间生长无明显差异;而在200 mmol·L-1NaCl胁迫条件下,转基因植株表现出更强的萌发性能(图3)。50 mmol·L-1NaCl处理组,转基因植株根系生长较野生型更茂密,侧根数量也更丰富。之后随着NaCl浓度的继续增加,转基因株种子萌发率仍显著高于野生型。其中,MaNHX转基因株表现略优于AtNHX1转基因株。
2.4 NaCl胁迫下MaNHX基因对转基因拟南芥叶绿素含量的影响
野生型和MaNHX转基因拟南芥的叶绿素含量检测结果显示,在正常培养条件下,MaNHX转基因拟南芥的叶绿素水平略高于WT株系;200 mmol·L-1NaCl胁迫处理后,转基因株、野生型植株叶片叶绿素都明显下降,其中,转基因株叶绿素含量下降幅度约19.9%,而野生型植株平均下降幅度为25.6%。NaCl胁迫后,转基因株叶绿素含量是野生型的1.11倍(图4-A)。离体实验也显示转基因株系叶片在NaCl胁迫下褪色更慢(图4-B)。这表明NaCl胁迫时,MaNHX的过量表达有助于减缓叶绿素含量的下降速度。

MaNHX转基因株(MaNHX1-2、4、6)、AtNHX转基因株(AtNHX1-2、3、4)和野生型拟南芥在不同浓度NaCl胁迫下,萌发14 d的调查结果The wild type (WT, col-0) and transgenic (AtNHX1-2, 3, 4 and MaNHX1-2, 4, 6 were three transgenic lines of 35S::AtNHX1 and 35S::MaNHX, respectively.) seedlings were observed for germination score after 14 days exposure to salt stress图3 转基因拟南芥种子在NaCl胁迫下的萌发性能比较Fig.3 Germination efficiency of transgenic Arabidopsis lines under salinity stress.

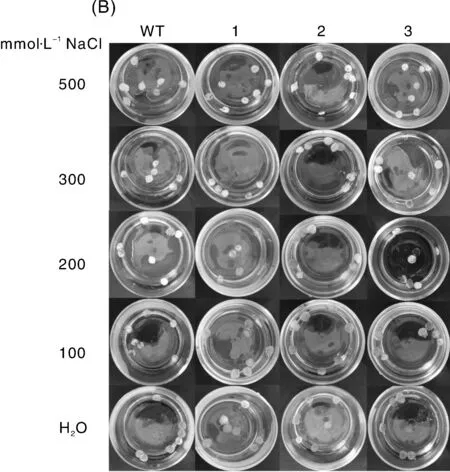
A,200 mmol·L-1 NaCl胁迫下拟南芥叶片叶绿素含量变化。B,拟南芥离体叶盘在不同浓度NaCl溶液中浸泡的颜色观察。WT,野生型;1-3分别为转基因株系MaNHX1-2,-4,-6的T3苗A, Chlorophyll content of Arabidopsis leaves under 200 mmol·L-1 NaCl stress. B, Phenotypic differences in the leaf discs dipped in different concentration of NaCl solution. WT, wild type; 1-3 was the T3 transgenic lines of MaNHX1-2,-4,-6, respectively图4 NaCl胁迫处理下拟南芥叶片叶绿素含量的变化Fig.4 Chlorophyll content of Arabidopsis leaves under NaCl stress
2.5 NaCl胁迫下转基因植株的MDA含量和抗氧化物酶活性变化
NaCl胁迫下,叶片的相对含水率降低,其中WT降低14.52%,而转基因株系只降低了10.01%,表明转基因株系的保水性能较野生型有明显增强(图5-A)。NaCl胁迫下,植株叶片MDA含量下降,但转基因株系下降幅度较WT下降幅度小7.06%(图5-B;两种抗氧化物酶活性都呈现增高趋势,其中转基因株CAT和SOD活性分别较野生型高出1.11倍和1.45倍(图5-C,5-D)。
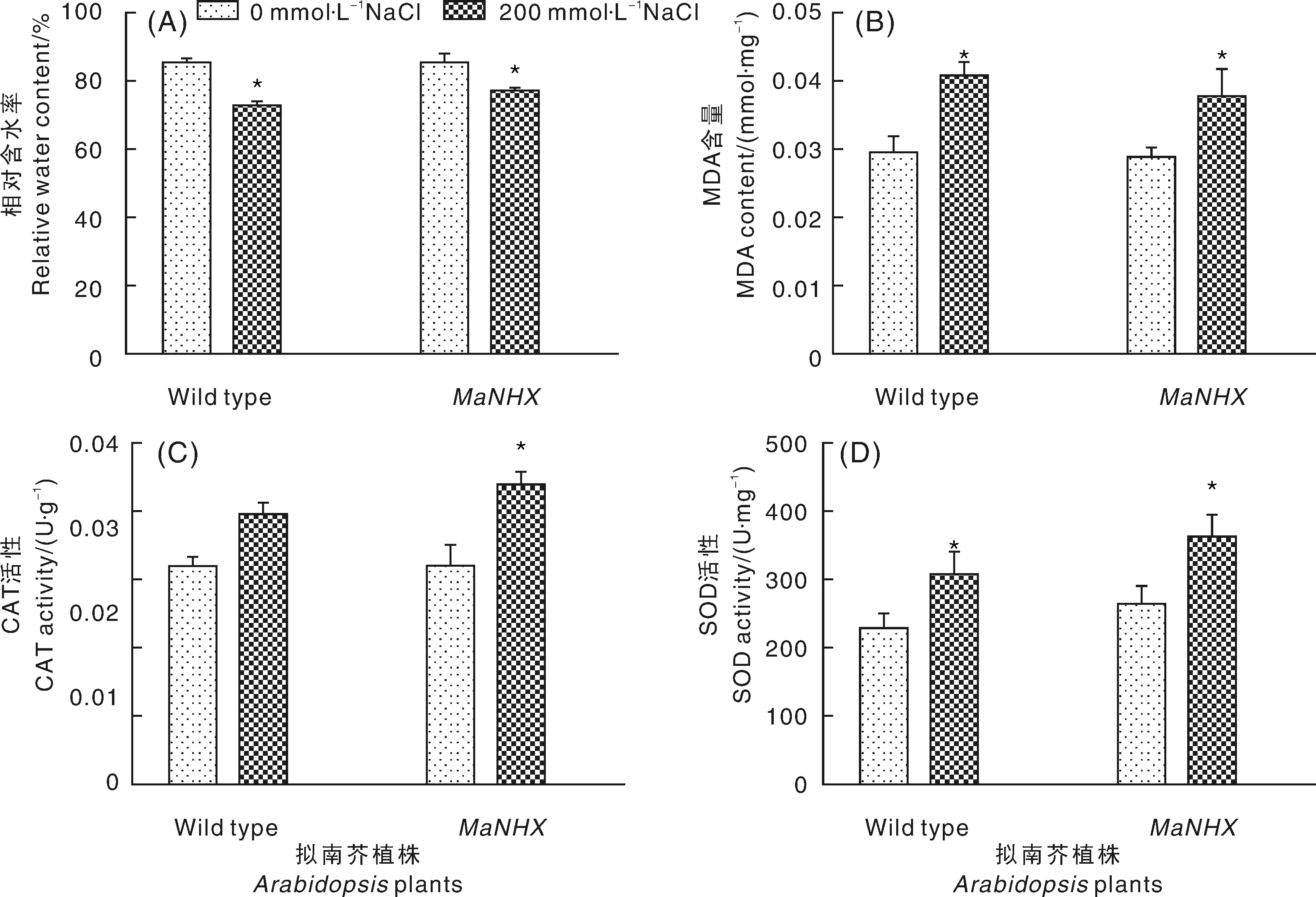
数据以鲜质量计。*表示差异显著(P<0.05)Data was detected based on fresh weight. *means significant difference at the levels of P<0.05图5 200 mmol·L-1 NaCl胁迫对拟南芥生理指标的影响Fig.5 Physiological analysis of Arabidopsis under 200 mmol·L-1 NaCl stress
3 讨论
液泡膜上的Na+/H+逆向转运蛋白是目前研究得较为深入的植物耐盐基因之一,它负责将Na+区隔到液泡,减少胞质中Na+浓度,避免过多的Na+对胞质酶造成伤害,干扰生理生化代谢;另一方面使植物利用NaCl作为渗透剂,减小细胞水势,促进植物从外界吸水,从而有利于其在盐渍化土壤中生存。目前已有超过200个编码Na+/H+逆向转运蛋白基因在GenBank和Pfam数据库中注册,涵盖细菌、酵母、各类植物等。本研究克隆了桑树NHX基因,其编码蛋白具有Na+/H+和K+/H+无机离子逆向转移蛋白的保守结构域,与拟南芥NHX1、盐芥NHX1(ThNHX1)等相似[18]。与川桑NHX1(MnNHX1,GenBank登录号KJ720637)[14]序列比对显示,MaNHX与MnNHX1同源性为61%,这可能是NHX家族存在多种亚类基因,或同一亚类在不同种属植物间的差异而致。今后可以通过进一步克隆鉴定桑树NHX家族基因,并结合亚细胞定位、免疫组化等方法,更系统和深入地了解NHX家族(特别是同一物种)的基因功能。
盐胁迫下植物叶片叶绿素含量不仅直接关系到植物光合同化过程,也是衡量植物耐盐性的重要生理指标之一。叶绿素是植物进行光合作用的主要色素,其含量的稳定与植株在盐胁迫下的耐受能力密切关联[22]。本研究中,在同等NaCl浓度处理下,转基因拟南芥叶片叶绿素含量较野生型高,同时离体叶片的黄化变慢,这与姜超强等[23]对AtNHX1转基因杨树的研究结果一致。检测抗氧化物酶活性发现,在200 mm·mL-1NaCl处理下,转基因拟南芥叶片SOD和CAT活性比野生型更高,可以有效地清除胁迫产生的活性氧类物质,从而降低活性氧对植物细胞的伤害,使得转基因株系在NaCl胁迫下具有较低的MDA含量(图5)。本研究结果与周树峰等[24]对AtNHX1转基因烟草的研究结果一致。He等[25]在棉花中异源表达AtNHX1,转基因棉花的光合速率和氮同化率均比非转基因植株高,转基因棉花棉纤维和产量增加。过表达AtNHX1不仅增强了小麦植株的耐盐性,也提高了小麦产量[7]。以上研究进一步表明,超表达NHX基因在遗传改良作物抗逆等性能上具有应用前景。
综上,桑树NHX基因表达受盐胁迫信号调控,在拟南芥中过量表达MaNHX能增加NaCl胁迫下拟南芥的萌发能力,提高叶绿素含量、叶片含水率以及抗氧化酶活性。该研究深化了我们对桑树NHX的耐盐性机理认识,并为今后的抗逆育种工作提供了候选基因资源。
[1] SCHROEDER J I, DELHAIZE E, FROMMER W B, et al. Using membrane transporters to improve crops for sustainable food production [J].Nature, 2013, 497(7447): 60-66.
[2] DEINLEIN, ULRICH, STEPHAN, et al. Plant salt-tolerance mechanisms [J].TrendsinPlantScience, 2014, 19(6): 371.
[3] YAMAGUCHI T, HAMAMOTO S, UOZUMI N. Sodium transport system in plant cells [J].FrontiersinPlantScience, 2013, 4(410): 410.
[4] APSE M P, AHARON G S, SNEDDEN W A, et al. Salt tolerance conferred by overexpression of a vacuolar Na+/H+antiport inArabidopsis[J].Science, 1999, 285(5431): 1256.
[5] ZHANG H X, BLUMWALD E. Transgenic salt-tolerant tomato plants accumulate salt in foliage but not in fruit [J].NatureBiotechnology, 2001, 19(8): 765-768.
[6] ZHANG H X, HODSON J N, WILLIAMS J P, et al. Engineering salt-tolerantBrassicaplants: characterization of yield and seed oil quality in transgenic plants with increased vacuolar sodium accumulation [J].ProceedingsoftheNationalAcademyofSciences, 2001, 98(22): 12832.
[7] XUE Z Y, ZHI D Y, XUE G P, et al. Enhanced salt tolerance of transgenic wheat (TritivumaestivumL.) expressing a vacuolar Na+/ H+antiporter gene with improved grain yields in saline soils in the field and a reduced level of leaf Na+[J].PlantScience, 2004, 167(4): 849-859.
[8] FUKUDA A, NAKAMURA A, TAGIRI A, et al. Function, intracellular localization and the importance in salt tolerance of a vacuolar Na(+)/H(+)antiporter from rice [J].PlantCellPhysiology, 2004, 45(2): 146-159.
[9] YE C Y, ZHANG H C, CHEN J H, et al. Molecular characterization of putative vacuolar NHX-type Na(+)/H(+)exchanger genes from the salt-resistant treePopuluseuphratica[J].PhysiologyPlant, 2009, 137(2): 166-174.
[10] VIJAYAN K, DOSS S G, CHAKRABORTI S P, et al. Breeding for salinity resistance in mulberry (Morusspp.) [J].Euphytica, 2009, 169(3): 403-411.
[11] VIJAYAN K, SRIVASTAVAA P P, RAGHUNATHB M K, et al, Enhancement of stress tolerance in mulberry [J].ScientiaHorticulturae, 2011, 129(4): 511-519.
[12] 刘岩, 张薇, 计东风, 等. NaCl胁迫对桑树种子萌发和Na+/H+逆向转运基因表达的影响[J]. 蚕业科学, 2013, 39(5): 851-857. LIU Y, ZHANG W, JI D F, et al. Effect of NaCl stress on seed germination and Na+/H+antiporter protein gene expression in mulberry (MorusL.) [J].ScienceofSericulture, 2013, 39(5): 851-857. (in Chinese with English abstract).
[13] 林天宝, 刘岩, 张薇, 等. NaCl胁迫对桑苗生理生化指标的影响[J], 浙江农业科学, 2013 (12): 1667-1672. LIN T B, LIU Y, ZHANG W, et al. Effect of NaCl stress on physiological index of mulberry [J].JournalofZhejiangAgriculturalScience, 2013 (12): 1667-1672. (in Chinese)
[14] 边晨凯, 龙定沛, 刘雪琴, 等. 桑树 Na+/H+逆向转运蛋白基因(MnNHX1)的克隆与耐盐力表达[J], 林业科学, 2015, 51(8): 16-25. BIAN C K, LONG D P, LIU X Q, et al. Cloning and expression to salt stress of Na+/H+antiporter gene (MnNHX1) in mulberry tree [J].ScientiaSilvaeSinicae, 2015, 51(8): 16-25. (in Chinese with English abstract)
[15] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-DeltaDeltaC(T))method [J].Methods. 2001, 25(4): 402-408.
[16] 李合生, 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2000, 131-137, 258-260.
[17] GOUIAA S, KHOUDI H, LEIDI E O, et al. Expression of wheat Na(+)/H(+)antiporterTNHXS1 and H(+)-pyrophosphataseTVP1 genes in tobacco from a bicistronic transcriptional unit improves salt tolerance [J].PlantMolecularBiology, 2012, 79(1/2): 137-155.
[18] 周梅仙. 盐芥ThNHX1基因的生物信息学分析[J], 湖北农业科学, 2009, 48(1): 19-23. ZHOU M X, Bioinformatic analysis ofThNHX1 gene fromThellungiellahalophile[J].HubeiAgriculturalSciences, 2009, 48(1): 19-23. (in Chinese with English abstract)
[19] WU G Q, XI J J, WANG Q, et al. TheZxNHXgene encoding tonoplast Na(+)/H(+)antiporter from thexerophyteZygophyllumxanthoxylumplays important roles in response to salt and drought [J].JournalofPlantPhysiology, 2011, 168(8): 758-767.
[20] GUAN B, HU Y, ZENG Y, et al. Molecular characterization and functional analysis of a vacuolar Na(+)/H(+)antiporter gene (HcNHX1) fromHalostachyscaspica[J].MolecularBiologyReports, 2011, 38(3): 1889-1899.
[21] 吴晓朦, 马雪梅, 马金彪, 等. 盐胁迫下盐角草Na+/H+转运基因表达分析[J]. 生物学杂志, 2014, 31(5): 60-65. WU X M, MA X M, MA J B, et al. Expression analysis ofSalicorniaeuropaeaNa+/H+antiporters under salt stress [J].JournalofBiolgoy, 2014, 31(5): 60-65. (in Chinese with English abstract).
[22] 王素平, 李娟, 郭世荣, 等. NaCl胁迫对黄瓜幼苗植株生长和光合特性的影响[J]. 西北植物学报,2006, 26(3): 455-461. WANG S P, LI J, GUO S R, et al. Effects of NaCl stress on growth and photosynthetic characteristics of cucumber (CucumbersativusL.) seedlings [J].ActaBot.Boreal.-Occident.Sin, 2006, 26(3): 455-461. (in Chinese with English abstract).
[23] 姜超强, 李杰, 刘兆普, 等. 盐胁迫对转AtNHX1基因杨树光合特性与叶绿体超微结构的影响[J], 西北植物学报, 2010, 30(2): 301-308. JIANG C Q, LI J, LIU Z P, et al. Photosynthetic characteristics and chloroplast ultrastructure of trnsgenic poplar under NaCl stress [J].ActaBot.Boreal.-Occident.Sin, 2010, 30(2): 301-308. (in Chinese with English abstract).
[24] 周树峰, 兰海, 郑明敏, 等.AtNHX1提高烟草耐盐性的研究[J], 安徽农业科学, 2010, 38(19): 10059-10060, 10064. ZHOU S F, LAN H, ZHENG M M, et al. Study on improving salt tolerance by transformation of tobacco withAtNHX1 gene [J].JournalofAnhuiAgriculturalScience, 2010, 38(19): 10059-10060, 10064. (in Chinese with English abstract).
[25] HE C, YAN J, SHEN G, et al. Expression of anArabidopsisvacuolar sodium/proton antiporter gene in cotton improves photosynthetic performance under salt conditions and increases fiber yield in the field [J].PlantCellPhysiology, 2005, 46(11): 1848-1854.
(责任编辑 侯春晓)
Cloning and functional characterization of a Na+/H+antiporter gene from mulberry
LIU Yan, JI Dongfeng, SHEN Guoxin, WEI Jia, LIN Tianbao, ZHU Yan, LYU Zhiqiang*
(InstituteofSericulture,ZhejiangAcademyofAgriculturalSciences,Hangzhou310021,China)
Salinity is a major factor that adversely affects the growth and yield of plants worldwide. PlantsNa+/H+antiporters(NHX) play significant role in adaption to salt stress by compartmentalizing excess cytosolic Na+into vacuoles and maintaining ionic equilibrium. Here we cloned an orthologous ofNHX1 gene from You1#, a popular mulberry variety used especially in Southwest China. The length ofMaNHXcDNA was 2 016 bp with a deduced molecular mass of 59.28 ku and pI 6.67. The consensus amiloride binding motif (82LFFIYLLPPI91) was observed in the third putative transmembrane domain. Heterologous expression ofMaNHXinArabidopsisenhanced plants salt tolerance, which was verified by retaining higher chlorophyll content, higher antioxidase activity, slower reudction of malondialdehyde (MDA) content in transgenic lines than those in WT plants when confronted with the NaCl stress. Consequently, our work suggested thatMaNHXwas a candidate salt tolerance determinant gene in future mulberry breeding.
Na+/H+antiporter pump; salinity stress; mulberry; transgenic.
10.3969/j.issn.1004-1524.2017.06.03
2016-08-23
家蚕基因组生物学国家重点实验室开放课题(sklsgb2013015);现代农业产业技术体系建设专项(蚕桑)(CARS-22-ZJ0105);浙江省农业(畜禽)新品种选育重大科技专项(2016C02054)
刘岩(1976—),女,河南焦作人,博士,副研究员,主要从事桑蚕分子生物学研究。E-mail: mayanly @sina.com
*通信作者,吕志强,E-mail: 13958131715@139.com
S718.46
A
1004-1524(2017)06-0874-08
