十三个柑橘品种叶片光合特性研究
2017-07-03孙国超罗近予汪志辉
邱 霞,叶 霜,熊 博,廖 玲,孙国超,荣 毅,罗近予,代 琳,汪志辉,,*
(1.四川农业大学 园艺学院,四川 成都 611130; 2.四川农业大学 果蔬研究所,四川 成都 611130)
十三个柑橘品种叶片光合特性研究
邱 霞1,叶 霜1,熊 博1,廖 玲1,孙国超2,荣 毅1,罗近予1,代 琳1,汪志辉1,2,*
(1.四川农业大学 园艺学院,四川 成都 611130; 2.四川农业大学 果蔬研究所,四川 成都 611130)
为研究不同柑橘品种光合特性,试验以6类13个柑橘品种为材料,对其瞬时光合作用参数、光响应特性、CO2响应特性和光合关键酶活性进行了测定与分析。结果表明,13个柑橘品种光合生理参数和光合酶活性存在显著差异,其光补偿点和光饱和点分别为11.99~60.00和523.88~1 155.73 μmol·m-2·s-1, CO2补偿点和CO2饱和点分别为20.01~72.02和1 364.44~1 811.29 μmol·mol-1,Rubisco、RCA和PEPC活性分别为3.74~5.34、10.97~23.83和5.06~9.39 μ IU。综合分析不同柑橘光合参数和光合酶活性得知,合江佛手、黄果柑、巴西酸橙光合能力较强,大雅柑、晚红血橙和尤力克柠檬次之,爱媛38号和红肉琯溪蜜柚相对较低。在柑橘中检测到较高活性的C4途径关键酶PEPC,其与Rubisco比值为0.95~2.26,说明在柑橘中可能存在微量的C4途径。
柑橘;光合作用;光响应;CO2响应;光合酶
柑橘是世界第一大类水果,在农产品贸易中占十分重要的地位。中国柑橘产量占世界20%以上,居世界首位,但由于品质参差不齐,我国柑橘出口量仅占世界8%[1],因此筛选优良品种、改善和提高果实品质、增强产品的市场竞争力仍是我国柑橘产业发展的关键。果实品质优劣与光合作用强弱有密切的关系[2],光合能力是产量和品质形成的基础,其干物质的积累90%以上来自叶片的光合产物[3]。有关柑橘光合作用的研究较多,但大多集中在光合速率和光合日变化上[4-6],且种类和品种较为单一,不能完全体现各品种本身的特性。
植物光合作用对有效光合辐射(PAR)和胞间CO2浓度(Ci)变化的响应是植物生理生化和生态特性变化的重要指标[7-8],其响应特征对研究柑橘光合能力、光合潜力及生态适应性具有重要意义。核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)是光合作用中固定CO2的关键酶,Rubisco活化酶(RCA)是核基因编码的可溶性叶绿体酶,类似Rubisco的分子伴侣[9],Rubisco的活化受RCA调节[10],Rubisco和RCA的活性对植物的光合作用非常重要[11]。磷酸烯醇式丙酮酸羧化酶(PEPC)是C4途径中最初固定CO2的酶,大量研究表明,PEPC不仅存在于C4植物中,而且广泛存在于C3植物中[12-14]。Hiratsuka等[15]研究表明,温州蜜柑中可能有微量C4途径存在,但其他柑橘中是否存在C4途径,PEPC活性是否会影响柑橘光合特性等方面的研究尚未见报道。
本试验以6类13种具代表性或栽植广泛的柑橘为材料,在控制有效光照辐射和CO2浓度的条件下,研究不同柑橘品种的瞬时光合速率、光响应特性、CO2响应特性和光合关键酶活性,并分析柑橘光合效率的影响因素,为选择高光效亲本、筛选优良品种、提高柑橘产量和品质提供理论基础。
1 材料与方法
1.1 试验材料
试验于2016年4月17日—19日在金堂县柑橘母本园进行,供试品种为3年生的巴西酸橙、合江佛手、尤克力柠檬、红肉琯溪蜜柚、晚红血橙、沃柑、甘平、口之津32号、爱媛38号、春见、不知火、大雅柑和黄果柑(表1)。每个品种均选择生长良好、树势基本一致的植株3株,选择树冠南面一年生枝条第3~5片健康功能叶进行光合作用和相关酶活性的测定。试验地常规管理,光照良好,土壤为黄壤。
表1 供试柑橘品种分类、名称及来源
Table 1 Classification, name and source of citrus cultivars for test

分类Classification名称Cultivars品种来源Sources酸橙C.aurantium(L.)巴西酸橙Brazilsourorange引种Introduction枸橼类C.medicavar.合江佛手Hejiangbergamot本地种Nativespecies柠檬/檬C.limon(L.)Burm.f.尤力克柠檬Eurekalemon引种Introduction柚C.grandis(L.)Osbeck.红肉琯溪蜜柚HongrouGuanxipum-melo琯溪蜜柚芽变产生BudmutationofGuanxipummelo甜橙C.sinensis(L.)Osbeck.晚红血橙Wanhongbloodorange塔罗科血橙株心系变异VariationfromnucellarlineofTaroccobloodorange杂柑类C.reticulataBlanco.沃柑Or坦普尔×丹西红橘Temple×Dancytangerine甘平Ganping西子香×不知火Nishinoka×Shiranui口之津32号Kouzhijin32(清见×恩科尔2号)×默科特(Kiyomi×Enkeer.2)×Murcott爱媛38号EhimeKashi38南香×西子香Nankou×Nishinoka春见Harumi清见椪柑F-2432Kiyomi×F-2432Ponkan不知火Shiranui清见×中野3号椪柑Kiyomi×No.3NakanoPonkan大雅柑Dayagan清见×新生系3号椪柑Kiyomi×No.3nucellarlinePonkan黄果柑Huangguogan橘与橙的天然杂交群变异Variationofnaturalhybridizationbetweentangerineandor-ange
1.2 测定方法
1.2.1 瞬时光合作用参数测定
瞬时光合参数测定于4月17日—19日(晴天)上午8:30—10:30进行,采用便携式光合作用仪(LI-6400XT,USA)测定,CO2压缩钢瓶缓释控制系统内CO2含量为400 μmol·mol-1,LED红蓝光源控制光强为1 200 μmol·m-2·s-1,测定植株叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci),计算瞬时水分利用效率(WUE=Pn/Tr)。重复3 d,每个品种测定3株树,每株树测定3片叶,计算平均值。
1.2.2 光响应曲线的测定
光响应曲线测定时间及仪器同1.2.1节,光强由高到低依次设定为2 000、1 800、1 500、1 200、1 000、800、600、400、200、100、50、30、0 μmol·m-2·s-1,CO2含量设定为400 μmol·mol-1,采用LightCurve2程序自动测定,整理数据绘制Pn-PAR响应曲线,用直角双曲线的修正模型[7]进行数据拟合分析,得到光饱和点(LCP)、光补偿点(LSP)、光补偿点最大光合速率(LSPn)和表观量子效率(AQY)等参数。
1.2.3 CO2响应曲线的测定
CO2响应曲线测定时间及仪器同1.2.1节,样品室CO2含量依次设定为400、300、200、100、50、400、400、600、800、1 000、1 200、1 500、2 000 μmol·mol-1,光强设定为1 200 μmol·m-2·s-1,采用A-Ci Curve2程序自动测定,整理数据绘制Pn-Ci响应曲线,用直角双曲线的修正模型[7]进行数据拟合分析,得到CO2饱和点(CCP)、CO2补偿点(CSP)、CO2补偿点最大光合速率(CSPn)、羧化效率(CE)、Rubisco最大羧化效率(Vcmax)、RuBP最大再生速率(Jmax)和磷酸丙糖利用率(TPU)等参数。
1.2.4 Rubisco、RCA和PEPC活性的测定
取1.2.1节中已测定光合参数的叶片,立即置于液氮中,带回实验室测定Rubisco、RCA和PEPC活性。称取剪除叶缘和叶脉的叶片材料0.5 g,冰浴研磨,加5 mL的磷酸缓冲液(pH 7.2~7.4,4 ℃预冷)制成组织匀浆。分别采用植物核酮糖-1,5-二磷酸羧化酶/加氧酶、植物活化酶和磷酸烯醇式丙酮酸羧化酶ELISA试剂盒(上海博宇生物科技有限公司)测定,根据说明书分别在预先包被了Rubisco/RCA/PEPC单克隆抗体的酶标包被板上进行操作,将提取的样品与标准品在37 ℃条件下反应30 min,洗板,加入酶标试剂,37 ℃反应30 min,再次洗板,加入显色液,显色10 min加入终止液终止反应,用酶标仪在450 nm处测定吸光值,数据均测定3次,取平均值,根据标准曲线计算样品Rubisco、RCA和PEPC相对活性。
1.3 数据分析
用光合计算软件以直角双曲线的修正模型[7]对光响应和CO2响应曲线的试验数据进行处理,用SPSS 19.0软件以Duncan新复极差法做P<0.05水平的方差分析,并用Microsoft Excel 2016对数据进行整理和作图。
2 结果与分析
2.1 不同柑橘品种叶片瞬时光合作用参数
由表2可知,13个柑橘品种间光合作用参数存在显著差异,不同柑橘品种的Pn为5.50~9.81 μmol·m-2·s-1,WUE为3.58~6.36 mmol·mol-1,瞬时水分利用效率(WUE)是净光合速率与蒸腾速率的比值,它是耦合植物叶片光合与水分生理过程的重要指标[16],一般水分利用效率越高,表明植物同化作用下积累干物质的能力越强[17],合江佛手和黄果柑的Pn和WUE两项指标均较高,其次为大雅柑、巴西酸橙和晚红血橙,爱媛38号和红肉琯溪蜜柚较低。Gs为0.075~0.107 mol·m-2·s-1,巴西酸橙和黄果柑较高;Ci为244.02~264.36 μmol·mol-1,红肉琯溪蜜柚和爱媛38号较高,与Pn呈相反规律;Tr为1.34~1.64 mmol·m-2·s-1,口之津32号和沃柑较高。
2.2 不同柑橘品种叶片光响应曲线
不同柑橘品种光合速率(Pn)对有效光合辐射(PAR)梯度变化的响应关系如图1所示,13个柑橘品种叶片的光响应曲线变化速率及最大光合速率均存在较大差异。13个柑橘品种的Pn均随着PAR的增强整体呈先快速上升后减缓趋势,当PAR小于500 μmol·m-2·s-1时,Pn随着PAR的上升迅速升高,当PAR为500~1 200 μmol·m-2·s-1时,Pn随着PAR的增强而上升的趋势减缓,逐渐达到饱和,但不同柑橘品种的上升速率及光饱和点存在较大差异,当PAR大于1 200 μmol·m-2·s-1时,所有柑橘品种Pn均达到饱和,Pn保持在较稳定水平或呈略下降趋势。
表2 不同柑橘品种瞬时光合作用参数
Table 2 Transient photosynthesis parameters of different citrus cultivars
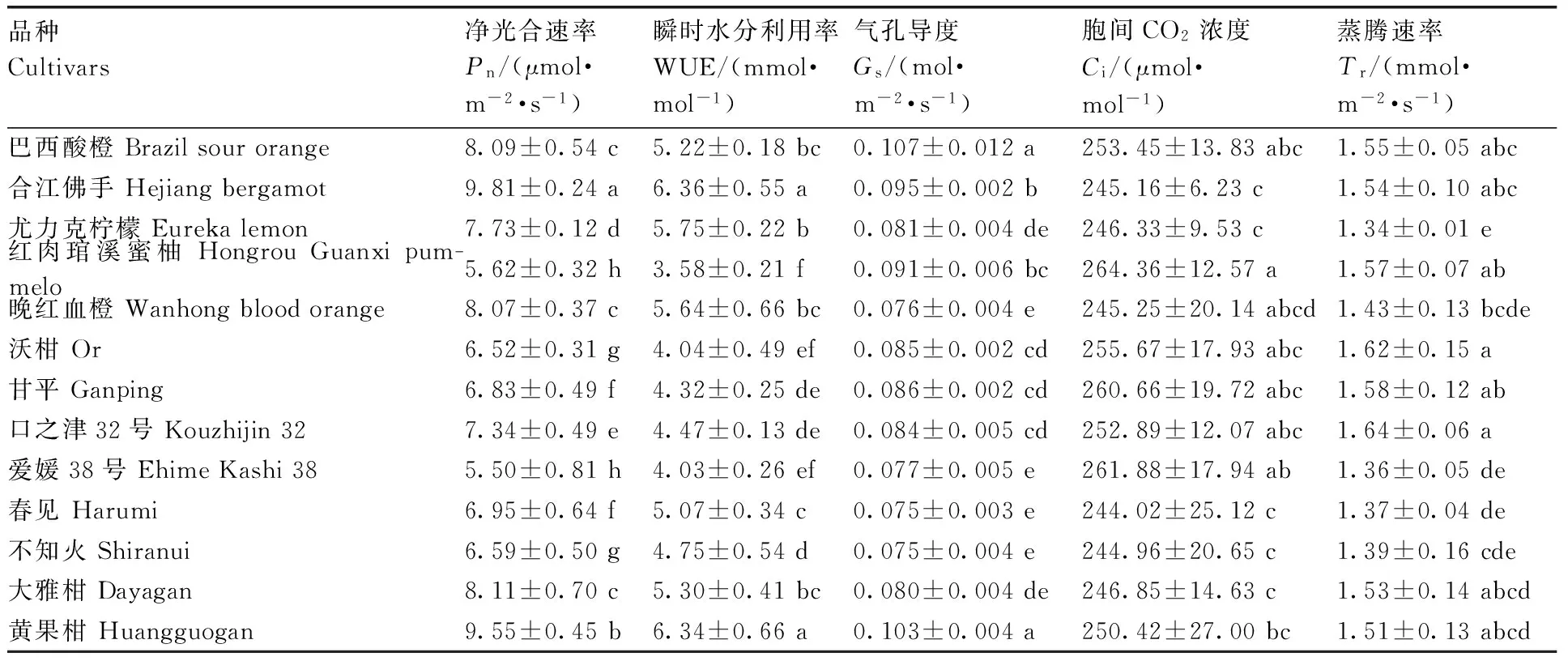
品种Cultivars净光合速率Pn/(μmol·m-2·s-1)瞬时水分利用率WUE/(mmol·mol-1)气孔导度Gs/(mol·m-2·s-1)胞间CO2浓度Ci/(μmol·mol-1)蒸腾速率Tr/(mmol·m-2·s-1)巴西酸橙Brazilsourorange8.09±0.54c5.22±0.18bc0.107±0.012a253.45±13.83abc1.55±0.05abc合江佛手Hejiangbergamot9.81±0.24a6.36±0.55a0.095±0.002b245.16±6.23c1.54±0.10abc尤力克柠檬Eurekalemon7.73±0.12d5.75±0.22b0.081±0.004de246.33±9.53c1.34±0.01e红肉琯溪蜜柚HongrouGuanxipum-melo5.62±0.32h3.58±0.21f0.091±0.006bc264.36±12.57a1.57±0.07ab晚红血橙Wanhongbloodorange8.07±0.37c5.64±0.66bc0.076±0.004e245.25±20.14abcd1.43±0.13bcde沃柑Or6.52±0.31g4.04±0.49ef0.085±0.002cd255.67±17.93abc1.62±0.15a甘平Ganping6.83±0.49f4.32±0.25de0.086±0.002cd260.66±19.72abc1.58±0.12ab口之津32号Kouzhijin327.34±0.49e4.47±0.13de0.084±0.005cd252.89±12.07abc1.64±0.06a爱媛38号EhimeKashi385.50±0.81h4.03±0.26ef0.077±0.005e261.88±17.94ab1.36±0.05de春见Harumi6.95±0.64f5.07±0.34c0.075±0.003e244.02±25.12c1.37±0.04de不知火Shiranui6.59±0.50g4.75±0.54d0.075±0.004e244.96±20.65c1.39±0.16cde大雅柑Dayagan8.11±0.70c5.30±0.41bc0.080±0.004de246.85±14.63c1.53±0.14abcd黄果柑Huangguogan9.55±0.45b6.34±0.66a0.103±0.004a250.42±27.00bc1.51±0.13abcd
同列数据后无相同小写字母表示差异显著(P<0.05),下同。
Values within a column followed by different lowercase letters indicate the significant difference (P<0.05), and the same as below.

图1 不同柑橘品种叶片光合作用的光响应曲线Fig.1 Light response curves of leaves photosynthesis in different citrus cultivars
进一步分析不同柑橘品种叶片的光饱和点的最大光合速率(maximum photosynthetic rate at light saturation point,LSPn)、光补偿点(light compensation point,LCP)、光饱和点(light saturation point,LSP)及表观量子效率(apparent quantum efficiency,AQY),存在显著差异(表3)。本试验测定的LSPn值为CO2浓度控制在400 μmol·m-2·s-1条件下,光强达到该品种光饱和点时,叶片的最大光合速率拟合值,在一定程度上能反映该品种的光合能力,不同柑橘的LSPn为6.48~10.74 μmol·m-2·s-1,合江佛手和黄果柑较高,分别为10.74和10.43 μmol·m-2·s-1,爱媛38号与红肉琯溪蜜柚LSPn较低,仅6.48和6.74 μmol·m-2·s-1,其他柑橘LSPn均为7~10 μmol·m-2·s-1。LCP和LSP分别体现植物对弱光和强光的利用能力,可以用来衡量不同柑橘品种的需光程度[3],不同柑橘的LCP为11.99~60.00 μmol·m-2·s-1,LSP为523.88~1 155.73 μmol·m-2·s-1,差异显著,沃柑和尤克力柠檬LCP仅11.99、12.00 μmol·m-2·s-1,对弱光利用率较强;不知火、沃柑、巴西酸橙和大雅柑LSP均超过1 000 μmol·m-2·s-1,对强光利用率较高,且这几个品种的LSP-LCP差值也较大,表明这些品种能利用的光强范围较广,光适应性较强。AQY可反映植物吸收与转换光能色素蛋白复合体的多寡、利用弱光能力的强弱[18]。不同柑橘品种的AQY为0.013~0.041,其中合江佛手和沃柑最高,均为0.041。
2.3 不同柑橘品种叶片CO2响应曲线
表3 不同柑橘品种叶片光合作用的光响应参数
Table 3 Light response parameters of leaf photosynthesis in different citrus cultivars

品种Cultivars光饱和点光合速率LSPn/(μmol·m-2·s-1)光补偿点LCP/(μmol·m-2·s-1)光饱和点LSP/(μmol·m-2·s-1)光饱和点-光补偿点LSP-LCP/(μmol·m-2·s-1)表观量子效率AQY巴西酸橙BrazilSourorange9.58±0.59b33.98±0.73c1130.03±31.79a1096±32.09a0.013±0.002c合江佛手HejiangBergamot10.74±0.35a20.41±0.64e523.88±20.35h503±41.10f0.041±0.003a尤力克柠檬Eurekalemon8.71±0.10cd12.00±0.56f603.79±34.31gh592±29.96ef0.033±0.002ab红肉琯溪蜜柚HongrouGuanxipummelo6.74±0.55f31.99±1.13c919.78±13.36bc888±106.39b0.015±0.001c晚红血橙Wanhongbloodorange9.28±0.15bc24.00±1.27e791.94±25.72d768±44.74cd0.037±0.002a沃柑Or7.21±0.45ef11.99±0.57f1139.33±34.76a1127±58.61a0.041±0.002a甘平Ganping8.14±0.56d60.00±0.97a980.05±39.90b920±62.90b0.015±0.001c口之津32号Kouzhijin328.39±0.83d28.00±1.14d772.05±26.05de744±48.60cd0.033±0.002ab爱媛38号EhimeKashi386.48±0.38f32.00±1.38c655.91±26.54fg624±30.28e0.027±0.002b春见Harumi7.87±0.25de23.99±0.67e695.69±18.91ef672±45.93de0.035±0.002ab不知火Shiranui8.32±0.14d51.99±0.79b1155.73±34.06a1104±79.02a0.017±0.001c大雅柑Dayagan9.39±0.15bc52.00±0.70b1075.92±22.70a1024±77.73a0.017±0.003c黄果柑Huangguogan10.43±0.71a24.00±1.58e860.00±34.12cd836±47.78bc0.039±0.003a
不同柑橘品种光合速率(Pn)对胞间CO2浓度(Ci)梯度变化的响应关系如图2所示,13个柑橘品种叶片的CO2响应曲线变化速率及最大光合速率均存在较大差异,与光响应曲线相似。所有柑橘品种的Pn均随着Ci的增大整体呈先上升后减缓趋势,但上升速率明显快于柑橘对PAR的响应。当Ci小于800 μmol·mol-1时,Pn随着Ci的上升迅速升高;当Ci为800~1 400 μmol·mol-1时,Pn随着Ci的增大而升高的趋势减缓;当Ci大于1 400 μmol·mol-1时,保持在较稳定水平或以较低速率持续上升,与光响应曲线不同的是,几乎未出现因CO2浓度过高而受到抑制的现象。

图2 不同柑橘品种叶片光合作用的CO2响应曲线Fig.2 CO2 response curves of leaves photosynthesis in different citrus cultivars
由表4可见,试验测定的CO2饱和点最大光合速率(maximum photosynthetic rate at CO2saturation point,CSPn)值为光强控制在1 200 μmol·m-2·s-1条件下,CO2浓度达到该品种饱和时,叶片的最大光合速率拟合值,能一定程度上反映该品种的光合潜力。不同柑橘的CSPn为11.47~32.39 μmol·m-2·s-1,不同品种之间差异显著,其中巴西酸橙最高,达32.39 μmol·m-2·s-1;其次是黄果柑和合江佛手,分别为30.25和30.08 μmol·m-2·s-1;红肉琯溪蜜柚最低,仅11.47 μmol·m-2·s-1。CO2补偿点(CO2compensation point,CCP)和CO2饱和点(CO2saturation point,CSP)分别体现植物对低CO2浓度和高CO2浓度的利用能力,不同柑橘的CCP为20.01~72.02 μmol·mol-1,CSP为1 364.44~1 811.29 μmol·mol-1,品种间存在显著差异,巴西酸橙、合江佛手和黄果柑的CCP仅20.01、20.01和21.95 μmol·mol-1,可见这3个品种在低浓度CO2条件下能快速达到补偿点;爱媛38号和沃柑CSP高达1 811.29和1 732.17 μmol·mol-1,对高浓度CO2利用率较强。羧化效率(carboxylation efficiency,CE)是低CO2浓度下,Pn对CO2浓度响应曲线中的初始斜率,其大小反映了植物Rubisco活性,即同化CO2的效率[13, 19],而最大电子传递速率则反映了RuBP最大再生速率(maximum regeneration rate of RuBP,Jmax)的大小[20]。不同柑橘CE为0.013~0.041,合江佛手最高为0.043,其次为巴西酸橙和黄果柑。此外Rubisco最大羧化效率(maximum carboxylation efficiency of Rubisco,Vcmax)、Jmax和磷酸丙糖利用率(utilization rate of triose phosphate,TPU)也是植物光合作用速率的重要指标,其对于加快植株快速积累光合产物而进行正常的营养生长和生殖生长具有决定性的作用[21],不同品种间的Vcmax、Jmax和TPU指标均呈现相似规律,巴西酸橙、合江佛手和黄果柑较高,红肉琯溪蜜柚最低,与CSPn差异情况相似。
表4 不同柑橘品种叶片光合作用的CO2响应参数
Table 4 CO2response parameters of leaf photosynthesis in different citrus cultivars

品种CultivarsCSPn/(μmol·m-2·s-1)CCP/(μmol·mol-1)CSP/(μmol·mol-1)CEVcmax/(μmol·mol-1)Jmax/(μmol·mol-1)TPU/(μmol·mol-1)巴西酸橙BrazilSourorange32.39±1.05a20.01±1.66f1648.42±52.95cde0.041±0.002ab51.54±3.74a43.53±1.17a11.74±0.39a合江佛手HejiangBergamot30.08±2.64a20.01±1.39f1364.44±47.16h0.043±0.001a47.33±1.51ab38.76±0.71b10.42±0.27b尤力克柠檬Eurekalemon17.86±1.02d44.00±1.36d1467.85±93.76g0.021±0.001cd30.55±2.03d25.80±1.51e6.88±0.53d红肉琯溪蜜柚HongrouGuanxipumme-lo11.47±0.28f32.00±1.02e1567.98±86.23f0.015±0.002de15.82±0.61f13.93±0.92g3.59±0.19f晚红血橙Wanhongbloodorange19.50±0.32cd72.02±0.96a1596.50±74.00def0.019±0.002de31.00±0.13d26.62±0.90de7.39±0.28d沃柑Or19.64±1.34cd48.00±1.43d1732.17±72.50b0.019±0.001de31.10±0.81d27.07±1.08de7.34±0.35d甘平Ganping19.07±0.66cd72.01±2.12a1560.25±72.50f0.019±0.001de29.71±1.06d29.71±1.96c7.04±0.32d口之津32号Kouzhijin3220.82±0.80c64.02±2.15bc1576.59±65.90ef0.021±0.002cd34.45±2.80cd28.88±1.42cd7.93±0.29cd爱媛38号EhimeKashi3814.13±0.68e67.97±2.01ab1811.29±84.69a0.013±0.001e21.37±0.90e18.76±0.45f5.14±0.53e春见Harumi14.02±0.77e68.00±1.97ab1675.95±80.01bcd0.013±0.001e22.20±1.50e18.78±1.97f5.15±0.46e不知火Shiranui15.54±0.82e59.98±2.12c1655.43±45.08bcde0.015±0.001de24.58±1.22e20.58±2.27f5.66±0.64e大雅柑Dayagan23.49±0.78b31.99±1.34e1563.72±75.09f0.027±0.002c37.32±2.60c30.62±1.05c8.44±0.20c黄果柑Huangguogan30.25±2.15a21.95±1.08f1721.75±50.14bc0.035±0.004b40.08±3.12b38.23±2.02b10.37±0.39b
2.4 不同柑橘品种叶片光合关键酶活性
核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)作为碳同化最主要的酶,是植物光合作用、生长和果实发育的限制因子之一[13]。13个柑橘品种Rubisco活性在3.76~5.34 μ IU,其中合江佛手Rubisco活性最高,达5.34 μ IU;其次是黄果柑和晚红血橙,分别为5.15和5.06 μ IU;红肉琯溪蜜柚活性最低,仅3.76 μ IU。13个柑橘品种Rubisco活化酶(RCA)活性为10.97~23.83 μ IU,不同柑橘RCA活性与Rubisco活性差异相似,也是合江佛手最高,达23.83 μ IU;红肉琯溪蜜柚最低,仅10.97μ IU,与Rubisco活性呈相似规律。磷酸烯醇式丙酮酸羧化酶(PEPC)是C4光合途径关键酶,13个柑橘品种叶片中检测到较高水平的PEPC,其活性为5.06~9.39 μ IU,PEPC/Rubisco比值为0.95~2.26,其中巴西酸橙PEPC活性最高,达9.39 μ IU;其次是黄果柑和口之津32号,分别为9.25和8.88 μ IU;合江佛手和尤克力柠檬较低,仅5.06和5.20 μ IU。
表5 不同柑橘品种叶片光合关键酶活性
Table 5 Activities of photosynthetic key enzymes in leaves of different citrus cultivars

品种CultivarsRubisco/μIURCA/μIUPEPC/μIUPEPC/Rubisco巴西酸橙BrazilSourorange4.15±0.17de15.41±0.68f9.39±0.48a2.26±0.05a合江佛手HejiangBergamot5.34±0.16a23.83±0.45a5.06±0.21e0.95±0.02h尤力克柠檬Eurekalemon4.82±0.16bc17.16±1.69e5.20±0.57e1.08±0.06h红肉琯溪蜜柚HongrouGuanxipummelo3.76±0.14f10.97±0.88h8.00±0.24c2.13±0.05ab晚红血橙Wanhongbloodorange5.06±0.19b20.80±0.50c8.21±0.31c1.62±0.05fg沃柑Or4.07±0.19de14.24±0.97g6.77±0.51d1.67±0.02efg甘平Ganping4.37±0.25d17.48±0.88e8.14±0.22c1.86±0.06cd口之津32号Kouzhijin324.17±0.23de15.59±1.25f8.88±0.60ab2.13±0.03ab爱媛38号EhimeKashi384.66±0.26c18.70±0.77d7.21±0.21d1.55±0.05g春见Harumi3.99±0.36ef13.81±0.56g7.91±0.27c1.98±0.08bc不知火Shiranui4.17±0.15de14.69±0.90fg7.22±0.43d1.73±0.06def大雅柑Dayagan4.26±0.39de16.79±1.07e8.42±0.32bc1.98±0.07bc黄果柑Huangguogan5.15±0.37ab22.00±1.02b9.25±0.44a1.80±0.08de
3 结论与讨论
本研究是在调控光合有效辐射和CO2浓度条件下进行的,基本保证了外界条件的一致性,但不同柑橘叶片各项光合指标仍存在显著差异,说明柑橘品种间的遗传差异是导致品种间光合能力差异的重要因素,与前人[4-6]的研究结果一致。这可能与柑橘在系统发育过程中形成的与自然条件相适应的叶片形态和功能有关[3],不同柑橘品种的叶片大小、形态和光合关键酶活性均存在明显差异,因而表现出不同的光合特性。综合分析不同柑橘的光合指标和光合酶活性,合江佛手、黄果柑和巴西酸橙光合能力较强,大雅柑、晚红血橙和尤力克柠檬次之,爱媛38号和红肉琯溪蜜柚相对较低;杂柑中黄果柑光合能力最强,爱媛38号相对较低。
光照和CO2含量是影响柑橘光合作用的重要因子。Pn-PAR响应曲线拟合结果显示,不同柑橘品种的光补偿点为11.99~60.00 μmol·m-2·s-1,光饱和点为523.88~1 155.73 μmol·m-2·s-1,光饱和点和光补偿点分别代表光照强度与光合作用关系的上限和下限临界指标,两者差值代表光能有效利用范围[18,22],沃柑、不知火和巴西酸橙的光饱和点与光补偿点差值均较大,且光补偿点均较高,说明这些品种不易受到光强的限制,对环境适应性较强。CO2是光合作用的原料,Pn-Ci响应曲线拟合结果显示,不同柑橘的CO2饱和点为1 364.44~1 811.29 μmol·mol-1,而大气中的CO2浓度约0.03%,远低于柑橘的CO2饱和点,成为其光合作用的限制因子。有学者提出增加CO2浓度可以提高树体的光合能力[23-24],Idso等在酸橙试验中证明,当CO2浓度提高到1 000 μmol·mol-1时酸橙净光合速率提高了200%,且暗呼吸作用下降到原始值的20%,说明高浓度CO2条件下柑橘对光合产物的消耗减少,有利于光合产物的积累[23]。因此,在1 800 μmol·mol-1范围内适当提高CO2浓度,有利于柑橘叶片提高光合速率。
柑橘中可能存在微弱的C4光合途径。Rubisco处于光合碳还原和光合碳氧化2个方向相反但又相互连锁的循环交叉点上[25],它对净光合速率起着决定性的作用[26],常被称为光合速率的限速酶[27]。本试验结果显示,多数柑橘Rubisco和RCA活性与净光合速率呈正相关规律,但爱媛38号的Rubisco和RCA活性均较高,而光合速率最低,可能与其叶片形态卷曲,有效光合面积较小有关。此外,巴西酸橙的Rubisco和RCA活性均较低,但其CSPn和LSPn均较高,可能与其较高的PEPC活性有关。PEPC是C4途径关键酶,可介导β羧化反应,把CO2固定为OAA,后转变为四碳酸[28],大大提高了植物光合生产力[29]。C4植物中存在高活性的PEPC,一般为16~18 μ IU[30],PEPC/Rubisco比值为4左右,而C3植物通常利用Rubisco催化羧化反应,PEPC活性较低,为0.3~0.35 μ IU,PEPC/Rubisco比值小于1[31]。13种柑橘PEPC活性为5.20~9.39 μ IU、PEPC/Rubisco比值为0.95~2.26,介于两个范围之间,因此柑橘中可能有微量的C4途径存在。李合生[30]提出,C3植物CCP大于40 μmol·mol-1,CSPn在10~25 μmol·m-2·s-1,多数柑橘品种符合上述标准,但PEPC活性最高的巴西酸橙和黄果柑,CCP均仅为20.01 μmol·mol-1,CSPn高达32.39和30.25 μmol·m-2·s-1,这种较强的光合能力是否是C3途径和微量C4途径共同作用的结果,柑橘中是否存在C4植物结构和C4途径中间产物,有待进一步的论证。
[1] 伍佳文,祁春节. 中国柑橘鲜果出口市场细分研究[J]. 湖南农业科学, 2014(16): 59-61. WU J W, QI C J. Export market segmentation of China’s citrus fruit [J].HunanAgriculturalSciences, 2014 (16):59-61. (in Chinese with English abstract)
[2] 蔡楚雄,邓雄,曹洪麟,等. 6个芒果品种的叶绿素荧光日变化研究初报[J]. 广东农业科学,2003(2): 17-19. CAI C X, DENG X, CAO H L, et al. Study on day-changing of chlorophyll fluorescence of 6 mango varieties [J].GuangdongAgriculturalSciences, 2003 (2):17-19. (in Chinese with English abstract)
[3] 简水仙,李松伟,邓烈,等. 影响柑桔光合作用的内外因素研究综述[J]. 中国南方果树, 2011(4): 32-36. JIAN S X, LI S W, DENG L, et al. A review of studies on internal and external factors affecting photosynthesis of citrus[J].SouthChinaFruits, 2011(4): 32-36. (in Chinese)
[4] 刘国琴,樊卫国,何嵩涛,等. 16个柑桔品种的光合特性[J]. 种子, 2003(5): 13-15. LIU G Q, FAN W G, HE S T, et al. Study on photosynthetic characteristics of sixteen citrus cultivars[J].Seed, 2003(5): 13-15. (in Chinese with English abstract)
[5] 宋勤飞,欧阳斌. 不同柑橘品种光合生理生态特性的日变化[J]. 贵州农业科学, 2009, 37(9): 178-181. SONG Q F, OUYANG B. Daily variation of photosynthetic physio-ecological characteristics of different citrus cultivars[J].GuizhouAgriculturalSciences, 2009, 37(9): 178-181. (in Chinese with English abstract)
[6] 黄永敬,唐小浪,马培恰,等. 几个柑橘品种叶片光合特性比较研究[J]. 中国农学通报, 2008, 24(12): 132-135. HUANF Y J, TANG X L, MA P Q, et al. Comparison of photosynthetic characteristics among several citrus cultivars[J].ChineseAgriculturalScienceBulletin, 2008, 24(12):132-135. (in Chinese with English abstract)
[7] 叶子飘. 光合作用对光和CO2响应模型的研究进展[J]. 植物生态学报, 2010,34(6): 727-740. YE Z P. A review on modeling of responses of photosynthesis to light and CO2[J].ActaPhytoecologicaSinica, 2010, 34(6): 727-740. (in Chinese with English abstract)
[8] 周洪华,陈亚宁,李卫红,等. 干旱区胡杨光合作用对高温和CO2浓度的响应[J]. 生态学报, 2009,29(6): 2797-2810. ZHOU H H, CHEN Y N, LI W H, et al. Photosynthesis ofPopuluseuphraticaolive and its response to CO2concentration and high temperature in arid environment[J].ActaEcologicaSinica, 2009, 29(6): 2797-2810. (in Chinese with English abstract)
[9] 廖玲,曹淑燕,荣毅,等. 不同砧木对黄果柑光合特性、光合作用关键酶及其基因表达的影响[J]. 浙江农业学报, 2016,28(5): 769-775. LIAO L, CAO S Y, RONG Y, et al. Effects of different rootstocks on photosynthetic characteristics, activities and gene expres-sion of key enzymes of photosynthesis in Huangguogan[J].ActaAgriculturaeZhejiangensis, 2016, 28(5): 769-775. (in Chinese with English abstract)
[10] 翁晓燕,毛伟华. 水稻叶片生育过程中Rubisco活化酶及其与Rubisco和光合速率的关系[J]. 浙江农业学报, 2000,12(3): 5-9. WENG X Y, MAO W H. The relationship of Rubisco activase to Rubisco and photosynthetic rate during development of rice leaf[J].ActaAgriculturaeZhejiangensis, 2000, 12(3):5-9. (in Chinese with English abstract)
[11] WHITNEY S M, ANDREWS T J. Plastome-encoded bacterial ribulose-1,5-bisphosphate carboxylase/oxygenase (RubisCO) supports photosynthesis and growth in tobacco[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2001, 98(25): 14738-14743.
[12] JENKINS C L, FURBANK R T, HATCH M D. Mechanism of C4photosynthesis a model describing the inorganic carbon pool in bundle sheath cells[J].PlantPhysiology, 1989,91(4): 1372-1381.
[13] KELLY G J, LATZKO E. Chloroplast phosphofructokinase: I. proof of phosphofructokinase activity in chloroplasts[J].PlantPhysiology, 1977, 60(2): 290-294.
[14] 汪小福,刘仁虎,陈笑芸,等. 甘蓝型油菜磷酸烯醇式丙酮酸羧化酶的研究分析[J]. 浙江农业学报, 2010,22(3): 276-280. WANG X F, LIU R H, CHEN X Y. et al. Analysis ofBrassicanapusphosphoenolpyruate carboxylase (PEPC)[J].ActaAgriculturaeZhejiangensis, 2010, 22(3): 276-280. (in Chinese with English abstract)
[15] HIRATSUKA S, SUZUKI M, NISHIMURA H, et al. Fruit photosynthesis inSatsumamandarin[J].PlantScience, 2015, 241: 65-69.
[16] 叶子飘,杨小龙,康华靖. C3和C4植物光能利用效率和水分利用效率的比较研究[J]. 浙江农业学报, 2016, 28(11): 1867-1873. YE Z P, YANG X L, KANG H J. Comparison of light-use and water-use efficiency for C3and C4species[J].ActaAgriculturaeZhejiangensis, 2016, 28(11): 1867-1873. (in Chinese with English abstract)
[17] 吴文超,曲延英,高文伟,等. 不同棉花品种对盐、旱胁迫的光合响应及抗逆性评价[J]. 新疆农业科学, 2016,53(9): 1569-1579. WU W C, QU Y Y, GAO W W, et al. Evaluation of cotton stress resistance based on the responses of the photosynthetic indexes to salt and drought stress [J].XinjiangAgriculturalSciences, 2016, 53(9): 1569-1579. (in Chinese with English abstract)
[18] 胡利明,夏仁学,周开兵,等. 不同砧木对温州蜜柑光合特性的影响[J]. 园艺学报, 2006, 33(5): 937-941. HU L M, XIA R X, ZHOU K B, et al. Effects of different rootstocks on the photosynthesis ofSatsumamandarin[J].ActaHorticulturaeSinica, 2006,33(5): 937-941. (in Chinese with English abstract)
[19] 曾光辉,郭延平,王法格,等. 冬、春季节柑桔叶片光合机构运转的研究[J]. 浙江大学学报(农业与生命科学版), 2006,32(4): 410-414. ZENG G H, GUO Y P, WANG F G, et al. Operation of photosynthetic apparatus of citrus leaves in winter and spring[J].JournalofZhejiangUniversity(Agriculture&LifeSciences), 2006,32(4): 410-414. (in Chinese with English abstract)
[20] 郭卫东,郑建树,张真真,等. 短暂低温对佛手光合生理的影响[J]. 生态学报, 2009, 29(5): 2286-2293. GUO W D, ZHENG J S, ZHANG Z Z, et al. Effects of short term chilling stress on the photosynthetic physiology of fingered citrons (Citrusmedicavar. sarcodactylis Swingle) [J].ActaEcologicaSinica, 2009, 29(5): 2286-2293. (in Chinese with English abstract)
[21] 王海珍,韩路,徐雅丽,等. 胡杨异形叶光合作用对光强与CO2浓度的响应[J]. 植物生态学报, 2014,38(10): 1099-1109. WANG H Z, HAN L, XU Y L, et al. Photosynthetic responses of the heteromorphic leaves inPopuluseuphraticato light intensity and CO2concentration[J].ActaPhytoecologicaSinica, 2014, 38(10): 1099-1109. (in Chinese with English abstract)
[22] 王雁,马武昌. 扶芳藤、紫藤等7种藤本植物光能利用特性及耐荫性比较研究[J]. 林业科学研究, 2004,17(3): 305-309. WANG Y, MA W C. Comparative studies on light utilization characteristics and shade tolerance of 7 climbing shrub species[J].ForestResearch, 2004,17(3):305-309. (in Chinese with English abstract)
[23] IDSO S B, KIMBALL B A. Effects of atmospheric CO2enrichment on photosynthesis, respiration, and growth of sour orange trees[J].PlantPhysiology, 1992, 99(1): 341-343.
[24] ALLEN L H, VU J C V. Carbon dioxide and high temperature effects on growth of young orange trees in a humid, subtropical environment[J].AgriculturalandForestMeteorology, 2009, 149(5): 820-830.
[25] 田秀英. RuBP羧化酶加氧酶的研究进展[J]. 重庆师专学报,2000,19(3): 77-79. TIAN X Y. The recent research in ribulose 1,5-bisphosphate carboxylase/oxygenase[J].JournalofChongqingTeachersCollege, 2000,19(3): 77-79. (in Chinese with English abstract)
[26] JORDAN D B, OGREN W L. The CO2/O2specificity of ribulose 1,5-bisphosphate carboxylase/oxygenase: Dependence on ribulosebisphosphate concentration, pH and temperature[J].Planta, 1984, 161(4): 308-313.
[27] 韩春丽. 弱光下纽荷尔脐橙光合生理特性研究[D]. 武汉:华中农业大学, 2008. HAN C L. Studies on the photosynthetic physiological characteristics ofCitrussinensiscv. Newhall leaves under low light stress[D]. Wuhan: Huazhong Agricultural University, 2008. (in Chinese with English abstract)
[28] CHRISTIN P A, ARAKAKI M, OSBORNE C P, et al. Shared origins of a key enzyme during the evolution of C4and CAM metabolism[J].JournalofExperimentalBotany, 2014, 65(13): 3609-3621.
[29] KU M S, AGARIE S, NOMURA M, et al. High-level expression of maize phosphoenolpyruvate carboxylase in transgenic rice plants[J].NatureBiotechnology, 1999, 17(1): 76-80.
[30] 李合生. 现代植物生理学 [M]. 3版. 北京:高等教育出版社, 2012: 160-169.
[31] BOWES G. Chapter 5 Single-cell C4photosynthesis in aquatic plants[M]// RAGHAVENDRA A S, SAGE R F. C4 photosynthesis and related CO2 concentrating mechanisms. Netherlands: Springer, 2011: 63-80.
(责任编辑 张 韵)
Photosynthetic characteristics of 13 citrus cultivars
QIU Xia1, YE Shuang1, XIONG Bo1, LIAO Ling1, SUN Guochao2, RONG Yi1, LUO Jinyu1, DAI Lin1, WANG Zhihui1,2,*
(1.CollegeofHorticulture,SichuanAgriculturalUniversity,Chengdu611130,China; 2.InstituteofPomologyandOlericulture,SichuanAgriculturalUniversity,Chengdu611130,China)
In order to study the photosynthetic characteristics of different citrus cultivars, 13 citrus varieties of 6 categories were used as test materials, and the instantaneous photosynthesis parameters, response characteristics to light, response characteristics to CO2and photosynthetic key enzyme activities were determined and analyzed. The results showed that there were significant differences in the photosynthetic parameters and photosynthetic enzyme activities among the 13 citrus cultivars. The light compensation point and the light saturation point were between 11.99-60.00 and 523.88-1 155.73μmol·m-2·s-1, respectively; the CO2compensation point and the CO2saturation point were between 20.01-72.02 and 1 364.44-1 811.29 μmol·mol-1, respectively; the Rubisco, RCA and PEPC activity were respectively between 3.74-5.34, 10.97-23.83 and 5.06-9.39 μ IU, respectively. Comprehensive analysis of different citrus photosynthetic physiological parameters and photosynthetic enzyme activity showed that the photosynthetic capacity of Hejiang Bergamot, Huangguogan and Brazil Sour orange was strong; the photosynthetic capacity of Dayagan, Wanhong blood orange and Eureka lemon were the second; the photosynthetic capacity of Ehime Kashi.38 and Hongrou Guanxi pummelo were relatively worst. Higher activity of PEPC was detected in citrus, which is a key enzyme in the C4photosynthetic pathway, and the ratio of PEPC to Rubisco was between 0.95-2.26, indicating that there may be a weak C4photosynthetic pathway in citrus.
citrus; photosynthesis; light response; CO2response; photosynthetic enzymes
10.3969/j.issn.1004-1524.2017.06.09
2017-02-07
四川省教育厅项目(14CZ0002);四川省科技厅项目(2016NZ0056)
邱霞(1993—),女,四川成都人,硕士研究生,从事现代果树栽培与生理研究。E-mail: qiuxia1526@hotmail.com
*通信作者,汪志辉,E-mail: wangzhihui_siau@126.com
S666
A
1004-1524(2017)06-0917-09
