生物分子相互作用技术检测黄曲霉毒素B1
2017-07-03许艳丽鲍蕾何晓霞吴振兴静平曹文卿梁成珠
许艳丽 鲍蕾 何晓霞 吴振兴 静平 曹文卿 梁成珠*
(1.山东出入境检验检疫局山东青岛266001;2.青岛出入境检验检疫局)
生物分子相互作用技术检测黄曲霉毒素B1
许艳丽1鲍蕾1何晓霞2吴振兴1静平1曹文卿1梁成珠1*
(1.山东出入境检验检疫局山东青岛266001;2.青岛出入境检验检疫局)
建立一种利用生物分子相互作用技术检测饲料中黄曲霉毒素B1的方法。将黄曲霉毒素B1抗体固化在芯片上,样品经甲醇-水提取、稀释后通过固化黄曲霉毒素B1抗体的芯片,从而测定样品中的黄曲霉毒素B1含量。方法检出限为1 μg/kg,检测限为2 μg/kg,回收率为67.0%-90.1%,相对标准偏差为6.57%-7.81%。该方法检测灵敏度高、检测时间短、操作简便易行。
生物分子相互作用;黄曲霉毒素;黄曲霉毒素B1抗体
1 前言
黄曲霉毒素(Aflatoxins,AFT)是真菌的次级代谢产物,主要是由黄曲霉(A.flavus)、寄生曲霉(A.parasiticus)和集蜂曲霉(A.nonius)等菌株产生。黄曲霉毒素是一种毒性很强的肝毒素,可引起肝脏的急性或慢性损害,此外对肾脏等其他多种组织器官也能造成严重损害。更为严重的是黄曲霉毒素已被证实具有致癌、致畸、致细胞突变的“三致”作用,黄曲霉毒素B1被公认为是目前致癌力最强的天然物质,广泛存在于花生、玉米、麦类、稻谷等农产品中,严重危害人、畜、禽类健康[1],1993年黄曲霉毒素被世界卫生组织(WHO)的癌症研究机构划定为Ⅰ类致癌物[2]。
黄曲霉毒素的检测方法主要有薄层色谱法、高效液相色谱法、质谱法以及以酶联免疫为基础的免疫分析/免疫亲和分析法,如酶联免疫吸附法等多种方法[3-7]。生物分子相互作用分析技术是超微量检测领域中一项新兴的检测技术,是将表面等离子共振与芯片技术相结合而建立的一类微量物质检测技术,由于该技术无需借助标记物进行分析,使其广泛应用于各类小分子化合物、多肽、蛋白质、寡核苷酸和寡聚糖直至类脂、噬菌体、病毒和细胞的测定和诊断[8-11]。与其他分析技术不同,生物分子相互作用分析技术是一项通用的检测技术,可以任意耦联如上所述任一种生物分子到生物芯片表面,因此生物分子相互作用分析技术的应用领域特别广泛,尤其适合高通量检测,在几分钟内自动完成一个样品的分析,能在无人情况下连续分析几百个样品。
本研究以毒性最大的黄曲霉毒素B1(简称AFB1)为研究对象,探索利用分子相互作用技术检测AFB1的方法。
2 材料与方法
2.1 材料
2.1.1 仪器
Biacore 3000:美国GE Healthcare公司;CM-5商品芯片:美国GE Healthcare公司;ULTRA-TURRAXT-25高速均质器:德国IKA公司。
2.1.2 试剂
EDC、NHS:美国GE Healthcare公司;AFB1抗体:SIGMA公司;黄曲霉毒素B1、B2、G1、G2(AFB1、AFB2、AFG1、AFG2):SIGMA公司;甲醇、乙腈:均为色谱纯,德国默克公司;PBS溶液(10倍浓缩液):VICAM公司;Glycine-HCl(pH 3.0、pH 2.5和pH 1.5)、0.1 mol/L HAc-NaAc缓冲液(pH=4.5)、1 mol/L盐酸乙醇胺溶液(pH=8.5):美国GE Healthcare公司;水为重蒸水。
2.2 方法
2.2.1 溶液配制
载流缓冲液(PBS):将PBS溶液用水稀释10倍,经过滤、脱气后,4-8℃下保存。
样品稀释液:0.1 mol/L HAc-NaAc缓冲液,pH=4.5,无菌过滤。
封闭液:1 mol/L盐酸乙醇胺溶液(pH=8.5),无菌过滤。
AFB1抗体:将AFB1抗体溶于100 μL水中,于-20℃下保存。
2.2.2 芯片表面处理方法
芯片表面用0.4 mol/L的EDC和0.1 mol/L NHS等体积混合后上机,活化10 min后,进样AFB1抗体,设置流速10 μL/min,进样10 min,然后用封闭液封闭6 min,流速为10 μL/min。
2.2.3 样品的提取及制备
本样品选取基质效应较大的饲料样品,称取25.0 g样品,加入125 mL 60%甲醇-水溶液,用高速均质器均质2 min提取,以普通滤纸过滤10 mL,加入20 mL水稀释,再次以玻纤滤纸过滤,待用。
2.2.4 测试条件
载流为PBS,流速为5 μL/min。
3 结果与分析
3.1 AFB1抗体在传感芯片表面的固化
本研究采用的标准物为AFB1,分子式C17H12O6,分子量312.27,分子内不含有氨基或亚氨基,因此,采用将AFB1抗体偶联到羧化后的葡聚糖(CM5)芯片表面。AFB1抗体固化、封闭后的RU增量约为11535.7 RU(RU:Resonance unit共振单位)。
本研究测试了在不同pH值醋酸钠溶液里进行偶联的效果,如图1所示。a(pH 4.0)、b(pH 4.5)、c(pH 5.0)都可以实现需要的偶联水平,c与b偶联量相差不多,但c偶联量达到了饱和状态,因此,选用b(pH 4.5)的10 mmol/L醋酸钠进行抗体偶联。

图1 不同pH的醋酸钠偶联量
3.2 芯片再生实验
分别采用3种pH值(pH 3.0、pH 2.5和pH 1.5)的Glycine-HCl再生溶液进行检测,结果见图2。

图2再生条件试验
图2 显示,在pH值3.0时,Sample response值与初始值(starting levels)相比明显降低,说明再生条件过于温和,芯片上结合的化合物可能未完全洗脱;在pH值1.5时,baseline值与初始值(starting levels)相比明显降低,表明再生条件过于严苛,芯片上偶联的抗体受到损伤。综合上述考虑,在后续实验中选择pH 2.5的Glycine-HCl再生溶液。
固化AFB1抗体芯片检测溶液中AFB1的实验如图3所示。选择再生条件为pH 2.5的Glycine-HCl溶液,10 μL,流速为5 μL/min。由图3可以看出,采用这一再生条件,实验结果的重复性和一致性都很好。
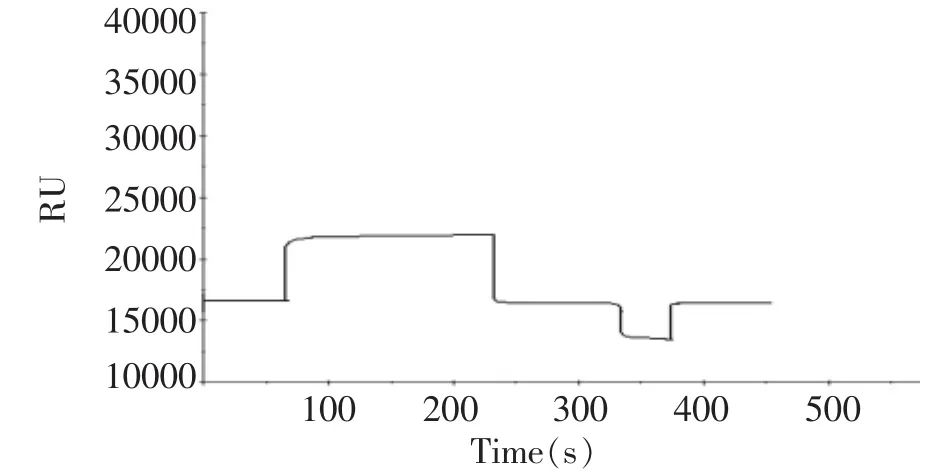
图3 芯片再生实验
3.3 偶联后芯片的稳定性
将CM5芯片偶联AFB1抗体后,存于PBS缓冲液中,置于4℃冰箱保存,每隔2-5 d取出,检测芯片的共振响应,结果如图4所示。在30 d内共振响应无明显改变,检测的相对标准偏差为2.2%,可见该偶联条件下AFB1抗体稳定性较好。

图4 偶联后芯片稳定性测试
3.4 方法的建立及标准曲线
根据以上确定的实验条件,采用固化AFB1抗体芯片检测一组梯度AFB1标准溶液,得到的标准曲线(图5)显示线性较好。

图5 不同浓度的AFB1的标准曲线
3.5 方法的检出限和检测限
根据不同浓度标准溶液谱图的信噪比(S/N)确定方法的检出限和检测限,方法的检出限为1 μg/kg(S/N≥3),检测限为2 μg/kg(S/N≥10)。
3.6 方法的回收率及精密度测定
本方法的精密度实验是在空白饲料中添加AFB1抗体标准溶液,添加水平为1水平(2 μg/kg)、2水平(4 μg/kg)、3水平(8 μg/kg)共3个水平,每水平进行10次平行实验,回收率范围在67.0%-90.1%;精密度为6.57%-7.81%。
3.7 方法的特异性
本实验向被测样品添加不同浓度的AFB2、AFG1、AFG2等与AFB1结构类似的生物毒素作为竞争干扰物,检测其对AFB1的影响。结果显示,AFB2、AFG1、AFG2作为干扰物,没有对AFB1的检测产生显著影响,说明该方法具有良好的选择性和专一性。
4 结论
本研究利用生物分子相互作用技术,在芯片表面固化AFB1抗体后直接检测样品中的AFB1含量。对该方法的试剂稳定性、方法特异性、回收率等进行了验证,结果表明,该方法的检测灵敏度高,有机溶剂使用量少,每个芯片的每个通道可重复利用,降低了检测成本;检测时间短,一般5 min内即可检测出结果,降低了检测人员的工作强度;该方法操作简便易行,可以实现标准化操作,易于推广;通过SPR检测器的自动记录,减少主观性,可以用于不同样品的大批量检测,应用于不同的检测需求中。
[1]Brown M P,Brown-Jenco C S,Payne G A.Genetic and molecular analysis of aflatoxin biosynthesis[J].Fungal Genet Bil,1999,26:81-98.
[2]Henry S H.Reducing Liver cancer:Global control of aflatoxin[J].Science,1999,286:2543-2454.
[3]尚瑛达,曹素芳.薄层色谱法测定黄曲霉毒素B1探讨[J].粮食与油脂,1993,(4):50-51.
[4]刘艳丽,程安春,汪铭书.黄曲霉毒素及其检测方法的研究进展[J].黑龙江畜牧兽医,2006,(06):15-17.
[5]许艳丽,鲍蕾,静平,等.生物传感器在生物毒素检测中的应用进展[J].食品质量安全检测学报,2012,3(5):432-436.
[6]Cuccioloni M,Mozzicafreddo M,BarocciS,et al.Biosensor-Based Screening Method for the Detection of AflatoxinsB1-G1[J].Anal Chem,2008,80:9250-9256.
[7]连庚寅,王雄,宋欢.免疫亲和柱净化高效液相色谱法测定坚果中黄曲霉毒素[J].农产品加工(学刊),2010,(06):32-34.
[8]张捷,陈广全,乐加昌,等.生物传感器在食源性致病菌检测中的应用[J].食品工业科技,2011,(32):453-456.
[9]Jing Yuan,Dawei Deng,Denis R Lauren,et al.Surface Plasmon resonance biosensor for the detection of ochratoxin A in cereals and beverages[J].Anal Chim Acta,2009,656(1-2):63-71.
[10]段媛媛,刘德立.SPR生物传感器的特点及其在生物特异性相互作用分析中的应用[J].生物技术通报,2002,32(1):72-76.
[11]黄汉昌,姜招峰,朱宏吉.SPR技术分析生物分子相互作用的研究方法[J].生物技术通报,2008,(1):108-112.
Determination of Aflatoxin B1by Biomolecular Interaction Analysis
XU Yanli1,BAO Lei1,HE Xiaoxia2,WU Zhenxing1,JING Ping1,CAO Wenqing1,LIANG Chengzhu1*
(1.Shandong Exit-Entry Inspection and Quarantine Bureau,Shandong,Qingdao,266001;2.Qingdao Exit-Entry Inspection and Quarantine Bureau)
The concentration of aflatoxin B1in feed was determined by the surface plasmon resonance technique.The chip immobilized by anti-AFB1body to determine the AFB1in the sample solution.The LOD of method is 1 μg/kg and LOQ is 2 μg/kg,the recoveries of AFB1are 67.0%-90.1%,and the relative standard deviations are 6.57%-7.81%.This method is of high sensitivity,convenience operation.
Biomolecular Interaction Analysis;Aflatoxin B1;Aflatoxin B1Anti-Body
TS207.4
E-mail:evillive1124@163.com;*通讯作者E-mail:liangcz@163.com
国家质检总局科技计划项目(2012IK174)
2016-11-15
