聚乙二醇洛塞那肽注射液联合二甲双胍对2型糖尿病患者的疗效
2017-07-01姚璐武云涛田国祥夏常泉王晓兵张峰
姚璐,武云涛,田国祥,夏常泉,王晓兵,张峰
• 论著 •
聚乙二醇洛塞那肽注射液联合二甲双胍对2型糖尿病患者的疗效
姚璐1,武云涛1,田国祥1,夏常泉1,王晓兵1,张峰1
目的 观察聚乙二醇洛塞那肽注射液(PEX168)联合二甲双胍对2型糖尿病患者的降糖疗效,并初步评价其安全性。方法 纳入2012年11月~2014年1月于陆军总医院干四科就诊的2型糖尿病患者36例,其中男性26例,女性10例,年龄41~65岁,平均年龄(53.6±9.9)岁。采用随机、双盲、平行对照试验设计,将所有患者分为:安慰剂组(11例)、PEX168-100 μg组(13例)和PEX168-200 μg组(12例)。用药12周,后随访4周。观察治疗前和随访4周后各组患者的糖化血红蛋白(HbA1c)、空腹血糖(FBG)和餐后2 h血糖(2h PBG)的变化及药物不良反应的发生情况。结果 治疗12周后,PEX168-100 μg组和PEX168-200 μg组FBG、2h PBG以及HbA1c较治疗前明显下降,差异有统计学意义(P均<0.05)。与安慰剂组治疗后比较,PEX168-100 μg组和PEX168-200 μg组FBG、2h PBG以及HbA1c下降更明显,差异有统计学意义(P均<0.05)。PEX168-100 μg组有1例(7.7%)发生恶心;PEX168-200 μg组有2例(16.7%)发生恶心,1例(8.3%)发生头痛,症状均随用药时间的延长而自行改善。所有患者未有低血糖、肝肾功能异常和胰腺炎等不良反应发生。结论 聚乙二醇洛塞那肽注射液能有效地降低2型糖尿病患者的血糖,初步观察具有良好的安全性及耐受性,可为今后的临床应用提供参考。但本研究病例数有限,今后需大样本的观察研究。
聚乙二醇洛塞那肽注射液;二甲双胍;糖尿病;2型
世界卫生组织提出,到2030年糖尿病患者将达7亿以上[1]。目前约50%的糖尿病患者血糖控制未达标,因此需要寻找新的降糖途径单药或联合治疗,以达到更好疗效和耐受性。研究证实,人胰高血糖素样肽1(GLP-1)及其类似物具有促进β细胞增殖、血糖依赖性的促进胰岛素分泌等作用,目前已成为新型降糖药的研究热点。百泌达(Exenatide)是首个获得美国FDA批准的模拟GLP-1的2型糖尿病治疗药物[2]。但由于GLP-1很不稳定,可迅速被体内的二肽基肽酶Ⅳ(DPP-4)快速降解,半衰期很短,需每日两次皮下注射才能达到治疗效果。本研究所应用的聚乙二醇洛塞那肽(PEX168)为我国自主研制药物,是一种长效的胰高血糖素样肽类似物,其作用机制与已批准上市的胰高血糖素样肽类似物Exenatide一致。为评价聚乙二醇洛塞那肽治疗2型糖尿病的有效性及安全性,本研究行小样本量的初步临床试验,结果如下。
1 资料与方法
1.1 研究对象 纳入2012年11月~2014年1月于陆军总医院干四科就诊的2型糖尿病患者36例,其中男性26例,女性10例,年龄41~65岁,平均年龄(53.6±9.9)岁。入选标准:①根据1999年WHO诊断标准已被确诊为2型糖尿病;②入组前二甲双胍单药治疗≥12周且剂量≥1500 mg/d;③筛选时7.5%≤糖化血红蛋白(HbA1c)≤11.0%(本院检测)可以进入导入期,入组时7.0%≤HbA1c≤11.0%(中心化检测);④20岁≤年龄≤70岁;⑤19 kg/m2≤体质指数≤35 kg/m2。患者均签署知情同意书,本临床试验获得CFDA的批准。排除标准:①聚乙二醇洛塞那肽注射液皮试阳性;②随机化前使用了以下任何一种药物或治疗:GLP-1类似物、胰岛素、生长激素、除二甲双胍外的任何具有降血糖作用的药物(包括中草药)、皮质类固醇药物、非消化道给药或关节内给药;③有重度低血糖发作病史;1型糖尿病、单基因突变糖尿病、胰腺损伤所致的糖尿病或继发性糖尿病;严重的急慢性胃肠道疾病;有高血压病史且经降压药治疗后收缩压>160 mmHg和/或舒张压>100 mmHg(1 mmHg=0.133kPa);有严重心血管疾病、急慢性胰腺炎病史;有甲状腺髓样癌史;急性代谢并发症(酮症酸中毒、乳酸性酸中毒或高渗性昏迷状态)、增殖性视网膜病变或黄斑病变;随机化前3个月内体重变化超过10%;④谷丙转氨酶>2.0倍正常上限值和/或谷草转氨酶>2.0倍正常上限值和/或总胆红素>1.5倍正常上限值,且复查确诊者;血肌酐超出正常值范围,和/或尿蛋白≥++;空腹三酰甘油≥5.64 mmol/L(500 mg/dL);经研究者判断不适宜参加本研究的甲状腺功能异常者;血淀粉酶超出正常上限值,且复查确诊者;妊娠或哺乳期的女性。
1.2 方法
1.2.1 研究药物 聚乙二醇洛塞那肽注射液(PEX168):两种规格0.5 ml:100 μg和0.5 ml:200 μg,由国内某药业股份有限公司提供。对应批号分别为:201203012、201203021。用法用量:每周一次,每次0.5 ml/支,上臂皮下注射。聚乙二醇洛塞那肽模拟液:0.5 ml/支,由国内某药业股份有限公司提供,批号:201203011。盐酸二甲双胍片(格华止):500 mg/片,由中美上海施贵宝制药有限公司生产,批号:1202082。
1.2.2 分组及给药方法 采用随机、双盲、安慰剂平行对照设计,对二甲双胍单药(≥1500 mg/d)治疗≥8周的2型糖尿病患者进行筛选,如在我院化验7.5%≤HbA1c≤11.0%,且均符合纳入排除标准即可进入4周的导入期。患者进入导入期后,改为统一口服格华止(1500 mg/d)。在正式入组前3 d患者来我院进行一般情况的检查,并再次抽血送指定检验中心检测HbA1c,中心检测结果7.0%≤HbA1c≤11.0%的患者即可进入聚乙二醇洛塞那肽注射液治疗期。共纳入2型糖尿病患者36例,所有患者按随机化原则分配到3个组:安慰剂组(11例)、PEX168-100 μg组(13例)、PEX168-200 μg组(12例)。所有患者每周一次来医院,每次上臂皮下注射0.5 ml药物。连续给药12次后停止治疗,进入4周随访期。整个给药及随访期间所有患者维持格华止基础治疗不变,于第12次给药后第4周到医院进行疗效和安全性评价。在整个治疗期间,研究药物采用双盲给药方式,格华止采用开放给药方式且在整个研究期间保持剂量不变,均维持合理控制饮食、适量运动等非药物治疗。三组患者的性别比、年龄、体质指数、入组时的血糖、糖化血红蛋白等比较,差异无统计学意义(P均>0.05),具有可比性。
1.2.3 观察指标 ①所有患者均在治疗前和停止给药4周后空腹抽取肘静脉血10 ml,检测空腹血糖(FBG)、餐后2 h血糖(2 hPBG)及HbA1c。血糖采用罗氏公司MODULAR P800全自动生化分析仪测定,HbA1c采用高压液相色普仪测定;②记录给药和随访期间各种不良反应,包括消化道不适、低血糖、实验室检查异常、肝肾功能损害等。
1.3 统计学方法 采用SAS 9.1.3统计软件进行数据分析。计量资料采用均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 三组治疗前后FBG、2h PBG及HbA1c的比较治疗12周后,PEX168-100 μg组和PEX168-200 μg组FBG、2h PBG以及HbA1c较治疗前明显下降,差异有统计学意义(P均<0.05)。与安慰剂组治疗后比较,PEX168-100 μg组和PEX168-200 μg组FBG、2h PBG及HbA1c下降更明显,差异有统计学意义(P均<0.05)(表1),并可观察到PEX168-200 μg组对FBG及2h PBG的改善程度优于PEX168-100 μg组,呈良好的量-效趋势。
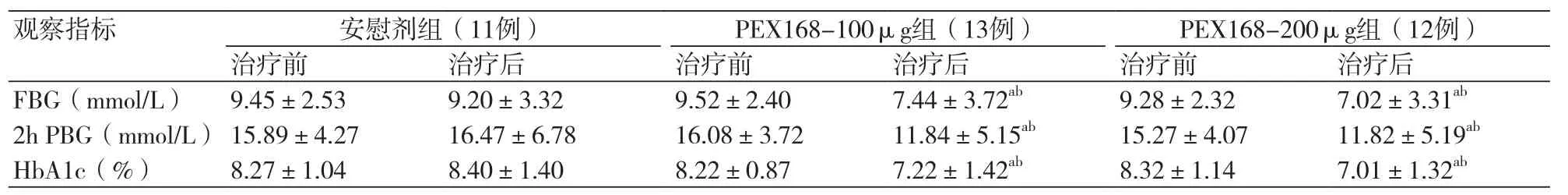
表1 三组治疗前后各项指标的变化情况
2.2 三组不良反应比较 本研究最常见的不良反应为消化道不适,主要表现为恶心,其次为头痛,治疗期间PEX168-100μg组1例(7.7%)发生恶心;PEX168-200μg组2例(16.7%)发生恶心,1例(8.3%)发生头痛,不良反应的发生具有剂量依赖性。PEX168-200 μg组较安慰剂组和PEX168-100 μg组不良反应发生率增加,差异有统计学意义(P均<0.05)。所有患者未经特殊处理,症状随用药时间延长而自行改善。患者均未发生低血糖、肝肾功能异常和胰腺炎等(表2)。
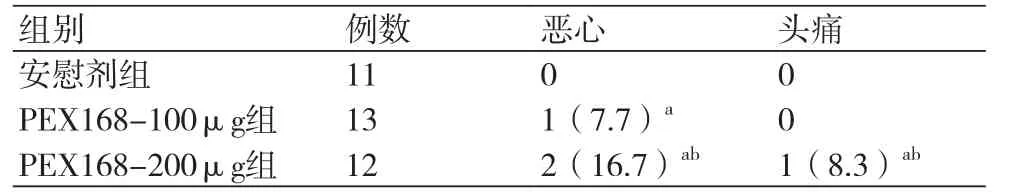
表2 三组不良反应比较(n,%)
3 结论
2型糖尿病是一种复杂的代谢疾病,除胰岛素分泌异常外,胃肠道激素的分泌异常在其发生发展中也起着非常重要的作用[3]。长期以来,人们主要通过口服药物及注射胰岛素来控制血糖,研究显示每年约有10%的糖尿病患者因治疗失效而使病情加剧[4]。肠促胰素是人体进餐后由肠道细胞分泌的多肽类激素,包括由回肠和结肠的L细胞分泌的GLP-1和由十二指肠的K细胞分泌的葡萄糖依赖性促胰岛素多肽(GIP),两者同为DPP-4的底物[5]。研究发现2型糖尿病患者的GLP-1分泌受损,GIP的分泌水平未见明显减少,但其促胰岛素分泌的作用却严重受损,提示GLP-1在2型糖尿病患者中发挥更重要的作用[6]。艾塞那肽[7]是首个上市的GLP-1受体激动剂,为从毒蜥唾液腺中分离到的GLP-1类似物,由39个氨基酸残基组成,分子量为4262.67,与GLP-1有53%的同源性,与GLP-1同作用于G蛋白偶联受体,并有更高亲和力[8],半衰期更长[9]。艾塞那肽能增加葡萄糖依赖性胰岛素分泌;减少胰高血糖素分泌,肝脏输出的葡萄糖减少;减少食物吸收,使体重减轻[10];延缓胃排空[11],使餐后葡萄糖升高的速率减慢,且不会增加胃酸分泌[12]。艾塞那肽可在调节血糖的同时,保护胰岛功能,改善患者的体重增加,并具有心血管保护作用等优势。从目前临床前研究发现,聚乙二醇洛塞那肽作用机制与Exenatide相似,但由于聚乙二醇洛塞那肽在化学结构上的改造,使药物的作用时间延长,从而减少了给药次数,具有治疗更加方便的优势。目前临床上常用的胰岛素最少的给药次数是每日一次皮下注射,使用不便。而聚乙二醇洛塞那肽只需每周一次,提高了患者的依从性。
本研究初步结果显示,聚乙二醇洛塞那肽(PEX168)注射液(100 μg或200 μg)每周一次皮下注射,可降低2型糖尿病患者的血糖,并且注射剂量少,防止大量应用胰岛素导致的体重增加,同时从目前观察看又无低血糖等不良反应,应用方便,为今后糖尿病患者的治疗提供了一种更方便、安全的方法。但本试验临床病例数有限,目前只是初步小样本量的观察结果,今后需进一步增加临床病例加以观察研究,争取为新型降糖药物的研发及应用提供更多的临床依据。
[1] 阮平平,俞国勋,马力,等. 抗糖尿病药物SGLT抑制剂最新研究进展[J]. 现代生物医学进展,2015,7(15):4182-5.
[2] 侯书杰,才丽,李克剑,等. GLP-1类似物艾塞那肽研究进展[J]. 中国执业药师,2013,7(10): 38-9.
[3] 陆菊明. 基于肠促胰素治疗药物在中国或亚洲患者中的应用比较[J]. 中国糖尿病杂志,2014,5(22):476-80.
[4] 占美,吴逢波,吴斌,等. 艾塞那肽治疗2型糖尿病安全性的系统评估[J]. 中国医院药学杂志,2011,31(6):473-7.
[5] 李小囡,李可心,张英. 艾塞那肽治疗2型糖尿病的疗效观察[J]. 吉林医学,2012, 12(33):7476-7.
[6] Neumiller JJ. Differential chemistry(structure),mechanism of action and pharmacology of GLP-1 receptor agonists and DPP-4 inhibitors[J]. J Am Pharm Assoc,2009,49(Suppl 1):16-29.
[7] Nguyen HN,Wey SP,Juang JH,et al. The glucose-lowering potential of exendin-4 orally delivered via a pH-sensitive nanoparticle vehicle and effects on subsequent insulin secretion in vivo[J]. Biomaterials,2 011,32(10):2673-82.
[8] Zhou J,Cai ZH,Li L,et al. Preparation and PEGylation of exendin-4 peptide secreted from yeast pichiapastoris[J]. Eur J Pharm Biopharm, 2009,72(2):412-7.
[9] Gao W,Jusko WJ. Pharmacokinetic and pharmacodynamic modeling of exendin-4 in type 2 diabetic Goto-Kakizaki rats[J]. J Pharmacol Exp Ther,2011,336(3):881-90.
[10] Ai G,Chen Z,Shan C,et al. Single and multiple-dose pharmacokinetics of exendin-4 in rhesus monkeys[J]. Int J Pharm,2008,353(1):56-64.
[11] 徐静,宋晓燕,付裕. 艾塞那肽治疗肥胖2型糖尿病的临床观察[J].中国糖尿病杂志,2013,7(21):619-21.
[12] Bradley DP,Kulstad R,Schoeller DA,et al. Exenatide and weight loss[J]. Nutrition,2010, 3(5):243-49.
本文编辑:姚雪莉
Curative effect of polyethylene glycol loxenatide injection combined with metformin in patients with type2 diabetes mellitus
YAO Lu*, WU Yun-tao, TIAN Guo-xiang, XIA Chang-quan, WANG Xiao-bing, ZHANG Feng.*Forth Department of Geriatrics, Chinese PLA Army General Hospital, Beijing 100700, China.
YAO Lu, E-mail: luluheng@126.com
Objective To observe the curative effect of lowering blood sugar of polyethylene glycol loxenatide injection (PEX168) combined with metformin in patients with type 2 diabetes mellitus (T2DM), and review the safety. Methods The patients (n=36, male 26, female 10, aged from 41 to 65 and average age=53.6±9.9) were chosen from Chinese PLA Army General Hospital from Nov. 2012 to Jan. 2014. All patients were divided, by applying randomized, double-blind and parallel controlled trial design, into placebo group (n=11), PEX168-100 μg group (n=13) and PEX168-200 μg group (n=12). All groups were treated for 12 weeks and followed up for 4 weeks. The changes of glycated hemoglobin (HbAlc), fasting blood glucose (FBG) and 2-hour postprandial blood glucose (2hPBG), and adverse drug reactions were observed in all groups before treatment and after followed up for 4 weeks. Results The levels of FBG, 2hPBG and HbA1c decreased significantly in PEX168-100 μg group and PEX168-200 μg group after treatment for 12 weeks (all P<0.05). The levels of FBG, 2hPBG and HbA1c decreased more significantly in PEX168-100 μg group and PEX168-200 μg group compared with placebo group after treatment (all P<0.05). There was 1 case (7.7%) with nausea in PEX168-100 μg group, 2 (16.7%) with nausea and 1 (8.3%) with headache in PEX168-200 μg group, and the symptoms were relieved as treatment time was prolonged. There were no adverse reactions occurred in all patients including hypoglycemia, dysfunctions of liver and kidney and pancreatitis. Conclusion PEX168 can effectively reduce the level of blood sugar in T2DM patients, and it has higher safety and tolerance after preliminary observation, which can provide a reference for future clinical application. But the cases are limited in this study, larger sample are needed in future observation and study.
Polyethylene glycol loxenatide injection; Metformin; Diabetes; Type 2
R587.1
A
1674-4055(2017)05-0577-03
1100700 北京,陆军总医院干四科
姚璐,E-mail:luluheng@126.com
10.3969/j.issn.1674-4055.2017.05.17
