2015年欧洲心脏病学会关于感染性心内膜炎并发症
2017-07-01治疗的指南解读
治疗的指南解读
梁峰1,胡大一2,方全3,沈珠军3
• 指南解读 •
2015年欧洲心脏病学会关于感染性心内膜炎并发症
治疗的指南解读
梁峰1,胡大一2,方全3,沈珠军3
感染性心内膜炎(IE)是一种致死性疾病,虽然其治疗获得进展,但死亡率仍居高不下并可导致各种严重并发症。目前IE的指南基本上基于专家意见,由于该病发病率低,缺乏随机试验以及荟萃分析研究数量有限。2009年欧洲心脏病学会(ESC)关于IE预防、诊断和治疗指南,推出各种创新理念,包括手术最佳时机的确定。但是多种进展要求ESC更新原来的指南,如大系列的IE文章发表,及以前不同指南的巨大差异。另外最近多种新指南确立并强调“心内膜炎团队”,即需要一种多科协作治疗方法。
该指南工作组主要目的是提供明确和简单的建议,帮助医务人员进行临床决策制定。这些推荐通过对现有文献的全面回顾后,达成专家共识制定。使用基于证据的积分系统,依据推荐强度类别和证据水平。但是强调,无论如何指南不可能无视医务工作者对每一例个体患者合适准确的判断决策,以及合适和/或必要时与患者和监护者的沟通协商,同时医务工作者有责任验证药物和器械使用原则和规定。本文解读2015年欧洲心脏病学会关于左心系统感染性心内膜炎并发症治疗的指南。
1 左心瓣膜感染性心内膜炎的主要并发症及其治疗
由于严重并发症导致大约半数IE患者需手术治疗。活动期(即患者仍接受抗生素治疗时)考虑早期手术的原因是避免严重感染导致渐进性心力衰竭(HF)和不可逆结构损害,以及预防全身栓塞。然而疾病活动期手术治疗导致极高风险。手术指证是患者高危特征,该特征使抗生素治愈成为不可能,同时不合并难以痊愈的伴发病或并发症。年龄本身并不是手术的禁忌证。
推荐早期与一位心外科医生讨论,以便确定最佳治疗方案。需早期手术的患者经常难以识别,也是“心脏团队”的一项重要目标。每例患者必须个体化,诊断的同时识别风险增加的所有因素。手术的需要通常由多种高危特征组合确定。某些病例无论抗生素治疗持续多长时间,需要急诊手术(24 h内)或亚急诊手术治疗(几天内,<7 d)。其他病例,进行择期手术(抗生素治疗至少1~2周后进行手术)前可能需在严密临床和超声心动图监查下推迟,而留出1或2周的抗生素治疗时间。IE早期手术的3个主要适应证是心力衰竭、感染失控和栓塞事件预防。
左心瓣膜感染性心内膜炎手术适应证和时机:(1)HF:主动脉瓣或二尖瓣自身瓣膜心内膜炎(NVE)或人工瓣膜心内膜炎(PVE)患者出现严重急性反流、梗阻或瘘管引起难治性肺水肿或心源性休克,需急诊手术(ⅠB);主动脉瓣或二尖瓣NVE或PVE患者出现严重反流或梗阻而引起HF症状或血流动力学耐受不良的超声心动图指证,需亚急诊手术治疗(ⅠB)。(2)感染失控:局部感染失控(脓肿、假性动脉瘤、瘘管,赘生物进行性增大),进行亚急诊手术治疗(ⅠB);真菌或多重耐药菌导致的感染,进行亚急诊手术治疗或择期手术(ⅠC);虽经合适的抗生素治疗以及感染性转移灶已充分控制,但血培养持续阳性,需亚急诊手术治疗(ⅡaB);葡萄球菌或非HACEK革兰阴性菌导致的PVE,应行亚急诊手术治疗或择期手术(ⅡaC)。(3)预防栓塞:主动脉瓣或二尖瓣NVE或PVE患者,虽经适当的抗生素治疗,一次或多次栓塞事件后赘生物持续>10 mm,需亚急诊手术治疗(ⅠB);主动脉瓣或二尖瓣NVE患者,赘生物>10 mm,导致严重瓣膜狭窄或反流,而手术风险低,需亚急诊手术治疗(ⅡaB);主动脉瓣或二尖瓣NVE 或PVE患者,合并孤立的巨大赘生物(>30 mm),需亚急诊手术治疗(ⅡaB);主动脉瓣或二尖瓣NVE或PVE患者,合并孤立的大赘生物(>15 mm),以及无手术的其他适应证,可进行亚急诊手术治疗(如果手术可保留自身瓣膜则可首选手术)(ⅡbC)。
1.1 感染性心内膜炎合并心力衰竭 HF是IE最常见的并发症,是IE最常见的手术适应症。42%~60%的NVE病例发生HF,IE侵犯主动脉瓣较二尖瓣更常发生HF。尽管心内瘘管以及罕见的瓣膜梗阻也可导致HF,但新发和恶化的重度主动脉瓣或二尖瓣反流是导致HF的主要原因。NVE的瓣膜反流可能由于二尖瓣腱索断裂、瓣膜破裂(连枷状瓣叶)、瓣膜穿孔、赘生物干扰瓣膜关闭而导致。一种特殊情况是原发主动脉IE的感染性反流束导致二尖瓣前叶感染。结果二尖瓣房侧瓣叶瘤形成最终可能导致二尖瓣穿孔。
HF的临床表现包括呼吸困难、肺水肿、心源性休克。IE合并HF患者的大规模前瞻性队列研究ICE试验中,66%的患者为纽约心功能(NYHA)分级Ⅲ或Ⅳ级。除临床表现外,经胸超声心动图(TTE)对最初评估和随访至关重要。经食道超声心动图(TOE)可很好评价继发于二尖瓣损伤和瓣膜瘤导致的瓣膜穿孔。对瓣膜功能障碍的血流动力学评价、肺动脉压测量、心包积液检测、左室收缩功能和左右心脏充盈压评价和监测,超声心动图也非常有用。B型尿钠肽对IE患者HF的诊断和监测具有潜在的应用价值。心脏肌钙蛋白和B型尿钠肽的升高均与IE不良预后相关。中、重度HF是住院、6个月和1年内死亡的最重要预测因素。
感染性心内膜炎患者出现HF的手术适应证和时机:患者手术选择和手术时机最好由心内膜炎团队确定。发生HF对多数IE患者提示需手术,是亚急诊手术的主要适应证。严重主动脉或二尖瓣反流、心内瘘管或赘生物引起瓣膜梗阻导致HF的患者适应手术。急性严重主动脉或二尖瓣反流,虽不合并临床HF但出现左室舒张末压升高(如二尖瓣提前关闭)、左房压升高或中、重度肺动脉高压的超声心动图表现,也为手术适应证。这些原则对NVE和PVE均适用。药物治疗时仍呈现持续性肺水肿或心源性休克的患者,无论感染状态如何,必须行急诊手术。当HF不太严重时,则必须进行亚急诊手术治疗。既使无HF,巨大赘生物导致的严重主动脉瓣或二尖瓣关闭不全患者,也应手术治疗。
虽然部分低危患者早期手术可能是一种治疗选择,但对耐受良好(纽约心功能分级I或Ⅱ级)严重瓣膜反流患者,如无手术其他适应证,严格临床和超声心动图观察下,抗生素治疗是一种良好的治疗选择。依据瓣膜损害的耐受性和瓣膜性心脏病ESC治疗指南的推荐,应考虑择期手术治疗。
总之,HF是IE最常见及最严重的并发症之一。除非患有严重伴发病,否则即使心源性休克患者,HF仍然是NVE 和PVE患者早期手术的一种适应证。
1.2 感染失控 感染失控是IE最恐惧的并发症之一,是手术第二个常见原因。当感染持续和出现局部感染未控制的表现时,考虑出现感染失控。耐药或超强毒力微生物感染常导致感染失控。
1.2.1 持续感染 持续感染的定义是主观性的,包括发热和抗生素治疗7~10 d后持续血培养阳性。持续发热是IE治疗过程中观察到的常见问题,通常在特定抗生素治疗下7~10 d内体温正常。持续发热可能与几种因素有关,包括抗生素治疗不足、耐药菌、有感染径路、局部感染未控制、栓塞并发症、或心脏外的感染和抗生素的不良反应等。持续发热的治疗包括更换静脉通路、反复实验室检查、血培养、超声心动图检查以及寻找心内或心外感染灶。
1.2.2 感染性心内膜炎的瓣周蔓延 IE向瓣周蔓延是感染失控的最常见原因,导致不良预后以及需手术治疗的可能性高。瓣周并发症包括脓肿、假性动脉瘤和瘘管。瓣周脓肿在主动脉瓣IE较常见(NVE为10%~40%)以及PVE更常见(56%~100%)。二尖瓣IE患者,瓣周脓肿通常发生于后方或侧面。主动脉瓣IE,瓣周蔓延最常发生于二尖瓣主动脉瓣间纤维。系列超声心动图检查发现脓肿形成为一种动态过程,开始主动脉根部壁增厚并蔓延最后瘘管形成。一项研究显示,瓣周并发症最重要风险因素为人工瓣膜、主动脉瓣位置和凝固酶阴性葡萄球菌感染。
假性动脉瘤和瘘管是IE严重的并发症,常导致严重瓣膜和瓣周损害。据报道IE瘘管发生率为1.6%,金黄色葡萄球菌是最常见的相关微生物(46%)。虽然该人群手术治疗率很高,但住院死亡率仍居高不下(41%)。感染严重蔓延的其他并发症少见,可能包括室间隔缺损、三度房室传导阻滞及急性冠状动脉综合征。
对不明原因的持续发热或新发房室传导阻滞的病例,应疑似感染的瓣周蔓延。因此,持续治疗过程中应反复行心电图检查,尤其是主动脉瓣IE。对瓣周并发症的诊断,TOE、多层螺旋CT(MSCT)、正电子发射断层扫描(PET)或CT非常有用,但TTE的敏感度<50%。感染的瓣周蔓延常通过系统性TOE检查发现。但既使进行TOE检查,小的脓肿仍可能被漏诊,尤其是合并瓣环钙化时位于二尖瓣的小脓肿。
1.2.3 IE患者出现感染失控的手术适应证和时机 ①持续感染:IE部分病例,单纯抗生素治疗不能充分根除感染。既使充分抗菌治疗(7~10 d)后仍持续发热和血培养阳性,以及出现心外脓肿(脾、脊柱、脑或肾脏)并排除了发热的其他原因,适宜手术治疗。但此种困境手术的最佳时机不清。最近研究显示抗生素启动治疗48~72 h后血培养持续阳性为住院死亡率的独立风险因素。这些结果提示,血培养持续阳性的其他原因排除后(合适的抗生素治疗方案),抗生素治疗3 d后血培养仍为阳性,应考虑手术治疗。②局部感染失控的征象:局部感染失控的表现包括赘生物体积进行性增大、脓肿、假性动脉瘤和瘘管形成。通常也出现持续发热并推荐尽快手术。罕见情况为:无手术的其他适应证及抗生素治疗极易控制发热,在临床和超声心动图严密随访下小脓肿或假性动脉瘤可保守治疗。③抗菌治疗控制感染的可能性低的微生物感染:真菌性IE,多重耐药菌病例(如耐甲氧西林金黄色葡萄球菌或万古霉素耐药的肠球菌),或革兰氏阴性菌导致的罕见感染,适宜手术。葡萄球菌或非HACEK革兰氏阴性菌导致的PVE也应考虑手术治疗。金黄色葡萄球菌的NVE,如果早期抗生素治疗反应不佳,适宜手术。PVE合并金黄色葡萄球菌感染的患者,应行手术治疗。
总之,感染失控常与感染瓣周蔓延或“难治性”微生物感染有关。除非合并严重的伴发病,否则局部感染失控是IE患者早期手术的一项适应证,而感染失控进行的手术效果较其他原因更差。
1.3 全身性栓塞的预防
1.3.1 感染性心内膜炎的栓塞事件 栓塞事件是IE常见及致命性的并发症,与心脏赘生物脱落迁移相关。脑和脾脏是左侧IE最常见的栓塞部位,而肺栓塞在右心自身瓣膜IE和起搏器电极IE常见,卒中是严重的并发症,导致脑血管病发病率和死亡率增加。相反20%~50%的IE患者栓塞事件可能完全无症状,尤其是累及脾脏和脑循环患者,可通过无创性影像检查诊断。因此系统性腹部和脑CT检查可有助于诊断。但肾功能受损或血流动力学不稳定的患者使用显影剂应谨慎,由于与肾毒性抗生素合用,可导致肾功能损害恶化的风险。
总之,IE的栓塞风险非常高,20%~50%的患者发生栓塞事件。但抗生素治疗后新发栓塞事件的风险仅为6%~21%。ICE研究人群发现,接受合适抗菌素治疗患者治疗第一周的卒中发生率为4.8/1000病人天,第二周降为1.7/1000病人天,其后进一步降低。
1.3.2 栓塞风险的预测 超声心动图对预测栓塞事件具有重要作用,尽管个体患者的预测仍然困难。栓塞风险增加的因素包括,赘生物大小和移动度,赘生物位于二尖瓣,抗生素治疗后赘生物体积进行性增大或缩小,特殊的微生物(金黄色葡萄球菌、牛链球菌、念珠菌),既往栓塞,多瓣膜IE和生物标记物。其中赘生物大小和移动度是新发栓塞事件最有效的独立预测因子。赘生物长度>10 mm的患者处于较高栓塞风险,更大(>15 mm)和可移动赘生物的患者风险甚至更高,尤其累及二尖瓣的葡萄球菌IE。一项最近研究发现,巨大赘生物(长度>30 mm)患者神经系统并发症的风险特别高。
最近一项IE研究显示,6个月新发栓塞的发生率为8.5%。六项因素与栓塞风险升高相关(年龄、糖尿病、房颤、既往栓塞史、赘生物长度和金黄色葡萄球菌感染),并用于建立“栓塞风险计算器”。个体患者无论出现什么风险因素,必须强调抗生素治疗后第1 d新发栓塞的风险最高,随后快速降低,尤其2周后降低更为明显;尽管赘生物残留时某些风险永久持续,尤其是非常大的赘生物。因此,抗生素治疗的最初2周进行手术预防栓塞的获益最大,此时为栓塞风险的高峰期。
1.3.3 预防感染性心内膜炎栓塞的手术适应证和时机 降低栓塞事件风险最佳方法是及早制定合适的抗生素治疗方案,加用抗血小板治疗虽前景良好,但发表的随机研究显示并不降低栓塞风险。预防栓塞事件早期进行手术的确切作用仍存在争议。欧洲心脏调查(Euro Heart Survey)研究,54%的NVE患者和25%的PVE患者赘生物大小是手术的一种原因,但很少是唯一的原因。对单纯巨大赘生物早期手术的价值目前尚存争议。一项最近随机试验显示,与传统治疗相比巨大赘生物患者早期手术显著降低死亡和栓塞事件的风险。但入组患者风险低,早期手术和传统治疗组之间6个月全因死亡率无显著差异。
最后,预防栓塞早期手术的决策必须考虑既往栓塞事件的发生、IE其他并发症、赘生物的大小和移动度、保守性手术的可能性及抗生素疗程。手术总体获益应与手术风险权衡,须考虑患者临床状况和伴发病。
预防栓塞进行手术的主要适应证和时机如前所述。即使合适的抗生素治疗但仍出现1次或以上临床或无症状栓塞事件后,赘生物持续>10 mm患者适宜手术。虽然依据保守性手术可能性,手术决策更加困难并且必须认真评估个体化治疗;但主动脉瓣或二尖瓣巨大孤立赘生物(>15 mm)患者可考虑手术治疗。预防栓塞手术必须及早进行,启动抗生素治疗后的最初几天内(进行亚急诊手术治疗),此时栓塞的风险最高。
总之,IE栓塞的发生率常见,20%~50%的IE病例发生,但启动抗生素治疗后降为6%~21%。抗生素治疗的最初2周内栓塞的风险最高,尽管合并其他风险因素但其与赘生物的大小和移动度相关最为密切。预防栓塞及早手术的决策往往难以决择,个体患者互不相同。决定性因素包括赘生物的大小和移动度,既往栓塞,微生物的种类和抗生素治疗持续的时间。
2 感染性心内膜炎的其他并发症
2.1 神经系统并发症 有症状的神经系统并发症发生于15%~30%的IE患者,主要为赘生物栓塞所致。大多数病例神经系统表现发生于IE确诊前或确诊时,但新发或复发性事件也可随后发生于IE疾病的过程中。临床表现差异较大,同一患者可能包括多种症状或体征,但局灶性症状为主以及常诊断为缺血性卒中。也可表现为短暂脑缺血发作、脑出血或蛛网膜下腔出血、脑脓肿、脑膜炎、和中毒性脑病,明确证据提示35%~60%的IE患者也可发生无症状脑栓塞。与其他细菌性IE相比,金黄色葡萄球菌感染性IE更易导致神经系统并发症。赘生物的长度和移动度也与栓塞风险相关。神经系统并发症导致死亡率增加及后遗症,尤其是卒中患者。早期诊断和启动合适的抗生素治疗对预防首发或复发性神经系统并发症具有重要意义。高危患者早期手术是栓塞预防第二重要手段,而抗栓药物则无用。
大多数IE患者的成功治疗需要药物和手术联合治疗。发生神经系统事件后,心脏手术适应证常仍然存在或进一步强化,但必须权衡围手术期风险及术后预后。随机研究不可能进行,而队列研究存在偏倚,只能通过统计学方法部分矫正。但无症状脑栓塞或短暂性脑缺血发作后,术后神经功能衰退的风险低,如果仍存在手术适应证推荐手术不必迟疑。发生一次缺血性卒中后,除非神经预后不良,否则心脏手术不是禁忌。有关卒中和心脏手术之间的最佳时间间隔证据并不一致,但最近资料支持早期手术。如果头颅CT排除脑出血及神经损伤不严重(即昏迷),HF、感染失控、脓肿或栓塞风险持续高则需要进行的手术不应延迟,并具有较低的神经系统风险(3%~6%)及神经功能完全恢复可能性很大。相反,脑出血的患者,神经系统的预后不良,手术通常应推迟至少1个月;尽管最近一项研究报道,脑出血后2周内进行手术的IE患者神经功能恶化的风险相对较低。因此写作组决定改编证据级别适合于Ⅱa类推荐。如亚急诊手术,神经外科团队和心内膜炎团队务必密切合作。IE出现神经系统并发症的推荐治疗总结见图1。
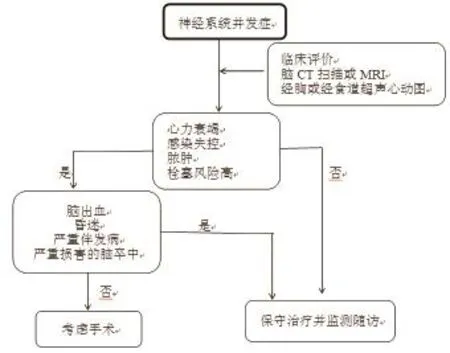
图1 感染性心内膜炎合并神经系统并发症的治疗策略
感染性心内膜炎神经系统并发症的治疗:无症状栓塞或短暂脑缺血发作后,如果适宜心脏手术治疗则推荐立即手术不应延迟(ⅠB)。对颅内巨大、逐渐增大或破裂的感染性动脉瘤,推荐神经外科手术或血管腔内治疗(ⅠC)。脑出血后,通常推迟手术至少≥1个月(ⅡaB)。卒中后,只要不出现昏迷及头颅CT或磁共振成像(MRI)排除脑出血,发生HF、感染失控、脓肿或栓塞风险持续高,应考虑手术不得有任何延误(ⅡaB)。IE合并神经系统症状的患者,应检查颅内感染性动脉瘤。应考虑CT或MR血管造影用于诊断。如果无创性检查阴性但仍然怀疑颅内动脉瘤,应考虑传统的脑血管造影(ⅡaB)。
IE患者疑似神经系统任何并发症务必进行颅脑影像学检查。最常行CT平扫或增强。MRI平扫或钆增强具有较高的敏感度,可更好地探查和分析具有神经系统症状患者的脑部病变,其可能对手术时机的选择产生一定影响。无神经系统症状的患者,脑部MRI常能检查出病变,其可能改变治疗策略,尤其手术的适应证和时机。脑部MRI常能检查出IE患者的微小出血(直径≤10 mm的T2低信号)。脑部微出血的患者与脑实质出血缺乏关联以及术后并不发生神经系统并发症,因此建议脑微出血不应解释为活动性出血,当适应手术时不应推迟。
总之IE患者15%~30%发生症状性神经系统事件,另外也常发生无症状神经系统事件。卒中(缺血性和出血性)导致死亡率增加。及时诊断和启动合适的抗生素治疗对预防首发或复发性神经系统并发症至关重要。如果适宜手术,首发神经系统事件后,通常不禁忌手术,除非广泛脑损害或颅内出血。
2.2 感染性动脉瘤 感染性(霉菌性)动脉瘤起因于感染物栓塞到血管腔内或滋养血管,或通过血管内膜感染随后传播。感染性动脉瘤典型表现为壁薄易碎,因此破裂和出血的倾向高。没有风险因素可预测破裂,与非感染性动脉瘤相反,瘤体大小似乎并非破裂的可靠预测因素。
最常见位于颅内,报道2%~4%发生率可能低估,由于部分感染性动脉瘤临床无症状。感染性动脉瘤的早期检出和治疗是至关重要的,由于继发破裂后的发病率和死亡率高。临床表现差异极大(即局灶性神经功能缺损、头痛、意识模糊、癫痫发作),所以有神经系统症状的IE病例应进行系统的影像学检查,以明确颅内感染性动脉瘤。脑CT和脑MRI均可明确诊断感染性动脉瘤,具有良好的敏感度和特异度。但传统的血管造影仍是金标准,当无创性检查阴性以及仍然疑似时应该进行。
由于缺乏随机临床试验,感染性动脉瘤无公认的标准治疗。因此治疗应由心内膜炎团队制定,具体患者个体化。部分感染性动脉瘤抗菌素治疗期间可能消失,而其他需要手术和血管内干预治疗,取决于破裂的可能性、动脉床的部位以及患者的临床状况。
有关颅内感染性动脉瘤,破裂的动脉瘤必须立即通过手术或血管内干预治疗。未破裂的感染性动脉瘤应在抗生素治疗下,随后进行系列颅脑影像检查;如果血管瘤缩小或完全消失,通常不必手术或血管内干预治疗。但如果血管瘤增大或保持不变,可能患者需要干预治疗。另一方面,如果感染性动脉瘤体积大以及有症状,推荐神经外科手术或血管内治疗。最后如果需要早期心脏手术,术前可考虑血管内干预治疗,取决于相关脑损害、患者血流动力学状态以及手术的风险。
2.3 脾脏并发症 脾梗死常见而且常无症状。持续或反复发热、腹痛和菌血症提示出现并发症(脾脓肿或破裂)。虽然脾栓塞常见但脾脓肿罕见。这些患者应该进行腹部CT、MRI或超声评价。最近证实PET对IE患者诊断脾转移性感染有用。脾破裂或巨大脓肿,对单纯抗生素治疗反应不佳,可考虑脾切除,并应在瓣膜手术前进行,除非瓣膜手术迫切需要解决。罕见情况,脾切除和瓣膜手术同时进行。经皮穿刺引流对手术风险高危的患者是一种替代治疗。
2.4 心肌炎和心包炎 心力衰竭可能由于心肌炎导致,其常导致脓肿和免疫反应。室性心律失常可能提示心肌受累,并预示预后不良。心肌受累最好使用TTE和心脏MRI评价。炎症反应、HF、瓣周并发症或感染本身可导致心包积液,可能是更严重IE的一种征象。罕见的情形,破裂的假性动脉瘤或瘘管可与心包相通,具有严重并常致命性的后果。化脓性心包炎罕见,可能需要手术引流。
2.5 心律失常和传导阻滞 传导阻滞是IE少见的并发症。根据患者注册资料,发生率为1%~15%的病例,其发生导致预后不良和死亡率更高。传导阻滞(主要是Ⅰ度、Ⅱ度和Ⅲ度房室传导阻滞,罕见束支阻滞)是由于心内膜感染向外蔓延,从瓣膜到传导系统,通常与瓣周并发症有关。完全房室传导阻滞最常与左侧瓣膜受累有关(主动脉瓣36%,二尖瓣33%),由于房室结的解剖关系,房室结接近于无冠瓣和二尖瓣前叶。IE患者合并完全房室传导阻滞的一项研究,病理学检查显示存在感染,常伴有脓肿和瘘管,影响传导系统;阵发性房室传导阻滞的患者,该水平层面检查发现炎症反应,可解释事件的可逆性。因此心内膜炎患者心电监护过程中出现传导异常,提醒医生瓣周并发症发生的可能性。赘生物碎片栓塞冠状动脉的病例,诱发的心肌缺血可能是快速心律失常发作的基础。
IE患者可出现房颤,可发生于IE之前或为IE的一种并发症而发作。报道房颤老年患者更常见并导致不良预后。最近大规模、前瞻性IE系列研究显示,房颤导致栓塞风险增高,与其他风险因素相同(年龄、糖尿病、既往栓塞、赘生物长度和金黄色葡萄球菌感染)。所以房颤可能增加IE患者充血性心力衰竭和栓塞的风险;但是无具体的研究,也无对这些患者治疗的国际共识。这些患者的抗凝治疗应该依据感染性心内膜炎团队提供的个体化原则。
2.6 肌肉骨骼表现 IE发病过程中肌肉骨骼症状(关节痛、肌痛、背痛)常见。风湿病的表现可能是IE的首发症状,并可能延误诊断,尤其当典型的表现不太明显以及出现炎症诱导的多种抗体(即,抗中性粒细胞胞浆抗体阳性)。关节痛发生于10%的患者,而肌痛发生率为12%~15%,背痛约13%,腰椎疼痛是IE合并椎体骨髓炎患者最常见的症状。外周关节炎发生率14%左右,IE患者椎间盘炎发生率约为1.8%~15%。链球菌和葡萄球菌菌血症发病率高的IE患者脊柱化脓性骨髓炎的发生率4.6%~19%。IE可合并化脓性骨髓炎反之化脓性骨髓炎可合并IE。椎体骨髓炎患者发生草绿色链球菌IE的发生率更高。背痛或骨疼痛的IE患者,应该进行脊柱CT,最好是脊柱MRI,或全身18F-FDG-PET/CT检查。相反,明确诊断为化脓性椎间盘炎或骨髓炎的患者合并易发IE的心脏疾病,应该进行超声心动图检查。
明确的椎间盘炎和骨髓炎患者,通常需要延长抗生素治疗,直到18F-FDG PET/CT或MRI检查无炎症活动的表现。IE患者其他肌肉骨骼表现不常见,包括1%病例出现骶髂关节炎;0.9%的患者出现类似于风湿性多肌痛疾病状态,有肩膀和臀部疼痛和晨僵表现;3.6%的患者出现皮肤白细胞碎裂性血管炎(紫癜性皮肤损害)。
2.7 急性肾功能衰竭 急性肾功能衰竭是IE常见的并发症,可导致IE预后恶化。肾功能障碍发生与住院死亡率和术后不良事件风险增加独立相关。急性肾功能障碍发生于6%~30%的患者,原因如下:①免疫复合物和血管炎性肾炎;②肾梗死,主要是由于脓毒性栓子导致,发生于疾病过程的任何时间;③HF或严重脓毒症以及心脏手术后患者的血流动力学障碍;④抗生素的毒性(急性间质性肾炎),与氨基糖苷类、万古霉素(与氨基糖苷类抗生素的协同毒性)、甚至大剂量青霉素显著相关;⑤影像学检查使用造影剂的肾毒性。严重肾功能衰竭患者可能需要透析并且死亡率高。较轻的急性肾功能衰竭常可逆转。为减轻该并发症,依据肌酐清除率调整抗生素剂量,并严密监测血清肌酐水平(使用氨基糖苷类和万古霉素)。血流动力学障碍和既往肾功能不全的患者影像学检查应避免使用肾毒性造影剂。
3 总结
IE的三大主要并发症心力衰竭、感染失控、栓塞事件均为早期手术的适应证,即心力衰竭或血流动力学障碍,持续感染、局部感染失控、难治性微生物感染,赘生物持续>10 mm伴有栓塞或瓣膜功能障碍、巨大孤立赘生物(>15 mm)。IE早期手术的原因是避免严重感染导致渐进性心力衰竭和不可逆结构损害,以及预防全身栓塞。除非合并严重的伴发病,否则即使心源性休克患者,HF是NVE和PVE患者早期手术的一种适应证。感染失控最常与感染瓣周蔓延或“难治性”微生物感染有关,但感染失控的手术效果较差。IE抗生素治疗的最初2周内栓塞的风险最高,以后明显降低;早期手术预防栓塞的决定性因素包括:赘生物的大小和移动度,既往栓塞,微生物的种类和抗生素治疗持续的时间。
IE患者15%~30%发生症状性神经系统事件,也常发生无症状神经系统事件,卒中(缺血性和出血性)导致死亡率增加;及时诊断和合适的抗生素治疗可明显预防神经系统并发症;如果适宜手术则首发神经系统事件后通常手术不禁忌,除非广泛脑损害或颅内出血。感染性动脉瘤治疗应由心内膜炎团队制定并个体化;部分抗菌素治疗期间可能消失,而其他需要手术和血管内干预治疗,取决于破裂的可能性、动脉床的部位、以及患者临床状况。脾脏转移性感染抗生素治疗;脾破裂或巨大脓肿抗生素治疗不佳,可考虑脾切除,并应在瓣膜手术前进行,除非瓣膜手术迫切需要解决;对手术风险高危患者可经皮穿刺引流。心肌炎可导致心力衰竭和室性心律失常。炎症反应、HF、瓣周并发症或感染本身可导致心包积液,但化脓性心包炎罕见可能需要手术引流。传导阻滞是IE少见的并发症,提醒医生瓣周并发症发生的可能性。赘生物碎片栓塞冠状动脉可能诱发快速心律失常发作。房颤可增加IE患者心力衰竭和栓塞的风险。IE可合并化脓性骨髓炎,相反化脓性骨髓炎可合并IE;明确的椎间盘炎和骨髓炎患者,通常需要延长抗生素治疗,直到18F-FDG PET/CT或MRI检查无炎症活动的表现。IE合并急性肾功能衰竭常见并导致IE预后恶化,肾功能障碍发生与IE住院死亡率和术后不良事件风险增加独立相关。
[1] Habib G,Lancellotti P,Antunes MJ,et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J,2015,36(44):3075-128.
本文编辑:孙竹
R542.42
A
1674-4055(2017)05-0513-05
北京市卫生系统高层次卫生技术人才培养项目资助(2009-3-68)
1102600 北京,首都医科大学大兴教学医院心内科;2100044 北京,北京大学人民医院心脏中心;3100730 北京,中国医学科学院北京协和医院心内科
沈珠军,E-mail:zhujun66shen@126.com
10.3969/j.issn.1674-4055.2017.05.01
