人瘢痕疙瘩间充质样干细胞向成骨细胞分化过程中Notch信号表达的研究
2017-07-01梁钦博邓呈亮魏在荣王波张文夺王达利
梁钦博 邓呈亮 魏在荣 王波 张文夺 王达利
人瘢痕疙瘩间充质样干细胞向成骨细胞分化过程中Notch信号表达的研究
梁钦博 邓呈亮 魏在荣 王波 张文夺 王达利
目的 研究人瘢痕疙瘩间充质样干细胞向成骨细胞分化过程中,Notch 1~4受体的表达情况,探讨Notch信号通路是否参与调控人瘢痕疙瘩间充质样干细胞的成骨分化。方法 经患者知情同意后,分离培养人瘢痕疙瘩间充质样干细胞,采用流式细胞术检测CD29、CD34、CD44、CD45及CD90的表达;免疫细胞化学法检测Oct 4的表达;体外诱导其向成骨细胞分化,诱导3周后行茜素红染色;于诱导前及诱导后2、3周,采用实时定量-多聚酶链反应(RT-PCR)及免疫蛋白印迹法(western blot),分别检测细胞Notch 1~4受体mRNA及蛋白的表达。结果 流式细胞术结果表明,分离培养的细胞高表达间充质干细胞表型 CD29(98.76%)、CD44(98.11%)、CD90(97.86%),不表达造血干细胞表型 CD34(0.05%)、CD45(0.03%);免疫细胞化学法检测多能干细胞标志物Oct4呈阳性表达;向成骨细胞体外诱导3周后,茜素红染色可见明显的钙盐结节。RT-PCR和western blot结果显示,随着诱导时间的延长,Notch 1~4受体mRNA和蛋白的相对表达量逐渐减少,差异有统计学意义(P<0.05)。结论 在人瘢痕疙瘩间充质样干细胞向成骨细胞诱导分化过程中,Notch受体信号的表达逐渐减弱,低水平的Notch信号激活可能有利于瘢痕疙瘩间充质样干细胞的成骨分化。
瘢痕疙瘩;间充质干细胞;Notch信号通路;成骨分化
瘢痕疙瘩是人体真皮损伤后引发或自发产生 的以胶原及细胞外基质异常沉积所致的过度瘢痕化,目前尚无理想的治疗方法。Notch信号通路是在动物进化过程中高度保守的细胞间信号传导通路,其参与干细胞的早期分化,决定干细胞的分化方向,是调控干细胞分化的重要信号通路。大量研究表明,Notch信号通路对间充质干细胞(mesenchymal stemcells,MSCs)成骨分化的调控存在争议[1-2]。我们前期研究在瘢痕疙瘩中分离出干细胞(keloid-derived mesenchymal stem cells,KMSCs),经诱导后可以向脂肪细胞、成骨细胞、软骨细胞方向分化,且通过RT-PCR检测发现Notch 1~4基因在KMSCs中表达[3-4]。而既参与调控MSCs的分化,又可能参与瘢痕疙瘩形成的Notch信号通路,是否调控KMSCs的分化,目前尚不清楚。自2014年9月至2015年9月,我们参照前期研究方法,分离出KMSCs,诱导其向成骨细胞分化,通过实时定量PCR及蛋白印迹法检测诱导前后不同时间段细胞中Notch 1~4受体mRNA和蛋白的表达,比较mRNA和蛋白的相关变化,为进一步研究KMSCs的定向分化抑制和瘢痕疙瘩的治疗,提供基础研究的资料。
1 对象与方法
1.1 标本来源及制备
本研究获得遵义医学院附属医院医学伦理委员会(遵医伦理批复20150612)同意。手术切除瘢痕疙瘩6例,由遵义医学院附属医院整形外科提供。瘢痕疙瘩病史1~2年,平均16个月;男性3例,女性3例;年龄18~65岁。瘢痕疙瘩位于前胸、后背、耳垂等部位,手术前均未接受相关治疗。所有离体标本均由患者签属知情同意书。标本离体后,无菌条件下收集保存,在2 h内开始进行细胞提取。
1.2 主要仪器与试剂
PCR基因扩增仪、实时荧光定量PCR仪(CFX96)、PCR 扩增仪(C1000PCR)、全能型凝胶成像分析系统(ChemiDocMP)均由美国BIO-RAD公司生产;流式细胞仪(Accuri C6,美国Becton Dickinson公司);小鼠抗人单克隆荧光标记抗体(CD29-PE、CD34-PE、CD44-FITC、CD90-FITC、CD45-APC,美国eBioscience公司);Western相关试剂(北京博奥森生物技术公司);细胞培养相关试剂(美国Sigma公司)。
1.3 方法
1.3.1 人KMSCs的分离、培养 收集手术切除的瘢痕疙瘩标本,修剪、切割后加入3 mg/ml的Ⅱ型中性蛋白酶于4℃下消化,次日弃上皮,剪切真皮部分,加入Ⅰ型胶原酶,置于37℃下消化2 h,加入DnaseⅠ终止消化;离心弃上清液,重悬细胞,过滤、离心,添加10 ml增殖培养基(含10%FBS的低糖DMEM培养基,添加1%双抗、2 mML-谷氨酰胺、100 mM非必须氨基酸及550 μm2-巯基乙醇)悬浮,接种培养瓶中培养,倒置显微镜下观察细胞形态;待细胞生长达90%,消化后离心,培养基重新悬浮,按1×104/cm2的细胞密度传代接种,每隔3 d换液1次。
1.3.2 流式细胞术检测人KMSCs表面标志 收集第3代KMSCs,洗涤2次,加入PBS,震荡,直接加入荧光素标记的小鼠抗人抗体,室温避光孵育20~25 min,加入PBS 2 ml,震荡洗涤,离心去上清液,加入200 μl多聚甲醛固定液,上机分析,采用小鼠抗人的IgG作为同型对照。
1.3.3 免疫细胞化学检测Oct4的表达 取第3代人KMSCs接种于放置盖玻片的培养皿中进行细胞爬片,培养72 h后取出盖玻片,漂洗,4%多聚甲醛固定,冲洗,加入山羊血清封闭液孵育约30 min,加入Oct4抗体一抗过夜,次日复温,漂洗,加入二抗,置于37℃下30 min,冲洗,3-二氨基联苯胺(DAB)显色,冲洗,苏木素染色液复染,光镜观察并拍照。
1.3.4 体外诱导人KMSCs向成骨细胞分化 取第3代人KMSCs,以1×105/ml细胞密度接种于预放置盖玻片的6孔板内,细胞生长达80%~90%,换成3 ml/孔成骨诱导培养基(含5 mMβ-GP、1×10-7mmol/L DEX、50μg/ml vitamin C、10%FBS),于37℃、5%CO2细胞孵箱培养,2~3 d换液1次,诱导21 d后进行茜素红S染色,检测钙盐沉积;吸弃成骨细胞诱导液,漂洗,4%多聚甲醛固定,1%茜素红S染色5 min,显微镜下观察。
1.3.5 实时定量PCR检测诱导前及诱导14、21 d目的细胞Notch 1~4 mRNA的表达 ⑴引物设计。引物由大连宝生物TAKARA公司设计、合成。Notch1:F:5′GCTACGA GTGTGCCTGTGA 3′R:5′AGCCATTGATGCCGTCCTC 3′,扩增片段为 117bp;Notch 2:F :5′AGTGGTATGGACTGTGAGGAG 3′R :5′GAAGGCAGAGGCA GGAGAA 3′,扩增片段为106bp;Notch 3:F:5′CGATGTCAACGAGTGTCTGTC 3′R:5′TGTG TTGG CGTACAGGTCTT 3′,扩增片段为100bp;notch4:F:5′TCG GTGCTGGCTTCTCTTC 3′R:5′TACTGGTCATAGGCTGGAGTG 3′,扩增片段 为 120 bp;β-actin:F:5′GCACTCTTCCAGCCTTCCTT 3′R:5′TGTGTTGGCGTAC AGGTCTT 3′;扩增片段为114 bp。⑵总RNA的提取及Realtime-PCR。收集待测细胞,常规方法提取总RNA,检测OD值,计算RNA浓度。10 μl体系(含200 ng总RNA)反转录为 cDNA,以(20 μl)扩增体系在 ABI 7900 qPCR仪上进行目的基因的扩增。预变性95℃,2 min,变性 94℃,20 s,退火 65℃,20 s,延伸72℃,30 s;共40个循环。以样本Ct值作为统计参数,内参基因 Ct=(Ct1+Ct2+Ct3)/3;用相对定量公式XN,C=2-ΔΔCt计算目的基因的相对表达量。
1.3.6 免疫蛋白印迹法检测诱导前及诱导14、21 d目的细胞Notch 1~4 mRNA的表达 在目的细胞中分别加入蛋白裂解液,研磨提取总蛋白,低温保存备用;BCA法测蛋白浓度;30 μg/孔上样后100 V电泳;湿转法将蛋白转移至PVDF膜上;用10%脱脂奶粉封闭1 h;加入1∶600兔抗人Notch 1~4单克隆抗体,4℃过夜;二抗为1∶4000辣根过氧化物酶(HRP)标记山羊抗兔IgG,于常温下作用1 h;用LumiLight化学发光试剂盒曝光、显影、定影。实验用兔抗人β-actin多克隆抗体(1∶600)作为内参。所得显影后,用Quantity One图像分析系统扫描条带的灰度值,以Notch 1~4条带与β-actin条带灰度值的比值表示蛋白的相对表达水平,整理分析数据结果。
1.4 统计学处理
2 结果
2.1 人KMSCs的形态和生长特性
原代培养的KMSCs在倒置显微镜下观察,细胞呈短梭形、三角形、椭圆形等不规则形状,原代细胞生长较慢,3~4 d增殖速度加快,8~10 d细胞可连续生长至瓶底80%~90%;传代培养的KMSCs较原代更易贴壁,且增殖速度加快,5~6 d细胞汇合率可达90%以上,细胞排列不规则,胞体拉伸,形态均一,多为长梭形(图 1,2)。
2.2 流式细胞术检测细胞表面标志
采用流式细胞术分析第3代细胞表型。结果显示,该细胞群高表达 MSCs表型 CD29、CD44、CD90;不表达造血系统抗原标记CD34、CD45。见图3。
2.3 免疫细胞化学检测Oct4的表达
免疫细胞化学结果显示,人KMSCs细胞核呈棕黄色,多能干细胞标志Oct4呈阳性表达,用PBS处理的空白对照组为阴性表达(图4,5)。
2.4 人KMSCs向成骨细胞诱导分化
人KMSCs在诱导剂作用下进行成骨诱导后,细胞形态呈多边形或不规则形状,簇状分布,重叠生长。细胞团随着诱导时间的延长而增大。3周后茜素红染色可见明显钙盐结节形成(图6,7)。
2.5 RT-PCR检测KMSCs Notch 1~4基因表达
RT-PCR结果显示,随着诱导时间延长,Notch 1~4 mRNA的相对表达量逐渐降低,差异有统计学意义(P<0.05,表 1)。
2.6 Western Blot检测KMSCs Notch 1~4蛋白表达
Western blot检测结果显示,随着诱导时间的延长,Notch 1~4蛋白的相对表达量逐渐减少,其差异有统计学意义(P<0.05)。见表 2,图 8。
表1 RT-PCR检测Notch 1~4基因不同时间点的相对表达情况±s
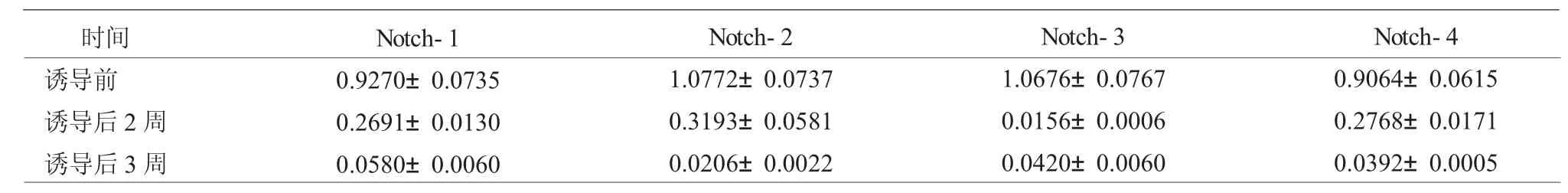
表1 RT-PCR检测Notch 1~4基因不同时间点的相对表达情况±s
?
表2 Western蛋白印迹法检测Notch 1~4蛋白不同时间点的表达情况±s
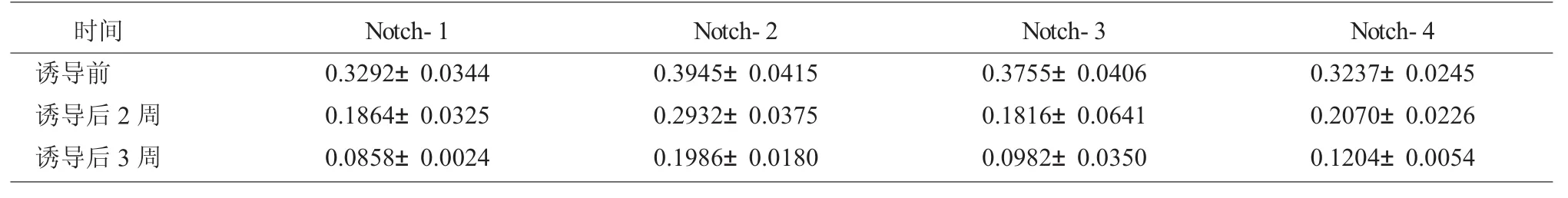
表2 Western蛋白印迹法检测Notch 1~4蛋白不同时间点的表达情况±s
?
3 讨论
Notch信号通路是在动物进化过程中高度保守的细胞间信号传导通路,可介导细胞间的信号接触,调节细胞的增殖与分化。Notch信号通路激活,导致Notch相关受体上调,同时下调Notch相应配体,而Notch配体的表达对Notch受体有下调作用。这种正反馈机制,使Notch受体及配体的细微差别在干细胞增殖发育过程中不断放大,从而决定了干细胞的不同分化方向[5-6]。Notch信号通路在调控成体干细胞分化方面发挥重要作用,一般认为,增强Notch通路会促进成体干细胞分化[7-8]。而在MSCs分化方面,Notch通路所发挥的作用不尽相同,Notch通路的激活或阻滞与MSCs具体分化为何种功能细胞有关[9-12]。在Notch信号通路中,对MSCs成骨定向分化方面的研究较多,目前存在的争议也较大。有研究表明[1-2],Notch信号通路激活可以促进MSCs的成骨分化,也能抑制MSCs的成骨分化。可见,MSCs在成骨分化过程中,Notch信号的表达情况,目前的研究并不清楚。Syed和Bayat[13]通过RT-PCR检测瘢痕疙瘩与正常皮肤真皮组织中Notch 1~4受体及配体的表达,在体外激活或阻断Notch信号通路后,研究瘢痕疙瘩成纤维细胞生物学活性的改变,表明Notch信号通路参与了瘢痕疙瘩的形成。研究组前期结果显示,Notch信号通路和KMSCs均与瘢痕疙瘩的形成有关。但是,不同的Notch亚型在肿瘤形成过程中,发挥的作用也不尽相同,而KMSCs与Notch信号通路及其不同亚型的关系如何,Notch信号通路是否参与调控KMSCs的分化,对于临床研究瘢痕疙瘩的发病机制以及防治有着重要的作用。
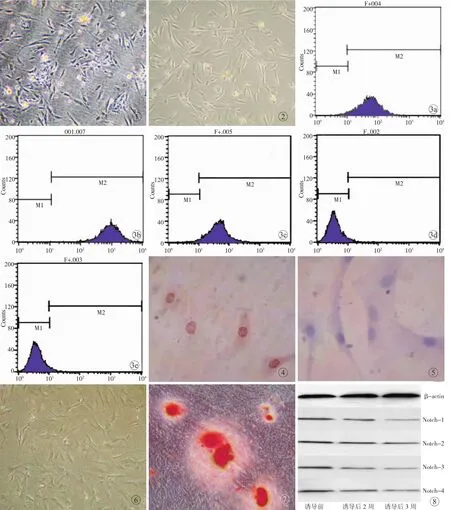
图1 人KMSCs原代培养第2天(倒置显微镜×40) 图2 人KMSCs第3代第2天(倒置显微镜×40) 图3 流式细胞术检测人KMSCs表面标志分子 a.CD29-PE阳性率为98.76% b.CD44-FITC阳性率为98.11% c.CD90-FITC阳性率为97.86% d.CD34-APC阳性率为0.05% e.CD45-PE阳性率为0.03% 图4 人KMSCs内Oct4呈阳性表达(倒置显微镜×400) 图5 空白对照组(倒置显微镜×400) 图6 人KMSCs诱导前(倒置显微镜×40) 图7 诱导3周后,可见明显的钙盐结节(茜素红染色×40) 图8 诱导前后Notch 1~4的相对表达情况
本研究参照了前期的研究方法,从临床收集的瘢痕疙瘩中成功分离MSCs,经流式细胞术鉴定,该类细胞高表达CD29、CD44、CD90等间充质来源的表面标志,不表达CD34、CD45等造血干细胞特征表面标志。采用免疫细胞化学法检测该细胞群Oct4蛋白表达呈阳性。采取成骨诱导培养基(含10%FBS、1×10-7mmol/L DEX、50 μg/ml vitamin C、5 mM β-GP),诱导3周后可见明显的钙盐沉积,说明所提取细胞已成功诱导为成骨细胞,提示该细胞确实具有向成骨细胞分化的潜能。这些进一步证实了瘢痕疙瘩中存在MSCs,且在诱导KMSCs向成骨细胞分化过程中,于诱导前及诱导后2、3周不同时间段,采取实时定量PCR和Western blot检测Notch不同亚型的mRNA、蛋白的表达情况。结果显示,随着诱导时间的延长,Notch不同亚型的mRNA、蛋白的相对表达量逐渐降低,Notch信号通路逐渐减弱。本研究结果提示,Notch信号通路可能负调控KMSCs的成骨分化,激活低水平的Notch信号,有利于KMSCs的成骨分化。当然,在KMSCs的成骨诱导分化过程中,Notch信号通路逐渐减弱,也有可能是调控MSCs成骨分化的其他信号通路,如骨形态发生蛋白(bone morphogenetic protein,BMP)、Wnt信号通路等,这些信号通路的激活导致Notch信号通路抑制。V Deregowski(2006年)和MJ Hilton(2008年)先后报道了Notch信号能调节BMP或Wnt信号诱导的成骨形成,可见MSCs的成骨分化虽涉及多种信号通路,可能共同影响细胞的命运,但Notch信号通路均通过直接或间接的形式参与,是最重要的诱导成骨分化的信号通路。本研究的不足在于收集的临床样本较少,统计学意义仍有待大样本量的研究。另外,研究结果仅能说明在KMSCs向成骨细胞诱导分化过程中,Notch信号通路有改变,但无法很好地反映Notch信号通路在MSCs向成骨细胞分化过程中的具体作用。下一步的研究将考虑加入Notch信号通路的激动剂或阻断剂,以观察KMSCs的分化。
总之,本研究结果进一步证实了Syed等[13]的研究,即Notch信号通路参与了瘢痕疙瘩的形成。同时,我们推测,瘢痕疙瘩的发病机制与肿瘤有高度的相似性,瘢痕疙瘩内存在MSCs;Notch信号通路极有可能参与调控KMSCs的自我更新与分化;低水平的Notch信号激活可能有利于KMSCs的分化,高水平的Notch信号激活可能抑制KMSCs的分化,维持KMSCs的自我更新。因此,若阻断Notch信号通路,维持Notch信号持续处于低水平,可能会促进KMSCs的分化;若能精细调控这些信号通路,可避免KMSCs向成纤维细胞方向分化,从而有望达到控制瘢痕疙瘩发生、发展的目的。
[1] Lough DM,Chambers C,Germann G,et al.Regulation of ADSC osteoinductive potential using notch pathway inhibition and gene rescue:a potential on/off switch for clinical applications in bone formation and reconstructive efforts[J].Plast Reconstr Surg,2016,138(4):642e-652e.
[2] Ongaro A,Pellati A,Bagheri L,et al.Characterization of Notch SignalingDuringOsteogenicDifferentiationinHumanOsteosarcoma Cell Line MG63[J].J Cell Physiol,2016,231(12):2652-2663.
[3] 邓呈亮,王波,张子阳,等.Notch基因在人瘢痕疙瘩间充质样干细胞中的表达[J].中华整形外科杂志,2014,30(3):197-202.
[4] 王达利,朱晶晶,邓呈亮,等.人瘢痕疙瘩来源干细胞的生物学特性鉴定[J].中华烧伤杂志,2011,27(3):210-214.
[5] Bi P,Shan T,Liu W,et al.Inhibition of notch signaling promotes browning of white adipose tissue and ameliorates obesity[J].Nat Med,2014,20(8):911-918.
[6] Fuwa TJ,Hori K,Sasamura T,et al.The first deltex null mutant indicates tissue-specific deltex-dependent notch signaling in Drosophila[J].Mol Genet Genomics,2006,275(3):251-263.
[7] Robinson AP,Foraker JE,Ylostalo J,et al.Human stem/progenitor cells from bone marrow enhance glial differentiation of ratneural stem cells:a role for transforming growth factor β and Notch signaling[J].StemCells Dev,2011,20(2):289-300.
[8] KinghamPJ,MantovaniC,TerenghiG.Notchindependent signalling mediates Schwann cell-like diferentiation of adipose derived stem cells[J].Neurosci Lett,2009,467(2):164-168.
[9] 柳柯,刘桂英,杨洋,等.Notch信号通路在骨髓间充质干细胞向肝细胞分化过程中的动态表达特征[J].中华临床解剖学杂志,2013,31(3):308-313,317.
[10] 张一婷,尹爱平,李利利,等.阻断Notch信号通路促骨髓间质干细胞体外分化为胰岛样细胞[J].中华肾脏病杂志,2014,30(8):619-626.
[11] Tang Y,Urs S,Boucher J,et al.Notch and transforming growth factor-beta (TGF beta)signaling pathways cooperatively regulate vascular smooth muscle cell diferentiation[J].J Biol Chem,2010,285(23):17556-17563.
[12] Oldershaw RA,Hardingham TE.Notch signaling during chondrogenesis of human bone marrow stem cells[J].Bone,2010,46(2):286-293.
[13] Syed F,Bayat A.Notch signaling pathway in keloid disease:enhanced fibroblast activity in a jagged-1 peptide-dependent manner in lesional vs.extralesional fibroblasts[J].Wound Repair Regen,2012,20(5):688-706.
Expression of Notch signaling pathway expression in the differentiation of human keloid-derived mesenchymal stem cells into osteoblast
LIANG Qin-bo,DENG Cheng-liang,WEI Zai-rong,WANG Bo,ZHANG Wen-duo,WANG Da-li.(Department of Plastic Surgery,Affiliated Hospital of Zunyi Medical College,Zunyi 563000,China)
Objective To study the expression of Notch receptor 1 to 4 in the differentiation of human keloid-derived mesenchymal stem cells (hKMSCs)into osteoblast.To explore whether the Notch signaling pathway participates in the regulation of osteogenic differentiation of hKMSCs.Methods hKMSCs were isolated and cultured after patients'informed consent.The expression of CD29,CD34,CD44,CD45 and CD90 were detected by flow cytometry,and the expression of Oct4 was detected by immunocytochemistry.hKMSCs were induced to differentiate into the osteoblast in vitro,and alizarin red staining was performed at 3 weeks after induced.RT-PCR and Western Blot were performed to detect the expression of mRNA and protein of Notch receptor 1 to 4 at 2 and 3 weeks before and after induction.Results The results of flowcytometry showed that mesenchymal stem cell phenotype of CD29(98.76%),CD44(96.45%)and CD90(97.86%)were highly expressed and hematopoietic stem cell phenotype of CD34(0.05%)and CD45(0.03%)were expressed at a low level.The results of immunocytochemistry showed that the expression of pluripotent stem cell marker Oct4 was positive.After 3 weeks of osteogenic inductionin vitro,obvious calcium salt nodules could be seen through alizarin red staining.The results of RT-PCR and Western Blot showed that with the prolongation of induction time,the relative expression of mRNA and protein of Notch receptor 1 to4 was graduallyreduced.The difference was statisticallysignificant(P<0.05).Conclusion In the differentiation ofhKMSCs into osteoblast,the expression of the Notch signaling pathway was gradually weakened.Lowlevel of Notch signal activation was beneficial to the osteogenic differentiationof hKMSCs.
Keloid;Mesenchymal stemcells;Notch signalingpathway;Osteogenic differentiation
Deng Cheng-liang,Email:cheliadeng@sina.com.
2016-11-16)
10.3969/j.issn.1673-7040.2017.02.016
2012-2016国家临床重点专科基金 国卫办医函[2013]544,国家自然科学基金(81660323),贵州省科学技术基金(黔科合J字LKZ[2012]31号)
10.3969/j.issn.1673-7040.2017.02.016
遵义医学院附院 烧伤整形外科,贵州 遵义 563003
邓呈亮,Email:cheliadeng@sina.com
本文引用格式:梁钦博,邓呈亮,魏在荣,等.人瘢痕疙瘩间充质样干细胞向成骨细胞分化过程中Notch信号表达的研究 [J].中国美容整形外科杂志,2017,28(2):118-122.
