水葫芦木质素的提取及其苯胺吸附性能
2017-06-29孙文鹏宋燕西王栋纬张紫琴
孙文鹏,宋燕西,2*,王栋纬,张紫琴,钱 国
(1.东华大学 环境科学与工程学院 国家环境保护纺织污染防治工程技术中心,上海 201620;2.复旦大学 聚合物分子工程国家重点实验室,上海 200433)
水葫芦木质素的提取及其苯胺吸附性能
孙文鹏1,宋燕西1,2*,王栋纬1,张紫琴1,钱 国1
(1.东华大学 环境科学与工程学院 国家环境保护纺织污染防治工程技术中心,上海 201620;2.复旦大学 聚合物分子工程国家重点实验室,上海 200433)
采用碱提法从生态入侵植物水葫芦中提取木质素,利用傅立叶红外光谱(FT-IR)和扫描电镜(SEM)等手段对所获得的木质素进行表征,研究了水葫芦木质素对水中苯胺的吸附性能,考察了溶液pH值、吸附时间、初始浓度等因素对水葫芦木质素吸附苯胺的影响。当NaOH溶液浓度0.1 mol/L,提取时间4 h,温度100 ℃,料液比1∶20时,水葫芦木质素的收率最大为6.81%。红外图谱显示,在1 456~1 656 cm-1处存在木质素的芳香环骨架振动吸收峰;扫描电镜显示,木质素呈大量细小的颗粒,木质素颗粒表面存在许多微小的孔状结构,有利于吸附作用的发生。在室温下,溶液pH 6.0,苯胺初始浓度为150 mg/L,吸附剂用量为5 mg,吸附时间120 min时,水葫芦木质素对苯胺的最大吸附容量为12.2 mg/g。苯胺吸附实验数据拟合符合准二级动力学模型以及Langmuir吸附等温模型。水葫芦木质素对苯胺的吸附以单分子层化学吸附为主,属于优惠吸附。相同吸附条件下,水葫芦木质素对湖泊水样中苯胺的吸附与实验模拟水样的吸附效果相近。水葫芦木质素可作为富集分离材料用于分析样品制备以及水中污染物的吸附。
水葫芦;木质素;碱提法;苯胺;吸附
天然物质中有效成分的提取应用是重要的分离分析研究方向[9-10],水葫芦作为一种生态入侵植物,对生态平衡与环境安全造成威胁[11],资源化利用是解决水葫芦问题的根本方法。目前对水葫芦有效成分的提取及应用研究主要集中在多糖[12]以及叶绿素[13]等方面,而关于水葫芦中木质素的提取应用研究目前尚未见报道。苯胺作为一种化工原料,广泛应用于染料、药物以及橡胶等方面,但同时也成为一种常见的环境污染物。环境中苯胺的吸附分离研究一直受到关注。为了解决水葫芦污染问题,变废为宝,促进水葫芦资源的利用,本文利用碱法提取水葫芦中的木质素,考察碱法提取的影响因素,并进一步研究了水葫芦木质素对水中苯胺的吸附行为。研究结果为水葫芦木质素的提取及开发利用提供了参考。
1 实验部分
1.1 实验材料与仪器
水葫芦,采集于上海松江某河道;甲苯、无水乙醇、氢氧化钠、浓盐酸、苯胺(分析纯,国药集团化学试剂有限公司)。
SET-02索氏提取器(上海洪纪仪器设备有限公司);Sartorius pH计(北京鑫盛鸿阳科技有限公司);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);SC-3612 低速离心机(安徽中科中佳科学仪器有限公司);NEXUS-670傅立叶红外光谱仪(美国Thermo Nicolet公司);LGJ-10E多歧管型冷冻干燥机(北京四环科学仪器厂有限公司);JS-1600小型离子溅射仪(北京和同创业科技有限责任公司);TM-1000日立台式电子显微镜(日立高新技术公司);TU-1810 紫外-可见分光光度计(北京普析通用仪器有限公司)。
1.2 木质素提取
1.2.1 水葫芦原料脱脂脱蜡处理 选取洗涤烘干后的水葫芦样品,粉碎后过60目筛,保存于干燥箱中待用。取干燥的水葫芦样品用滤纸包好后置于索氏提取器的提取管内,以体积比为1∶2的乙醇-甲苯混合溶液为提取溶剂,回流提取8~10 h,以除去水葫芦中的蜡质、树脂和脂肪;提取后的样品用乙醇抽滤洗涤3次,之后在100 ℃烘箱中干燥4 h,所得产物即为脱脂脱蜡水葫芦样品,置于干燥器备用。
1.2.2 氢氧化钠提取脱脂脱蜡水葫芦木质素[14]将脱脂脱蜡的水葫芦样品浸泡在0.1 mol/L的NaOH溶液中,在100 ℃,料液比为1∶20时,加热搅拌回流4 h;反应结束后趁热过滤,向溶液中边搅拌边缓慢加入5%盐酸,调至pH 3.0,继续搅拌15 min后过滤,滤饼用70 ℃温水洗涤至中性,于65 ℃烘箱内干燥至恒重,所得产物即为木质素。
1.3 水葫芦木质素的表征
采用溴化钾压片法,将干燥后的水葫芦木质素样品与溴化钾混合研磨后压片,用NEXUS-670傅立叶红外光谱仪测定样品的光谱图,扫描波数为400~4 000 cm-1;利用TM-1000日立台式电子显微镜对水葫芦木质素进行SEM分析,观察样品的微观形态。
1.4 吸附实验
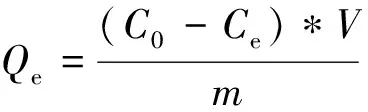
取一定体积的某湖泊水样,用微孔滤膜过滤,以除去水样中的悬浮颗粒物,收集滤液按照上述方法研究不同浓度苯胺溶液中吸附剂的吸附性能。
2 结果与讨论
2.1 水葫芦木质素的提取研究
利用NaOH溶液碱提法提取水葫芦中木质素,考察了提取时间、温度、NaOH溶液浓度以及料液比对水葫芦木质素提取收率的影响。获得最佳提取条件为:NaOH溶液浓度0.1 mol/L,时间4 h,温度100 ℃,料液比1∶20(g∶mL),此时水葫芦木质素的最大收率为6.81%。

图1 水葫芦木质素的红外光谱图Fig.1 Infrared spectrum of water hyacinth lignin
2.2 水葫芦木质素的FT-IR分析
对水葫芦木质素进行红外光谱表征,红外光谱如图1所示,在3 370~3 400 cm-1处为酚羟基和醇羟基的伸缩振动吸收峰[15];在2 929 cm-1和 2 858 cm-1处分别为C—H 的对称和不对称的伸缩振动,证明有CH3—,—CH2—的存在[16];3 073 cm-1处为苯环的C—H伸缩振动吸收峰;由于木质素的结构主体为苯丙烷基,所以结构中含有大量的苯环,在1 456~1 656 cm-1处存在芳香环骨架振动吸收峰[17];1 408 cm-1处为酚羟基的伸缩振动吸收峰;1 323 cm-1处为紫丁香核吸收峰[18];1 224 cm-1处为紫丁香基的芳香核C—O伸缩振动吸收峰[14];1 163 cm-1处为C—O—C的伸缩振动吸收峰;1 031 cm-1处为芳香环C—H面内弯曲振动吸收峰[18]。上述特征峰的存在证明产物为木质素。
2.3 水葫芦木质素的扫描电镜分析
图2为木质素的扫描电镜图,从图中可以看出木质素样品中存在大量细小无定形颗粒,部分木质素颗粒表面存在许多微小的蜂窝状孔隙结构,这些特征表明木质素具有较大的比表面积,有利于吸附作用。

图2 水葫芦木质素的SEM图
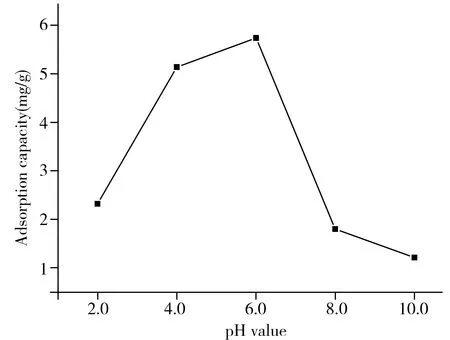
图3 pH值对木质素吸附苯胺的影响Fig.3 Effect of pH value on the adsorption of lignin for aniline
2.4 溶液pH值对水葫芦木质素吸附性能的影响
通过改变溶液的pH值(2.0~10.0)研究了水葫芦木质素对苯胺的吸附行为,结果如图3所示。室温下,在苯胺溶液初始浓度为40 mg/L,溶液体积为10 mL,木质素用量为10 mg条件下,当pH值由2.0增至6.0时,水葫芦木质素对苯胺的吸附容量逐渐增大,并在pH 6.0时达到最大,其最大吸附容量为5.74 mg/g;当pH值继续增大时,木质素对苯胺的吸附容量开始降低。这是因为苯胺在水溶液中的pKa为4.64,溶液pH值会影响其在溶液中的存在形式,当pH<4.64时,苯胺多以离子态的形式存在,与木质素的分子间作用力较弱;随着pH值的增加,当pH>4.64时,苯胺则主要以游离态的形式存在,更易被水葫芦木质素吸附,并在pH 6.0时吸附容量达到最大;但随着pH值的增加,木质素作为一种酚类聚合物,其酚羟基不断解离,对苯胺的吸附性能也随之下降,因此,实验选择最佳pH值为6.0。
2.5 吸附时间对水葫芦木质素吸附性能的影响
考察了室温下,苯胺的初始浓度为40 mg/L,pH值为6.0时,吸附时间对水葫芦木质素吸附苯胺的影响。结果显示在吸附的前30 min内,苯胺的吸附速率快速升高,吸附容量随之迅速增大;在30~120 min,吸附速率开始变缓,吸附容量变化不大;当吸附时间达到120 min后,吸附趋于饱和,苯胺的吸附容量也逐渐达到最大。这是因为在吸附的初始阶段,水葫芦木质素存在着大量空置的活性位点,这些活性位点的存在有利于苯胺的吸附,因而平衡吸附容量增大较快,随着苯胺分子被吸附,活性位点被占据,吸附达到了饱和状态,同时已吸附的苯胺会产生空间位阻,抑制溶液中游离的苯胺的吸附,剩余的空活性位点越来越难被溶液中的苯胺分子所占据。因此,一开始吸附速度快,之后吸附速率减小,最终约在120 min达到吸附脱附平衡,因此选择最佳的吸附时间为120 min。
为了进一步研究水葫芦木质素对苯胺的吸附特性,本实验采用准一级与准二级动力学模型对木质素的吸附数据进行动力学模型拟合,准一级动力学模型与准二级动力学模型数学表达式分别见式(1)与(2):
ln(Qe-Qt)=-k1t+lnQe
(1)
(2)
式中:Qt为任意时刻的吸附容量(mg/g);t为吸附时间(min);k1为准一级吸附速率常数(min-1);k2为准二级吸附速率常数(g·mg-1·min-1)。对于水葫芦木质素而言,以准一级和准二级动力学模型拟合时得到的线性关系较好,相关系数(r2)分别为0.989和0.997,准二级动力学方程的相关系数相对更高,说明水葫芦木质素对苯胺的吸附更符合准二级动力学方程;此外,准一级和准二级动力学模型的吸附容量值Qe(cal)分别为6.97,6.61 mg/g,而实际吸附容量值Qe(exp)为6.08 mg/g,故准二级动力学模型的吸附容量值与实际吸附容量值更为吻合。由于准二级动力学方程能更好地描述水葫芦木质素对苯胺的吸附过程,说明水葫芦木质素对苯胺的吸附以化学吸附为主。

图4 水葫芦木质素对苯胺的吸附等温线Fig.4 Adsorption isotherm of aniline on lignin from water hyacinth
2.6 初始浓度对水葫芦木质素吸附苯胺的影响及其等温吸附
在室温下,吸附时间120 min,pH 6.0时,研究了不同初始浓度水葫芦木质素对苯胺吸附容量的影响,实验结果显示,在初始浓度为150 mg/L时,水葫芦木质素对苯胺的吸附容量达到最大,为12.2 mg/g。利用不同平衡浓度对吸附容量作图可获得水葫芦木质素对苯胺的吸附等温线(图4)。
采用Langmuir和Freundlich等温吸附模型对吸附数据进行拟合,拟合方程分别为式(3)和(4):
(3)
(4)
式中:Qm为苯胺的饱和吸附容量(mg/g);KL为Langmuir平衡系数(L/mg);KF和n分别为Freundlich平衡系数(mg1-1/n·L1/n/g)和Freundlich常数。Langmuir和Freundlich等温吸附模型拟合的结果表明,采用Langmuir等温吸附模型对吸附实验数据进行拟合的相关系数r2为0.977,大于Freundlich等温吸附模型拟合的相关系数r2(0.953),说明采用Langmuir等温吸附模型能更好地描述水葫芦木质素对苯胺的吸附,该吸附过程为单分子层吸附,主要为化学吸附,基于Langmuir的最大吸附容量为16.1 mg/g。Freundlich等温吸附模型拟合时n>1,说明苯胺在水葫芦木质素上的吸附是有利的[19]。
2.7 实际水样中水葫芦木质素对苯胺的吸附性能
取湖泊实际水样过滤后于280 nm的波长下测定其吸光度,样品无吸收,未检出苯胺。取过滤后湖泊实际水样配制3种不同浓度的苯胺溶液(40,100,150 mg/L),在最佳吸附条件下,考察了水葫芦木质素对湖泊水样中苯胺的吸附。结果显示,水葫芦木质素对含3种不同浓度苯胺的实际水样的吸附容量分别为5.18,10.2,11.9 mg/g。与相同吸附条件下实验模拟水样的结果进行比较,吸附数据相近,当苯胺浓度为150 mg/L时,吸附容量的相对偏差为1.3%,说明水葫芦木质素可用于环境水体中苯胺吸附分离。
3 结 论
在优化实验条件下,碱法提取水葫芦木质素的收率为6.81%。苯胺的吸附性能研究显示,室温下,pH 6.0,水葫芦木质素5 mg,苯胺初始浓度为150 mg/L,吸附时间120 min时,水葫芦木质素对苯胺的最大吸附容量为12.2 mg/g。水葫芦木质素对苯胺的吸附以单分子层化学吸附为主,基于Langmuir的最大吸附容量为16.1 mg/g,且水葫芦木质素对湖泊水样中苯胺的吸附容量与实验模拟水样的吸附容量相近。与多壁碳纳米管[20]、硅胶[21]、松木屑[22]等苯胺吸附材料相比,水葫芦木质素的孔隙结构较为发达,吸附效果好,原料廉价,是一种环境友好的苯胺吸附材料,可将其作为一种有效的富集分离材料,用于水中化学物质的富集分离、分析样品的前处理以及水中环境污染物的吸附。
[1] Jiang T D.Lignin.2nd ed.Beijing:Chemical Industry Press(蒋挺大.木质素.2版.北京:化学工业出版社),2001:1.
[2] Sangha A K,Parks J M,Standaert R F,Ziebell A,Davis M,Smith J C.J.Phys.Chem.B,2012,116(16):4760-4768.[3] Zhou Y,Zhang H P,Zhang J P,Luo X G,Lin X Y.Environ.Chem.(周艳,张红平,张建平,罗学刚,林晓艳.环境化学),2016,35(9):1952-1960.
[4] Adebayo M A,Prola L D,Lima E C,Puchana-Rosero M,Catalua R,Saucier C,Umpierres C S,Vaghetti J C,Da Silva L G,Ruggiero R.J.Hazard.Mater.,2014,268(3):43-50.
[5] Jin L,Sellers T,Schultz T P,Nicholas D D.Holzforschung,2009,44(3):207-210.
[6] Qin Y L,Yang D J,Guo W Y,Qiu X Q.J.Ind.Eng.Chem.,2015,27:192-200.
[7] He C,Li Z,Zhao Z X,Xi H X.IonExchangeAdsorpt.(何莼,李忠,赵桢霞,奚红霞.离子交换与吸附),2006,22(6):481-488.
[8] Zhang B P,Ma Z C,Yang F,Liu Y,Guo M C.ColloidsSurf.A,2017,514:260-268.
[9] Li J Y,Luo J,Li M L,Lu Y,Liu Z H.J.Instrum.Anal.(李佳银,罗晋,李觅路,陆英,刘仲华.分析测试学报),2012,31(1):45-50.
[10] Bian M,Yang Y,Zhou H.J.Instrum.Anal.(边敏,杨勇,周昊.分析测试学报),2013,32(2):174-178.
[11] Malik A.Environ.Int.,2007,33(1):122-138.
[12] Yu C,Jun D.Biotechnology(余陈,君达.生物技术),2007,17(2):62-65.
[13] Yu P,Shen F W,Xu J Y,Zhou X Y,Lu Y,Feng X,Luo Y.Pratacult.Sci.(于萍,沈发伟,许嘉怡,周晓雅,陆瑶,冯霞,罗艳.草业科学),2014,31(5):971-976.
[14] Li Y,Shi G,Gui Y,Zhang L.Chem.Res.Appl.(李赢,石刚,贵阳,张梁.化学研究与应用),2015,27(6):903-909.
[15] Pinheiroa F G C,Soaresb A K L,Santaellac S T,Silvad L M A,Canutod K M,Cácerese C A,Freitas R M,Andrade F J P,Leitãod R C.Ind.CropsProd.,2017,96:80-90.
[16] Xiong W L,Yang D J,Zhong R S,Li Y,Zhou H F,Qiu X Q.Ind.CropsProd.,2015,74:285-292.
[17] Lin R C,Cheng J,Song W L,Ding L,Xie B,Zhou J,Cen K.Bioresour.Technol.,2015,182(1):1-7.
[18] Guo J B,Tao Z Y,Luo X G.J.Instrum.Anal.(郭京波,陶宗娅,罗学刚.分析测试学报),2005,24(3):77-81.
[19] Shi S H,Song Y X,Shen X T,Chen X T,Sun W P.J.Instrum.Anal.(时水洪,宋燕西,沈晓婷,陈旭涛,孙文鹏.分析测试学报),2016,35(7):883-887.
[20] Xie X,Gao L,Sun J.ColloidsSurf.A,2007,308:54-59.
[21] Liang Z J,Shi W X,Zhao Z W,Sun T Y,Cui F Y.ColloidsSurf.A,2017,513:250-258.
[22] Zhou Y B,Gu X C,Zhang R Z,Lu J.Ind.Eng.Chem.Res.,2014,53(2):887-894.
Extraction of Lignin from Water Hyacinth and Its Performance of Aniline Adsorption
SUN Wen-peng1,SONG Yan-xi1,2*,WANG Dong-wei1,ZHANG Zi-qin1,QIAN Guo1
(1.State Environmental Protection Engineering Center for Pollution Treatment and Control in Textile Industry,School of Environmental Science and Technology,Donghua University,Shanghai 201620,China;2.State Key Laboratory of Molecular Engineering of Polymers,Fudan University,Shanghai 200433,China)

water hyacinth;lignin;alkali extraction;aniline;adsorption
2017-01-12;
2017-02-07
国家自然科学基金资助项目(51278095);复旦大学聚合物分子工程国家重点实验室开放研究课题基金(K2014-11)
10.3969/j.issn.1004-4957.2017.06.015
O657.32;O625
A
1004-4957(2017)06-0788-06
*通讯作者:宋燕西,博士,副教授,研究方向:新型分离分析材料的制备及其在分离分析方面的应用,色谱材料及色谱分析方法研究,Tel:021-67792551,E-mail:syx@dhu.edu.cn
