基于QuEChERS法提取液相色谱-串联质谱法测定新会陈皮中的9 种真菌毒素和农药残留
2017-06-29彭晓俊曾丽珠伍长春梁伟华
彭晓俊,曾丽珠,伍长春,梁伟华
(1.新会出入境检验检疫局,广东 江门 529100;2.阳江出入境检验检疫局,广东 阳江 529500)
基于QuEChERS法提取液相色谱-串联质谱法测定新会陈皮中的9 种真菌毒素和农药残留
彭晓俊1*,曾丽珠2,伍长春1,梁伟华1
(1.新会出入境检验检疫局,广东 江门 529100;2.阳江出入境检验检疫局,广东 阳江 529500)
建立了QuEChERS-改性多壁碳纳米管提取净化结合液相色谱-质谱联用同时检测新会陈皮中6 种真菌毒素和3 种农药残留的分析方法,并对影响提取、净化、检测效率的因素进行了优化。以乙腈-水(80∶20)提取样品,适量改性多壁碳纳米管净化后,净化液直接用HPLC-MS/MS进行测定,选择多反应监测模式,基质匹配标准溶液外标法定量。在优化实验条件下,9 种目标化合物在各自线性范围内均具有良好的线性关系,相关系数为0.983 8~0.998 2,检出限(S/N=3)为0.18~10 μg/kg。在低、中、高3个加标水平的平均回收率为72.4%~106%,相对标准偏差为2.2%~7.4%。该法准确、灵敏度高﹑操作简单﹑快速,可满足新会陈皮中上述9 种化合物同时测定的要求,应用于真菌毒素和农药残留的快速筛查和确证,结果满意。
QuEChERS;改性多壁碳纳米管;液相色谱-串联质谱(HPLC-MS/MS);真菌毒素;农药残留;新会陈皮
陈皮为芸香科植物橘及其栽培变种的干燥成熟果皮,新会是陈皮的道地产区,新会陈皮为广东十大地道中药材之一,是“广东三宝”(陈皮、老姜、禾秆草)的第一宝和清廷贡品,而经年陈藏的新会陈皮更是珍品。2016 年新会陈皮种植面积共6.5 万亩,陈皮总产量预计达7 000 吨,行业产值近30 亿元,但新会陈皮面临的食品安全风险十分严峻。陈皮在加工储存过程中,由于受温度湿度等影响,容易霉变而产生真菌,真菌代谢产生有毒的真菌毒素,真菌毒素能损坏人的肝肾功能、致癌、致畸并诱发免疫抑制性疾病[1]。在这些代谢物中,黄曲霉毒素类、赭曲霉毒素类、玉米赤霉烯酮对人体健康危害尤为巨大。农作物种植过程中引入的农药残留,通过食物链进入人体,进而危害人类健康,同样是导致食品安全突发事件频发的主要原因。2,4-二氯苯氧乙酸(2,4-D)是应用最为广泛的除草剂,灭多威是一种广谱性氨基甲酸酯类杀虫剂,毒死蜱则是最常用的杀虫剂,这3 种农药高效、广谱,具有击倒速度快、作用范围广等特点,在我国使用广泛[2]。因此,由真菌毒素、农药残留产生的健康风险问题日益受到人们的关注。
目前,真菌毒素的检测方法主要有酶联免疫法(ELISA)[3-5]、薄层色谱法[6]、液相色谱法[7-9]和液质联用法[10-14]等,但前3种方法的选择性较差,只能检测单一种类的真菌毒素。农药的定量检测一般采用气相色谱法[15-16]、气质联用法[17-18]。现有的真菌毒素、农药残留检测方法相对较为独立,真菌毒素和农药残留不能同时检测,无法满足食品安全突发事件检测时间短、检测目标组分多的快速处置要求。近年来,液质联用技术(HPLC-MS/MS)在检测方面的优势逐渐显现,采用选择离子监测技术,可大大提高检测的灵敏度和准确性,已被越来越多地应用于高通量分析,但常规前处理方法步骤繁琐、有机试剂消耗量大,对操作人员技能要求高。新会陈皮含有挥发油、黄酮化合物、有机酸等化学成分,还有大量色素、脂肪、糖等生化成分,用传统的液液萃取、索氏抽提、固相萃取等前处理方法,普遍存在基质干扰严重、步骤繁琐、重现性差且有机溶剂消耗量大等缺点。2003年,Anastassiades等[19]建立了QuEChERS(Quick,Easy,Cheap,Effective,Rugged,Safe)新型样品前处理方法,QuEChERS可以根据样品基质和待测物的特性,选择合适的有机提取溶剂和净化填料,具有快捷、简便、高效、环保等优点。QuEChERS前处理方法结合液质联用测定陈皮中真菌毒素、农药残留的方法尚未见报道。1991 年,日本电镜专家Iijima[20]发现了多壁碳纳米管(MWNTs),但未处理的MWNTs表面缺少官能基团,疏水性强、不溶不熔、易缠结团聚,影响了其作为吸附剂应用。本文通过对MWNTs进行衍生化化学修饰,用强氧化性酸对MWNTs进行酸处理,使其表面产生一定量的羟基、羧基等含氧活性官能基团,有效提高了改性MWNTs在溶液介质中的分散性能和对有机化合物的吸附性能,加之改性MWNTs准一维的中空管结构和高的比表面积,因此在吸附方面具有优异的性能。本研究利用改性MWNTs在吸附方面具有的优异性能去除样品中的干扰,采用QuEChERS提取、改性MWNTs净化、液质联用测定,建立了新会陈皮中6 种真菌毒素和3 种农药残留的快速、准确、简便分析方法。相关研究能够为样品的快速筛查提供可靠的技术支持,将其应用于新会陈皮食品安全突发事件的快速应急处置工作,可整体提升应急处置工作效率。
1 实验部分
1.1 仪器与试剂
LC-20AT 高效液相色谱仪(日本Shimadzu公司);API 3200质谱仪(美国ABsciex公司);H-800-1 型透射电子显微镜(日本日立公司);Nexus 670 型傅立叶变换红外光谱扫描仪(美国Thermo公司);2-16 型通用台式高速离心机(德国Sigma公司);DZF-6050 型真空干燥机(上海精密仪表公司);KQ 2200DB 型超声振荡器(昆山超声仪器有限公司);LAB DANCER 涡旋混合器(德国IKA公司);DN-12W 氮吹仪(上海比郎公司);Milli-Q 超纯水系统(美国Millipore公司);50 mm×0.22 μm聚四氟乙烯微孔滤膜(美国Millipore公司)。
2,4-二氯苯氧乙酸(2,4-D)、灭多威(Methomyl)、毒死蜱(Chlorpyrifos)、黄曲霉毒素G2(AFG2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素B1(AFB1)、赭曲霉毒素A(OTA)和玉米赤霉烯酮(ZEN)标准品均购自美国Sigma公司;甲醇、乙腈(色谱纯,德国默克公司);甲酸、乙酸铵(优级纯,上海安谱公司);MWNTs填料(纯度>95%,直径10~20 nm,长度300~800 nm,深圳纳米港有限公司);Florisil填料(80~100 目,上海博势公司);PSA填料(平均粒度45 μm,孔体积0.8 m3/g,山东奥秘公司);硅胶(60~100目,青岛海洋化工);实验用水为超纯水。
1.2 仪器工作条件
1.2.1 色谱条件 色谱柱:Shimadzu C18(150 mm×2.1 mm×3.5 μm);流速:0.20 mL/min;柱温:30 ℃;进样量:10 μL;流动相:A为5 mmol/L 乙酸铵水溶液(含1%甲酸),B 为乙腈;梯度洗脱程序:0~2 min,10%B;2~20 min,10%~80%B;20~26 min,10%B。
1.2.2 质谱分析条件 离子源:电喷雾离子源(ESI);扫描方式:正离子扫描;检测方式:多反应监测(MRM);喷雾电压:5 500 V;离子源温度:550 ℃;碰撞气压力:60 kPa;气帘气压力:250 kPa;雾化气压力:550 kPa;加热辅助气压力:550 kPa;MRM参数见表1。
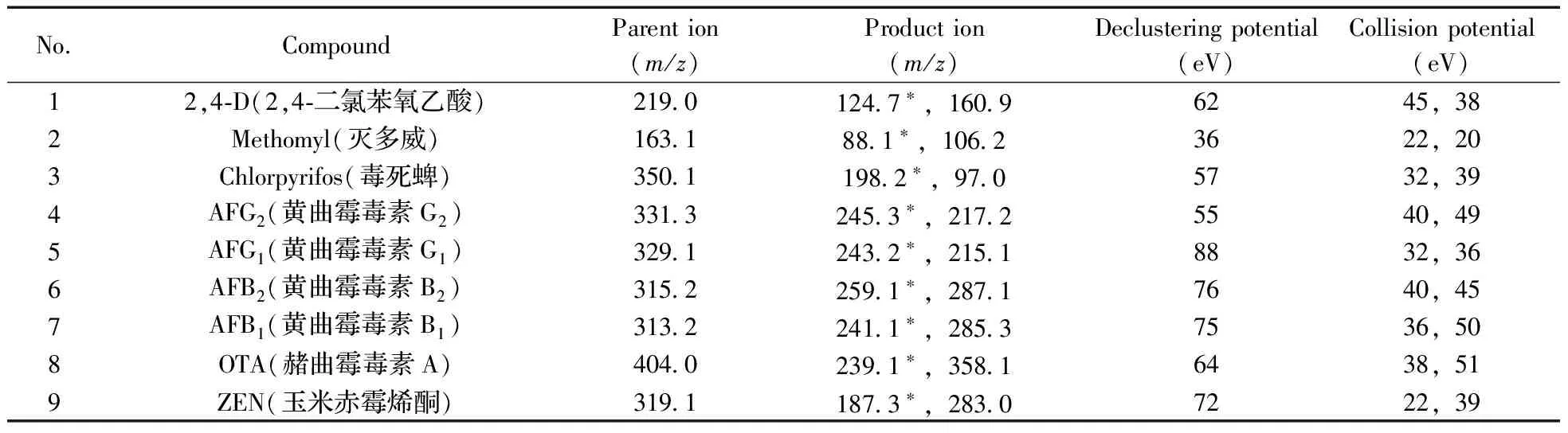
表1 9种化合物的串联质谱检测参数
*quantitative ion
1.3 MWNTs改性
称取50 g MWNTs置于500 mL烧瓶中,加入50 mL浓硫酸,超声30 min,再向烧瓶中加入30 mL浓硝酸,超声30 min,静置,用吸管吸除上层混酸清液,然后加入1 000 mL水稀释,稀释液过0.22 μm的聚四氟乙烯微孔滤膜,水洗至滤液pH值为7.0,所得黑色固体经真空烘箱50 ℃干燥即得被氧化的改性MWNTs。
1.4 样品处理
称取粉碎的新会陈皮2.00 g于50 mL具塞离心管中,加入10 mL乙腈-水(80∶20,体积比,下同),振荡1 min,再加入0.6 g改性MWNTs,振荡1 min,超声10 min,5 000 r/min离心5 min,吸取上层清液过0.22 μm有机相滤膜,供上机测定。
2 结果与讨论
2.1 MWNTs表面改性
MWNTs独特的中空管结构以及高比表面积使之具有作为净化吸附剂的优异性能。但未改性的MWNTs由于表面缺少活性官能基团,限制了其在吸附领域的应用,因此须对MWNTs表面进行氧化改性,使其表面产生一定量的羧基、羟基等活性官能基团。本研究中氧化改性前后的透射电镜照片(TEM)见图1。由图1可见,氧化改性后所得MWNTs分散均匀,有一定的长径比,长度分布均匀,说明本研究所采用的氧化改性方法效果好。氧化前后MWNTs的红外光谱见图2,可观察到氧化后的MWNTs在3 414 cm-1处出现较宽的吸收峰,该吸收峰由羟基伸缩振动所引起,在1 704 cm-1处的吸收峰羧基中的羰基伸缩振动所引起,这些结果可以说明强酸氧化后MWNTs的表面产生了羟基和羧基官能基团。
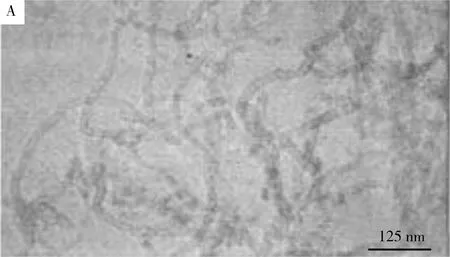
图1 未经氧化(A)及混酸氧化后(B)所得MWNTs的TEM照片
Fig.1 TEM images of MWNTs of raw untreated(A) and treated(B) with a mixture acid by oxidation

图2 未经氧化(a)及混酸氧化后(b)所得红外光谱图Fig.2 Infrared spectra of MWNTs of raw untreated(a) and treated(b) with a mixture acid by oxidation
2.2 提取溶液的选择
将目标化合物从样品中有效提取是多残留分析必须解决的首要问题,样品提取一般采用有机溶剂加水作为提取溶液,提取液含水可以湿润基质,增强有机溶剂的渗透能力,便于有机溶剂的渗入和萃取,从而提高对目标化合物的提取效率。本研究的目标化合物为脂溶性物质,溶于乙腈、乙醚和氯仿等有机溶剂,但乙醚、氯仿等有机试剂毒性大,而乙腈能有效沉淀蛋白质和脂肪,适用性广,因此真菌毒素、农药检测一般选择乙腈-水作为提取溶液。本研究以2,4-D、灭多威、AFB1和ZEN作为考察物,以回收率作为考察指标,在新会陈皮空白样品中添加25 μg/kg混标,考察了乙腈-水体积比分别为100∶0,90∶10,80∶20,70∶30时的回收率。结果显示,当乙腈-水比例为80∶20时提取效果最好。因此,实验选用乙腈-水(80∶20)作为提取溶液。
2.3 净化吸附剂的选择
新会陈皮基质复杂,为了消除杂质干扰,本研究对改性MWNTs,Florisil,PSA,硅胶4种吸附剂的净化作用进行了比较。在空白新会陈皮中添加一定量的混合标准溶液,分别采用改性MWNTs,Florisil,PSA和硅胶吸附剂进行净化,以2,4-D、灭多威、AFB1和ZEN的回收率作为考察指标。结果表明,Florisil能有效地吸附极性化合物,但净化液呈浅黄色,PSA能有效去除提取液中的有机酸、脂肪酸、糖类,但去除生物碱、色素、维生素、黄酮化合物等的效果不佳,用Florisil和PSA作净化吸附剂,杂质对目标化合物有干扰;硅胶对蛋白质、脂肪、维生素等杂质有较高的吸附量,但也能牢固吸附目标化合物,4种化合物的回收率低。改性MWNTs可有效除去样品中的水溶性和脂溶性杂质,净化液无色,杂质背景对目标化合物检测无影响且回收率最高。此外,改性MWNTs能在广泛的pH值范围内保持稳定,保证了净化效果及方法的通用性,因此本研究采用改性MWNTs作为净化吸附剂。
考察了改性MWNTs吸附剂用量分别为0.2,0.4,0.6,0.8,1.0 g时对目标化合物回收率的影响。结果显示,随着吸附剂用量增加,目标化合物的回收率增大,这是由于真菌毒素和农药含π电子少,杂质与吸附剂能形成更强的π-π吸附而减少了对目标化合物的干扰。当吸附剂用量为0.6 g时回收率最高,继续增加吸附剂用量,目标化合物的回收率无明显变化,因此,选择吸附剂的最佳用量为0.6 g。
2.4 质谱条件的优化
配制9 种真菌毒素、农药混合标准溶液,用蠕动泵以10 μL/min的流速连续注射,在正离子模式下进行一级母离子全扫描,得到目标化合物的分子离子峰,优化去簇电压、雾化气、气帘气等参数。根据欧盟2002/657/EC《质谱分析方法鉴定点数》指令要求,在确定母离子的基础上选择两个以上的子离子,打碎目标分子离子峰进行二级质谱扫描(子离子扫描),采集全扫描的二级质谱图,得到碎片离子信息,对碰撞能、碰撞室出口电压等参数进行优化,最终每种目标化合物分别选择1 个定量离子外标法定量,2 个定性离子和丰度比为定性依据,质谱参数见表1。
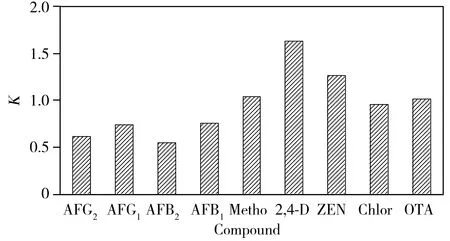
图3 9 种化合物的基质效应Fig.3 Matrix effects of nine compounds
2.5 基质效应
基质效应指样品中被分析物以外的组分对分析过程及结果准确性的影响和干扰。不同真菌毒素、农药在同一基质中具有不同的基质效应,同一真菌毒素、农药在不同基质中的基质效应也不同,同时基质效应还与浓度具有一定的关系,随着浓度增加,基质效应逐渐减弱。本实验对新会陈皮的基质效应进行了研究,样品基质效应采用标准曲线测定法,即配制2 组标准曲线,第1 组、第2 组分别用纯有机溶剂、基质空白提取液配制混合标准溶液,分别绘制有机溶剂标准曲线和基质匹配标准曲线,采用基质匹配标准曲线斜率和有机溶剂标准曲线斜率之比(K)来评价基质效应:若K值介于0.9~1.1之间,基质效应不明显,K大于1.1时为基质增强效应,小于0.9则是基质抑制效应。结果显示:以新会陈皮作为基质时,AFG2,AFG1,AFB2和AFB1为基质减弱效应,2,4-D和ZEN表现为基质增强效应,其他3 种化合物无明显的基质效应(见图3)。为提高定量的准确性,本实验采用基质匹配标准溶液(即以空白的新会陈皮净化液配制标准溶液制作校正曲线)校正方法进行定量分析和计算,对基质效应进行补偿。
2.6 线性范围与检出限
以空白新会陈皮基质提取液为溶液,根据9种化合物的响应强弱,配制不同质量浓度的混合标准溶液,在优化的色谱-质谱条件下进行测定,以定量离子的仪器响应峰面积(y)对各目标化合物的浓度(x)进行线性回归,9 种目标化合物的线性范围、相关系数和检出限见表2。由表可见目标化合物在各自线性范围内呈良好的线性关系,相关系数为0.983 8~0.998 2,以3 倍信噪比(S/N=3)计算方法检出限(LOD)为0.18~10 μg/kg,混合标准溶液的总离子流图见图4。


图4 混合标准溶液(A)、新会陈皮(B)与新会陈皮添加标准品(C)的总离子流图
Fig.4 TIC chromatograms of mixed standard solution(A),a xinhui dried orange peel(B) and a xinhui dried orange peel spiked with standards(C) the peak numbers(1-9) denoted were as the same as those in Table 1
2.7 回收率与精密度
为了评价方法的适用性,在上述最优条件下,取新会陈皮空白样品,按低、中、高3个浓度水平分别添加混合标准液,每个浓度水平重复6 次考察方法精密度,结果见表2。各目标化合物的加标回收率为72.4%~106%,相对标准偏差(RSD)为2.2%~7.4%。方法的准确度高、稳定性好,可满足痕量分析的要求。

表2 方法的线性范围、相关系数、检出限、平均回收率及相对标准偏差(n=6)
(续表2)

No.CompoundLinearrange(μg/L)rLOD(μg/kg)Spiked(μg/kg)RecoveryR/%RSDsr/%3Chlorpyrifos1 0~1000 99822 55 0,10,5096 4,101,1025 8,6 3,2 24AFG20 10~200 99630 180 50,1 0,5 0101,96 3,1067 4,5 8,3 95AFG10 10~200 99410 240 50,1 0,5 072 4,91 2,92 63 9,6 6,4 56AFB20 10~200 99240 200 50,1 0,5 085 6,92 4,93 45 6,6 2,6 07AFB10 10~200 99120 210 50,1 0,5 092 7,88 3,89 56 2,7 1,5 68OTA5 0~5000 99631025,50,25083 8,89 7,96 16 2,6 2,5 89ZEN5 0~5000 99249 725,50,25092 4,99 5,1034 2,5 3,7 2
2.8 实际样品的分析
采用本文建立的方法对300余份日常送检的新会陈皮进行检测,以实验室空白、平行样和样品加标进行质量控制,其中6 份样本检出2,4-D(8.9~12 μg/kg),3 份样本检出OTA(26.8~95.5 μg/kg),其余样品未检出真菌毒素和农药。
3 结 论
研究结果表明,以改性MWNTs作为净化剂,将QuEChERS净化法与HPLC-MS/MS结合可用于新会陈皮中真菌毒素和农药残留的检测。方法的加标回收率为72.4%~106%,RSD为2.2%~7.4%,检出限为0.18~10 μg/kg,方法前处理步骤简便快速,结果准确,检出限满足国内外标准的限量要求。此外,该方法能同时完成真菌毒素和农药残留2 类不同组分的检测,为食品安全提供了技术保障,具有一定的推广价值。
[1] Wagacha J M,Muthomi J W.Int.J.Food.Microbiol.,2008,124(1):1-12.
[2] Nie J Y,Li Z X,Liu C D,Fang J B,Wang C,Guo Y Z,Lei S R,Li H F,Xu G F,Yan Z.Sci.Agric.Sin.(聂继云,李志霞,刘传德,方金豹,王成,郭永泽,雷绍荣,李海飞,徐国锋,闫震.中国农业科学),2014,47(18):3655-3667.
[3] Zhang D H,Li P W,Zhang Q,Zhang W.Biosens.Bioelectron.,2011,26(6):2877-2882.
[4] Li X,Li P,Zhang Q,Li Y,Zhang W,Ding X X.Anal.Chem.,2012,84(12):5229-5235.
[5] Wang Y R,Wang H,Li P W,Zhang Q,Kim H J,Gee S J,Hammock B D.J.Agric.FoodChem.,2013,61(16):2426-2433.
[6] GB 5009.24-2010.National Food Safety Standard Determination of Aflatoxins M1 and B1 in Foods.National Standards of the People's Republic of China(食品中黄曲霉毒素M1和B1的测定.中华人民共和国标准).
[7] Xie G,Wang S X,Zhang Y.J.Instrum.Anal.(谢刚,王松雪,张艳.分析测试学报),2011,30(12):1362-1366.
[8] Hashemi M,Taherimaslaka Z,Rashidi S.J.Chromatogr.B,2014,960:200-208.
[9] Wang L Z,Wang Z,Gao W W,Chen J,Yang M H,Kuang Y,Huang L F,Chen S L.FoodChem.,2013,138(2/3):1048-1054.
[10] Varga E,Glauner T,Berthiller F,Krska R,Schuhmacher R,Sulyok M.Anal.Bioanal.Chem.,2013,405:5087-5104.[11] Streit E,Schwab C,Sulyok M,Naehrer K,Krska R,Schatzmayr G.Toxins,2013,5(3):504-523.
[12] Storm M L D,Rasmussen R R,Rasmussen P H.Toxins,2014,6(8):2256-2269.
[13] Nardiello D,Lo Magro S,Iammarino M,Palermo C,Muscarella M,Centonze D.Curr.Anal.Chem.,2014,10(3):355-365.
[14] Varga E,Glauner T,Berthiller F,Krska R,Schuhmacher R,Sulyok M.Anal.Bioanal.Chem.,2013,405(15):5087-5104.
[15] Zhao W J,Sun X K,Deng X N,Huang L,Yang M M,Zhou Z M.FoodChem.,2011,127(2):683-688.
[16] Li Y M,Yang M,Tan W,Yang H X,Gao S Q,Li G Z,Wang H B.Sci.Technol.Food.Ind.(李杨梅,杨敏,谭伟,杨宏兴,高斯祺,李桂镇,王红斌.食品工业科技),2014,35(19):316-320.
[17] Gao R,Rao Z,Guo X C,Huang Y,Li X J.J.Instrum.Anal.(高冉,饶竹,郭晓辰,黄毅,李晓洁.分析测试学报),2014,33(5):539-544.
[18] Wu L J,Song Y,Hu M Z,Xu X,Zhang H Q,Yu A M,Ma Q,Wang Z M.Talanta,2015,134:366-372.
[19] Anastassiades M,Lehotay S J,Stajnbaher D,Schenck F J.J.AOACInt.,2003,86(2):412-431.
[20] Iijima S.Nature,1991,354:56-58.
Determination of Nine Mycotoxins and Pesticide Residues in Xinhui Dried Orange Peel by Liquid Chromatography-Tandem Mass Spectrometry with QuEChERS Clean-up
PENG Xiao-jun1*,ZENG Li-zhu2,WU Chang-chun1,LIANG Wei-hua1
(1.Xinhui Entry-Exit Inspection and Quarantine Bureau,Jiangmen 529100,China;2.Yangjiang Entry-Exit Inspection and Quarantine Bureau,Yangjiang 529500,China)
An analytical method based on QuEChERS with modified multiwalled carbon nanotubes(MWNTs) as adsorbent was developed.The determination of 6 mycotoxins and 3 pesticides residues,including 2,4-D,methomyl,chlorpyrifos,AFG2,AFG1,AFB2,AFB1,OTA and ZEN in xinhui dried orange peel was carried out by liquid chromatography-tandem mass spectrometry(LC-MS/MS).The factors affecting the extraction,purification and detection efficiency were optimized,and the optimal conditions were as the following:the samples were extracted with acetonitrile-water(80∶20) mixed solution,and purified by QuEChERS method with modified MWNTs as adsorbent.The separation was performed on a Shimadzu C18(150 mm×2.1 mm×3.5 μm) column,then determined by LC-MS/MS under multiple reaction monitoring(MRM) mode and quantified by external standard method with the matrix-matched standards solution.Under the optimized conditions,the calibration curves of 9 compounds were linear in the respective concentration ranges with correlation coefficients of 0.983 8-0.998 2.The detection limits(S/N=3) were in the range of 0.18-10 μg/kg.The recoveries at low,medium and high spiked levels ranged from 72.4% to 106%,with relative standard deviations of 2.2%-7.4%.With the advantages of accuracy,high sensitivity,easy operation and rapidness,the method was suitable for the simultaneous determination of mycotoxins and pesticide in xinhui dried orange peel,and was applied in the rapid screening of toxic and harmful substances in foods with satisfactory results.
QuEChERS;modified multiwalled carbon nanotubes;liquid chromatography-tandem mass spectrometry(HPLC-MS/MS);mycotoxins;pesticide residue;xinhui dried orange peel
2017-01-09;
2017-02-13
国家质检总局科技项目(2016IK066 );江门市科技项目(20161408 )
10.3969/j.issn.1004-4957.2017.06.006
O657.63;S852.44
A
1004-4957(2017)06-0738-06
*通讯作者:彭晓俊,硕士,高级工程师,研究方向:食品安全,Tel:0750-6312076,E-mail:pxj2129@163.com
